Для каких целей применяют этиленгликоль и глицерин кратко
Обновлено: 02.07.2024
Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом
Гликоли (диолы)
CH 2 - CH 2
OH OH
Этиленгликоль
Этиленгликоль (этандиол)
- Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо смешивается с водой, сильно понижает температуру замерзания воды (60%-ый раствор замерзает при -49 ˚С) –это используется в системах охлаждения двигателей – антифризы.
- Этиленгликоль токсичен – сильный Яд! Угнетает ЦНС и поражает почки.
CH 2 - OH
CH – OH
(1,2,3 – пропантриол)
Глицерин (пропантриол-1,2,3)
- Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
- Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
Номенклатура
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
Получение многоатомных спиртов
I . Получение двухатомных спиртов
В промышленности
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:
R - CH - CH 2 + 2 NaOH водный раствор → R - CH - CH 2 + 2 NaCl
3. Из синтез-газа:
2CO + 3H2 250°,200 МПа ,kat → CH2(OH)-CH2(OH)
В лаборатории
1. Окисление алкенов:
R - CH = CH 2 + H 2 O + KMnO 4 → R - CH - CH 2 + MnO 2 + KOH
II . Получение трёхатомных спиртов (глицерина)
В промышленности
Омыление жиров (триглицеридов):
CH 2 - O - CO - R CH 2 - OH O
CH- O-CO-R + 3NaOH → CH-OH + 3 R - C- O - Na
│ │ ( натриевая соль карбоновой кислоты )
Химические свойства многоатомных спиртов
Кислотные свойства
1. С активными металлами:
(гликолят натрия)
2. С гидроксидом меди( II ) – качественная реакция!
CH –OH + Cu → CH – O + 2H2O
голубой ярко-синий раствор
осадок (глицерат меди( II ))
Основные свойства
1. С галогенводородными кислотами
2. С азотной кислотой
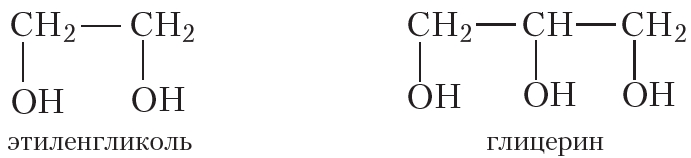
В молекулах многоатомных спиртов, в отличие от одноатомных, содержится не одна, а несколько гидроксильных групп. Приведём формулы простейших двухатомного и трёхатомного спиртов:
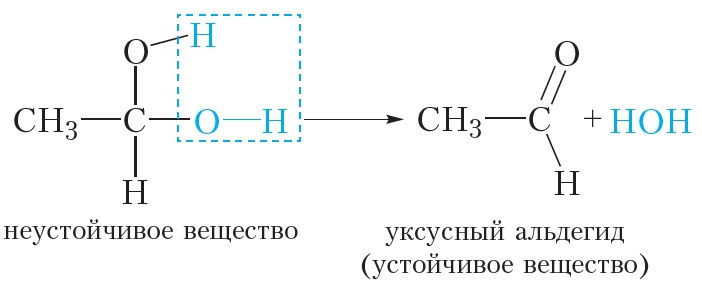
Обратите внимание, что в молекулах многоатомных спиртов гидроксильные группы находятся у разных атомов углерода. Вещества, в которых две гидроксильные группы соединены с одним и тем же атомом углерода, неустойчивы и не могут быть получены в свободном виде. Такие вещества сразу же отщепляют молекулу воды:
В связи с этим молекула двухатомного спирта должна содержать не менее двух атомов углерода, трёхатомного — трёх и т. д.
Простейший двухатомный спирт называется этиленгликоль, трёхатомный — глицерин. Эти вещества похожи друг на друга по физическим свойствам и представляют собой бесцветные вязкие жидкости. Между молекулами многоатомных спиртов, как и между молекулами одноатомных спиртов, образуются водородные связи, поэтому этиленгликоль и глицерин имеют высокие температуры кипения: 198 °С и 290 °С соответственно. Полярные гидроксильные группы придают многоатомным спиртам растворимость в воде. Этиленгликоль и глицерин смешиваются с водой в любых соотношениях.
Названия многоатомных спиртов строят так же, как и названия одноатомных. Наличие в молекуле двух гидроксильных групп обозначается сочетанием -диол, трёх -триол и т. д. Назовём этиленгликоль и глицерин по номенклатуре ИЮПАК:
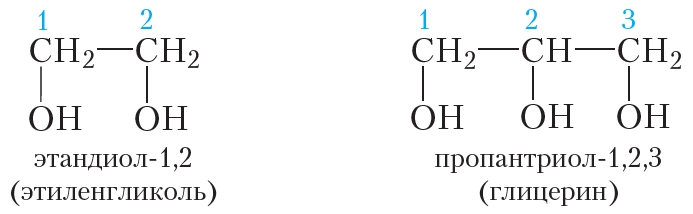
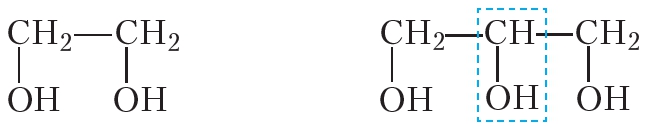
Состав молекул этиленгликоля и глицерина различается на группу CH—OH, а не СН2:
То есть этиленгликоль и глицерин не являются гомологами. Ближайшим гомологом этиленгликоля является пропандиол-1,2:
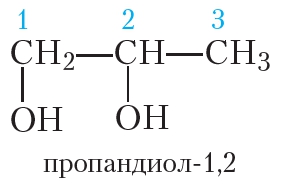
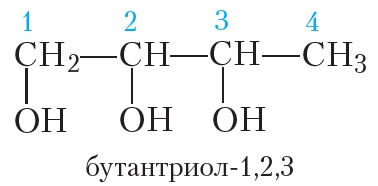
Ближайший гомолог глицерина — бутантриол-1,2,3:
Этиленгликоль сейчас в основном применяют для получения антифризов (смесей, замерзающих только при очень низких температурах). Второе применение - производство полиэтилентерефталата (ПЭТ).
Глицерин в основном применяли для производства взрывчатых веществ на основе тринитрата глицерина ("нитроглицерин"). Сейчас в связи с переходом на другие взрывчатые вещества, производство глицерина существенно сократилось. По большому счёту, он больше нигде не нужен.
Как не нужен? Его же в ликеры добавляют! Применяют и в других отраслях пищевой промышленности. А также в разных в медицинских и косметических препаратах. В википедии еще указано: "табачное производство, электронные сигареты, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке)". А в "Хим. энциклопедии" - для производства "глифталевых смол (см. Алкидные смолы), как мягчитель для тканей, кожи, бумаги, компонент эмульгаторов, антифризов, смазок, кремов для обуви, мыл и клеев, парфюм. и косметич. препаратов, мед. мазей, ликеров, кондитерских изделий". Так что без глицерина мы никуда.
Вот о глифталевых смолах я и забыл. А остальные применения настолько мелкие, что о них не стоит и упоминать. Этиленгликоль производится и применяется тысячами тонн. Когда глицерин производился для производства "нитроглицерина ", то тоже производился тысячами тонн. А на всё остальное, приведённое Вами, вернее в википедии, достаточно нескольких десятков тонн (я имею в виду мировое производство).
Да, несколько десятков тонн в год - это не крупнотоннажное производство. Говоря словами аналитиков - "полумикромасшт аб". Но все же применение.
Когда-то в молодости я работал в научно-исследовательском секторе ВУЗа. Мне приходилось встречать статьи, в которых описывались соединения (циклические ацетали) на основе 2-бром-2-нитро-1,3-пропандиола. Более близкого к "нитроглицерину" соединения я не встречал.
Полагаю, что наверное можно каким-то образом провести реакцию замещения брома на гидроксильную группу, и получить искомый "нитроглицерин".
Всё очень просто, главное аккуратно перевести единицы измерения.
Как известно, литр - это кубический дециметр. В метре - 10 дециметров, а в кубическом - 10^3 Дм.
Следовательно, литр это м3/1000, а м3=1000 литров (пришли к банальной вещи сложным путём, зато верно).
В килограмме 1000 грамм.
То есть кг/м3=1000г/1000л=г/ л.
Соответственно 30 кг/м3 = 30 г/л.
Глицирин прекрасно смешивается с водой. Он даже поглощает влагу из воздуха (если в помещении есть влажность). Косметические средства на основе глицирина увлажняют кожу лица, рук,придает эластичность, но не забываем способность вытягивать воду, поэтому крем наносить только во влажных помещениях, например в ванной комнате.
Если в муку добавлено слишком мало воды, то она превратится в плотный ком теста.

Добавим в муку побольше воды - получим очень жидкое тесто из которого получаются такие вкусные блинчики.

Но если мы возьмём совсем мало муки и большое количество воды, то мука разведётся в воде.

Вода приобретает беловато-мутноватый цвет. Если этому настою дать постоять, то через некоторое время можно увидеть как на дне стакана образуется осадок в виде серовато-беловатых хлопьев. Если такой раствор постоянно подогревать и помешивать, то мы сможем получить клейстер.
Значит, мука не растворилась в воде и даже сохранила свои качества - образовывать клейковину при нагревании.
Что такое газы? Газами мы называем вещества, температура кипения которых ниже "комнатной".
Альдегиды - органические вещества. Различия в свойствах органических веществ обусловлены в первую очередь количеством атомов углерода, входящих в молекулу. Так, если рассматривать простейшие органические вещества - углеводороды, то первые 4 их представителя - газообразные вещества, и только начиная с пятиуглеродных молекул (пентаны) углеводороды - жидкие. Замена части атомов водорода другими (более тяжёлыми!) атомами приводит к незначительному повышению температур кипения, но тем не менее, например монохлорпроизводные метана и этана - остаются газами. Кислородсодержащие вещества имеют значительно более высокие температуры кипения из-за возможности образования водородных связей. Однако в альдегидах образование водородных связей - невозможно, поэтому они, в отличие от спиртов и кислот с тем же количеством атомов углерода в молекуле, имеют более низкие температуры кипения, из-за этого первые два представителя альдегидов - в обычных условиях газообразны.
Если о некоторых химических веществах, с которыми люди сталкиваются каждый день, они не имеют не малейшего представления, то другие – постоянно на слуху. Например, глицерин. Увлажняющие и стабилизирующие свойства прочно закрепили вещество в косметической и пищевой промышленности, но они же вытеснили его из других: военной сферы и сектора охлаждающих жидкостей, где предпочли перейти на этиленгликоль.

Что нужно знать о глицерине?
Глицерин – это вязкая прозрачная жидкость без запаха со сладким вкусом. Он относится к простейшим трёхатомным спиртам. Вещество гигроскопично и хорошо растворяется в воде и спиртах.
Глицерин имеет низкую температуру плавления – меньше 20 °C и высокую – кипения, она близка к 300 °C.
Глицерин применяется достаточно широко. Это определили:
- доступность – он входит в состав почти всех растительных и животных жиров;
- нетоксичность;
- экономическая выгодность.
Один из основных способов получения глицерина – омыление жиров гидроксидами. Именно с помощью такой технологии он был впервые получен в 1779 году шведским химиком Карлом Вильгельмом Шееле при нагревании оливкового масла с оксидом свинца.
К середине века, в 1853 году Ричард А. Тилгман открыл еще один промышленный способ получения глицерина – нагревание жиров и воды под давлением до 200 °C. Позже был придуман синтетический метод производства с помощью хлорирования пропилена при высоких температурах и последующем омылении щелочью полученных на его основе хлоргидринов. Сейчас глицерин – побочный продукт производства биотоплива.
Активно применяться в промышленности глицерин начал в начале XIX века в основном – в фармакологи. К середине века синтезированный на его основе продукт – нитроглицерин – получил распространение в качестве взрывчатого вещества. До сих пор по мощности его превосходит только ядерная бомба.
Нитроглицерин проиграл этиленгликолю
Как часто бывает в истории, сразу несколько ученых в разных концах света почти одновременно пришли к его созданию:
- в 1847 году нитроглицерин получил итальянский химик Асканио Собреро;
- в 1853 году русский химик Николай Зинин разработал метод получения нитроглицерина из глицерина с использованием концентрированной азотной кислоты при низких температурах. Также он предложил способы применения вещества в качестве взрывчатки.
Главной слабостью нитроглицерина была его нестабильность – он мог взорваться в любой момент от производства до хранения.
Но наиболее распространенный продукт в этой области с применением нитроглицерина разработал в 1863 году швед Альфред Нобель. После многих неудачных экспериментов и целой серии взрывов на производствах и при перевозке он создал динамит, пропитав нитроглицерином диатомит – почти сплошь состоящую из пор инфузорную землю. При этом запатентован продукт был только в 1867 году после серии экспериментов.
Однако создатель динамита так и не добился его полной безопасности, и тот требовал квалифицированного обращения, а также имел ряд принципиальных для военного дела ограничений: его нельзя было долго хранить, а также прессовать.
С 1925 года дефицитный на тот момент глицерин в сфере взрывчатых веществ начал заменять этиленгликоль, а к 1930-ому году новое вещество использовалось уже практически всеми производителями динамита. Впоследствии его заменил менее требовательный к себе тротил.
Новое время требует новых решений
Аналогичная ситуация произошла и в другой области применения глицерина – в качестве компонента охлаждающей жидкости. При разведении с водой он мог не замерзать до -40°C, но его использование в сложных механизмах вызывало ряд вопросов.
Антифриз на базе глицерина часто оставался слишком вязким и недостаточно текучим. Этот недостаток пытались решить, разбавляя его этанолом и метанолом, но в итоге в 1930 годы также заменили глицерин на этиленгликоль, как на более удобный и доступный вариант.
Хотя на рынке охлаждающих жидкостей до сих пор встречаются глицериново-метанольная продукция, от ее использования специалисты активно отговаривают. Основной аргумент – вязкость растворов с глицерином не может гарантировать необходимую циркуляцию в механизмах, что может привести к перегреву агрегатов. Подобный антифриз приводит к коррозии при длительном использовании.
Во многих странах, в том числе в Европе, антифриз на основе глицерина запрещен законодательно. Но в Китае этот вариант с учетом его более низкой стоимости активно используется.
Гораздо более широкое распространение в современной промышленности глицерин получил в косметической сфере и секторе бытовой химии, где он используется в кремах, мыле и шампунях. Помимо этого, вещество активно применяется в пищевой промышленности в качестве стабилизатора – пищевая добавка Е422, позволяя увеличить срок хранения продукта. В небольших количествах он является совершенно безвредной для здоровья человека добавкой.
Гигроскопичность глицерина позволяет использовать его в табачном производстве для регулировки влажности продукции. В последние годы, помимо бумажных, набирают популярность электронные сигареты, основой работы которых являются растворы на базе глицерина. Также среди сфер его применения текстильное производство, фармацевтика, текстильная и кожевенная отрасли, бумажная и лакокрасочная промышленность.
Западная экспансия
Несмотря на существенное потребление – более 100 тысяч тонн, в России глицерин производится в очень небольших количествах.

Объем выпуска снизился почти на 2% к уровню прошлого года
Более 90% потребностей российского рынка покрывается за счет импорта. Одна из ключевых причин такой ситуации – недостаточно высокое качество внутреннего продукта, чистота которого должна стремиться к 100%, а в России зачастую не превышает 98%.
Внутренним производителям сложно конкурировать по экономической эффективности с западными поставщиками, для которых сырой глицерин – побочный продукт производства биодизеля – топлива на основе растительных компонентов.
Глицерин остается только дистиллировать до нужной чистоты с содержанием основного вещества не менее 99,5%. Основными импортерами глицерина в страну являются Германия, Бразилия, Германия и Украина.
Азия остается крупнейшим производителем глицерина на основе жирных кислот – на нее приходится около 80% производства этим способом. Однако продукт, сделанный традиционным методом, в последние годы занимает менее 10% в глобальном объеме выпуска вместе с синтетическим глицерином.
Неоднозначные перспективы
В целом потребление глицерина сокращается во всем мире из-за сужения сфер его применения, например, замены кускового мыла жидким. Также с активным переходом Европы в рамках Парижского соглашения по климату на безуглеровозобновляемую энергетику и планами по переводу транспорта на электрические и водородные двигатели снижается интерес к биодизелю, от объемов производства которого напрямую зависит выпуск и биоглицерина.
В то же время, по мнению экспертов, в ряде других отраслей – пищевой и косметической – спрос на глицерин останется стабильным еще долгие годы.
В следующем материале мы подробно расскажем, почему антифриз и теплоносители на основе глицерина проигрывают своим собратьям на базе этиленгликоля! Подписывайтесь на рассылку, чтобы ничего не пропустить!
Производители моноэтиленгликоля, использующие сжиженные углеводородные газы (СУГ) в качестве сырья, в январе смогли увеличить маржинальность производств на фоне снижения его стоимости. Но эксперты предупреждают, что такая ситуация сохранится недолго с учетом активного роста цены на нефть.
Этиленгликоль — один из ключевых видов сырья в химической промышленности. До сих пор его получали почти исключительно из ископаемого топлива, но развитие биотехнологий делает возможным коммерческое производство на основе возобновляемых ресурсов, например, сахарного тростника или кукурузы.
Читайте также:
- Метод изучения педагогической документации в доу
- Не пойдет в школу как писать правильно
- Какую роль может сыграть велосипед для подготовки будущего водителя транспортного средства кратко
- Система оценки результативности профориентационной деятельности воспитателя доу учителя ноо
- Проект птицы в старшей группе детском саду

