Дан раствор слабого электролита как увеличить степень его диссоциации кратко
Обновлено: 05.07.2024
В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита:
где α— степень диссоциации;
п — количество ионов в растворе;
N— общее число молекул в растворе.
По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
В растворах слабых электролитов процесс диссоциации протекает обратимо и его можно представить в виде обратимой химической реакции. Так, для процесса диссоциации уксусной кислоты:
константа равновесия этого процесса будет равна:
где [СНзСОО-], [Н+] — концентрация ионов;
[СН3СООН] — концентрация непродиссоциированных молекул.
Константа равновесия, соответствующая диссоциации слабого электролита, называется константой диссоциации.
Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, температуры и не зависит от концентрации раствора.
Константа диссоциации показывает устойчивость молекул вещества к диссоциации. Чем меньше значение константы диссоциации в данном растворе, тем слабее диссоциирует электролит.
Степень диссоциации a изменяется с изменением концентрации раствора. Рассмотрим эту зависимость на примере слабого электролита уксусной кислоты:
Принимая исходную концентрацию кислоты равной с, а степень диссоциация a, получаем, что концентрация части кислоты, которая диссоциирована, будет равна aс. Так как при диссоциации одной молекулы кислоты образуется по одному иону Н+ и СНзСОО-, то их концентрации будут равны aс. Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна с — aс = с(1 — a). Подставив значения равновесных концентраций ионов и кислоты в уравнение (5.2), получим:
Пример 3. Вычислите степень диссоциации хлорноватистой кислоты и концентрацию ионов водорода в растворе с молярной концентрацией 0,05 моль/дм3.
Решение. НСlO — слабый электролит: HCIO « Н+ + СlO-. Следовательно, в соответствии с законом разбавления Оствальда (5.4, б), определяем степень диссоциации:
Кдис(НСlO) = 5×10-8 моль/дм3.
Молярную концентрацию определяем по формуле (5.5). Так как при диссоциации НС1О « Н++ СlO- образуется один ион Н+ (k(Н+) =1), то
Ответ: a(HClO) = 1 ×10-3; с(Н+) = 5×10 5 моль/дм3.
Пример 4. Степень диссоциации уксусной кислоты в 0,1 моль/дм3 растворе равна 1,32×10 -2. Вычислите константу диссоциации кислоты.
Решение. В уравнение закона разбавления Оствальда (5.3) подставим данные:
Ионное произведение воды, водородный показатель (рН). Вода является слабым электролитом и диссоциирует на ионы в незначительной степени. Процесс диссоциации воды может быть записан уравнением:
Константа диссоциации будет равна:
Преобразуем выражение (5.7) к следующему виду:
Концентрацию молекул воды можно рассчитать, разделив массу 1 дм3 на массу 1 моля:
моль/дм3; Кдис =1,8×10 -16.
Произведение двух постоянных величин есть величина постоянная
Полученное уравнение показывает, что для воды и разбавленных водных растворов при постоянной температуре произведение концентрации ионов водорода и гидроксила есть величина постоянная.
Эта постоянная величина называется ионным произведением воды.
Численное значение ионного произведения равно:
Таким образом, произведение концентрации ионов водорода и гидроксильных ионов в растворе при температуре 295 К равно 10-14.
Отсюда, для чистой воды концентрация ионов при температуре 295 К равна:
Если к чистой воде добавить кислоту, то часть ионов Н+ кислоты соединится с ионами ОН- и образуются молекулы воды. При этом концентрация Н+ возрастает, концентрация ОН- уменьшается, а произведение этих концентраций будет оставаться постоянным, равным 10-14 .
Допустим, что концентрация ионов водорода при добавлении кислоты увеличилась в 1000 раз и стала [Н+] = 10-4 моль/дм3, тогда концентрация ионов [ОН-] в растворе будет равна:
Мы получаем, что в растворах с различной средой всегда присутствуют ионы Н+ и ОН-.
Если: [Н+] = [ОН-] = 10 -7 — нейтральная среда;
[Н+] > [ОН-] > 10 -7 — кислая среда;
Для характеристики кислотности (щелочности) среды введен специальный параметр — водородный показатель, или рН. Водородным показателем, или рН, называется взятый с обратным знаком десятичный логарифм концентрации ионов водорода в растворе:

0,1 нормальный раствор - децинормальный.
Мольная доля - это величина, характеризующая отношение количества молей данного вещества к общему количеству молей всех веществ, находящихся в смеси или растворе. Для того чтобы определить мольные доли веществ, необходима лишь таблица Менделеева и элементарное умение совершать вычисления.
Чтобы определить мольную долю того или иного вещества, вам понадобится сначала вычислить количество молей и этого вещества и всех других веществ, содержащихся в смеси (растворе), потом подставить эти величины в следующую формулу:Х = n1/Σn , где Х – мольная доля интересующего нас вещества, n1 – количество его молей, а Σn – сумма количества молей всех имеющихся веществ.
Электролитическая диссоциация. Влияние природы вещества на его способность к электролитической диссоциации в водном растворе. Гидратация ионов в растворе. Основания и кислоты с точки зрения теории электролитической диссоциации. Ион гидроксония. Амфотерные гидроксиды. Кислотно-основной характер диссоциации. Диссоциация средних, кислых и основных солей.
Под электролитической диссоциацией понимают распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов. Например, молекула уксусной кислоты так диссоциирует в водном растворе:
CH3COOH === + СО
Процесс диссоциации во всех случаях является обратимым, поэтому при надписи уравнений диссоциации применяется знак обратимости(стрелочки –туда и обратно).
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Гидратация ионов во многом определяет их поведение в растворе — она влияет на скорость передвижения ионов, на условия их взаимного сближения и адсорбции на разделах фаз. Чем больше и устойчивей гидратная оболочка, тем труднее перемещаться ионам в воде и сближаться друг с другом или адсорбироваться.
С точки зрения теории электролитической диссоциации основания — это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид-ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
NаОН « Na+ + OH-; Ва(ОН)2 « Ba2+ + 2OH-; NH3·H2O « NH4+ + OH-.
С точки зрения теории электролитической диссоциации кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н+,
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
СН3СООН = Н+ + СН3СОО-.
Гидроксо́ний (оксоний, гидроний) НзО+ — комплексный ион, соединение протона с молекулой воды.
Амфоте́рные гидрокси́ды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или осно́вных гидроксидов.
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:

В ряде случаев промежуточным продуктом при разложении является метагидроксид, например:


При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:

При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:

Соли – это электролиты, которые диссоциируют в растворе на катионы металлов (и NH4+) и анионы кислотных остатков. Соли по своему составу бывают кислые, основные и средние. Кислые соли характерны для слабых многоосновных кислот, основные – для слабых многокислотных оснований, а средние соли могут быть образованы как сильными, так и слабыми кислотами и основаниями. Однако независимо от состава, соли первично диссоциируют на катион металла и кислотный остаток.
Средняя соль AICI3 Û AI+3 + 3CI- , ZnSO4 Û Zn+2 + SO42-.
Кислая соль KHCO3 Û K+ + HCO3- NaH2PO4 Û Na+ + H2PO4
Основная соль- ZnOHCI Û ZnOH+ + CI- Cr(OH)2NO3 Û Cr(OH)2+ + NO3-
Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации. Основные представления теории сильных электролитов. Истинная и кажущаяся степень диссоциации в растворах сильных электролитов. Концентрация ионов в растворе и активность.

В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита: α = п/N ,
где α— степень диссоциации; п - количество ионов в растворе;
N— общее число молекул в растворе.
По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Электролиты, степень диссоциации которых в растворах α K2 > K3 = 8 · 10-3 > 6 · 10-8>10-12
Суммарному равновесию: H3PO4 ↔ 3H+ + PO43- отвечает суммарная константа диссоциации: K = K1· K2 ·K3
Закон разбавления Оствальда. Степень диссоциации определяется константой диссоциации и концентрацией слабого электролита в растворе.
Рассмотрим равновесные молярные концентрации исходного слабого электролита и образовавшихся катионов и анионов в состоянии химического равновесия:
| Молярные концентрации веществ В начальный момент времени (τ0) К моменту достижения равновесия (τравн.) | MA с0 [MA] = (1−α )с0 | M+ [M+] = αс0 | A− [A−] = αс0 |

Данное выражение было впервые выведено немецким физико-химиком В. Оствальдом (закон разбавления Оствальда). Закон разбавления показывает, что степень диссоциации данного слабого электролита зависит от его концентрации и константы диссоциации. Последняя в данном растворителе и для данного электролита зависит только от температуры.
При очень низкой степени диссоциации (α о С), она называется ионным произведением воды KW:
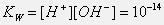
Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100 о С значения 10 -13 .
В чистой воде при 25 о С концентрации ионов водорода и гидроксила равны между собой:
[H + ] = [OH - ] = 10 -7 моль/л
Растворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными.
Если к чистой воде прибавить кислоту, концентрация ионов водорда повысится и станет больше, чем 10 -7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение 10 -14 . Тоже самое будет происходить и при добавлении к чистой воде щелочи. Концентрации
ионов водорода и гидроксила связаны между собой через ионное произведение, поэтому, зная концентрацию одного из ионов, легко вычислить концентрацию другого. Например, если [H + ] = 10 -3 моль/л, то [OH - ] = KW/[H + ] = 10 -14 /10 -3 = 10 -11 моль/л, или, если [OH - ] = 10 -2 моль/л, то [H + ] = KW/[OH - ] = 10 -14 /10 -2 = 10 -12 моль/л. Таким образом, концентрация ионов водорода или гидроксила может служить количественной характеристикой кислотности или щелочности среды.
На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями.
Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода:
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила:
Легко показать, прологарифмировав ионное произведение воды, что
Если рН среды равен 7 - среда нейтральная, если меньше 7 - кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила.
это число эквивалентов в 1 литре раствора. Обозначают символом Сн

0,1 нормальный раствор - децинормальный.
Мольная доля - это величина, характеризующая отношение количества молей данного вещества к общему количеству молей всех веществ, находящихся в смеси или растворе. Для того чтобы определить мольные доли веществ, необходима лишь таблица Менделеева и элементарное умение совершать вычисления.
Чтобы определить мольную долю того или иного вещества, вам понадобится сначала вычислить количество молей и этого вещества и всех других веществ, содержащихся в смеси (растворе), потом подставить эти величины в следующую формулу:Х = n1/Σn , где Х – мольная доля интересующего нас вещества, n1 – количество его молей, а Σn – сумма количества молей всех имеющихся веществ.
Электролитическая диссоциация. Влияние природы вещества на его способность к электролитической диссоциации в водном растворе. Гидратация ионов в растворе. Основания и кислоты с точки зрения теории электролитической диссоциации. Ион гидроксония. Амфотерные гидроксиды. Кислотно-основной характер диссоциации. Диссоциация средних, кислых и основных солей.
Под электролитической диссоциацией понимают распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов. Например, молекула уксусной кислоты так диссоциирует в водном растворе:
CH3COOH === + СО
Процесс диссоциации во всех случаях является обратимым, поэтому при надписи уравнений диссоциации применяется знак обратимости(стрелочки –туда и обратно).
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Гидратация ионов во многом определяет их поведение в растворе — она влияет на скорость передвижения ионов, на условия их взаимного сближения и адсорбции на разделах фаз. Чем больше и устойчивей гидратная оболочка, тем труднее перемещаться ионам в воде и сближаться друг с другом или адсорбироваться.
С точки зрения теории электролитической диссоциации основания — это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид-ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
NаОН « Na+ + OH-; Ва(ОН)2 « Ba2+ + 2OH-; NH3·H2O « NH4+ + OH-.
С точки зрения теории электролитической диссоциации кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н+,
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
СН3СООН = Н+ + СН3СОО-.
Гидроксо́ний (оксоний, гидроний) НзО+ — комплексный ион, соединение протона с молекулой воды.
Амфоте́рные гидрокси́ды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или осно́вных гидроксидов.
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:

В ряде случаев промежуточным продуктом при разложении является метагидроксид, например:


При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:

При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:

Соли – это электролиты, которые диссоциируют в растворе на катионы металлов (и NH4+) и анионы кислотных остатков. Соли по своему составу бывают кислые, основные и средние. Кислые соли характерны для слабых многоосновных кислот, основные – для слабых многокислотных оснований, а средние соли могут быть образованы как сильными, так и слабыми кислотами и основаниями. Однако независимо от состава, соли первично диссоциируют на катион металла и кислотный остаток.
Средняя соль AICI3 Û AI+3 + 3CI- , ZnSO4 Û Zn+2 + SO42-.
Кислая соль KHCO3 Û K+ + HCO3- NaH2PO4 Û Na+ + H2PO4
Основная соль- ZnOHCI Û ZnOH+ + CI- Cr(OH)2NO3 Û Cr(OH)2+ + NO3-
Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации. Основные представления теории сильных электролитов. Истинная и кажущаяся степень диссоциации в растворах сильных электролитов. Концентрация ионов в растворе и активность.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита: α = п/N ,
где α— степень диссоциации; п - количество ионов в растворе;
N— общее число молекул в растворе.
По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Электролиты, степень диссоциации которых в растворах α K2 > K3 = 8 · 10-3 > 6 · 10-8>10-12
Суммарному равновесию: H3PO4 ↔ 3H+ + PO43- отвечает суммарная константа диссоциации: K = K1· K2 ·K3
Закон разбавления Оствальда. Степень диссоциации определяется константой диссоциации и концентрацией слабого электролита в растворе.
Рассмотрим равновесные молярные концентрации исходного слабого электролита и образовавшихся катионов и анионов в состоянии химического равновесия:
| Молярные концентрации веществ В начальный момент времени (τ0) К моменту достижения равновесия (τравн.) | MA с0 [MA] = (1−α )с0 | M+ [M+] = αс0 | A− [A−] = αс0 |

Данное выражение было впервые выведено немецким физико-химиком В. Оствальдом (закон разбавления Оствальда). Закон разбавления показывает, что степень диссоциации данного слабого электролита зависит от его концентрации и константы диссоциации. Последняя в данном растворителе и для данного электролита зависит только от температуры.
При очень низкой степени диссоциации (α о С), она называется ионным произведением воды KW:
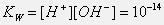
Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100 о С значения 10 -13 .
В чистой воде при 25 о С концентрации ионов водорода и гидроксила равны между собой:
[H + ] = [OH - ] = 10 -7 моль/л
Растворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными.
Если к чистой воде прибавить кислоту, концентрация ионов водорда повысится и станет больше, чем 10 -7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение 10 -14 . Тоже самое будет происходить и при добавлении к чистой воде щелочи. Концентрации
ионов водорода и гидроксила связаны между собой через ионное произведение, поэтому, зная концентрацию одного из ионов, легко вычислить концентрацию другого. Например, если [H + ] = 10 -3 моль/л, то [OH - ] = KW/[H + ] = 10 -14 /10 -3 = 10 -11 моль/л, или, если [OH - ] = 10 -2 моль/л, то [H + ] = KW/[OH - ] = 10 -14 /10 -2 = 10 -12 моль/л. Таким образом, концентрация ионов водорода или гидроксила может служить количественной характеристикой кислотности или щелочности среды.
На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями.
Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода:
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила:
Легко показать, прологарифмировав ионное произведение воды, что
Если рН среды равен 7 - среда нейтральная, если меньше 7 - кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила.
Читайте также:

