Что такое водород простыми словами кратко и понятно для детей
Обновлено: 04.07.2024
Водород — самый легкий химический элемент, занимающий в периодической таблице Менделеева начальное место.
Его атомный номер — единица. На одноатомную форму водорода приходится около 75% барионной массы, она считается самым распространенным веществом во всей Вселенной. Водородная плазма — основное вещество звезд, за исключением компактных.
У водорода три изотопа:
- протий (1H);
- дейтерий (2H);
- тритий (3H).
К общим характеристикам относятся следующие свойства: не имеет цвета запаха, вкуса. Двухатомная форма ( Н 2 ) нетоксична, однако в соединении с воздухом (или О 2 ) пожароопасна и склонна к взрывам. Взрывоопасность также проявляется в присутствии прочих газов-окислителей, например, фтора, хлора.
На Земле водород присутствует в составе молекулярных соединений, например, вода. Его роль в кислотно-основных реакциях трудно переоценить.
Нахождение в природе, изучение его свойств
Звездная температура позволяет существовать водороду в виде плазмы. Это примерно 6000оС. Однако пространство между звездами заполнено отдельными молекулами, атомами и ионами, которые зачастую образовывают молекулярные скопления различных размеров и форм — облака. Плотность вещества при этом не является постоянной величиной, как и его температура.
В коре Земли водород считается десятым по распространенности элементом. Его массовая доля равна 1%. В то же время по числу атомов он достигает 17%. Это второе место после кислорода, доля которого равна 52%. Отсюда и значительная роль водорода в природе, особенно в химических превращениях.
Водород, в отличие от кислорода, не может существовать в свободном состоянии, только в связанном. Исключение составляет атмосфера, в сухом остатке которой 0,00005% простого вещества — водорода.
Все органические вещества включают в свой состав водород. Велика его доля в живых клетках (по количеству атомов его удельный вес достигает 63%).
В составе воды водород имеет большое значение в протекании геохимических процессов. Так, вулканические газы вызывают истечение определенных количестве водорода вдоль разломов (причина — рифтогенез). По этой же причине часто обнаруживают водород в районе угольных месторождений.
Натуральные минералы могут содержать Н 2 в виде ионов аммония, гидроксил-ионов и воды.
Причина появления молекул Н 2 в атмосфере — разложение формальдегида — участника окисления метана и прочих органических соединений. Кроме того, причина его образования — неполное сгорание топлива и биомассы, фиксация азота некоторыми микроорганизмами, содержащимися в воздухе.
Молекулы водорода легкие, поэтому имеют высокую тепловую скорость. При попадании в верхние слои атмосферы такие молекулы часто улетают в космос, при этом их потери могут достигать 3 кг каждую секунду.
Химические и физические свойства
Начиная говорить о химических свойствах водорода, нужно отметить чрезвычайную прочность его двухатомной молекулы. Для того, чтобы она распалась и атомы могли провзаимодействовать с другими участниками химической реакции, необходима энергия:
1 2 H 2 → 2 H - 432 к Д Ж
Обычные температурные условия обеспечивают протекание реакций только с металлами высокой активности, к примеру, с кальцием:
1 2 C a + H 2 → C a H 2
Исключение составляет реакция с фтором, продуктом которой является фтороводород:
1 2 F 2 + H 2 → 2 H F
Если имеется возможность повышения температуры (либо при другом воздействии, к примеру, освещении), водород может вступать в реакцию с большинством металлов и неметаллов:
1 2 O 2 + 2 H 2 → 2 H 2 O
В реакциях с галогенами образуются галогеноводороды:
1 2 H 2 + F 2 → 2 H F (в темноте происходит взрыв)
1 2 H 2 + C l 2 → 2 H C l (на свету происходит взрыв)
В реакции с оксидами водород проявляет восстановительные свойства:
1 2 C u O + H 2 → H 2 O + C u
Высокая температура делает возможной реакцию с сажей:
1 2 C + 2 H 2 → C H 4
Когда активные металлы соединяются с водородом, образуются гидриды, например гидрид натрия (NaH), гидрид кальция ( C a H 2 ), гидрид магния ( M g H 2 ). Эти солеобразные твердые, легко гидролизирующиеся вещества:
1 2 C a H 2 + 2 H 2 → C a ( O H ) 2 + 2 H 2
Оксиды металлов, реагируя с водородом, восстанавливаются с выделением воды:
1 2 F e 2 O 3 + 3 H 2 → 2 F e + 3 H 2 O
Благодаря свойствам водорода, он нашел применение для восстановления органических веществ. Протекают реакции с участием катализатора, а также при высоких параметрах давления и температуры. К примеру, насыщенные алканы образуются в результате гидрирования ненасыщенных алкенов и алкинов.
Физические свойства водорода:
- В 14,5 раз легче воздуха. Поэтому молекулы движутся быстрее других молекул газов, передавая тепло.
- Имеет высокую теплопроводность (в 7 раз выше, чем у воздуха).
- Двухатомная молекула.
- Плотность — 0,08987 г/л, температура кипения-252,76оС, удельная теплота сгорания — 120,9*106Дж/кг, растворимость в воде — 18,8 мл/л
Хорошо растворяется в металлах, поэтому способен диффундировать в них. В серебре не растворим.
Получение водорода, как добыть вытеснением из воды
Потребление в мире водорода составляет порядка 75 млн т. Основная масса приходится на нефтепереработку и производство аммиака. Получение водорода для таких промышленных нужд происходит в основном из природного газа (его расход составляет 205 млрд м3). Оставшуюся часть берут из угля. Примерно 100 тыс т вырабатывают с помощью реакции электролиза.
Получение водорода сопровождается поступлением в атмосферу 830 млн т углекислого газа. Стоимость получения водорода из газа составляет от полутора до трех долларов за каждый кг.
Получение водорода методом электролиза в химии выглядит так:
1 2 2 N a C l + 2 H 2 O → 2 N a O H + C l 2 + H 2
Метод конверсии метана при температуре 1000оС с водяными парами:
1 2 C H 4 + H 2 O ↔ C O + 3 H 2
Следующий способ получения — пропускание водяных паров над горящим коксом (температура не менее 1000оС):
1 2 H 2 O + С ↔ С O + H 2
Свободный водород выделяется в результате реакции катализа окислением кислородом:
1 2 2 C H 4 + O 2 ↔ 2 C O + 4 H 2
В промышленности H2 часто получают путем электролиза водных растворов активных металлов:
1 2 2 H 2 O → 4 e - 2 H 2 ↑ + O 2 ↑
а также путем крекинга и риформинга углеводородов при переработке нефти.
Существуют способы получения Н2 лабораторными способами:
- Металл + разбавленная кислота: 1 2 Z n + H 2 S O 4 → Z n S O 4 + H 2 ↑
- Реакция кальция с водой: 1 2 C a + 2 H 2 O → C a ( O H ) 2 + H 2 ↑
- Гидролиз гидридов металлов: 1 2 N a H + H 2 O → N a O H + H 2 ↑
- Взаимодействие щелочи с цинком (алюминием): 1 2 2 A l + 2 N a O H + 6 H 2 O → 2 N a ( A l ( O H ) 4 ) + 3 H 2
- В результате электролиза водных растворов щелочей либо кислот: 1 2 2 H 3 O + + 2 e - → 2 H 2 O + H 2 ↑
В промышленности используется очистка водорода из сырья, которое содержит углерод (в частности — водородсодержащий газ ВСГ). Методы следующие:
- ВСГ придают температуру конденсации метана и этана -158оС и давление 4МПа. При концентрации в сырье 40% процент очищенного водорода доходит до 93-94%. Такой метод называется низкотемпературной конденсацией.
- Адсорбционное выделение на цеолитах.
- Абсорбционное выделение жидкими растворителями.
- Мембранное концентрирование.
- Селективное поглощение металлами.
Получение и собирание водорода в домашних условиях, техника безопасности
Чтобы образовавшийся водород собрать, можно закрыть банку крышкой, сделав в ней отверстие, в которое вставить трубку. Второй конец трубки закрепить в воздушном шарике.
Поскольку водород является взрывоопасным веществом, делать это нужно крайне осторожно, начиная от момента возможного вытеснения крышки до конца процесса. Попадание водорода в воду приведет к образованию вещества, способного вызвать обморожение.
Особенности применения водорода
Водород используется во многих производственных сферах, что отражено в таблице:
| Применение | Доля |
| Производство аммиака | 54 % |
| Нефтепереработка и химическая промышленность | 35 % |
| Производство электроники | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
В химической промышленности активный водород идет на производство аммиака (50%), метанола (8%). В нефтеперерабатывающей — для гидрокрекинга и гидроочистки. На эти цели расходуется около 37% всего водорода, что производится.
Для химических лабораторий водород — газ-носитель для газовой хроматографии, а для метеорологии — наполнитель оболочек метеозондов.
Водород — ценное ракетное топливо, однако, ввиду незначительного диапазона температур, используется смесь жидкой и твердой фаз.
В электроэнергетике водород применяют для охлаждения электрогенераторов. Его высокая теплопроводность позволяет использовать газ для заполнения сфер гирокомпасов и колб LED-лампочек.

Атомы водорода образуют двухатомные молекулы простого вещества водорода, формула которого Н2. Рассмотрим, что имеют в виду, когда говорят о химическом элементе водороде.
Водород как химический элемент
Атом водорода самый легкий, самый простой по строению и один из самых маленьких по размерам. Относительная атомная масса водорода равна:
Сравните ее с относительной атомной массой кислорода и убедитесь, что атомы водорода во много раз легче.
Атомы водорода соединяются с атомами других химических элементов, образуя сложные вещества. Как химический элемент водород входит в состав воды, кислот, природного газа, нефти, глюкозы и многих других веществ. В растительных и животных организмах, включая и человеческий, химический элемент водород содержится главным образом в составе воды и самых разнообразных органических веществ.
Водород как простое вещество
Молекулы водорода образованы двумя атомами химического элемента водорода. Формула его Н2. Относительная молекулярная масса простого вещества водорода равна:
![]()
Следовательно, молярная масса водорода равна:
Молярный объем водорода, как кислорода и других газов при нормальных условиях, равен:
![]()
В виде простого вещества водород встречается на Земле лишь в небольшом количестве в вулканических и некоторых других природных газах. Молекулы водорода Н2 обнаружены в верхних слоях земной атмосферы. В Солнечной системе простое вещество водород входит в состав атмосферы планет — Юпитера, Сатурна, Урана.
На заметку: Недавние исследования Юпитера, самой большой планеты Солнечной системы, позволили ученым высказать предположение, что под водородной атмосферой этой планеты находится океан жидкого водорода. Глубина этого океана — десятки тысяч километров. Ядро планеты составляет оболочка, состоящая из твердого водорода.
История открытия водорода

Физические свойства водорода
Водород при нормальных условиях находится в газообразном состоянии. Это бесцветный газ, у которого нет запаха и вкуса.
Молекула водорода самая легкая из молекул всех веществ. Поэтому газообразный водород по плотности значительно уступает воздуху и кислороду — он в 14,5 раза легче воздуха и в 16 раз легче кислорода. В этом легко убедиться на опыте.
Если наполнить три одинаковых резиновых шарика водородом, углекислым газом и кислородом, крепко завязать их ниткой и выпустить из рук одновременно, то они поведут себя по-разному (рис. 94). Шарик с водородом быстро поднимется к потолку, а шарики с углекислым газом и кислородом опустятся на пол. Быстрее окажется на полу шарик с
углекислым газом.
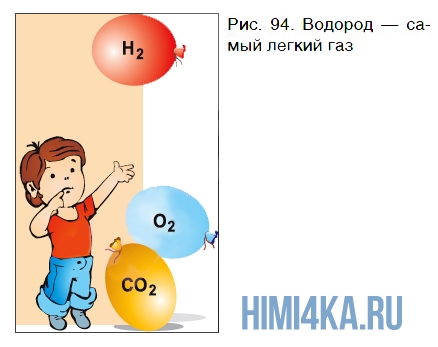
На заметку: Поскольку водород, как мы знаем, в 14,5 раза легче воздуха, им заполняли воздушные шары и дирижабли. Первыми поднялись на воздушном шаре французские физики Ф. Робер и Ж. Шарль (1783). В августе 1887 г. полет на воздушном шаре, наполненном водородом, с научной целью совершил Д. И. Менделеев.
На заметку: Некоторые металлы при повышенной температуре поглощают водород, впитывая его, как губка воду. Например, в образце металла палладия объемом 1 дм 3 растворяется водород объемом свыше 800 дм 3 . При нагревании насыщенного водородом палладия этот газ легко выделяется обратно. Палладий и некоторые другие металлы могут служить как бы аккумуляторами водорода.
При нормальных условиях растворимость водорода в воде меньше, чем кислорода, — 0,0016 г водорода на 1 дм 3 воды. Поскольку водород малорастворим, в лаборатории его собирают методом вытеснения воды или воздуха.
У водорода самые низкие после благородного газа гелия температуры кипения (−252,8 °С) и плавления (−259,2 °С).
Краткие выводы урока:
- Водород — наиболее распространенный элемент во Вселенной.
- Простое вещество водород Н2 — самый легкий газ, у которого нет запаха, цвета, вкуса.
- Водород мало растворяется в воде, его можно собирать методом вытеснения воды и воздуха.
Самым распространённым химическим элементом во Вселенной является водород. Это в своём роде точка отсчёта, потому что в таблице Менделеева его атомное число равняется единице. Человечество надеется, что сможет узнать о нём побольше как об одном из самых возможных транспортных средств в грядущем. Водород - это самый простой, самый лёгкий, самый распространённый элемент, его много повсюду - семьдесят пять процентов от всей массы вещества. Он есть в любой звезде, особенно много водорода в газовых гигантах. Его роль в звёздных реакциях синтеза является ключевой. Без водорода нет воды, а значит - нет и жизни. Все помнят, что молекула воды содержит один атом кислорода, а два атома в ней - водород. Это всем известная формула Н2О.

Как мы его используем
Обнаружил водород в 1766 году Генри Кавендиш, когда анализировал реакцию окисления металла. Через несколько лет наблюдений он понял, что в процессе горения водорода происходит образование воды. Ранее учёные выделяли этот элемент, но самостоятельным его не считали. В 1783 году водород получил имя гидроген (в переводе с греческого "гидро" - вода, а "ген" - рождать). Элемент, порождающий воду, - водород. Это газ, молекулярная формула которого Н2. Если температура близка к комнатной, а давление нормальное, этот элемент неощутим. Водород можно даже не уловить человеческими органами чувств - он безвкусен, не имеет цвета, лишён запаха. А вот под давлением и при температуре -252,87 С (очень большой холод!) этот газ разжижается. Так его и хранят, поскольку в виде газа он занимает гораздо больше места. Именно жидкий водород используют как ракетное топливо.
Водород может становиться твёрдым, металлическим, но для этого давление необходимо сверхвысокое, именно этим сейчас и занимаются самые видные учёные - физики и химики. Уже сейчас этот элемент служит альтернативным топливом для транспорта. Применение его похоже на то, как работает двигатель внутреннего сгорания: когда сжигают водород, высвобождается много его химической энергии. Также практически разработан способ создания топливного элемента на его основе: при соединении с кислородом происходит реакция, а посредством этого образуются вода и электричество. Возможно, скоро транспорт "пересядет" вместо бензина на водород - масса автомобилестроителей интересуется созданием альтернативных горючих материалов, есть и успехи. Но чисто водородный двигатель пока в перспективе, здесь множество трудностей. Однако и преимущества таковы, что создание топливного бака с твёрдым водородом идёт полным ходом, и учёные и инженеры отступать не собираются.

Основные сведения
Hydrogenium (лат.) - водород, первый порядковый номер в таблице Менделеева, обозначается Н. Атом водорода имеет массу 1,0079, это газ, не имеющий при обычных условиях ни вкуса, ни запаха, ни цвета. Химики с шестнадцатого века описывали некий горючий газ, обозначая его по-разному. Но получался он у всех при одинаковых условиях - когда на металл воздействует кислота. Водород даже самим Кавендишем много лет назывался просто "горючий воздух". Лишь в 1783 году Лавуазье доказал, что вода имеет сложный состав, путём синтеза и анализа, а через четыре года он же и дал "горючему воздуху" его современное название. Корень этого сложного слова широко употребляется, когда нужно называть соединения водорода и какие-либо процессы, в которых он участвует. Например, гидрогенизация, гидрид и тому подобное. А русское название предложил в 1824 году М. Соловьёв.
В природе распространение этого элемента не имеет равных. В литосфере и гидросфере земной коры его масса - один процент, зато атомов водорода - целых шестнадцать процентов. Наиболее распространена на Земле вода, и 11,19% по массе в ней - водород. Также он непременно присутствует практически во всех соединениях, из которых состоят нефть, уголь, все природные газы, глина. Есть водород и во всех организмах растений и животных - в составе белков, жиров, нуклеиновых кислот, углеводов и так далее. Свободное состояние для водорода не характерно и почти не встречается - его очень немного в природных и вулканических газах. Совсем ничтожный объем водорода в атмосфере - 0,0001%, по количеству атомов. Зато целые потоки протонов представляют водород в околоземном пространстве, из него состоит внутренний радиационный пояс нашей планеты.

Космос
В космосе ни один элемент не встречается так часто, как водород. Объем водорода в составе элементов Солнца - более половины его массы. Большинство звёзд образует водород, находящийся в виде плазмы. Основная часть разнообразных газов туманностей и межзвёздной среды тоже состояит из водорода. Он присутствует в кометах, в атмосфере целого ряда планет. Естественно, не в чистом виде, - то как свободный Н2, то как метан СН4, то как аммиак NH3, даже как вода Н2О. Очень часто встречаются радикалы СН, NH, SiN, OH, РН и тому подобные. Как поток протонов водород является частью корпускулярного солнечного излучения и космических лучей.
В обычном водороде смесь двух устойчивых изотопов - это лёгкий водород (или протий 1 Н) и тяжёлый водород (или дейтерий - 2 Н или D). Есть и другие изотопы: радиоактивный тритий - 3 Н или Т, иначе - сверхтяжёлый водород. А ещё очень неустойчивый 4 Н. В природе соединение водорода содержит изотопы в таких пропорциях: на один атом дейтерия приходится 6800 атомов протия. Тритий образуется в атмосфере из азота, на который воздействуют нейтроны космических лучей, но ничтожно мало. Что обозначают числа массы изотопов? Цифра указывает, что ядро протия - только с одним протоном, а у дейтерия в ядре атома не только протон, но и нейтрон. У трития в ядре к одному протону уже два нейтрона. А вот 4 Н содержит три нейтрона на один протон. Поэтому физические свойства и химические у изотопов водорода очень сильно отличаются по сравнению с изотопами всех других элементов, - слишком большое различие масс.

Строение и физические свойства
По строению атом водород наиболее прост по сравнению со всеми другими элементами: одно ядро - один электрон. Потенциал ионизации - энергия связи ядра с электроном - 13,595 электронвольт (eV). Именно из-за простоты этого строения атом водорода удобен как модель в квантовой механике, когда нужно рассчитать энергетические уровни более сложных атомов. В молекуле Н2 - два атома, которые соединены химической ковалентной связью. Энергия распада очень велика. Атомарный водород может образоваться в химических реакциях, например цинка и соляной кислоты. Однако взаимодействие с водородом практически не происходит - атомарное состояние водорода очень коротко, атомы сразу рекомбинируют в молекулы Н2.
С физической точки зрения водород легче всех известных веществ - более чем в четырнадцать раз легче воздуха (вспомним улетающие воздушные шарики на праздниках - внутри у них как раз водород). Однако он умеет кипеть, сжижаться, плавиться, затвердевать, и только гелий кипит и плавится при более низких температурах. Сжижать его сложно, нужна температура ниже -240 градусов по Цельсию. Зато теплопроводность он имеет очень высокую. В воде почти не растворяется, зато прекрасно происходит взаимодействие с водородом металлов - он растворяется почти во всех, лучше всего в палладии (на один его объем водорода уходит восемьсот пятьдесят объемов). Жидкий водород лёгок и текуч, а когда растворяется в металлах, часто разрушает сплавы из-за взаимодействия с углеродом (сталь, например), происходит диффузия, декарбонизация.

Химические свойства
В соединениях по большей части водород показывает степень окисления (валентность) +1, как натрий и другие щелочные металлы. Его и рассматривают как их аналог, стоящий во главе первой группы системы Менделеева. Но ион водорода в гидридах металлов заряжен отрицательно, со степенью окисления -1. Также этот элемент близок к галогенам, которые даже способны замещать его в органических соединениях. Значит, водород можно отнести и к седьмой группе системы Менделеева. В обычных условиях молекулы водорода активностью не отличаются, соединяясь только с самыми активными неметаллами: хорошо с фтором, а если светло - с хлором. Но при нагревании водород становится другим - он со многими элементами вступает в реакцию. Атомарный водород по сравнению с молекулярным очень активен химически, так в связи с кислородом образуется вода, а попутно выделяется энергия и тепло. При комнатной температуре эта реакция очень медленная, зато при нагревании выше пятисот пятидесяти градусов получается взрыв.
Используется водород для восстановления металлов, потому что у их оксидов он отнимает кислород. Со фтором водород образует взрыв даже в темноте и при минус двухсот пятидесяти двух градусах по Цельсию. Хлор и бром возбуждают водород только при нагревании или освещении, а йод - только при нагревании. Водород с азотом образует аммиак (так производятся большинство удобрений). При нагревании он очень активно взаимодействует с серой, и получается сероводород. С теллуром и селеном вызвать реакцию водорода трудно, а с чистым углеродом реакция происходит при очень высоких температурах, и получается метан. С оксидом углерода водород образует разные органические соединения, здесь влияют давление, температура, катализаторы, и всё это имеет огромное практическое значение. И вообще, роль водорода, а также и его соединений исключительно велика, поскольку он даёт кислотные свойства протонным кислотам. Со многими элементами образуется водородная связь, влияющая на свойства и неорганических и органических соединений.

Получение и применение
Получают водород в промышленных масштабах из природных газов - горючих, коксового, газов переработки нефти. Также его можно получить методом электролиза там, где электроэнергия не слишком дорога. Однако важнейшим способом производства водорода является каталитическое взаимодействие углеводородов, по большей части метана, с водяным паром, когда получается конверсия. Также широко применяется и способ окисления углеводородов кислородом. Добыча водорода из природного газа является самым дешёвым способом. Другие два - использование коксового газа и газа нефтепереработки - водород выделяется, когда сжижаются остальные компоненты. Они более легко поддаются сжижению, а для водорода, как мы помним, нужно -252 градуса.
Очень популярна в использовании перекись водорода. Лечение этим раствором применяется очень часто. Молекулярную формулу Н2О2 вряд ли назовут все те миллионы людей, которые хотят быть блондинками и осветляют себе волосы, а также и те, кто любит чистоту на кухне. Даже те, кто обрабатывает царапины, полученные от игры с котёнком, чаще всего не отдают себе отчёта, что применяют лечение водородом. Зато все знают историю: с 1852 года водород долгое время использовался в воздухоплавании. Дирижабль, изобретённый Генри Гиффардом, был создан на основе водорода. Их называли цеппелинами. Вытеснило цеппелины с небесных просторов стремительное развитие самолётостроения. В 1937 году произошла крупная авария, когда сгорел дирижабль "Гинденбург". После этого случая цеппелины более не использовались никогда. Зато в конце восемнадцатого века распространение воздушных шаров, наполненных водородом, было повсеместным. Помимо производства аммиака, сегодня водород необходим для изготовления метилового спирта и других спиртов, бензина, гидрогенизированного тяжёлого жидкого топлива и твёрдого топлива. Не обойтись без водорода при сварке, при резке металлов - она может быть кислородно-водородной и атомно-водородной. А тритий и дейтерий дают жизнь атомной энергетике. Это, как мы помним, изотопы водорода.

Неумывакин
Водород как химический элемент настолько хорош, что у него не могли не появиться собственные фанаты. Иван Павлович Неумывакин - доктор медицинских наук, профессор, лауреат Государственной премии и ещё много у него званий и наград, - в их числе. Будучи врачом традиционной медицины, он назван лучшим народным целителем России. Именно он разрабатывал многие методы и принципы оказания медицинской помощи космонавтам, находящимся в полёте. Именно он создал уникальный стационар - больницу на борту космического судна. В то же самое время был государственным координатором направления косметической медицины. Космос и косметика. Его увлечение водородом направлено не на то, чтобы сделать большие деньги, как это сейчас бытует в отечественной медицине, а напротив - научить народ вылечиваться от чего угодно буквально копеечным средством, без дополнительного посещения аптек.
Он пропагандирует лечение препаратом, который присутствует буквально в каждом доме. Это - перекись водорода. Неумывакина можно сколько угодно критиковать, он всё равно будет настаивать на своём: да, действительно, перекисью водорода можно вылечить буквально всё, потому что она насыщает внутренние клетки организма кислородом, разрушает токсины, нормализует кислотное и щелочное равновесие, а отсюда регенерируются ткани, омолаживается весь организм. Вылечившихся перекисью водорода пока ещё никто не видел и тем более не обследовал, однако Неумывакин утверждает, что, пользуясь этим средством, можно полностью избавиться от вирусных, бактериальных и грибковых заболеваний, предупредить развитие опухолей и атеросклероза, победить депрессию, омолодить организм и никогда не болеть ОРВИ и простудой.
Панацея
Иван Павлович уверен, что при грамотном использовании этого простейшего препарата и при соблюдении всех нехитрых инструкций можно победить очень многие болезни, среди которых и очень серьёзные. Список их огромен: от пародонтоза и ангины до инфарктов миокарда, инсультов и сахарного диабета. Такие пустяки, как гайморит или остеохондроз, улетают с первых сеансов лечения. Даже раковые опухоли пугаются и бегут от перекиси водорода, потому что стимулируется иммунитет, жизнь организма и его защита активизируются.
Лечить таким образом можно даже детей, разве что беременным женщинам лучше пока от употребления перекиси водорода воздержаться. Также не рекомендуется данный метод людям с пересаженными органами из-за возможной несовместимости тканей. Дозировка должна соблюдаться чётко: от одной капли до десяти, прибавляя по одной каждый день. Трижды в день (тридцать капель трёхпроцентного раствора перекиси водорода в сутки, ого!) за полчаса до еды. Можно вводить раствор внутривенно и под наблюдением врача. Иногда перекись водорода комбинируют для более действенного эффекта с другими препаратами. Внутрь раствор применяют только в разведённом виде - с чистой водой.
Наружно
Компрессы и полоскания ещё до создания профессором Неумывакиным его методики были весьма популярны. Все знают, что так же, как и спиртовые компрессы, в чистом виде перекись водорода применять нельзя, потому что получится ожог тканей, а вот бородавки или грибковые поражения смазывают локально и крепким раствором - до пятнадцати процентов.
При кожных высыпаниях, при головных болях тоже делают процедуры, в которых участвует перекись водорода. Компресс нужно делать с помощью хлопковой ткани, смоченной в растворе из двух чайных ложек трёхпроцентной перекиси водорода и пятидесяти миллиграммов чистой воды. Ткань накрыть плёнкой и укутать шерстью или полотенцем. Время действия компресса от четверти часа до полутора часов утром и вечером до выздоровления.
Мнение врачей
Мнения разделились, далеко не всех восхищают свойства перекиси водорода, более того, им не только не верят, над ними смеются. Находятся среди медиков и те, кто поддержал Неумывакина и даже подхватил развитие его теории, но их меньшинство. Большая часть врачей считает такого плана лечение не только неэффективным, но и часто губительным.
И правда, не существует пока официально ни единого доказанного случая, когда пациент вылечился бы перекисью водорода. Одновременно нет сведений и об ухудшении состояния здоровья в связи с применением этого метода. А вот время драгоценное теряется, и человек, получивший одно из серьёзных заболеваний и полностью положившийся на панацею Неумывакина, рискует опоздать к началу своего настоящего традиционного лечения.
Ключевые слова конспекта: характеристика элемента водород, физические свойства водорода, получение водорода.
Водород — первый, самый легкий элемент Периодической системы элементов. Массовая доля водорода в земной коре менее 1%.
Степень окисления водорода +1 — в составе воды, кислот, оснований, кислых солей. Степень окисления -1 встречается редко, в гидридах щелочных и щелочноземельных металлов: NaH, СаН2.
Изотопы водорода различаются массовыми числами: протий 1 Н, дейтерий 2 Н (D), тритий 3 Н (Т).
Практически весь водород в природе находится в виде соединений. Это — вода Н2О, природный газ метан СН4, углеводороды вида СаНb, например газ пропан С3Н8 и компонент нефти октан C8H18, соляная кислота НСl в нашем желудке. Водород в виде воды и органических соединений — важнейший элемент растительных и животных организмов, например в составе сахара С12Н22О11.
Физические свойства водорода Н2. Газ без цвета, вкуса и запаха, значительно легче воздуха, плотность 0,09 г/л — это самый легкий газ, температура сжижения -253°С, в воде практически нерастворим (в 100 г воды при н.у. растворяется 2,15 мл Н2).
Получение водорода. В лаборатории водород получают при взаимодействии соляной кислоты НСl или разбавленной серной кислоты H2SO4(p-p) с цинком Zn:
2НСl + Zn = ZnCl2 + Н2↑,
H2SO4(p-p) + Zn = ZnSO4 + H2↑.
Другой способ — разложение воды электрическим током:

В промышленности взаимодействие метана (и родственных ему углеводородов) с кислородом в присутствии паров воды называют конверсией. Так, из метана СН4 взаимодействием с кислородом в присутствии избытка паров воды получают водород:
2СН4 + O2 + 2Н2O = 6Н2 + 2СO2.
Для отделения углекислого газа образовавшуюся смесь газов под давлением пропускают через холодную воду. Углекислый газ в воде растворяется, а водород нет.
Иногда конверсию метана проводят при недостатке водяного пара:
CH4 + Н2O = CO +3H2.
Образующуюся смесь оксида углерода(II) с водородом <синтез-газ) используют в органическом синтезе.
Разложение воды электрическим током из-за дорогой стоимости электричества в больших масштабах невыгодно.
Также водород получают при взаимодействии водяного пара с раскаленным углем:
С + Н2O = СО + Н2.
Образующуюся смесь называют водяным газом.
В промышленности используют водород, выделяющийся в реакциях разложения при нагревании каменного угля или нефти без доступа воздуха.
Читайте также:

