Что такое растворимость кратко
Обновлено: 04.07.2024
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы по агрегатному состоянию бывают жидкие (раствор соли, кровь), твердые (сплавы металлов) и газообразные (воздух).
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов (растворы с электропроводимостью). В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
В истинных растворах размер частиц менее 1 нм , частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1 нм — 100 нм , частицы в таких растворах можно обнаружить при помощи ультрамикроскопа ( эффект Тиндаля ).
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные . По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Разбавленные растворы - растворы с небольшим содержанием растворенного вещества.
Концентрированные растворы - растворы с большим содержанием растворенного вещества.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный раствор – это раствор, в котором данное вещество при данной температуре больше не растворяется.
Ненасыщенный раствор - это раствор, в котором при данной температуре вещество ещё может растворяться.
Суспензией называют взвесь, в которой мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсией называют взвесь, в которой мелкие капельки какой-либо жидкости распределены между молекулами другой жидкости.
Коэффициент растворимости – отношение массы растворенного вещества к массе растворителя ( например , 10 г соли на 100 г воды).
По способности растворяться вещества условно делят на:
малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
растворимые (больше 1 г растворенного вещества на 100 г растворителя);
нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
При попадании в воду вещество может:
1. раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне;
2. химически прореагировать с водой;
3. не раствориться в воде и химически не прореагировать.
Одни вещества хорошо растворяются в воде, другие мало, а третьи – не растворяются совсем.
Растворение – физико–химический процесс , не ведущий к превращению одних веществ в другие.
Физический – разрушение структуры растворяемого вещества
Химический – образование гидратов (сольватов, если растворитель не вода), вследствие взаимодействия молекул растворителя с частицами растворённого вещества).
Если на разрушение кристаллической решётки затрачивается больше энергии, чем выделяется при образовании гидратов, то растворение сопровождается охлаждением раствора (NH 4 NO 3 ; KNO 3 ), а если меньше – нагреванием (приготовление растворов щелочей, кислот).
Растворение газов и жидкостей не сопровождается разрушением кристаллической решётки, поэтому такие процессы растворения всегда экзотермические.
Тепловые эффекты растворения подавляющего большинства веществ незначительны, потому не заметны.
Растворимость увеличивается с ростом температуры (бывают исключения). Вы прекрасно знаете, что удобнее и быстрее растворять сахар в горячей, а не в холодной воде.
Попробуйте сами определить растворимость веществ (см. Таблица растворимости солей, кислот и оснований в воде).
Задание. Определить растворимость следующих веществ: AgNO 3 , Fe(OH) 2 , Ag 2 SO 3 , Ca(OH) 2 , CaCO 3 , MgCO 3 , KOH.
Растворимость веществ
По растворимости в воде все вещества делятся на три группы:
1) хорошо растворимые, 2) малорастворимые и 3) практически нерастворимые.
Последние называют также нерастворимыми веществами . Однако следует отметить, что абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или кусочек золота, или серебра, то они в ничтожно малых количествах все же растворяются в воде. Как известно, растворы серебра или золота в воде убивают микробов. Стекло, серебро, золото - это примеры практически нерастворимых в воде веществ (твердые вещества). К ним следует также отнести керосин, растительное масло (жидкие вещества), благородные газы (газообразные вещества).
Примером малорастворимых в воде веществ могут служить гипс, сульфат свинца (твердые вещества), диэтиловый эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные вещества).
Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.

Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
- Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях. В случае, когда растворимость слишком мала для измерения, говорят, что вещество нерастворимо.
Зависимость растворимости веществ от температуры выражается с помощью кривых растворимости. По кривым растворимости производят различные расчёты. Например, можно определить массу вещества, которое выпадет в осадок из насыщенного раствора при его охлаждении.
РАСТВОРИ'МОСТЬ, и, мн. нет, ж. (науч.). Способность вещества растворяться. С повышением давления р. газов заметно увеличивается.
раствори́мость
1. хим. свойство твёрдого или газообразного вещества растворятся в жидкости
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать Карту слов. Я отлично умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: подсидеть — это что-то нейтральное, положительное или отрицательное?
способность в-ва образовывать с др. в-вом (или в-вами) гомог. смеси с дисперсным распределением компонентов (см. Растворы).Обычно растворителем считают в-во, к-рое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся р-р. Если до растворения оба в-ва находились в одном и том же агрегатном состоянии, р-рителем считается в-во, присутствующее в смеси в существенно большем кол-ве.
Р. определяется физ. и хим. сродством молекул р-рителя и растворяемого в-ва, соотношением энергий взаимод. однородных и разнородных компонентов р-ра. Как правило, хорошо раств. друг в друге подобные по физ. и хим. св-вам в-ва (эмпирич. правило "подобное раств. в подобном"). В частности, в-ва, состоящие из полярных молекул, и в-ва с ионным типом связи хорошо раств. в полярных р-рителях (воде, этаноле, жидком аммиаке), а неполярные в-ва хорошо раств. в неполярных р-рителях (бензоле, сероуглероде).
Согласно теории, предложенной Дж. Гильдебрандом (1935), взаимная Р. неэлектролитов возрастает с уменьшением разности их параметров растворимости d=(Е/V) 1/2 , где Е- теплота испарения, V-полярный объем. Параметр р-римости - одно из осн. понятий, определяющих когезион-ные св-ва в-в в конденсир. состояниях; важная технол. характеристика полимеров и р-рителей, лакокрасочных материалов и т. п. (см. Когезия). Р. мн. электролитов возрастает пропорционально кубу диэлектрич. проницаемости р-рителя. Обычно более растворимы электролиты с большей склонностью к сольватации р-рителем; образование кристаллогидратов обычно увеличивает Р. солей.
Р. данного в-ва зависит от т-ры и давления соотв. общему принципу смещения равновесий (см. Ле Шателье-Брауна принцип).Концентрация насыщ. р-ра при данных условиях численно определяет Р. в-ва в данном р-рителе и также наз. растворимостью. Пересыщенные р-ры содержат большее кол-во растворенного в-ва, чем это соответствует его Р., существование пересыщенных р-ров обусловлено кинетич. затруднениями кристаллизации (см. Зарождение новой фазы).Для характеристики Р. малорастворимых в-в используют произведение активностей ПА (для р-ров, близких по своим св-вам к идеальному,-произведение р-римости ПР).
Растворение газов в воде-экзотермич. процесс, поэтому с ростом т-ры Р. газов в воде уменьшается. В орг. р-рителях газы часто раств. с поглощением тепла и с ростом т-ры Р. газов повышается. В нек-рых случаях на кривых зависимости р-римости газов от т-ры наблюдается минимум (напр., система водород-вода). При постоянной т-ре в случае образования идеального разб. бинарного р-ра неэлектролита Р. газа (молярная доля в р-ре) пропорциональна его парциальному давлению над р-ром (см. Генри закон).С ростом давления для определения Р. газа необходимо учитывать отклонение его св-в от св-в идеального газа, что достигается заменой парциального давления летучестью.
Системы жидкость - жидкость (жидкие смеси) различаются по след. типам: жидкости смешиваются друг с другом во всех отношениях (напр., система вода - этанол); жидкости практически нерастворимы друг в друге (вода-ртуть); жидкости частично растворимы друг в друге (вода-диэтиловый эфир). С ростом т-ры взаимная Р. жидкостей в большинстве случаев увеличивается и, если не достигается т-ра кипения, существует т-ра, при к-рой обе жидкости смешиваются друг с другом в любых соотношениях,-т. наз. критич. т-ра р-римости, или верх. критич. точка смешения (ВКТС). Если достигается т-ра кипения, осуществляется трехфазное равновесие с участием паровой фазы и двух жидких фаз-паровая эвтектика или паровая перитектика. В нек-рых системах взаимная Р. повышается с понижением т-ры и возможно достижение ниж. критич. т-ры смешения (HKTС). Известны системы (напр., вода-трибу-тилфосфиноксид), где имеется и верхняя и нижняя критич. точки (см. Критическое состояние).Обычно область расслаивания жидкой смеси при понижении т-ры пересекается с линией ликвидуса с образованием монотектич. или синтек-тич. фазового равновесия (см. Диаграмма состояния).
Влияние давления на Р. зависит от того, как изменяется с давлением молярный объем в-ва и его парциальный молярный объем в р-ре. Если при нек-ром давлении молярный объем в-ва становится меньше его парциального молярного объема, Р. в-ва с ростом давления снижается. Такая закономерность характерна для неполярных р-рителей; напр., Р. гексахлорэтана в сероуглероде при 500 МПа меньше, чем при 0,1 МПа, в 15 раз. Для газов при высоких давлениях на кривой зависимости Р. от давления имеется максимум. Для электролитов на зависимость Р. от давления сказывается изменение молярного объема вследствие сольватации ионов молекулами р-рителя. Взаимная Р. жидкостей мало зависит от давления, зависимость становится заметной при давлениях порядка неск. ГПа.
В-во, способное раств. в двух неограниченно смешивающихся друг с другом р-рителях, распределяется между ними так, что отношение его активностей в этих р-рителях а 1 и а 2 при постоянной т-ре остается постоянным, независимо от общего кол-ва растворенного в-ва: a 1 /a 2 = К, где К- коэф. распределения (закон Бертло-Нернста). Для сильно разб. р-ров вместо отношения активностей компонентов можно записать отношение их концентраций.
Растворение твердых тел в жидкостях может сопровождаться поглощением тепла, в этом случае повышение т-ры приводит к увеличению Р. Если образуется идеальный р-р, зависимость Р. от т-ры записывается ур-нием Шредера
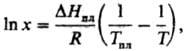
где DHпл и Тпл -энтальпияплавления и -т-ра плавления растворенного в-ва. Если энергия сольватации больше энергии, необходимой для разрушения кристаллич. решетки, растворение является экзотермич. процессом и Р. с ростом т-ры понижается. У нек-рых в-в (напр., гипс) наблюдается минимум на кривой зависимости Р. от т-ры. При образовании твердых растворов максимум Р. достигается, как правило, при т-ре трехфазного равновесия - эвтектического или перитектического. Но в нек-рых системах максимум Р. отвечает более высокой т-рс (системы с ретроградной растворимостью).
Р. изучают изотермич. или политермич. методами (см. Термический анализ). Полученные результаты представляют в виде диаграмм Р., к-рые являются частным случаем диаграммы состояния. Объемное изображение фазовых состояний системы в пространстве параметров состояния (т-ры и составов разл. фаз) сводят спец. приемами к фигурам на плоскости. Для тройной системы из двух солей и воды используют обычный концентрац. треугольник, вершины к-рого отвечают чистым компонентам (см. Многокомпонентные системы). Применяют также изображение Р. по способу Шрейнемакерса (Ф. Схрейнемакерс), при к-ром вершина прямоугольной системы координат отвечает чистой воде, а по обеим осям откладывают концентрации солей, выраженные кол-вом той или другой соли на определенное кол-во воды (1 моль). Точки, отвечающие чистым солям, лежат в бесконечности (см. рис. а).Др. прием построения диаграмм Р. на плоскости - способ Йенеке (см. рис. б):на оси абсцисс отражается состав солевой массы р-ра, т. е. соотношение концентраций солей, а по оси ординат откладывается кол-во воды на определенное кол-во растворенных в-в (напр., 1 моль). В этом способе в бесконечности находится точка, отвечающая чистой воде. На диаграммах (см. рис. аи б) буквой Жобозначено фазовое поле гомог. системы (р-ра), Ж+А и Ж+В- фазовые поля пересыщенных р-ров, Ж + А + В - тройная пересыщенная система; линии А'E отвечают р-рам, насыщ. компонентом А (концентрация насыщения при данном содержании В), линии ЕB'- р-рам, насыщенным компонентом В, Е-эвто-нич. точка системы (эвтоника), отвечающая составу р-ра, насыщенного двумя компонентами (аналог эвтектики на диаграммах плавкости). Точка эвтоники характеризуется макс. концентрацией растворенных в-в в р-ре, миним. парциальным давлением пара р-рителя над р-ром, постоянством состава р-ра и давления пара при изотермич. испарении вплоть до окончат. высыхания системы.
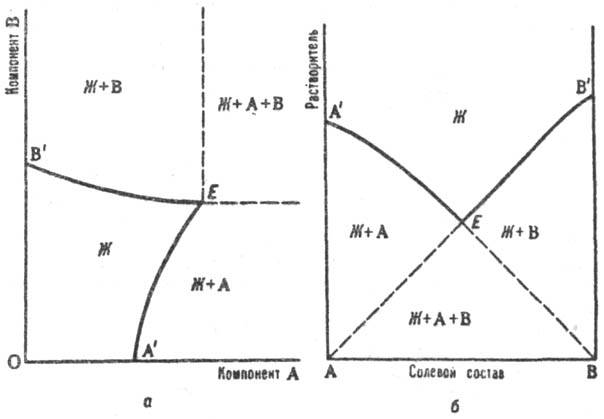
Изотермич. диаграмма р-римости тройной системы соль А - соль В - вода с изображением по способу Шрейнемакерса (а) и по способу Йенеке (б).Пояснения в тексте.
Использование диаграмм Р. позволяет установить сосуществующие фазы при данной т-ре и соответствующие им составы р-ров, провести расчеты процессов испарения, кристаллизации из р-ров и т. п., что необходимо для обоснования многих технол. схем. Напр., диаграмма Р. системы KCl-NaCl-H 2 O является основой технологии переработки сильвинитов, системы K 2 SO 4 -MgCl 2 -H 2 O-переработки полиминеральных галургич. руд.
Лит.: Новоселова А. В., Методы исследования гетерогенных равновесий, М., 1980; Ксензенко В. И., Кононова Г. Н., Теоретические основы переработки галургического сырья, М., 1982. П. И. Федоров.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:

здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20 o С:
Растворимость, г на 100 г H2O
Растворимость, г на 100 г H2O
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Растворимость твердых веществ в жидкостях зависит от структуры твердого вещества (от типа кристаллической решетки твердого вещества). Например , вещества с металлическими кристаллическими решетками (железо, медь и др.) очень мало растворимы в воде. Вещества с ионной кристаллической решеткой, как правило, хорошо растворимы в воде.
Есть замечательное правило: “подобное хорошо растворяется в подобном”. Вещества с ионным или полярным типом связи хорошо растворяются в полярных растворителях. Например , соли хорошо растворимы в воде. В то же время неполярные вещества, как правило, хорошо растворяются в неполярных растворителях.
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20 o С растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Температура различным образом влияет на растворимость твердых веществ в воде. В большинстве случаев растворимость твердых веществ возрастает с повышением температуры. Например , растворимость нитрата натрия NaNO3 и нитрата калия КNO3 при нагревании увеличивается (процесс растворения протекает с поглощением теплоты). Растворимость NaCl при увеличении температуры возрастает незначительно, что связано с почти нулевым тепловым эффектом растворения поваренной соли.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов).
Размеры частиц в истинных растворах - менее 10 -9 м (порядка размеров молекул).
Ненасыщенные, насыщенные и перенасыщенные растворы
Если молекулярные или ионные частицы, распределённые в жидком растворе присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества, раствор называется насыщенным. (Например, если поместить 50 г NaCl в 100 г H2O, то при 20ºC растворится только 36 г соли).
Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества.
Поместив в 100 г воды при 20ºC меньше 36 г NaCl мы получим ненасыщенный раствор .
При нагревании смеси соли с водой до 100°C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 20ºC, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором . Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
Перенасыщенный раствор - раствор, содержащий больше вещества, чем в насыщенном.
Растворение как физико-химический процесс
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией ).
Растворение протекает с образованием различных по форме и прочности продуктов - гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота образования раствора , рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются:
- поглощающие тепло процессы - разрушение кристаллической решётки, разрывы химических связей в молекулах;
- выделяющие тепло процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение NaOH - экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na + и OH - выделяется соответственно 422 и 510 кДж/моль.
Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH4NO3 наблюдается понижение температуры).
Растворимость
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях).
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
P - хорошо растворимые (более 1,0 г на 100 г воды);
M - малорастворимые (0,1 г - 1,0 г на 100 г воды);
Н - нерастворимые (менее 0,1 г на 100 г воды). Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот.
Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например,Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании.
Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.
Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Читайте также:
- В чем заключается основное значение биогеоценозов для природы и человека кратко
- Как заполнить заявление на электронный дневник в школу
- Какие требования предъявляет к речи классическая риторика кратко
- Почему театр существуя уже более 2000 лет не теряет в наши дни своей актуальности кратко
- Как предупредить возникновение обморожений кратко

