Что такое молекула атом кратко
Обновлено: 05.07.2024
Согласно современным представлениям основные положения атомно-молекулярной теории сводятся к следующим тезисам:
- Частицы веществ непрерывно движутся.
- Между частицами вещества действуют силы взаимного притяжения и отталкивания.
- Между составляющими частицами вещества существуют расстояния, размер которых зависит от агрегатного состояния.
- Молекулы состоят из атомов.
- Молекулы сохраняются при физических явлениях и разрушаются во время химических реакций.
- Атомы во время химических процессов остаются неделимыми, но перегруппировываются, в результате чего образуются новые соединения.
- Разнообразие веществ в природе обусловлена различными сочетаниями атомов, благодаря чему могут возникать вещества с молекулярным или немолекулярным строением.
Важнейшие понятия атомно-молекулярного учения
Согласно атомно-молекулярному учению, главными объектами химии являются атомы, молекулы, химические элементы, простые и сложные вещества.
Атомы — химически неделимые частицы, которые сохраняются при химических реакциях, но при этом частично может меняться строение электронной оболочки. Однако атомы разрушаются в процессе ядерных реакций.
Атом — это наименьшая, химически неделимая, электронейтральная частица элемента, которая состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Атом — это система, состоящая из ядра и электронной оболочки. В состав атомного ядра, радиус которого в 10000 раз меньше (10 -14 -10 -15 м) радиуса атома (~ 10 -10 м), входят ядерные частицы нуклоны.
Нуклоны — это положительно заряженные протоны и электронейтральные нейтроны. Электронная оболочка, размер которой определяет радиус всего атома — это совокупность электронов. Положительный заряд ядра определяется количеством протонов и равна по абсолютной величине отрицательному заряду электронной оболочки, который соответствует количеству электронов. Благодаря равенству по абсолютной величине зарядов протонов и электронов, атом электронейтрален. Протоны, нейтроны и электроны объединяются общим названием — субатомные частицы.
Массы протона и нейтрона практически одинаковы, а масса электрона в 1836 раз меньше, поэтому вся масса атома фактически сосредоточена в его ядре. По этой причине плотность вещества в ядре фантастически велика — порядка 10 13 -10 14 г / см 3 . Массы атомов различных элементов колеблются от 1,67 · 10 -27 кг (атом водорода) до 4,42 · 10 -25 кг (атом мейтнерия — элемента № 109).
Количественными характеристиками атома является заряд ядра и относительная атомная масса Аr . Эти величины указываются в периодической системе элементов.
Заряд ядра атома равен порядковому номеру элемента (закон Мозли).
Поскольку массы атомов очень малы, в химии внедрена внесистемная единица измерения, называемая атомной единицей массы (а.е.м.) и равна одной двенадцатой массы атома изотопа углерода-12 (m (атома 12 С) = 19,92 · 10 -27 кг):
Относительная атомная масса Аr — это физическая величина, равная отношению средней массы атома элемента к одной двенадцатой массы атома изотопа углерода-12:
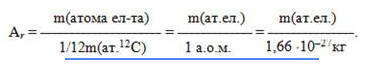
В системе измерений СИ Аr — безразмерная величина. Внесистемная единица измерения относительной атомной массы — а.е.м. Абсолютная масса атома равна произведению его относительной атомной массы на 1/12 массы атома углерода — 12 , например
m (ат.О) = А r (О) · 1,66 · 10 — 27 = 16 · 1,66 · 10 — 27 = 26,56 · 10 — 27 кг.
Атом носителем химических свойств элемента . Вместе с этим у атомов одного элемента могут быть разные массы вследствие явления изотопии , при котором атомы одного элемента содержат одинаковое количество протонов в ядре, но разное количество нейтронов, что сказывается на их массе .
Молекула
Молекулы — это реально существующие природные объекты, что подтверждается многими экспериментально доказанными фактами.
Молекула — это наименьшая частица вещества, которая способна самостоятельно существовать и имеет все химические свойства вещества.
Как материальные частицы молекулы имеют размеры и массы. Размеры молекул колеблются в пределах 10 -10 — 10 -7 м. Масса отдельной молекулы чрезвычайно мала. Так, масса молекулы воды составляет 2,895×10 -26 кг.
Молекула сохраняет химические свойства вещества. Известно, что вещество характеризуется определенными физическими и химическими свойствами. Физические свойства — это агрегатное состояние, плотность, температуры кипения и плавления, электропроводность, диэлектрическая проницаемость, цвет, запах, вкус и тому подобное. Понятно, что перечисленные свойства веществ могут быть присущи не одной молекуле, а достаточно большой их совокупности. Однако молекула имеет и собственные физические свойства: дипольный и магнитный моменты, способность к поляризации и тому подобное. А химические свойства вещества (способность вступать в химическое взаимодействие с другими веществами) в полной мере относятся и каждой отдельной молекуле.
Молекулы состоят из атомов, которые соединены между собой химическими связями в определенной последовательности и определенным образом ориентированы в пространстве. Количество атомов в молекуле колеблется от двух (Н2, О2, НСl) до нескольких тысяч (витамины, гормоны, белки). Атомы благородных газов (He, Ne, Ar, Kr, Xe, Rn) иногда называют одноатомными молекулами. Состав молекулы — важнейшая характеристика молекулы и вещества — описывается химическими формулами.
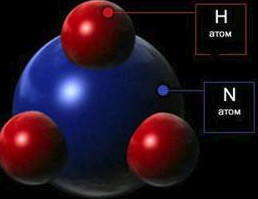
Схематическое модель молекулы NH3
Между молекулами есть расстояния, обусловленные агрегатным состоянием вещества: в газах они составляют 10 -8 — 10 -7 м, в твердых телах — примерно 10 -10 м.
При физических явлениях молекулы сохраняются, а при химических превращениях — разрушаются, образуя новые вещества.
Количественной характеристикой молекулы является относительная молекулярная масса Мr .
Относительная молекулярная масса Мr— это отношение средней массы молекулы вещества к 1/12 массы атома углерода-12.
В системе СИ относительная молекулярная масса Mr — безразмерная величина, а внесистемной единицей ее измерения является а.е.м.
Относительная молекулярная масса Мr равна сумме относительных атомных масс Аr элементов, входящих в состав молекулы, с учетом количества атомов каждого элемента , например:
M r (SO 2 ) = A r (S) + 2 A r (O) = 32 + 2 · 16 = 64 а.е.м.
Абсолютная масса молекулы определяется как произведение Мr на атомную единицу массы:
m (молекулы SO 2 ) = M r (SO 2 ) · 1,66 · 10 — 27 = 64 · 1,66 · 10 — 27 = 1,06 · 10 — 25 кг.
Химический элемент
Сейчас известно 118 химических элементов: из них 89 обнаружены в природе, а другие получены искусственно при проведении ядерных реакций.
Химический элемент — это вид атомов с одинаковым зарядом ядра.
Каждый элемент имеет свое название и символ. Названия элементов с порядковыми номерами 104-109 утверждены советом IUPAC (1997.) Позже были названы другие элементы. Теперь элемент №104 имеет следующие название и символ: Резерфорд Rf, №105 — Дубний Db, №106 — Сиборгий Sg, №107 — Борий Bh, элемент №108 — Хассий Hs, №109 — Мейтнерий Mt, №110 — Дармштадтий Ds. Химические элементы №№111-118 еще не получили официальных названий, поэтому их пока называют по порядковым номерам, например: №111 — Унунуний Uuu (один, один, один) №112 — Унунбий Uub (один, один, два) и т.д.
Химический символ означает, во-первых, название элемента, во-вторых, — один атом этого элемента при записях формул химических реакций.
Основной количественной характеристикой элемента является заряд ядра его атомов Z , совпадающей с порядковым номером элемента. В природе отсутствуют различные химические элементы, которые должны одинаковый заряд ядра, поэтому можно однозначно определить элемент с зарядом ядра его атома. Относительная атомная масса Аr тоже в определенной степени может служить количественной характеристикой элемента, но не исчерпывающей, так как по величине Аr невозможно определить элемент. Существуют атомы различных элементов с одинаковыми Аr — так называемые изобары. С другой стороны, как уже упоминалось, существуют атомы одного и того же элемента с различными Аr — изотопы .
Формулы изотопов конечно записывают с помощью символа химического элемента, отметив заряд ядра (слева снизу) и массового числа (слева сверху). Исключением являются изотопы элемента водорода, для которых наряду с традиционной символикой допускаются и индивидуальные названия и обозначения.
Простые и сложные соединения
Поскольку вещество — это любая совокупность атомов или молекул, то по составу все соединения можно разделить на простые и сложные.
Простыми веществами называются вещества, которые состоят из атомов одного элемента; простые вещества — это форма существования химического элемента в свободном состоянии.
Насчитывается более 500 простых веществ, а элементов известно всего 118. Такое расхождение объясняется явлением под названием аллотропия.
Аллотропия — это способность элемента образовывать несколько простых, отличающихся по свойствам веществ, которые называются аллотропными модификациями, или алотропамы.
Простые вещества могут иметь молекулярное и немолекулярное строение — атомное или металлическое. Молекулярное строение присуще кислороду, галогенам; атомное — благородным газам, алмазу, графиту; металлическое — металлам в разном состоянии.
Сложными веществами называются вещества, содержащие атомы различных элементов, то есть это форма существования элементов в связанном состоянии.
Сложные вещества могут иметь как молекулярное строение (Н2S, CH4, HCl, H2O), так и немолекулярное: ионное (NaCl, Na2O, NaOH) или металлическое (Fe3C — карбид железа).
Химические реакции, их классификация
Химическими реакциями являются процессы, при которых изменяется состав соединений вследствие разрушения связей в одних веществах и образования новых соединений.
Химические реакции — это явления, при которых происходят превращения одних веществ в другие без изменения состава атомных ядер.
Для условного записи химических реакций применяют уравнения химических реакций, где в левой части указывают формулы исходных веществ, а в правой — конечных продуктов, образовавшихся в результате реакции Перед формулами всех веществ проставляют необходимые стехиометрические коэффициенты — числа, с помощью которых сравнивают количества атомов каждого элемента слева и справа.
Итак, уравнение химической реакции — условный запись, в которой с помощью химических формул соединений и стехиометрических коэффициентов отмечают состав и количество исходных веществ и продуктов реакции .
Химические реакции всегда сопровождаются физическими эффектами, которые подтверждают протекание реакции. Визуальными признаками химических реакций обычно является выделение газа, выпадение осадка, изменение окраски реакционной среды или тепловой эффект.
Для химических реакций, проходящих между неорганическими реагентами, чаще всего используются такие классификации:
- По признаку изменения количества и состава исходных веществ и конечных продуктов все реакции делятся на типы:
- реакции разложения , в которых из одного сложного вещества образуется несколько продуктов. В общем виде:
- реакции соединения , в которых из нескольких веществ относительно простого состава образуется одна сложное вещество:
- реакции замещения , в которых простое вещество замещает составную часть сложного вещества, в результате чего образуются другие простая и сложная вещества: A + B C → A B + C A+BC→AB+C .
- реакции обмена , в которых молекулы сложных веществ обмениваются своими составными частями: A B + C D → A D + B C AB+CD→AD+BC .
- окислительно-восстановительные реакции, при которых происходит изменение степеней окисления у атомов одного или нескольких исходных веществ. Этот тип реакций подробно будет рассматриваться позже, а здесь мы ограничимся только примером окислительно-восстановительной реакции с указанием степеней окисления:
- реакции невалентных преобразований, в процессе которых меняется только состав веществ, а электронные оболочки отдельных атомов остаются неизменными, а значит и степени окисления в атомах всех элементов не изменяются. Типичными случаями реакций невалентных преобразований являются реакции обмена, а также некоторые реакции соединения и разложения.
- оборотные , при которых протекание реакций происходит как в прямом, так и в обратном направлении. Следует помнить, что при записи оборотных реакций вместо знаков равенства или стрелочки (= или → → ) Ставят две стрелки, направленные в противоположные стороны ( ↔ ↔ или ⇔ ⇔ ).
- необратимые , идущие в одном направлении до полного расходования хотя бы одного из реагентов. Как правило, необратимые реакции имеют одну из следующих признаков: а) продукты, получаемые, выходят из реакционной среды в виде осадка или газа; b) образуются малодиссоциированные соединения (то есть слабые электролиты: вода, слабая кислота или слабое основание) с) выделяется большое количество теплоты (горение, взрыв).
- гомогенные , при которых вещества, содержащиеся в системе, не отделяются друг от друга поверхностью раздела фаз;
- гетерогенные , характеризующихся наличием поверхности раздела фаз, то есть хоть одно соединение находится в другом агрегатном состоянии, чем остальные веществ.
- термохимические, которые сопровождаются тепловым эффектом, то есть энергия подводится или отводится в форме теплоты. По знаку тепловых эффектов реакции делятся на следующие типы:
- экзотермические, сопровождающиеся выделением теплоты;
- эндотермические, при которых теплота поглощается;
- молекулярными, при которых взаимодействие между веществами проходит результате столкновения отдельных молекул реагирующих веществ;
- ионными, протекающих при взаимодействии между ионами;
- радикальными, при которых одной из взаимодействующих частиц является радикал. Радикалы при записи обозначают с помощью точки рядом с формулой ( ∙ ∙ ).
- каталитические, протекающих в присутствии катализаторов — специальных веществ, которые ускоряют реакцию;
- некаталитические, в которых ускоряющий влияние катализатора отсутствует.
Начиная с первых уроков физики в школе, из-за неправильного объяснения, между понятиями атом и молекула часто ставится знак равенства . Но на самом деле это разные вещи. Так и живем мы с путаницей в голове, пока вдруг не узнаем, что эти штуки хотя и связаны, но значительно отличаются друг от друга. Говорить, что атом и молекула - одно и то же совсем неправильно .
Исходя из теории строения вещества, всё вокруг нас состоит из частиц . Будь-то камень или деревяшка, мясной стейк или банка со сметаной. Каждое физическое тело построено из атомов и молекул, как и кирпичный дом построен из кирпичей.
Конфигурация этого строения определяет свойства вещества. Скажем, взаимное расположение молекул делает воду жидкой, а камень твёрдым. Из-за особенностей строения одно тело хорошо горит, а другое может совсем не гореть. Понятно, что ещё играет роль и состав материала, но конфигурация строения тоже имеет весьма значимое влияние.
Материя состоит из молекул, а молекулы объединяются в различные структуры и строения . Аналогично тому, как мы строим стену из камней, молекулы тоже строятся из атомов. Любая молекула состоит из более мелких частиц. Эти мелкие частицы и носят название атомы . Подробно о том, из чего по современным представлениям состоит материя, мы рассказывали в этой статье .
Соответственно, если мы спрашиваем, чем отличается молекула от атома, это эквивалентно тому, как спросить чем кирпичная стена отличается от кирпича .
Получается, что именно атомы составляют материю, а молекулы состоят из разных атомов , которые объединились в некоторую структуру. Структуры могут быть самыми разными. Молекулы принимают самую причудливую форму. Они бывают и ветвистые, и линейные, и объемные. Между тем, атомы всегда выглядят, как сферический объект .
Опять же, представим это в простой форме. Мы строим стену из кирпичей, а сами кирпичи состоят из каких-то неясных структурных составляющих, типа мелких камней. В этом примере кирпичи - это молекулы, а то из чего состоит кирпич - это атомы.
Правда если копнуть поглубже, мы узнаем, что атомы тоже не являются мельчайшей частицей, а состоят из протонов, нейтронов и электронов. Правда и обозначенные структурные составляющие тоже не являются мельчайшими. Так и был построен коллайдер, целью которого являлось выявить мельчайшую частичку .
Есть и ещё одно очень важное отличие. Если молекулы можно воспринимать как нечто целое и мельчайшую частицу, существующую отдельно, то атомы всегда представлены в виде некоторых агломератов . Одиночных атомов в природе не существует. По крайней мере, в обычных условиях. Они всегда являются "системой".
Атом имеет электрический заряд, а молекула нейтральна. Ведь в ней всё уравновешено. На данный момент считается, что именно атом наделяет вещество теми или иными свойствами, а молекула их наследует. Правда до сих пор не определено, какая именно частица наделяет вещество массой , но это уже совсем другая история.
Ну и самое интересное мы оставили на последок. Атомы и молекулы на сегодняшний день возможно сфотографировать с помощью электронного микроскопа. Используя современную технику, удалось запечатлеть атом и молекулу.
На фотографии мы видим, что атом действительно имеет сферическую форму и организован согласно планетарной модели Резерфорда.
Ключевые слова конспекта: Атомно-молекулярное учение, атомы, молекулы и ионы, элементарные частицы, ядро, электрон, протон, нейтрон.
Учение о молекулах и атомах в основном было разработано в XVIII— XIX вв. Великий русский учёный М. В. Ломоносов утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). Многообразие веществ учёный объяснял соединением разных атомов в молекулах и различным расположением атомов в них.
Основоположником атомно-молекулярного учения принято считать известного английского учёного Джона Дальтона. Тем не менее некоторые представления об атомах и молекулах, высказанные Ломоносовым за полвека до Дальтона, оказались более достоверными, научными. Например, английский учёный отрицал возможность существования молекул, образованных одинаковыми атомами.
Атомно-молекулярное учение получило окончательное признание только в 1860 г. на Всемирном съезде химиков в Карлсруэ.
Молекулы
Каждое отдельно взятое вещество состоит из одинаковых молекул. Например, вещество вода состоит из молекул воды. Но размеры молекул воды очень малы, поэтому даже маленькая капелька воды содержит огромное количество молекул, которые имеют одинаковые состав и свойства.
Молекулы — это мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества. При химических реакциях молекулы распадаются, то есть они являются химически делимыми частицами. Молекулы состоят из атомов.
Атомы
Следует иметь в виду, что существуют также вещества, состоящие из отдельных одинаковых атомов. Мельчайшими частицами, сохраняющими характерные химические свойства таких веществ, являются атомы. Так, из отдельных атомов состоят благородные газы — гелий, неон, аргон и др. Атомы в отличие от молекул в ходе химических реакций не делятся на более мелкие части.
Атомы — это мельчайшие химически неделимые частицы вещества.
Элементарные частицы
В конце XIX—начале XX в. было обнаружено, что атомы состоят из ешё более мелких частиц. Эти частицы были названы элементарными частицами. В центре атома находится положительно заряженное ядро, вокруг которого находятся отрицательно заряженные частицы — электроны. Заряд электрона принято считать равным —1.
Ядро атома, в свою очередь, также состоит из элементарных частиц. В состав ядер атомов входят положительно заряженные частицы — протоны и частицы, имеющие почти такую же массу, как протоны, но не имеющие заряда,— нейтроны. Заряд протона численно равен заряду электрона, но имеет противоположный знак (+1).
Например, атом водорода состоит из ядра, в котором находится только один протон и один электрон. Атом гелия состоит из ядра, в котором находятся 2 протона и 2 нейтрона, а также 2 электрона. Атом лития состоит из ядра, в котором находятся 3 протона, 4 нейтрона, а также 3 электрона.
Ионы
![Атомы и молекулы]()
С древних времен люди стремились изучить природу вещей, которые их окружали. Постепенно пришли к мысли о том, что все вокруг состоит из мельчайших частиц.
По мере развития науки появилось понятие об атомах и молекулах. Эти частички чрезвычайно малы, и невооруженным глазом их не разглядеть. Любое крошечное количество вещества, например, пылинка, содержит невероятно большое количество атомов и молекул.
Что же такое атом? Так называют мельчайшую химически неделимую частицу вещества, а также наименьшую часть химического элемента, которая отражает его свойства. Атомы очень маленькие: их размеры находятся в диапазоне от 1 до 5 ангстрем (обозначается — Å.). Один ангстрем — это 10⁻¹⁰ м.
Когда атомы только открыли, их считали самыми маленькими из возможных частиц. Но сегодня нам известна их внутренняя структура:
- В центре каждого атома есть ядро с определенной массой. В нем находятся положительно заряженные протоны и нейтральные частицы нейтроны. Вместе их называют нуклоны.
- Пространство вокруг ядра заполняют частицы с отрицательными зарядами — электроны.
Например, в атоме гелия есть ядро с двумя протонами и двумя нейтронами, а вокруг него двигаются по своим орбитам два электрона.
![Атомы и молекулы]()
Мир атомов: Freepick
Элементарные или субатомные частицы во всех атомах одинаковы, отличается только их количество:
- Протоны — это частицы, которые имеют положительный электрический заряд. Условно его обозначают +1. Символ протона — p⁺.
- Нейтроны — это частицы, которые не имеют электрического заряда. У нейтронов он равняется нулю. Символ нейтронов — n⁰.
- Электроны — это частицы, которые имеют отрицательный электрический заряд. Условно его обозначают -1. Символ электронов — e, е⁻.
Ядра атомов заряжены положительно, так как в них находятся положительно заряженные протоны и нейтральные нейтроны. По величине заряд соответствует количеству протонов в ядре и равен порядковому номеру элемента в периодической системе.
Заряды протонов и электронов одинаковые по величине, но имеют противоположные знаки. В любом атоме число протонов и электронов равно. Поэтому заряд ядра и суммарный заряд всех электронов также равны, но имеют противоположные знаки. Следовательно, атом — электронейтральная частица.
Каждый известный атом обозначен специальным символом — латинской буквой. Все они представлены в периодической системе Д. И. Менделеева.
На современном этапе развития науки ученые стремятся разрушить атом, чтобы получить еще более мелкие частички. Однако они очень неустойчивы, и добиться их долговременного существования пока не получается.
Что известно о молекулах
Атомы различным образом соединяются друг с другом. Как из букв алфавита составляются тысячи слов, так одни и те же атомы образуют молекулы большого количества разных веществ, которые видим в окружающем мире.
Молекулой называют наименьшую частицу вещества, которая определяет его свойства и способна к самостоятельному существованию. Каждая молекула строится из атомов, которые составляют ее массу:
- Вещество (например, сахар) можно размолоть до состояния пыли, но все равно каждая из крупинок будет включать огромное количество одинаковых молекул сахара и сохранит свойства, которыми обладает вещество.
- Даже если измельчить вещество до отдельных молекул (например, сахар растворить в воде), то вещество продолжит существовать и будет проявлять свои свойства (раствор будет сладким на вкус). Поэтому каждую самостоятельно существующую молекулу сахара можем называть веществом.
- Продолжая дробление, будем разрушать молекулы на атомы.
- Если же несколько атомов отделить, то разрушится вещество. Конечно, атомы не исчезнут, они станут частью других молекул, но сахар как вещество прекратит свое существование.
Таким образом, вещества не вечны, так как их молекулы не могут быть вечными. Однако их атомы практически вечны. В тех веществах и предметах, которые окружают нас сегодня, находятся атомы, которые существовали еще во времена динозавров, походов Александра Македонского и открытия Колумбом Америки.
![Атомы и молекулы]()
Что такое молекулы: Freepick
Хоть молекулы и очень малы, их устройство определяют с помощью различных физических и химических методов. Чистые вещества состоят из молекул одного вида.
Если в физическом теле есть молекулы разных видов, то речь идет о смеси веществ. Когда в быту говорим о чистом воздухе, то называем так сложную смесь различных газообразных веществ. Химику придется серьезно поработать, чтобы выделить из нее отдельные чистые вещества.
Все вещества делят на простые и сложные:
- Молекулы простого вещества состоят из одинаковых атомов (азот, кислород, аргон, озон).
- Молекулы в сложном веществе составлены из атомов двух и более видов: углекислый газ, вода.
Часто физические тела состоят из молекул нескольких веществ. Их называют смесями. Важно не путать сложные вещества и смеси. Если в сложном веществе содержатся молекулы одного вида, то это не смесь.
Благодаря свойству атомов объединяться в разных вариациях количество веществ, как и видов молекул, бесконечно. Никто не сможет точно назвать число веществ, которые сегодня известны людям. Ориентировочно их количество исчисляется миллионами, а химики каждый день создают новые молекулы.
Таким образом все вещества, которые мы видим вокруг нас, состоят из молекул, а те, в свою очередь, построены из атомов. Ученым удалось исследовать мельчайшие частички — атомы — и подробно описать их структуру. Эти знания стали ключом к пониманию природы молекул и даже дали возможность создавать новые молекулы.
Узнавайте обо всем первыми
Подпишитесь и узнавайте о свежих новостях Казахстана, фото, видео и других эксклюзивах.
Читайте также:
- Расскажите о зарубежном опыте стандартизации сестринской деятельности кратко
- Что можно сделать из клея пистолета и из бумаги для школы
- Кто такой щетинкин петр ефимович и чем он прославился кратко
- Эссе моя педагогическая инициатива воспитателя детского сада
- Как изменилась жизнь крестьян после отмены крепостного права кратко




