Что такое коррозия какие виды коррозии различают кратко
Обновлено: 02.07.2024
- электрохимическая - процесс взаимодействия металла с коррозионной средой, при котором восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости.
Виды коррозии по условиям протекания:
- атмосферная коррозия - наиболее распространенный вид коррозии, связанный с разрушением металлов в атмосфере воздуха;
- газовая - коррозионное разрушение металла под воздействием газов при высоких температурах;
- жидкостная - вид коррозии металла в жидкой среде, который подразделяется на коррозию в электролитах и неэлектролитах;
- биокоррозия - вид коррозии, связанный с разрушением под влиянием живых микроорганизмов;
- структурная - связанная с неоднородностью структуры металлов;
- коррозия блуждающими токами - вид электрохимического разрушения под воздействием блуждающих токов;
- внешним током - электрохимическое разрушение металла под влиянием тока от внешнего источника;
- контактная коррозия - возникает при контакте разнородных металлов (имеющих разные стационарные потенциалы в данном электролите);
- щелевая коррозия - явление повышения скорости коррозионного разрушения в зазорах и щелях в металле;
- коррозия под напряжением - разрушение металла при одновременном воздействии агрессивной среды и механических напряжений;
- кавитация - разрушение металла при одновременном воздействии ударного воздействия внешней среды и коррозионного процесса;
- фреттинг-коррозия - вид коррозии, возникающий при колебательных перемещениях двух поверхностей относительно друг друга в условиях коррозионной среды;
- коррозия при трении (коррозионная эрозия) - происходит при одновременном воздействии на металл трения и коррозионной среды;
Виды коррозии по характеру разрушения:
- сплошная (общая коррозия) - охватывающая всю поверхность металла, которая находится под воздействием коррозионной среды;
- местная - распространяется лишь на некоторых участках поверхности металла.
Сплошная коррозия подразделяется на: равномерную, неравномерную и избирательную.
Местный вид коррозии бывает: пятнами, питтинговой, язвенной, сквозной, нитевидной, межкристаллитной, подповерхностной, ножевой, коррозионным растрескиванием и коррозионной хрупкостью.
Череповецкий завод металлоконструкций специализируется на производстве качественных металлических изделий. Наши сотрудники знают все о работе с ними, в том числе о способах защиты металла от коррозии. Из данной статьи вы узнаете о сущности этого явления, различных промышленных и бытовых технологиях обработки изделий.
Виды коррозии
Разнообразные металлы используются повсеместно. Почти все они со временем поддаются действию коррозии. Так называют процесс разрушения материала вследствие окисления. Именно поэтому вопрос защиты от коррозии так актуален. Своевременная обработка продлевает время эксплуатации металлических изделий, защищает от вредного воздействия окружающей среды.
Чтобы правильно защитить конструкцию от разрушения, необходимо разобраться в классификации коррозионных процессов. Это поможет корректно подобрать средство и способ обработки.
Выделяют три вида коррозии металла:
- атмосферная;
- жидкостная;
- почвенная.
Атмосферная коррозия вызвана влиянием приземистого слоя атмосферы. При этом виде разрушения металлические изделия контактируют с кислородом и водяными парами воздуха. Химически активные вещества в качестве примесей ускоряют процесс разрушения металла.

Относительная влажность воздуха — основной критерий для деления на подвиды. Различают сухую, влажную и мокрую атмосферную коррозию. По своей сути первая является химическим процессом, а влажная и мокрая — электрохимическими.
Это самый распространенный вид разрушения, так как ему подвергаются все металлические конструкции, которые находятся на открытом воздухе. В частности, речь о:
- трубопроводах;
- металлических частях строений;
- опорах;
- мостах;
- транспортных средствах.
Жидкостная коррозия поражает конструкции, находящиеся в жидкой среде. Условия взаимодействия с водой позволяют выделить следующие подвиды:
- коррозия при неполном погружении — только часть конструкции находится в коррозионной среде;
- по ватерлинии;
- при полном погружении — металл полностью погружен в жидкость;
- подводная;
- коррозия при переменном погружении — конструкция погружается в жидкую среду периодически, полностью или частично.

- трубопроводах;
- подземных герметичных резервуарах;
- опорах различных металлоконструкций.
Характерные типы поражения металлов ржавчиной
В большинстве случаев ржавчина возникает на поверхности металла. Однако в некоторых случаях поражение может проникнуть и вглубь. В зависимости от того, каким образом распространяется коррозия, она может быть:
- равномерной — когда конструкция разрушается по всей поверхности, что характерно для сплавов с однофазной структурой;
- местной (пятнами, язвенной, точечной) — поражает преимущественно многофазные сплавы с грубой структурой, реже чистые металлы или однофазные сплавы после разрушения защитной пленки;
- межкристаллитной — самая опасная за счет того, что разрушение незаметно внешне, ей подвержены сплавы алюминия и хромоникелевые стали;
- растрескивающей;
- подповерхностной;
- комбинированной.
Другой критерий для категоризации — это механизм коррозионного процесса. Согласно ему, коррозия может быть химической или электрохимической.
Химическое разрушение обусловлено окислением поверхности изделия в жидкой среде. Влиянию влаги из всех металлов сильнее всего подвержена сталь, за исключением нержавеющей. Содержащееся в ней железо образует три вида окислов. В большинстве случаев надежная защита стальной конструкции от разрушения невозможна. Также под действием жидкости быстро разрушаются кобальт, никель и свинец.
Электрохимическая коррозия сопровождается возникновением электрического тока. Может протекать в различных средах, всегда связана с серьезными разрушительными процессами. Например, если корродируют линии электропередач, элементы электрической цепи, то помимо самой коррозии, значительно возрастает энергопотребление.
Способы защиты от коррозии
Существует множество способов антикоррозионной обработки металлов, разработанных инженерами и учеными. Их можно разделить на две большие группы:
- Промышленные способы — применяются для защиты габаритных конструкций, в том числе строительных, транспортных, индустриальных. Это сложные и дорогостоящие методы.
- Бытовые способы —подходят для хозяйственных нужд. Это относительно простые и доступные методы обработки металлических изделий.
Промышленные способы защиты
Способы защиты металла от коррозии в промышленных целях включают:
- термическую обработку;
- лакокрасочное покрытие;
- пассивацию или легирование;
- защитное покрытие из металла;
- электрозащиту;
- применение ингибиторов.
Термическая обработка сводится главным образом к повышению жаропрочности металлов. Этого можно достичь различными путями. Такой способ защиты нацелен на борьбу с избирательным, точечным и межкристаллическим разрушением. Вследствие термообработки устраняется структурная неоднородность, сплав лишается внутреннего напряжения.
Защита от коррозии с помощью лакокрасочного покрытия весьма популярна благодаря надежности. Это доступный способ с простой технологией, позволяющий к тому же изменить цвет и внешний вид конструкции. В результате применения такой технологии защиты на поверхности изделия образуется сплошная пленка. Она препятствует разрушению металлической конструкции, защищает от агрессивного воздействия окружающей среды. Антикоррозионные лакокрасочные материалы обычно состоят из пленкообразующих веществ, растворителей, пластификаторов, пигментов, наполнителей, катализаторов. Эффективность применения такого способа во многом зависит от правильной технологии нанесения и подготовки поверхности. Немаловажным фактором является толщина покрытия.

Пассивация заключается в добавлении легирующих компонентов при плавке металлов. К таким примесям относятся хром, никель, молибден. Этот действительно эффективный способ замедляет анодный процесс. Металлический сплав переходит в состояние повышенной устойчивости к разрушению — происходит пассивация. На поверхности образуется оксидная пленка, обладающая совершенной структурой. Таким образом обрабатывают железо, алюминий, медь, магний, цинк, сплавы на их основе. В результате пассивации металлы приобретают не только коррозионную стойкость, но и жаропрочность.
Металлическое покрытие получило широкое распространение в качестве защитного средства. Оно может быть катодным или анодным. Целостность защитного слоя гарантирует эффективную защиту металла от нежелательного воздействия. Однако повреждение или образование пор на внешнем слое может спровоцировать окисление внутреннего. Поэтому данный способ вызывает споры. Формирование защитного металлического покрытия может происходить по-разному:
- электрохимическим путем;
- погружением в расплавленный металл;
- нанесением расплавленного покрытия на обрабатываемую поверхность струей сжатого воздуха;
- химическим.
Электрозащиту применяют, когда нужно защитить котлы, стальные детали, подводные детали морского транспорта, детали буровых платформ. Изделие подключают к отрицательному полюсу источника тока. Благодаря этому ток в электролите проходит через пластины-аноды, а не через защищаемую деталь.
Ингибиторами называют вещества, замедляющие или останавливающие химические реакции, которые провоцируют возникновение ржавчины. При введении в агрессивную среду ингибиторы создают на поверхности изделия адсорбционную пленку. Благодаря ей происходит изменение электрохимических параметров металлов, электродные процессы замедляются. Это эффективное и технологически несложное защитное мероприятие.
Бытовые способы защиты
Способы защиты от коррозии, которые применяются в быту, отличаются простотой и доступностью. Все мероприятия сводятся к нанесению лакокрасочных покрытий. Защита металла предполагает использование различных по составу средств. Среди компонентов могут быть:
- смолы на основе силикона;
- полимерные материалы;
- ингибиторы;
- металлические опилки.
В случае, если ржавчина уже повредила металлическую поверхность, предотвратить распространение коррозии можно при помощи:
- Грунтующих средств. Они обеспечивают хорошую адгезию, поэтому их нанесение на поверхность перед покраской экономит расход финишного покрытия. В составе содержатся ингибирующие вещества, за счет чего грунты так эффективны при защите металла от коррозии.
- Стабилизаторов — с их помощью происходит преобразование оксидов железа в другие вещества. Такие химические соединения не подвержены ржавлению.
- Веществ, преобразовывающих оксиды железа в соли. Замедляют повторное образование ржавчины.
- Смол и масел. Их действие заключается в нейтрализации ржавчины. Масла и смолы связывают ее частицы, уплотняя их.
Если при обработке поверхности с целью предотвращения коррозии используется несколько средств, лучше чтобы они были от одного производителя. Они должны подходить друг другу по химическому составу.

Работы по нанесению лакокрасочных средств в домашних условиях можно провести самостоятельно. В большинстве случаев для этого не требуется привлекать мастеров.
В быту чаще всего нуждаются в такой обработке следующие металлоконструкции:
- крыши;
- ворота;
- различные ограждения;
- спортивные снаряды;
- трубы;
- радиаторы;
- дверцы и ручки.
Обрабатывать можно как новые изделия для предотвращения их разрушения, так и те, которые эксплуатируются уже много лет, но их срок службы необходимо продлить.
Как провести обработку металла своими руками?
Самостоятельно проведение антикоррозионных работ требует соблюдения определенной последовательности действий:
- Поверхность, которую нужно уберечь от коррозии, необходимо подготовить. Ее тщательно очищают от пятен масла, ржавчины и прочих загрязнений. Это можно сделать при помощи металлических щеток или специальных насадок для болгарки.
- Когда поверхность должным образом подготовлена к нанесению грунтовки или преобразователя ржавчины, наносят слой средства. Он должен полностью впитаться и просохнуть.
- После этого на поверхность металла наносят защитную краску. Необходимо нанести два слоя, дав хорошо высохнуть каждому. Стоит позаботиться о защитных средствах для выполнения работ: перчатках, очках, респираторе.

Это стандартная схема обработки металлической поверхности для защиты от разрушения.
Защитные краски для металла
Нанесение на металлическую поверхность специальных защитных красок — одно из самых эффективных средств против коррозии. При высыхании они образуют твердую пленку с пигментами. Толщина этой пленки может варьироваться в зависимости от назначения металлического изделия. Толщина и характер взаимодействия краски с поверхностью определяют защитные свойства покрытия.
Антикоррозионные средства по металлу можно разделить на три группы:
- грунтовки;
- краски;
- средства для нанесения прямо поверх ржавчины.
Выбирая защитную краску, важно учитывать свойства металлической поверхности, на которую она будет наноситься. Например, для черных металлов, таких как сталь, лучше выбрать грунтовку, содержащую цинк. Дело в том, что оцинкованная поверхность в течение долгого времени способна противостоять разрушениям. Как правило, инструкция содержит информацию о том, для какого типа поверхности предназначается данный продукт.
Краска по ржавчине становится удачным решением в ситуации, когда поверхность невозможно качественно очистить от ржавчины. Она проста и удобна в использовании, ложится ровным плотным слоем. Покрытие, которое создает такая краска, отличается прочностью и устойчивостью к коррозии. Несмотря на то что на металлической поверхности уже имеются коррозионные очаги, краска по ржавчине не позволит им увеличиваться и распространяться.

Большинство средств подходят для того, чтобы наносить их вручную в бытовых условиях. Некоторые краски лучше ложатся, если их распылять. В составе красок учитывают то, что они будут использоваться в том числе для защиты конструкций, находящихся на улице. Средства можно наносить в уличных условиях. Как правило, антикоррозионные краски для лучшего эффекта наносят достаточно толстым слоем.
Окрашенная поверхность выглядит эстетично. При этом она надежно защищена от коррозии. Образовавшаяся в результате окрашивания пленка предотвращает отрицательное влияние света, влаги, примесей в атмосфере. Защита поверхности от окисления обеспечивается на срок до 8 лет.
Нормы и правила СНиП
Защита металлических конструкций от разрушения на предприятиях — это технологический процесс, при котором необходимо соблюдать установленные нормы. Официальный документ, который регулирует нормы и правила при антикоррозионных работах — СНиП 2.03.11—85.
Данный документ указывает допустимые методы обработки металлических поверхностей для предотвращения коррозии. Они включают:
- покрытие лакокрасочными материалами;
- пропитку антикоррозионным составом;
- оклейку специальными защитными пленками.
При выполнении защитных работ документ предписывает учитывать особенности среды: степень агрессивности, физическое состояние и характер действия. Для разных сред предусмотрено использование материалов, которым можно обеспечить эффективную защиту от разрушения.
Если обработка металлоконструкций от разрушения проводится самостоятельно, рекомендации и правила из СНиП необходимо учитывать.
На Череповецком заводе металлоконструкций все работы по предотвращению коррозии начиная от соответствующего проектирования и заканчивая послемонтажным обслуживанием, проводятся с учетом госстандартов и правил. Уверенность в высоком качестве металлоконструкций позволяет давать нашим клиентам гарантию до 24 месяцев на всю продукцию.
- Определение коррозии
- Виды коррозии металлов
- Химическая
- Методы защиты от коррозии
- Металлические покрытия
- Неметаллические покрытия
- Химические покрытия
- Изменение состава технического металла и коррозионной среды
- Электрохимическая защита
Теория коррозии предполагает, что для начала разрушения металла необходимо наличие четырёх основных компонентов:
Электрического соединения, которое существует между катодом и анодом.
Электролита или любой другой токопроводящей среды, облегчающей направленное перемещение ионов.
Обычное образование ржавчины на стали можно рассматривать как электрическую батарейку. Когда атомы металлов подвергаются воздействию окружающей среды, которая содержит кислород, металл производит электроны. Это действие можно локально ограничить, чтобы создать трещину или микроуглубление. С развитием процесса коррозия распространяется на прилегающую территорию, что приведет к общему ухудшению состояния поверхности. Ограниченная (точечная) коррозия способна вызвать усталость металла – снижение его прочностных характеристик, а имеющиеся коррозионные агенты, например, морская вода, могут привести к прогрессирующему росту трещины.

Теория коррозии утверждает также, что интенсификации поверхностного разрушения металла способствуют микроструктурные изменения, возникающие при повышенных температурах, в частности, при сварке. Это объясняется повышенными значениями энергии активации, из-за чего количество ионов, проводящих электрический ток, лавинообразно возрастает.
Определение коррозии
Коррозия - это постепенное разрушение объектов, обычно металлов, вызванное активной окружающей средой-электролитом и химической реакцией окисления.
Суть коррозионного процесса – наличие постоянно действующей анодной реакции. Она вызывается за счёт растворения металла, который генерирует электроны. Часть энергии активации дополнительно расходуется на другой процесс, называемый катодной реакцией. Эти два процесса уравновешивают произведенные заряды. Зоны, вызывающие эти процессы, могут быть расположены близко или далеко друг от друга, в зависимости от ситуации.
Электроны, генерируемые в процессе, должны потребляться посредством катодной реакции. Ионы водорода и электроны вступают в реакцию с образованием атомарного, а затем и газообразного водорода. Однако водород является сильнейшим восстановителем, поэтому дальнейшую коррозию можно предотвратить, создав на поверхности металла тонкую газовую плёнку. Она служит поляризатором, уменьшающим контакт металла с водой и уменьшающим коррозию. Таким образом, всё, что разрушает барьерную плёнку, увеличивает скорость коррозии.
Основными факторами, определяющими интенсивность процесса, являются:
Уровень возникающих механических и термических напряжений;
Характер протекающих химических реакций.
Коррозия сдерживает внедрение в производство новых металлических материалов и причиняет значительный ущерб экономике.
Виды коррозии металлов
Классификация всех коррозионных явлений может быть произведена по следующим параметрам:
По степени равномерности. Различают поверхностную коррозию, которая равномерно уменьшает толщину поверхности, и неравномерную коррозию – точечную или язвенную;
При межкристаллитной коррозии разрушение происходит по границам зёрен и распространяется вглубь металла.
Фреттинг-коррозия, когда два контактирующих между собой тела совершают относительно друг друга колебательные движения малой амплитуды (не более 100 мкм).
При одновременном воздействии растягивающих напряжений и агрессивной среды наблюдается коррозионное растрескивание межкристаллитного или транскристаллитного характера, а при наложении знакопеременных напряжений начинается коррозионно-усталостное разрушение. Защита металлов от коррозии, таким образом, предполагает также и одновременное уменьшение износа деталей.

Далее рассматриваются основные явления, которые происходят в повреждающихся зонах при различных видах коррозии.
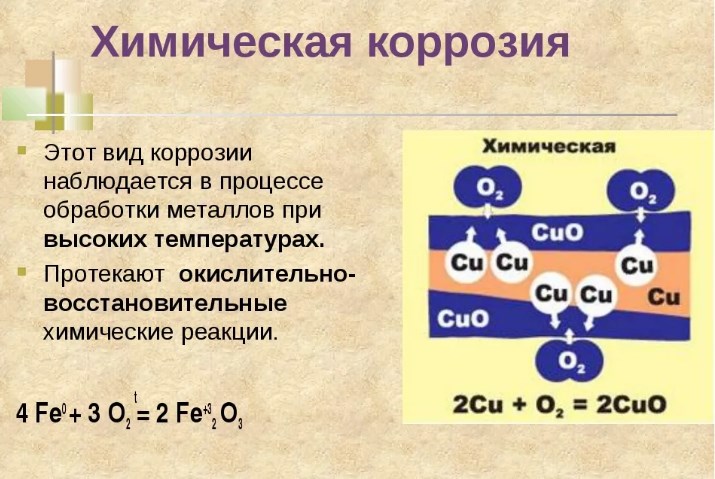
Химическая
Химическая коррозия относится к постепенному разрушению поверхности металла из-за реакции поверхности с веществами во внешней среде. Она происходит в результате окисления металла кислотами с образованием оксидов.
Высокотемпературный вариант заключается в воздействии на металл сухих газов. Все металлы в сухом воздухе покрыты очень тонким (2…10 мкм) слоем оксидов. Этот слой образуется при очень высоких температурах, когда реакция с кислородом воздуха идёт без каких-либо ограничений. При комнатной температуре реакция останавливается, поскольку оксидная плёнка становится слишком тонкой. В случае, например, с алюминием, такая плёнка, состоящая из оксида Al2O3, эффективно защищает поверхность алюминиевой посуды, поскольку коррозионная стойкость чистого алюминия невысока.
Химическая коррозия начинается в месте, где металл находится под давлением и изолирован от циркуляции воздуха. Это побуждает ионы металлов растворяться во влажной среде, что в конечном итоге ускоряет реакцию между ними и водой. В результате реакции образуются водные оксиды (известные при взаимодействии с железом как ржавчина) и свободные ионы.
Электрохимическая
Для моделирования процесса необходимо рассмотреть железную пластину, покрытую любым электропроводящим покрытием, например, оксидной окалиной, которая образовалась во время высокотемпературной обработки. При погружении пластины в раствор хлорида натрия, обнаруживается, что, если повредить целостность окалины, в этом месте ржавление железа пойдёт значительно быстрее. Электрохимическая коррозия наиболее достоверно объясняет ржавление железа в аэробных условиях.
Теория электрохимической коррозии предполагает наличие дополнительных химических реакций:
Fe → Fe ++ + 2e−, - анодная реакция;
2e− + O + H2O → 2OH− - катодная реакция.
Когда ионы металла растворяются, их заряд уравновешивается ионами хлорида, которые мигрируют в область атаки, притягиваясь образующимися ионами положительного заряда. Хлорид железа растворяется в воде, но это не создаёт препятствий для дальнейшей коррозии, поскольку раствор хлорида железа вследствие гидролиза очень кислый. По мере того, как ионы Fe ++ удаляются из этого места, они сталкиваются с гидроксильными ионами, которые либо присутствуют в воде естественным образом, либо образуются в результате катодной реакции. Результатом является образование и осаждение гидроксида железа Fe (OH)2. Далее, в присутствии растворённого кислорода, он быстро окисляется до оксигидроксида железа FeOOH.
Таким образом, при электрохимической коррозии происходят три реакции, причём в трёх разных местах. Анодная происходит в зонах потери металла, катодная – там, где растворённый в воде кислород может принимать электроны, а сама твёрдая окалина формируется в местах механических повреждений на поверхности изделия.
В последнее время выделяют ещё один вид коррозии – механохимическую, которая происходит в результате динамического взаимодействия контактирующих элементов окружающей среды в условиях высоких контактных давлений.
Методы защиты от коррозии
Ржавчина и другие коррозионные проявления могут приводить к проблемам с безопасностью, нарушать целостность производственного оборудования и расходных материалов. Даже плановое техническое обслуживание по удалению и устранению ржавчины увеличивает эксплуатационные затрат. Отработано ряд способов, используя которые, можно минимизировать коррозию.
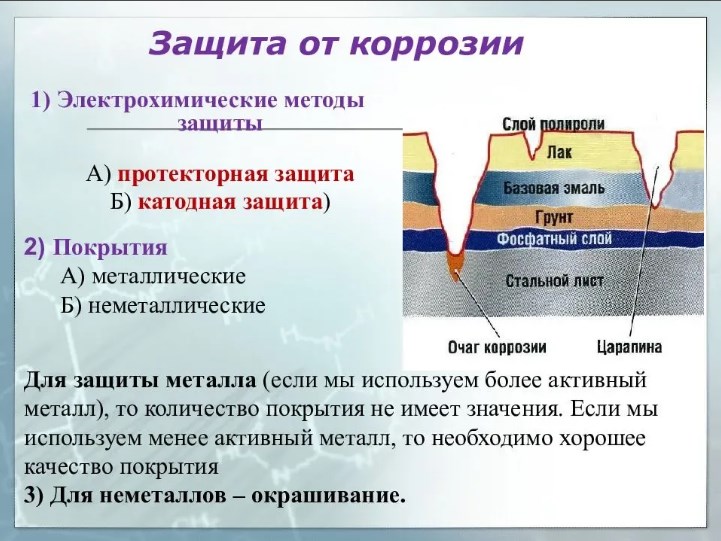
Металлические покрытия
Эти методы предотвращения коррозии заключаются в погружении стали в расплав металла, электрический потенциал которого меньше, чем железа (чем больше разница, тем эффективнее покрытие).
Практическое применение находят гальванические покрытия цинком или оловом, а также диффузионные покрытия никелем, хромом, кремнием или алюминием. По сравнению с другими методами защиты от коррозии гальванизация известна более низкими начальными затратами, устойчивостью и универсальностью.
Поскольку расход металла-протектора довольно велик, преимущество получают технологии, отличающиеся экономичностью используемых компонентов и прочностью создаваемых покрытий. Первым в этом списке находится цинкование. Железо в стали вступает в реакцию с цинком, образуя прочное покрытие из сплава, которое служит защитой.
Неметаллические покрытия
Один из самых простых способов предотвратить коррозию - использовать защитные покрытия из неметаллов - краски, пластика, воска или порошка. Порошки, включая эпоксидную смолу, нейлон и уретан, наносятся на металлическую поверхность и нагреваются до стадии расплавления, образуя тонкую плёнку.
Краска действует как покрытие, защищающее металлическую поверхность от электрохимического заряда, который исходит от коррозионно опасных соединений. Обычно используют комбинацию различных слоёв краски, которые выполняют разные функции. Грунтовка действует как ингибитор, промежуточный слой увеличивает общую толщину краски, а финишный слой обеспечивает устойчивость к факторам окружающей среды.
Химические покрытия
Относятся к методам временной антикоррозионной защиты стали, например, во время пластического деформирования при повышенных температурах. Наибольшее распространение получили технологии фосфатирования и оксалатирования.
При фосфатировании поверхность покрывают сплошным слоем фосфатных солей железа и марганца, а при оксалатировании – водорастворимыми солями щавелевой кислоты. Фосфатирование используется для обработки нелегированных сталей, оксалатирование – легированных. Покрытие прочно сцепляется с поверхностью, способствуя снижению трения и уменьшению износа инструмента. После окончания штамповки покрытие удаляют.
Изменение состава технического металла и коррозионной среды
Заключается в специальном легировании стали элементами, повышающими её коррозионную стойкость. Если это возможно, то в механическую систему, которая работает в условиях повышенной температуры и влажности, вводят смазку, содержащую противокоррозионные компоненты (восстановители).
Элементом, который положительно влияет на коррозионную стойкость стали, является хром. Для реализации этого эффекта сталь должна содержать не менее 13% хрома. Каждые дополнительные 5% хрома обеспечивают еще лучшую коррозионную стойкость.

Никель - второй важный элемент для улучшения коррозионной стойкости стали, причём добавка никеля приводит также к стабилизации аустенита. Третьим важным элементом повышения коррозионной стойкости является молибден. Однако его добавки повышают коррозионную стойкость только нержавеющих сталей с достаточным содержанием хрома и никеля.
Электрохимическая защита
Процесс коррозии, которая возникает при контакте двух разных металлов, находящихся в электролите, можно остановить использованием системы катодной защиты. Для реализации метода активные центры на поверхности металла необходимо преобразовать в пассивные путем предоставления электронов из другого источника (обычно используют аноды, прикрепленные к поверхности). Металлы, используемые для анодов - алюминий, магний или цинк.
Катодная защита очень эффективна в бытовой технике, однако аноды необходимо часто проверять, что увеличивает расходы на техническое обслуживание.

В зависимости от интенсивности и длительности коррозийного процесса металл может быть подвергнут как частичному, так и полному разрушению. Взаимодействие коррозийной среды и металла приводят к образованию на поверхности металла таких явлений, как окалина, оксидная пленка и ржавчина. Данные явления отличаются друг от друга не только внешним видом, но еще и степенью адгезии с поверхностью металлов. Так, например, в процессе окисления такого металла, как алюминий, его поверхность покрывает пленка оксидов, отличающаяся высокой прочностью. Благодаря этой пленке разрушительные процессы купируются и не проникают вовнутрь. Если говорить о ржавчине, то результатом ее воздействия является образование рыхлого слоя. Процесс коррозии в данном случае очень быстро проникает во внутреннюю структуру металла, что способствует его скорейшему разрушению.
Показатели, по которым осуществляется классификация коррозийных процессов:
- вид коррозийной среды;
- условия и механизм протекания;
- характер коррозийных разрушений;
- вид дополнительных воздействий на металл.
По механизму коррозийного процесса различают как химическую, так и электрохимическую коррозию металлов и сплавов.
Химическая коррозия – это взаимодействие металлов с коррозийной средой, в процессе которого наблюдается единовременное осуществление окисления металла и восстановление окислительного компонента среды. Взаимодействующие между собой продукты не разделены пространственно.
Электрохимическая коррозия – это взаимодействие металлов с коррозийно-активной средой, представляющей собой раствор электролита. Процесс ионизации атомов металла, а также процесс восстановления окислительного компонента данной коррозийной среды протекают в разных актах. Электродный потенциал раствора электролита оказывает существенное влияние на скорость этих процессов.
В зависимости от типа агрессивной среды существует несколько видов коррозии

Атмосферная коррозия представляет собой саморазрушение металлов в воздушной атмосфере, либо в газовой атмосфере, отличающейся повышенной влажностью.
Газовая коррозия – это коррозия металлов, происходящая в газовой среде, содержание влаги в которой минимально. Отсутствие влаги в газовой среде не единственное условие, способствующее саморазрушению металла. Также коррозия возможна и при высоких температурах. Наиболее часто встречается данный вид коррозии в нефтехимической и химической промышленности.
Радиационная коррозия представляет собой саморазрушение металла под воздействием на него радиоактивного излучения разной степени интенсивности.
Подземная коррозия – это коррозия, происходящая в почвах и различных грунтах.
Контактная коррозия представляет вид коррозии, образованию которого способствует контакт нескольких металлов, отличающихся друг от друга стационарными потенциалами в конкретном электролите.
Биокоррозия – это коррозия металлов, происходящая под воздействием различных микроорганизмов и их жизнедеятельности.
Коррозия током (внешним и блуждающим) – еще один вид коррозии металлов. Если на металл воздействует ток от внешнего источника, то это коррозия внешним током. Если же воздействие осуществляется посредством блуждающего тока, то это коррозия блуждающего тока.
Коррозийная кавитация представляет собой процесс саморазрушения металлов, возникновению которого способствует как ударное, так и коррозионное воздействие внешней среды.
Коррозия под напряжением представляет собой коррозию металла, причиной появления которой является взаимодействие коррозийно-активной среды и напряжений механического типа. Данный вид коррозии представляет существенную опасность для конструкций из металла, которые подвергаются сильнейшим механическим нагрузкам.
Фреттинг-коррозия — вид коррозии металлов, к которой приводит совокупность вибрации и воздействие коррозийной среды. Чтобы минимизировать вероятность возникновения коррозии при трении и вибрации, необходимо внимательно подходить к выбору конструкционного материала. Также необходимо применять специальные покрытия и по возможности снизить коэффициент трения.
По характеру разрушений коррозия разделяется на сплошную и избирательную
Сплошная коррозия полностью покрывает поверхность металла. Если скорость разрушений на всей поверхности одинакова, то это равномерная коррозия. Если разрушение металла на различных его участках происходит с разной скоростью, то коррозия называется неравномерной.
Избирательная коррозия подразумевает разрушение одного из компонентов сплава или же одной структурной составляющей.
Местная коррозия, проявляющаяся в виде отдельно разбросанных по поверхности металла пятен, представляет собой углубления разной толщины. Разрушения могут представлять собой раковины или точки.
Подповерхностная коррозия образуется непосредственно на поверхности металла, после чего активно проникает вглубь. Данный вид коррозии сопровождается расслоением изделий из металла.
Межкристаллитная коррозия проявляется в разрушении металла по границам зерен. По внешнему виду металла ее достаточно сложно определить. Однако очень быстро меняются показатели прочности и пластичности металла. Изделия из него становятся хрупкими. Наиболее опасен этот вид коррозии для хромистых и хромоникелевых видов стали, а также для алюминиевых и никелевых сплавов.
Щелевая коррозия образуется на тех участках металлов и сплавов, которые находятся в резьбовых креплениях, различных зазорах и под всевозможными прокладками.
Читайте также:

