Что такое кофермент кратко
Обновлено: 16.05.2024
Неорганические ионы. Активаторы ферментов. Простетические группы. Коферменты. НАД. НАДФ.
Полагают, что эти ионы заставляют молекулы фермента или субстрата принять форму, способствующую образованию фермент-субстратного комплекса. Тем самым увеличиваются шансы на то, что фермент и субстрат действительно прореагируют друг с другом, а следовательно, возрастает и скорость реакции, катализируемой данным ферментом. Так, например, активность амилазы слюны повышается в присутствии хлорид-ионов.
Простетические группы
Если кофактор прочно связан с ферментом и остается в этом связанном состоянии постоянно, то его называют простетической группой (от греч. prosthekf — добавление). Роль простети-ческих групп играют органические молекулы. Они помогают ферменту осуществлять его каталитическую функцию, как это видно на примере флавинадениндинуклеотида (ФАД). ФАД содержит рибофлавин (витамин В2), который является водород-акцепторной частью его молекулы.
Функция ФАД связана с окислительными путями клетки, в частности с процессом дыхания, в котором ФАД играет роль одного из переносчиков в дыхательной цепи.
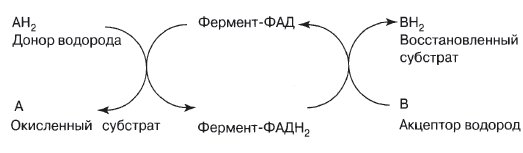
Конечный результат: 2Н переносятся от А к В. В качестве связующего звена между А и В действует один фермент. АНг и В вступают в соединение с активным центром фермента, и ФАД передает Нг от одного субстрата к другому.
Гем — это железосодержащая простетическая группа. Его молекула имеет форму плоского кольца (порфириновое кольцо, такое же, как у хлорофилла), в центре которого находится атом железа. Гем выполняет в организме ряд биологически важных функций.
Перенос электронов. В качестве простетиче-ской группы цитохромов) гем выступает как переносчик электронов. Присоединяя электроны, железо восстанавливается до Fe(II), а отдавая их, окисляется до Fe(III). Гем, следовательно, принимает участие в окислительно-восстановительных реакциях за счет обратимых изменений валентности железа.
Перенос кислорода. Гемоглобин и миоглобин — два гемсодержащих белка, осуществляющих перенос кислорода. Железо находится в них в восстановленной, Fe(II), форме.
Каталитическая функция. Гем входит в состав каталаз и пероксидаз, катализирующих расщепление пероксида водорода до кислорода и воды. Содержится он также и в некоторых других ферментах.
Коферменты (например, НАД, НАДФ, ацетилкофермент А, АТФ)
Коферменты, как и простетические группы, — это органические молекулы, выполняющие функцию кофакторов, но в отличие от простетических групп они сохраняют связь с ферментом только в ходе реакции. Все коферменты представляют собой производные витаминов.
Никотинамидадениндинуклеотид (НАД)
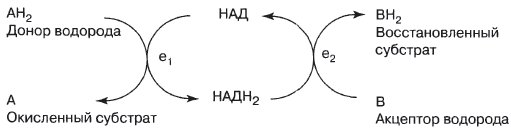
Конечный результат: 2Н переносятся от А к В. Здесь в качестве связующего звена между двумя различными ферментными системами ei и е2 действует кофермент.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Соединяясь с белковой частью молекулы фермента — апоферментом, К. образуют каталитически активный комплекс — холофермент. Прочно связанные с белками К. называются простетическими группами. Многие К. легко отделяются от ферментного белка и служат переносчиками электронов, отдельных атомов или групп атомов субстрата, превращение которого катализирует данный фермент, т.е. функционируют в качестве промежуточных акцепторов. К. могут участвовать в активировании молекул субстратов, образуя с ними реакционно-способные соединения, которые затем подвергаются ферментативному превращению. Некоторые метаболиты, выступающие в ферментативных реакциях как обычные субстраты, в определенных условиях могут выполнять роль К. Многие К. являются производными витаминов (Витамины), поэтому нарушение обмена веществ при витаминной недостаточности (Витаминная недостаточность) опосредовано через понижение активности определенных ферментов.
К важнейшим К. нуклеотидной природы относятся никотинамидные К. никотинамидадениндинуклеотид (НАД, NAD + ; синоним: дифосфопиридиннуклеотид, ДПН; устаревшее кофермент I, Kol, козимаза, кодегидр (оген)аза I] и его фосфорилированное производное никотинамидадениндинуклеотидфосфат [НАДФ, NADP + ; синоним: трифосфопиридиннуклеотид, ТПН; устаревшее кофермент II, KoII, фосфокозимаза, фосфокодегидр(оген)аза]. Никотинамидные К. входят в состав ряда дегидрогеназ — катализаторов ключевых окислительно-восстановительных реакций энергетического и пластического обмена. Молекула НАД представляет собой динуклеотид, построенный из аденинрибонуклеотида и никотинамидрибонуклеотида (последний отвечает за проявление каталитической активности НАД), связанных фосфоангидридным мостиком, а НАДФ имеет третий остаток фосфорной кислоты в положении 2' рибозы аденилового нуклеотида. Способность НАД и НАДФ переносить электроны и протоны от окисляемого субстрата к другому акцептору обеспечивает выполнение этими К. важной биологической функции в процессе клеточного дыхания (см. Дыхание тканевое). Окислительно-восстановительные реакции, протекающие с участием никотинамидных К., могут быть изображены в виде общего уравнения; АН2 + НАД(Ф) + = А + НАД(Ф)Н + Н + , где АН2 восстановленная форма субстрата. А — окисленная форме субстрата. Эти реакции состоят в обратимом переносе двух восстановительных эквивалента от субстрата к окисленному никотинамидному К. Один восстановительный эквивалент присутствует в восстановленном К. в виде атома водорода, другой — в виде электроне, при этом катион второго атома водорода переходит в среду а виде свободного Н + . Обнаружено около 350 НАД(Ф)-зависимых дегидрогеназ, как правило, специфичных в отношении либо НАД, либо НАДФ. Обычно связь никотинамидных и других нуклеотидных К. с белками легко диссоциирует. НАД-зависимые дегидрогеназы участвуют преимущественно в процессах катаболизма (например, в клеточном дыхании), в НАДФ-зависимые — главным образом в анаболических процессах (восстановительных биосинтетических реакциях). Содержание никотинамидных К., соотношение между их окисленными и восстановленными формами (НАДН и НАДФН), к также величию отношения НАД/НАДФ являются показателями активности метаболических процессов в ткани, характеризуют ее функциональное состояние. В организме НАД и НАДФ синтезируются из никотиновой кислоты (ниацина, или витамина РР) или никотинамида, поэтому недостаточность ниацина ведет к нарушению биосинтеза никотинамидных коферментов.
Определение этих К. производят обычно спектрофотометрически (по характерному поглощению окисленных форм при 260 нм восстановленных форм или при 340 нм), флюориметрически (длина волны возбуждения 340 нм, флюоресценции 480 нм) или потенциометрически.
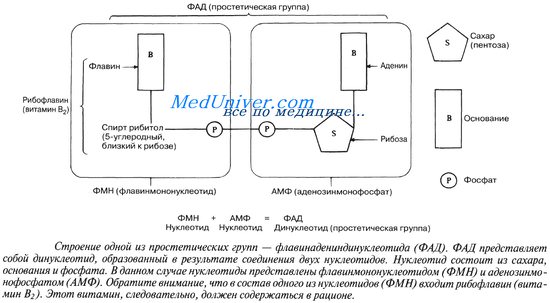
Флавиновые нуклеотиды, или флавиновые К. (флавинмононуклеотид, ФМН, 5-фосфорный эфир рибофлавина.; флавинадениндинуклеотид, ФАД, рибофлавин-5'-аденозиндифосфат), являются К. так называемых флавопротеинов — ферментов, широко распространенных в живых клетках, принимающих участие в обмене основных классов органических соединений и играющих важную роль в процессе биологического окисления (см. Дыхание тканевое). К флавиновым К. относится рибофлавин (витамин В2), недостаточность которого приводит к нарушению нормального функционирования флавинзависимых ферментов. В окисленном состоянии флавиновые К. имеют интенсивный желтый цвет, в восстановленном состоянии они бесцветны. Как правило, ФМН и ФАД прочно связаны с соответствующими белками-апоферментами. Флавопротеины (ферменты, коферментами которых являются производные флавинов) принадлежат к дыхательным ферментам класса оксидоредуктаз. Механизм окислительно-восстановительных реакций, катализируемых ими, обусловлен последовательным окислением и восстановлением флавиновых коферментов. Ряд ферментов (например, монооксигеназы) наряду с флавиновыми используют и никотинамидные К. Определение флавиновых К. проводят спектрофотометрически или флюориметрически в характерных для них областях поглощения при определенных длинах волн.
Кофермент А (КоА, восстановленная форма KoASH; синоним коэнзим А) — соединение аденозин-3',5'-фосфорной кислоты и β-меркаптоэтиламида пантотеновой кислоты, образующее с остатками органических кислот (R) тиоэфиры типа R—СО—SKoA. Играет роль К. в переносе и активировании кислотных остатков в реакциях ацилирования, конденсации, оксидоредукции или гидратации органических кислот. КоА участвует в клеточном дыхании, биосинтезе и окислении жирных кислот (Жирные кислоты), синтезе стероидов. Для нормального синтеза КоА необходимо адекватное поступление в организм пантотеновой кислоты, входящей в состав КоА.
Кофермент В12 (КоВ12, витамин В12) — α-(5,6-диметилбензимидазолил)-кобаламинцианид является коферментом ферментов, участвующих в переносе одноуглеродных фрагментах, обмене метионина и других соединений. Недостаток в рационе витамина В12, вызывающий в организме дефицит кофермента В12, клинически проявляется мегалобластной гиперхромной анемией, ее так называемой нутритивной (алиментарной) В12-дефицитной формой. Эндогенная недостаточность витамина В12 вследствие нарушения всасывания этого витамина в кишечнике также приводит к дефициту кофермента В12, клинически проявляющемуся одной из форм мегалобластной гиперхромной анемии — пернициозной (В12-дефицитной) анемией, или анемией Аддисона — Бирмера.
Пиридоксальфосфат и его производные являются простетическими группами ряда ферментов, участвующих в обмене аминокислот (Аминокислоты) (реакциях трансаминирования, декарбоксилирования и др.), а также фермента гликогенфосфорилазы. При недостаточном поступлении в организм пиридоксальфосфата — производного витамина В6 — нарушаются функции пиридоксальзависимых ферментов.
Дифосфотиамин является коферментом кетолаз и транскетолаз — ферментов, участвующих в декарбоксилировании α-кетокислот и расщеплении углеродной цепи фосфорилированных сахаров, и представляет собой производное витамина В1 (тиамина).
Менее распространены К. пептидной природы, важнейшим представителем которых является глутатион (CSH, ГSH, окисленный глутатион — CSSC или ГSSГ) — υ-L-глутамил-L-цистеинил-L-глицин, который принимает активное участие во многих окислительно-восстановительных реакциях и обеспечивает функционирование ряда SH-зависимых ферментов. Наиболее важной функциональной группой восстановленной формы глутатиона является сульфгидрильная (SH-) группа, которая легко подвергается ферментативному или неферментативному окислению с образованием дисульфидной (окисленной) формы глутатиона, состоящей из двух молекул восстановленного глутатиона (Г—S— S—Г). Таким образом глутатион функционирует как переносчик водорода. Глутатион принимает прямое участие в некоторых реакциях цис-транс-изомеризации, является коферментом системы глиоксилазы, формальдегид-дегидрогеназы, глутатионпероксидазы. С генетически обусловленным нарушением обмена глутатиона связан ряд наследственных болезней, в т.ч. наследственные гемолитические Анемии. Определение глутатиона производят колориметрически и ферментативными методами с применением глутатионпероксидазы и глутатионредуктазы.
Липоевая (тиоктовая) кислота — насыщенная серосодержащая жирная кислота — входит в качестве одного из К. в состав мультиферментных комплексов, осуществляющих декарбоксилирование α-кетокислот (пировиноградной, α-кетоглутаровой кислот). Выполняет роль промежуточного акцептора водорода и кислотных остатков за счет своей способности к обратимому восстановлению (переход S—S→SH).
Витамины К — жирорастворимые соединения, производные нафтохинона — играют роль К. в реакциях системы свертывания крови. Их водорастворимый аналог — викасол — применяют в медицине в качестве лекарственного средства.
Биотин (витамин Н) — водорастворимый витамин — выступает в качестве К. (простетической группы) в составе ряда ферментов, катализирующих реакции карбоксилирования — декарбоксилирования некоторых органических кислот, например пируваткарбоксилазы и ацетил-КоА-карбоксилазы — ферментов начальных этапов глюконеогенеза и синтеза липидов соответственно. В активном центре молекулы карбоксилаз биотин прочно связан амидной связью с ε-аминогруппой остатка лизина фермента.
Библиогр.: Диксон М. и Уэбб Э. Ферменты, пер. с англ., т. 1—3, М., 1982; Коферменты, под ред. А.А. Яковлева, М., 1973.
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг .

Коферменты представляют собой органические соединения небелковой природы, которые необходимы для функционирования многих ферментов. Большинство из них являются производными витаминов.
Причиной нарушения метаболизма и снижения синтеза полезных веществ в организме часто является снижение активности некоторых видов ферментов. Поэтому то коэнзимы столь нам необходимы.
В узком смысле, кофермент – это коэнзим Q10, производная фолиевой кислоты и некоторых других витаминов. Важное значение для организма человека имеют те коферменты, которые продуцируются витаминами группы B.
Кофермент нужен для того, чтобы повысить производительность клеточной энергии, которая нужна для поддержания жизнедеятельности. Любой процесс, который протекает в организме человека, требует колоссального энергетического ресурса, будь то умственная деятельность, работа сердечно-сосудистой или пищеварительной системы, физическая активность при нагрузке на опорно-двигательный аппарат. Благодаря реакции, в которую коферменты вступают с ферментами, продуцируется необходимая энергия.
Функции коферментов
Коферменты представляют собой небелковые соединения, которые способствуют активации потенциала ферментов. Они выполняют 2 основные функции:
- Участвуют в каталитических процессах. Кофермент сам по себе не вызывает в организме необходимых молекулярных превращений, в состав ферментов он входит вместе с апоферментом, и только при их взаимодействии происходят каталитические процессы связывания субстрата.
- Транспортировочная функция. Кофермент соединяется с субстратом, в результате чего образуется прочный транспортировочный канал, по которому свободно перемещаются молекулы до центра другого фермента.
Все коферменты объединяет одно важное свойство – они являются термически устойчивыми соединениями, но свойственные им химические реакции довольно сильно разнятся.
Классификация коферментов
По способам взаимодействия с апоферментом коферменты делятся на:
- Растворимые – во время реакции соединяется с молекулой фермента, после чего изменяется по химическому составу и высвобождается заново.
- Простетические – прочно связаны с апоферментом, в процессе реакции находится в активном центре фермента. Их регенерация происходит при взаимодействии с другим коферментом или субстратом.
По химической структуре коферменты делятся на три группы:
- алифатические (глутатион, липоевая кислота и др.)
- гетероциклические (пиридоксальфосфат, тетрагидрофолиевая кислота, нуклеозидфосфаты и их производные (КоА, ФМН, ФАД, НАД и др.), металлопорфириновые гемы и др.
- ароматические (убихиноны).
По функциональному признаку выделяют две группы коферментов:
- окислительно-восстановительные,
- коферменты переноса групп.
Коферменты в спортивной фармакологии
При интенсивных физических нагрузках расходуется большое количество энергии, ее запас в организме истощается, а многие витамины и питательные вещества потребляются гораздо быстрее, чем вырабатываются. Спортсмены испытывают физическую слабость, нервное истощение, нехватку сил. Для того чтобы помочь избежать многих симптомов были разработаны специальные препараты с коферментами в составе. Их спектр действия очень широк, назначаются они не только спортсменам, но и людям с достаточно серьезными заболеваниями.
Кокарбоксилаза
Кофермент, который образуется только из поступающего в организм тиамина. У спортсменов он служит средством профилактики перенапряжения миокарда, расстройств нервной системы. Препарат назначается при радикулитах, невритах, а также острой печеночной недостаточности. Вводится внутривенно, разовая доза не должна быть менее 100 мг.
Кобамамид
Заменяет по действию функционал витамина B12, является анаболиком. Помогает спортсменам нарастить мышечную массу, увеличивает выносливость, способствует быстрому восстановлению после занятий. Выпускается в форме таблеток и растворов для внутривенного введения, суточная норма составляет 3 таблетки или 1000 мкг. Длительность курса – не более 20 дней.
Оксикобаламин
По своему действию схож с витамином B12, но намного дольше держится в крови и гораздо оперативнее преобразуется в коферментную формулу благодаря прочному соединению с плазменными белками.
Пиридоксальфосфат
Для препарата характерны все свойства витамина B6. От него он отличается быстрым терапевтическим эффектом, назначается к приему даже при нарушении фосфорилирования пиридоксина. Принимается три раза в день, суточная доза составляет не более 0,06 гр, а курс – не дольше месяца.

Пиридитол
Активизирует метаболические процессы центральной нервной системы, повышает проходимость глюкозы, препятствует избыточному образованию молочной кислоты, повышает защитные свойства тканей, в том числе устойчивость к гипоксии, которая возникает во время интенсивных спортивных тренировок. Принимают препарат три раза в день по 0,1 гр. после завтрака в течение месяца
Пантогам
Является гомологом пантотеновой кислоты, ускоряет обменные процессы, снижает проявление болевых реакций, повышает устойчивость клеток к гипоксии. Действие препарата направлено на активацию работы головного мозга, повышение выносливости, показан к применению при черепно-мозговых травмах различного типа. Таблетки принимаются в течение месяца по 0,5 гр не чаще трех раз в день.
Карнитин
Выпускается в форме препарата для инъекций, действие которых направлено на активацию жирового обмена, ускорение регенерации клеток. Оказывает анаболическое, антигипоксическое и антитиреоидное действие. Является синтетическим заменителем витамина B6. Эффективен в виде внутривенной капельницы.

Флавинат
Образуется в организме из рибофлавина, активно участвует в углеводном, липидном и аминокислотном обмене. Выпускается в виде раствора для внутримышечных инъекций, так как его усвоение в желудке неэффективно при нарушении всасывания рибофлавина.
Липоевая кислота
Нормализует углеводный обмен. Повышает скорость окисления углеводов и жирных кислот, что способствует повышению энергетического запаса.

Коферменты (лат. приставка "co-" — объединение, сообща, вместе) , или коэнзимы — органические природные соединения небелковой природы, необходимые для осуществления каталитического действия ферментов [1] . Коферменты вместе с функциональными группами аминокислотных остатков фермента формируют активный центр фермента, на котором происходит связывание с субстратом и образование активированного фермент-субстратного комплекса.
Комплекс кофермента и апофермента образует целостную, биологически активную молекулу фермента, называемую холоферментом. Наиболее распространенную группу составляют соединения нуклеотидной природы, а также коферменты, содержащие остатки фосфорной кислоты.
Роль коферментов нередко играют витамины или их метаболиты (чаще всего — фосфорилированные формы витаминов группы B). Например, коферментом фермента карбоксилазы является тиаминпирофосфат, коферментом многих аминотрансфераз — пиридоксаль-6-фосфат.
В металлоферментах роль, аналогичную роли коферментов, могут исполнять катионы металлов, однако коферментами их обычно не называют.
Коферменты обычно непрерывно синтезируются, и их концентрация поддерживается на постоянном уровне внутри клетки. Например, НАДФ "пополняется" через пентозофосфатный путь и S-аденозилметионин с помощью метионинаденозилтрансферазы. Непрерывный синтез означает, что небольшие количества коферментов могут использоваться очень интенсивно. Например, человеческое тело переворачивает свой собственный жир в АТФ каждый день [2] .
Читайте также:
- Что такое искусственные материалы технология 7 класс кратко
- Оценка воздействия видов природопользования на окружающую среду 10 класс план урока
- Какие причины краха могущественной французской армии отмечает у черчилль кратко
- Чем отличается гимназия от школы в беларуси
- Кто основал первую школу прямого метода

