Что такое электролиты и как объясняется их способность проводить электрический ток кратко
Обновлено: 30.06.2024
Электроли́т — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Содержание
Степень диссоциации
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации [1] .
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
- Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Использование термина
В естественных науках
В технике
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
В электрохимии
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например, электролит золочения).
В источниках тока
Электролиты являются важной частью химических источников тока: гальванических элементов и аккумуляторов. [2] Электролит участвует в химических реакциях окисления и восстановления с электродами, благодаря чему возникает ЭДС. В источниках тока электролит может находиться в жидком состоянии (обычно это — водный раствор), или загущённым до состояния геля.
Электролитический конденсатор
В электролитических конденсаторах в качестве одной из обкладок используется электролит. В качестве второй обкладки - металлическая фольга (алюминий), или пористый, спечённый из металлических порошков блок (тантал, ниобий). Диэлектриком в таких кондесаторах служит слой оксида самого металла, формируемый химическими методами на поверхности металлической обкладки.
Конденсаторы данного типа, в отличие от других типов, обладают несколькими отличительными особенностями:
- Высокая объемная и весовая удельная ёмкость.
- Требование к полярности подключения в цепях постоянного напряжения. Несоблюдение полярности вызывает бурное вскипание электролита, приводящее к механическому разрушению корпуса конденсатора (взрыву).
- Значительные утечки и зависимость электрической ёмкости от температуры.
- Ограниченный сверху диапазон рабочих частот (типовые значения сотни кГц … десятки МГц в зависимости от номинальной ёмкости и технологии).
Примечания
- ↑Степень диссоциации (α) — отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита.
- ↑ГОСТ 15596-82 Источники тока химические. Термины и определения
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Проставив сноски, внести более точные указания на источники.
- Добавить иллюстрации.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Электролит" в других словарях:
электролит — электролит … Орфографический словарь-справочник
ЭЛЕКТРОЛИТ — (греч.). Жидкое тело, разлагаемое при помощи электрического (гальванического) тока. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЭЛЕКТРОЛИТ Жидкость, подверженная разложению посредством гальванического тока.… … Словарь иностранных слов русского языка
электролит — а, м. électrolyte m. < électro + гр. lytos разлагаемый. спец. Химическое вещество (в расплаве или растворе), способное разлагаться на составные части при прохождении через него электрического тока. Электролит аккумулятора. БАС 1. Швыряло… … Исторический словарь галлицизмов русского языка
электролит — Раствор, в котором при прохождении через него электрического тока происходит разложение вещества, которое приводит к появлению электрического тока. Электролит является основой аккумуляторов и батарей. [Гипертекстовый энциклопедический словарь по… … Справочник технического переводчика
ЭЛЕКТРОЛИТ — ЭЛЕКТРОЛИТ, раствор или расплав солей, способный проводить электрический ток и используемый для ЭЛЕКТРОЛИЗА (в ходе которого он разлагается). Ток в электролитах проводится заряженными частицами ИОНАМИ, а не электронами. Например, в свинцово… … Научно-технический энциклопедический словарь
ЭЛЕКТРОЛИТ — ЭЛЕКТРОЛИТ, электролита, муж. (от слова электрический и греч. lytos растворенный) (физ.). Раствор какого нибудь вещества, способного разлагаться на составные части при электролизе. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
электролит — сущ., кол во синонимов: 1 • католит (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Электролит — Электролитами называют вещества, растворы и сплавыкоторых с другими веществами электролитически проводят гальваническийток. Признаком электролитической проводимости в отличие от металлическойдолжно считать возможность наблюдать химическое… … Энциклопедия Брокгауза и Ефрона
электролит — – вещество, водный раствор или расплав которого проводит электрический ток. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ЭЛЕКТРОЛИТ — вещество, водный раствор или расплав которого проводит электрический ток (см.), образующимися в результате электролитической (см.). Этим Э., называемые также (см.) второго рода, отличаются от металлов (проводников первого рода), в которых перенос … Большая политехническая энциклопедия
Что такое электролит
Вещества, в которых электрический ток обусловлен движением ионов, то есть ионной проводимостью, называются электролитами. Электролиты относятся к проводникам второго рода, поскольку ток в них связан с химическими процессами, а не просто с движением электронов, как например в металлах.
Молекулы данных веществ в растворе способны к электролитической диссоциации, то есть они распадаются при растворении на положительно заряженные (катионы) и отрицательно заряженные (анионы) ионы. В природе можно встретить твердые электролиты, ионные расплавы и растворы электролитов. В зависимости от вида растворителя, электролиты бывают водные и неводные, а также особый вид - полиэлектролиты.

В зависимости от вида ионов, на которые распадается вещество при растворении в воде, можно выделить электролиты без ионов Н+ и ОН- (солевые электролиты), электролиты с обилием ионов Н+ (кислоты) и электролиты с преобладанием ионов ОН- (основания).

Если при диссоциации молекул электролита образуется равное число положительных и отрицательных ионов, такой электролит называется симметричным. Или же несимметричным, если количество положительных и отрицательных ионов в растворе не одинаково. Примеры симметричных электролитов — KCL-1,1-валентный электролит и CaSO4 – 2,2-валентный электролит. Представителем несимметричного электролита является, например, H2SO4 – 1,2-валентный электролит.

Все электролиты можно условно разделить на сильные и слабые, в зависимости от их способности к диссоциации. Сильные электролиты в разбавленных растворах почти полностью распадаются на ионы. К ним относится большое количество неорганических солей, некоторые кислоты и основания в водных растворах или растворителях с высокой диссоциирующей способностью, таких как спирты, кетоны или амиды.
Слабые электролиты распадаются лишь частично, и пребывают в динамическом равновесии с недиссоциированными молекулами. К ним относится большое количество органических кислот, а также многие основания в растворителях.
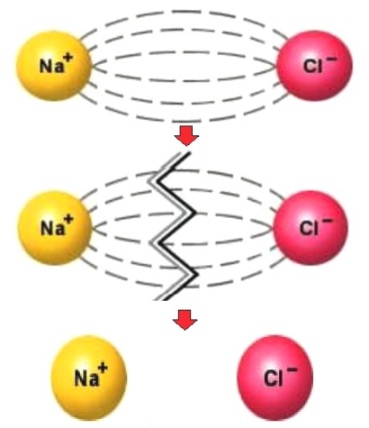
Степень диссоциации зависит от нескольких факторов: от температуры, от концентрации, от вида растворителя. Так, один и тот же электролит при разной температуре или при одинаковой температуре, но в разных растворителях, будет диссоциирован в разной степени.
Поскольку электролитическая диссоциация по определению порождает большее количество частиц в растворе, это приводит к значительным различиям в физических свойствах растворов электролитов и веществ иного рода: увеличивается осмотическое давление, изменяется температура замерзания по отношению к чистому растворителю и т. д.
Часто ионы электролита участвуют в электрохимических процессах и химических реакциях как самостоятельные кинетические единицы, независимо от других присутствующих в растворе ионов: на электродах, погруженных в электролит, при прохождении через электролит тока, протекают окислительно-восстановительные реакции, продукты которых добавляются в состав электролита.
Таким образом, электролиты — это сложные системы веществ, включающие в себя ионы, молекулы растворителя, недиссоциированные молекулы растворенного вещества, ионные пары и более крупные соединения. И свойства электролитов определяются поэтому целым рядом факторов: характером ион-молекулярных и ион-ионных взаимодействий, изменением структуры растворителя при наличии растворенных частиц и т. д.
Ионы и молекулы полярных электролитов очень активно взаимодействуют друг с другом, что приводит к формированию сольватных структур, роль которых становится значительнее с уменьшением размеров ионов и с ростом их валентностей. Энергия сольватации является мерой взаимодействия ионов электролита с молекулами растворителя.

Электролиты, в зависимости от их концентрации, бывают: разбавленными растворами, переходными и концентрированными. Разбавленные растворы близки по структуре к чистому растворителю, но присутствующие ионы нарушают эту структуру своим влиянием. Такие слабые растворы сильных электролитов отличаются от идеальных растворов по свойствам в силу электростатического взаимодействия между ионами.
Переходная область концентрации характеризуется значительным изменением структуры растворителя из-за влияния ионов. При еще более высокой концентрации большинство молекул растворителя участвуют в сольватационных структурах с ионами, создавая таким образом дефицит растворителя.
Концентрированный же раствор имеет структуру близкую к ионному расплаву или кристаллосольвату, отличающуюся высокой упорядоченностью и единообразием ионных структур. Такие ионные структуры связываются друг с другом и с молекулами воды в ходе сложных взаимодействий.
Для электролитов характерны высокотемпературная и низкотемпературная области их свойств, а также области высоких и нормальных давлений. С ростом давления или температуры снижается молярная упорядоченность растворителя, слабеет влияние ассоциативных и сольватационных эффектов на свойства раствора. А когда температура падает ниже температуры плавления — некоторые электролиты переходят в стеклообразное состояние. Примером такого электролита может служить водный раствор LiCl.

Сегодня электролиты играют особую важную роль в мире техники и биологии. В биологических процессах электролиты выступают средой неорганического и органического синтеза, а в технике — основой электрохимических производств.
Электролиз, электрокатализ, коррозия металлов, электрокристаллизация — данные явления занимают важные места во многих современных производствах, особенно применительно к энергетике и защите окружающей среды.
Электролиты – это проводящие среды, в которых протекает электрический ток, сопровождающийся переносом вещества.
Какие вещества являются электролитами. Электролиз
Положительно и отрицательно заряженные ионы являются носителями свободных зарядов в электролитах. Соединения металлов в расплавленном состоянии, некоторые твердые вещества относят к электролитам. Основными их представителями являются водные растворы неорганических кислот, солей, оснований. Их широко применяют в технике.
При прохождении электрического тока через электролит происходит одновременное выделение веществ на электродах. Данное явление получило название электролиза.
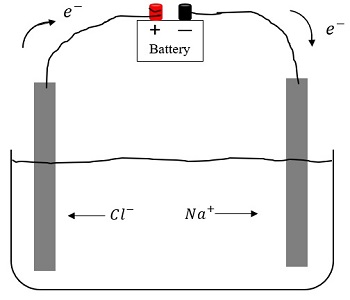
Электрический ток в электролитах рассматривается как перемещение ионов с обоими знаками в противоположных направлениях.
Движение положительных ионов направлено к отрицательному электроду (катоду), а отрицательных – к положительному электроду (аноду). Появление ионов с противоположными знаками в водных растворах солей, кислот, щелочей является следствием расщепления нейтральных молекул. Явление получило название электролитической диссоциации.
При диссоциации в водном растворе хлорида меди CuCl 2 на ионы меди и хлора получаем выражение:
CuCl 2 ⇄ Cu 2 + + 2 Cl - .
Рисунок 1 . 15 . 1 показывает принцип упорядоченного движения положительных ионов меди к катоду, а отрицательных ионов хлора – к аноду вследствие подключения электродов к источнику тока при действии электрического поля на эти ионы.
После достижения катода ионы меди нейтрализуются избыточным количеством его электронов и переходят в состояние нейтральных атомов, оседающих на катоде. Ионы хлора, добравшись к аноду, отдают по одному электрону. После чего происходит соединение попарно нейтральных атомов хлора для образования молекулы хлора Cl 2 . Его наличие обусловлено выделением пузырьков на аноде.
Многие реакции электролиза сопровождаются вторичными реакциями продуктов разложения, которые выделяются на электродах, с его материалом или растворителями.
Примером может служить электролиз раствора сульфата меди (медного купороса) CuSO 4 при опущенных в электролит электродов, изготовленных их меди.
Диссоциация молекул сульфата меди идет согласно формуле:
CuSO 4 ⇄ Cu 2 + + SO 4 2 - .
Нейтральные атомы меди оседают в виде твердого осадка на катоде. Таким образом получается химически чистая медь. При отдаче ионом SO 4 2 - двух электронов аноду становится нейтральным радикалом SO 4 , который вступает во вторичную реакцию с медным анодом:
SO 4 + Cu = CuSO 4 .
Получившаяся молекула сульфата меди переходит в раствор. Это показывает прохождение электрического тока через водный раствор сульфата меди для растворения медного анода и оседания меди на катоде. Концентрация данного раствора не меняется.
Рисунок 1 . 15 . 1 . Электролиз водного раствора хлорида меди.
Закон электролиза
В 1833 году М. Фарадеем был установлен закон электролиза.
Закон Фарадея определяет количества первичных продуктов, которые выделяются во время электролиза на электродах. Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q , прошедшему через электролит:
m = k Q = k I t , где k является электрохимическим эквивалентом.
Масса вещества, выделившегося на электроде, равняется массе всех ионов, пришедших к электроду, и запишется n = m 0 N = m 0 Q q 0 = m 0 q 0 I t .
Значения m 0 и q 0 являются массой и зарядом одного иона соответственно, а N = Q q 0 - числом ионов, пришедших к электроду при прохождении через электролит с зарядом Q . Отсюда следует, что электрохимический эквивалент k равняется отношению массы m 0 иона данного вещества к его заряду q 0 .
Заряд иона является произведением валентности вещества n на элементарный заряд e ( q 0 = n e ) , тогда запись выражения для k примет вид
k = m 0 q 0 = m 0 N А n e N А = 1 F M n .
Значение N А является постоянной Авогадро, M = m 0 N А - молярной массой вещества, F = e N А - постоянной Фарадея.
F = e N А = 96485 К л / м о л ь .
Постоянная Фарадея численно равняется заряду, который следует пропустить через электролит, для выделения на электроде одного моля одновалентного вещества.
Запись закона Фарадея для электролиза имеет вид
Явление электролиза широко применимо в современном промышленном производстве.
Электролиты — растворы, содержащие большую концентрацию ионов, обеспечивающих прохождение электрического тока. Как правило, это водные растворы солей, кислот и щелочей.
Это интересно![Электролит щелочной]()
В организме человека и животных электролиты играют важную роль: к примеру, электролиты крови с ионами железа транспортируют кислород в ткани; электролиты с ионами калия и натрия регулируют водно-солевой баланс организма, работу кишечника и сердца.
Свойства
Чистая вода, безводные соли, кислоты, щелочи ток не проводят. В растворах же вещества распадаются на ионы и проводят ток. Именно поэтому электролиты называют проводниками второго порядка (в отличие от металлов). Электролитами могут быть также расплавы и некоторые кристаллы, в частности диоксид циркония и иодид серебра.
Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы.
По типу ионов, образующихся в растворе, различают электролит щелочной (электропроводимость обусловлена ионами металлов и ОН-), солевой и кислотный (с ионами Н+ и остатками основания кислоты).
Электролиты делят на сильные и слабые. Чем лучше реагент растворяется (распадается на ионы), тем сильнее электролит, тем лучше он проводит ток. К сильным электролитам относятся щелочи, сильные кислоты и растворимые соли.
Для электролитов, использующихся в аккумуляторах, очень важен такой параметр, как плотность. От нее зависят условия эксплуатации аккумулятора, его емкость и срок службы. Определяют плотность с помощью ареометров.
Меры предосторожности при работе с электролитами
Самые популярные электролиты, это раствор концентрированной серной кислоты и щелочи — чаще всего гидроксиды калия, натрия, лития. Все они вызывают химические ожоги кожи и слизистых, очень опасные ожоги глаз. Именно поэтому все работы с такими электролитами нужно производить в отдельном, хорошо вентилируемом помещении, используя средства защиты: одежду, маски, очки, резиновые перчатки.
• Рядом с помещением, где проводятся работы с электролитами, должна храниться аптечка с набором нейтрализующих средств и кран с водой.
• Кислотные ожоги нейтрализуются раствором соды (1 ч.л. на 1 ст. воды).
• Ожоги щелочью нейтрализуют раствором борной кислоты (1 ч.л. на 1 ст. воды).
• Для промывания глаз нейтрализующие растворы должны быть в два раза слабее.
• Поврежденные участки кожи сначала промывают нейтрализатором, а потом мылом и водой.
• Если электролит пролили, его собирают опилками, потом промывают нейтрализатором и вытирают насухо.

При работе с электролитом следует выполнять все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
Хранят электролиты в пластиковых емкостях. Для работы подходит стеклянная, керамическая, фарфоровая посуда и инструменты.
Читайте также:


