Что происходит в организме в результате нарушения процессов апоптоза кратко
Обновлено: 05.07.2024
Апоптоз (греч. — опадание листьев) — программируемая клеточная смерть, регулируемый процесс самоликвидации на клеточном уровне, в результате которого клетка фрагментируется на отдельные апоптотические тельца, ограниченные плазматической мембраной. Фрагменты погибшей клетки обычно очень быстро (в среднем за 90 минут) фагоцитируются макрофагами либо соседними клетками, минуя развитие воспалительной реакции. Морфологически регистрируемый процесс апоптоза продолжается 1—3 часа. Одной из основных функций апоптоза является уничтожение дефектных (повреждённых, мутантных, инфицированных) клеток.
С ослаблением или подавлением апоптоза связывают, как минимум, три группы патологий. К одной из них относят проявление системных аутоиммунных процессов. Вторую группу заболеваний, ассоциированных с ослаблением апоптоза, составляют злокачественные опухоли. К третьей группе патологий можно отнести вирусные инфекции, связанные с подавлением апоптоза.
Апоптоз- процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он играет большую роль в морфогенезе и является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример - опухолевый рост. При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример - атрофия
Апоптоз - функции, механизмы
Апоптозом называется запрограммированная клеточная гибель. Этот процесс играет важную роль в росте и развитии организма, т. к. по мере созревания тканей некоторые клетки должны погибнуть, чтобы уступить место более дифференцированным и специализированным.
Если клетка не умирает и становится бессмертной, может развиться злокачественная опухоль. Впервые апоптоз был описан в 1970-е годы, но только в последнее время исследователи осознали его важную роль для развития организма, дифференцировки тканей и малигнизации.
Интерес к апоптозу возрос, когда выяснилось, что этот процесс находится под контролем генов, вовлеченных в злокачественную трансформацию, т. е. онкогенов, протоонкогенов и генов-супрессоров. Очевидно, что многие из этих генов активны во время развития организма.
Полагают, что изучение апоптоза и путей его регуляции позволит понять механизмы развития организма и старения. Утрата клеточного контроля над программированной клеточной гибелью ведет к развитию опухолей.
Стадия инициации апоптоза
Апоптоз — особый вид клеточной гибели, ответственный за устранение клеток в нормальных тканях. Тем не менее этот процесс наблюдается и при патологических процессах. Гистологически проявляется уменьшением клетки, буллезным разрушением клеточной мембраны и конденсацией клеточного ядра.
В итоге образуются апоптотические тельца, содержащие неповрежденные органеллы; окружающие клетки фагоцитируют эти тельца. Апоптоз не сопровождается воспалением, что отличает его от некроза. Последний сопровождается набуханием клетки, разрушением всех ее структур и развитием воспалительного ответа.
Стадия программирования апоптоза
Апоптоз играет важную роль в нормальном росте организма, а также в развитии и прогрессировании злокачественных опухолей. Спонтанный апоптоз встречается в злокачественных клетках и даже замедляет их рост.
Интенсивность этого процесса возрастает при облучении опухоли, проведении гормоно- и химиотерапии, при нагревании опухоли. В злокачественных опухолях апоптоз представляет механизм уничтожения клеток, в которых произошли канцерогенные изменения ДНК.
Однако если он заблокирован или подавлен мутациями контролирующих его генов, например BCL2 или ТР53, то эти клетки получают возможность свободно делиться и неограниченно накапливать мутации. Такая генетическая нестабильность — ранний этап развития злокачественных опухолей.
Стадия реализации апоптоза
Многие из современных методов лечения, например лучевая и химиотерапия, направлены на уничтожение клеток за счет повреждения их ДНК. Мутации гена BCL2 или ТР53 ухудшают эффективность лечения, т. к. подавляют клеточную гибель.
Более глубокое понимание процессов запрограммированной клеточной гибели может привести к разработке новых, более эффективных методов лечения. Ингибиторы апоптоза (например, протоонкоген BCL2) могут быть ответственны за развитие резистентности к противоопухолевым препаратам, позволяя выживать клеткам с патологической ДНК.
Вероятно, в дальнейшем будут выявлены и другие механизмы подавления апоптоза. Не следует думать, что этот процесс отражает нечто иллюзорное в биологической литературе, а термин принят только для описания отличной от некроза клеточной гибели. Апоптоз — фундаментальный процесс, контролируемый на молекулярном уровне, и можно надеяться, что его удастся расшифровать и использовать для медицинских нужд. Возможные механизмы апоптоза представлены на рисунке.
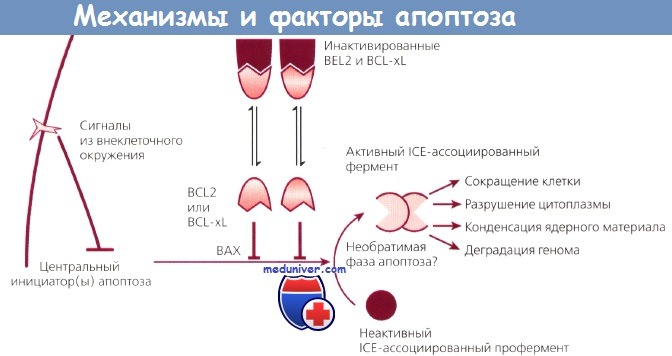
Возможные механизмы апоптоза и факторы, его контролирующие.
Внеклеточный сигнал запускает каскад событий, вовлекающий молекулы BCL2, BCL-xL и ВАХ.
Это ведет к наступлению программированной гибели клетки.
Этот механизм может быть заблокирован на любом из множества этапов, в результате чего клетка становится бессмертной.
ICE - интерлейкин-1b-превращающий фермент.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Благодаря этому процессу удаляются дефектные и нежелательные клетки организма, если апоптоз будет снижен, то велик риск развития и роста опухолей.
Некроз – это тоже форма клеточной гибели, но имеет существенные отличия от апоптоза:
- Некроз – процесс пассивный, может происходить даже при температуре +4°С, в то время как для апоптоза нужны затраты АТФ, и это активный процесс.
- Некроз происходит вследствие воздействия нефизиологических факторов (длительное отсутствие кислорода, механическое повреждение и т.д.), а апоптоз запускается физиологическими факторами.
- При некрозе разрушается мембрана клетки, и все содержимое клетки попадает в межклеточную жидкость, впоследствии провоцируя появление боли, покраснений, воспалений, опухолей и т.д. При некрозе соседние клетки тоже повреждаются, а при апоптозе погибающая клетка распадается на фрагменты, которые со всех сторон окружены плазматической мембраной. При апоптозе не бывает воспаления, получившиеся в результате распада фрагменты поглощаются фагоцитами или соседними клетками.
Примеры апоптоза:
- Шелушение кожи после продолжительного принятия солнечных ванн.
- Исчезновение перепонок между пальцами у человеческого плода, разрушение избыточного эпителия при слиянии небных отростков (при формировании твердого неба у плода).
- Исчезновение хвоста у головастиков.
- Самоуничтожение клеток, которые содержат чужеродный белок или мутации.
Внешнее влияние на процесс апоптоза
Внешние факторы действительно могут воздействовать на апоптоз, если они повреждают ДНК. Активируют апоптоз также повреждения клетки, нарушения регуляции клеточного роста, вирусные инфекции. Апоптоз, словно защитный щит, включается при потенциальной угрозе для организма, удаляя поврежденные клетки, которые могут причинить вред.
При этом независимо от причины апоптоза, его конечный путь регулируется только генами, внешние факторы и различные состояние организма могут только влиять на ускорение или замедление начальных стадий апоптоза.
Если в организме наблюдается усиленный апоптоз, то это может провоцировать раннее старение и развитие болезни Альцгеймера. Также доказано, что усиленный апоптоз наблюдается при нейротрофических заболеваниях, СПИДе, некоторых болезнях крови.
Если же апоптоз снижен (из-за избытка белка, ингибирующего апоптоз, или при недостатке гена, который следит за целостностью генома при митозе), то возрастает риск роста клеток злокачественных образований, эти клетки накапливаются, то есть растут и развиваются опухоли.

Выживание многоклеточных организмов требует состояния равновесия между пролиферацией и отмиранием клеток. Аномальная регуляция апоптоза (АП) подразумевается при возникновении и развитии практически всех заболеваний. Многие расстройства в процессе своего патогенеза можно классифицировать по признаку их взаимосвязи с избыточным или недостаточным АП клеток разного вида. В работе обсуждается значение нарушений АП в патогенезе ряда заболеваний.
Все аутоиммунные заболевания можно рассматривать в качестве принципиальных недостатков АП, так как отмирание аутореактивных лимфоцитов зависит от этого процесса. Исследования в области изучения функций молекул Fas и FasL позволяют сформировать новый взгляд на патогенез и лечение аутоиммунного сахарного диабета. В процессе его развития основным недостатком процесса регулирования АП является отсутствие аутотолерантности, что приводит к недостаточному апоптозному уничтожению аутореактивных Т-клеток. В присутствии опасных лимфоцитов, клетки поджелудочной железы разрушаются. Разрегулирование процесса выражения Fas и FasL, сопровождающее инфекции, может привести к тому, что клетки тканей будут индуцировать у своих соседей АП в форме локального аутоиммунитета. Патогенез тиреоидита Хашимото основан на системе Fas/FasL. Стимулирование тироцитов цитокинами при инфекции или иной форме воспаления приводит к выражению Fas вместе с FasL на тироцитах. Такая неблагоприятная ситуация может привести к уничтожению тироцитов друг другом, объясняя высокий уровень распространённости АП среди случаев тиреоидита Хашимото. При гепатитах стимулируемый Fas процесс отмирания гепатоцитов может быть блокирован специальным фармакологическим механизмом подавления каспаз.
Отсутствие аутотолерантности Т-лимфоцитов - в связи с недостаточным развитием либо анергии, либо стимулированного Fas АП - также может стать основой патогенеза лимфопролиферативных расстройств. Если аутореактивные лимфоциты возбуждаются и своевременно не удаляются или не становятся толерантными, то могут увеличить вероятность аутоиммунной реакции. Генные мутации Fas/FasL сопровождаются аутоиммунными расстройствами и повышенным уровнем лимфоцитов. Негативные и рецессивные мутации в гене Fas, которые препятствуют трансдукции апоптозного сигнала, обнаружены у пациентов с аутоиммунными лимфопролиферативными синдромами. У таких больных выявлены: скопление доброкачественных недоразвитых Т-лимфоцитов во вторичных лимфоидных органах (с увеличением до заметной аденопатии), поликлональная гипергаммаглобулинемия, выработка аутоантител, тромбоцитопения, нейтропения и гломерулонефрит.
АП имеет большое значение, как для патогенеза многих раковых болезней, так и резистентности их к противоопухолевым методам лечения. Мутации в гене p53 и его регуляторах являются широко распространёнными у онкологических больных. Подробное исследование АП открывает новую страницу в понимании и лечении рака. Отмирание апоптозной клетки играет роль во многих нейродегенеративных расстройствах, включая болезни Альцгеймера и Паркинсона, мышечную атрофию спинного мозга, боковой амиотрофический склероз. Проблема развития АП и уровней его молекулярных медиаторов при кардиологических болезнях человека становится всё более актуальной, так как уровень АП в больных сердцах высокий. Понимание молекулярных механизмов АП представляет собой основу предпосылок для развития современных методов лечения.

Каждый день в организме погибает большое количество клеток, а на смену им образуется равное количество новых: таково условие для поддержания клеточного гомеостаза. Удалить необходимо ненужные, старые и потенциально опасные. Одним из известных механизмов клеточной гибели является апоптоз, представляющий собой программируемый процесс.
Когда активируется апоптоз?
Физиологические ситуации:
- Разрушение клеток в процессе эмбриогенеза. Начальный этап развития организма сопровождается образованием избыточного клеточного материала, уничтожение которого происходит путем апоптоза в строго определённых местах и времени. Иначе говоря, гистогенез и органогенез тесно связаны с активацией апоптоза. Пример: удаление перепонок между зачатками пальцев.
- Инволюция гормонозависимых тканей после прекращения гормональной стимуляции. Пример: разрушение эндометрия во время менструального цикла, атрофия яичников в период менопаузы, постлактационное уменьшение молочной железы и атрофия простаты после кастрации.
- Ликвидация потенциально опасных лимфоцитов, которые могут реагировать на собственные ткани.
- Смерть клеток, которые уже послужили во благо организму. Например, гибель нейтрофилов при остром воспалительном ответе и лимфоцитов в конце иммунного ответа.
Патологические ситуации:
Внутриклеточный протеолитический каскад
Существует два класса каспаз: инициаторные (каспазы-2, -8, -9 и -10) и эффекторные (каспазы-3, -6 и -7). Первые отвечают за начало апоптоза, вторые же регулируют расщепление клеточных компонентов. Процесс развивается, как каскад, то есть состоит из нескольких ферментативных реакций. Субстратом на каждой стадии является белок, который в результате реакции превращается в активный фермент. Этот фермент в свою очередь использует другой белок в качестве субстрата, превращая его в активный фермент. И так повторяется несколько раз.
Каспазами разрушается множество белков, среди которых белки ядерной пластинки и белок-ингибитор активности эндонуклеазы. Расщепление последнего ведет к тому, что эндонуклеаза начинает разрезать ДНК. Разрушаются белки цитоскелета и клеточной адгезии, которые соединяют клетки друг с другом. Такой каспазный каскад необратим.

Рисунок 1 | Разрушение каспазой ингибитора эндонуклеазы и последствия. Апоптоз может протекать по двум различным путям — по внешнему и внутреннему (митохондриальному)
Внешний путь апоптоза
Этот путь запускается при связывании лиганда с рецептором смерти, находящимся на плазматической мембране различных клеток. Рецепторы смерти (death receptors — DR) бывают нескольких видов: TNF-R1, FAS (CD95), DR3, TRAIL-R1, TRAIL-R2 и др. Все они трансмембранные белки, содержащие внеклеточную часть — лиганд-связывающий домен — и внутриклеточную часть — домен смерти.
Иллюстрация такого пути — взаимодействие Fas рецептора на поверхности многих типов клеток с Fas-лигандом на цитотоксическом лимфоците. Домен смерти активированного рецептора объединяется с внутриклеточными белками FADD (Fas-associated death domain). Они в свою очередь объединяются с инициаторными каспазами, образуя сигнальный комплекс, вызывающий смерть (death-inducing signaling complex — DISC). Этот комплекс активирует инициаторные каспазы, которые затем включают в работу эффекторные каспазы, что дает начало апоптозу.
Существует ингибиторный белок, ограничивающий внешний путь. Этот белок называется FLIP. Он похож на инициаторную каспазу, но не обладает ее функцией. FLIP с каспазой-8 образует DISC, однако каспаза-8 не становится активной и апоптотический сигнал блокируется. Этот тормозный механизм помогает предотвратить нежелательную активацию внешнего пути.

Рисунок 2 | Внешний путь апоптоза
Внутренний путь апоптоза зависит от митохондрий
Этот путь может быть запущен в ответ на повреждение ДНК, активацию онкогенов, избыток Ca 2+ в клетке, отсутствие факторов роста (пептидный или стероидный гормон, стимулирующий рост и дифференцировку клетки), неправильно сложенные белки.
Активация пути ведет к повышению проницаемости наружной мембраны митохондрий. Из-за этого в цитоплазму выходят цитохром c и другие митохондриальные белки, которые инициируют апоптоз.
В норме они находятся в межмембранном пространстве этих органелл. Ключевой белок во внутреннем пути — цитохром с (компонент электрон-транспортной цепи). Выйдя в цитоплазму, он приобретает новые функции и присоединяется к фактору апоптотической протеазы 1 (apoptotic protease activating factor-1 — Apaf1).
Так образуется колесоподобная структура — апоптосома. Апоптосома активирует инициаторные каспазы-9, в свою очередь активирующие эффекторные каспазы, что дает начало апоптозу.

Рисунок 3 | Внутренний путь апоптоза
Апоптоз-регулируемый процесс
За внутренний путь апоптоза отвечают белки семейства Bcl2. Они контролируют выход проапоптотических белков из митохондрий (например, цитохром c). Название дано в честь гена белка Bcl2, который сверхэкспрессирован в некоторых лимфомах В-клеток (B cell lymphoma). В это семейство входят более 20 белков, которые могут быть разделены в три группы на основании их функций и количестве гомологичных доменов (Bcl2 Homology).
Первая группа — проапоптотические белки, которые увеличивают выход митохондриальных белков и запуск апоптоза.
Вторая группа — антиапоптотические белки, которые подавляют апоптоз, блокируя выход митохондриальных белков. Оба вида могут связываться друг с другом в различных комбинациях, подавляя свои функции. Баланс между активностью двух видов белков определяет, выживет ли клетка или погибнет по внутреннему пути апоптоза.
Антиапоптотическая группа представлена белками Bcl2 и BclXL, которые имеют четыре BH домена (BH1-4). Эти белки находятся на наружной мембране митохондрий и сохраняют ее непроницаемость. Таким образом это предотвращает утечку цитохрома c и других белков.
Проапоптотические белки — Bax и Bak. У них есть три BH домена (BH1-3). После своей активации Bax и Bak повышают проницаемость внешней мембраны митохондрий. Возможно, это происходит путем образования канала, что позволяет белкам выходить из межмембранного пространства в цитоплазму. Bak даже в отсуствие апоптотического сигнала связан с наружной мембраной митохондрий, а Bах локализован в цитозоле и транспортируется к митохондрии только после апоптотического сигнала.
Третья группа содержит (тоже проапототические) белки Bad, Bim, Bid, Puma и Noxa. Они имеют один BH домен (BH3), третий из четырех доменов BH, поэтому и получили название BH3 only proteins. Белки BH3-only играют ключевую роль в регулировании и стимулировании апоптоза и, таким образом, служат привлекательной целью терапевтического вмешательства. Следует отметить, что BH3 домен является единственным общим доменом для всех членов семейства Bcl2. Он опосредует взаимодействия между проапоптотическими и антиапоптотические белками.
Как происходит регуляция?
Факторы роста и другие сигналы выживания стимулируют выработку антиапоптотических белков. Они ингибируют апоптоз путем связывания проапоптотических белков на митохондриальной мембране. BH3-only белки, напротив, нейтрализуют активность антиапоптотических белков, таким образом способствуя собиранию проапоптотических белков Вах и Вак на поверхности митохондрии. Это приводит к выходу митохондриальных белков наружу.
Белок ВН3-only Bid связует оба пути апоптоза. В норме он неактивен. Но при активации внешнего пути каспаза-8 переводит белок Bid в активную форму. Bid перемещается к наружной мембране митохондрии и ингибирует антиапоптотические белки, тем самым увеличивая сигнал смерти.

Рисунок 4 | Схема регуляции внутреннего пути апоптоза
Другие способы регуляции
Клетка использует надежные механизмы от ненужной активации каспаз. Например, защитником служит семейство белков-ингибиторов апоптоза (inhibitors of apoptosis — IAPs). У человека они представлены следующими видами: cIAP1 (BIRC2), cIAP2 (BIRC3), X-связанный IAP (XIAP) и др.
Одни из этих белков связывают и ингибируют активированные каспазы. Другие - помечают каспазы для разрушения протеосомами. Функция ингибиторов заключается в установлении порога, который каспазы должны преодолеть для активации апоптоза. Активность IAP может быть подавлена белками из межмембранного пространства митохондрий, такими как Omi/HtrA2 и Smac/DIABLO, высвобождающимися во время апоптоза.
И еще о факторах выживания
Межклеточные сигналы регулируют деятельность клеток, в том числе и апоптоз. Необходим контроль, гарантирующий, что отдельные клетки ведут себя во благо всего организма, в противном случае их нужно удалить. Например, сигнальные белки, такие как Fas-лиганд, активируют рецепторы смерти и тем самым инициируют внешний путь апоптоза. Напротив, существуют факторы выживания — внеклеточные сигнальные молекулы, которые ингибируют апоптоз. Некоторые клетки требуют непрерывной сигнализации от других клеток, чтобы выживать. И это, по-видимому, помогает обеспечить жизнь только нужных клеток.

Рисунок 5 | (А) — Некоторые факторы выживания подавляют апоптоз, стимулируя выработку антиапоптотических белков, таких как Bcl2 или BclXL. (В) — Другие факторы активируют серин/треонин-протеинкиназу Akt (протеинкиназа B), которая путем фосфорилирования аминокислот серина и треонина приводит к инактивации проапоптотического белка Bad (он способствует апоптозу, так как он связывает и ингибирует Bcl2). После фосфорилирования Bad высвобождает Bcl2, который подавляет апоптоз. Активация этой протеинкиназы связана со многими злокачественными новообразованиями
Гибель нервной ткани
Нервные клетки вырабатываются избыточно в развивающейся нервной системе, а затем конкурируют за ограниченное количество факторов выживания. Эти факторы секретируются клетками-мишенями, к которым подходят нейроны. Нервные клетки, получающие достаточно сигналов выживания, живут, в то время как другие, не получающие нужного количества, умирают. Таким образом, число выживших нейронов соответствует количеству клеток-мишеней, с которыми они соединяются.
Жизнь и смерть у нервных клеток.

Рисунок 6 | Роль факторов выживания в гибели лишних нервных клеток
Каскады жизни и смерти
Каскад жизни
Факторы выживания для нейронов называются нейротрофическими факторами. Активация рецепторов нейротрофических факторов на пресинаптической мембране аксона приводит к увеличению факторов транскрипции, которые отвечают за образование антиапоптотических белков (Bcl-2, Bcl-xL), супероксиддисмутазы (подавляет повреждение клетки в результате окисления) и белков-ингибиторов апоптоза (IAP).
Каскад смерти
Апоптоз наблюдается в ходе процесса, который называется эксайтотоксичность. Этот процесс происходит при чрезмерной активации глутаматных рецепторов, в результате чего повышается приток Ca 2+ в постсинаптические области дендритов. Са 2+ , попадая в цитоплазму через ионные каналы на плазматической мембране и на эндоплазматическом ретикулуме, индуцирует апоптотический каскад, который активирует проапоптотическое белки Bax, Bad и p53. Эти белки действуют на митохондрии так, что повышается ее проницаемость, а в цитоплазму выделяется цитохром С. Это приводит к апоптозу.

Рисунок 7 | Каскады жизни и смерти
Как убрать апоптотическую клетку?
Апоптоз — очень аккуратный процесс клеточной смерти. Апоптотическая клетка и ее фрагменты не разрываются и не выделяют свое содержимое, а вместо этого остаются нетронутыми. Они съедаются без следов, поэтому воспалительного ответа нет. Апоптотическую клетку поглощают фагоциты. Процесс поглощения зависит от наличия химических изменений на поверхности мембраны клетки.
К таким изменениям относится наличие фосфатидилсерина, который служит сигналом для фагоцитарных клеток. Этот фосфолипид обычно расположен только на внутренней поверхности плазматической мембраны, а при апоптозе переворачивается на наружную поверхность. Макрофаги не фагоцитируют здоровые клетки, хотя у здоровых клеток на их поверхности есть некоторый фосфатидилсерин.

Рисунок 8 | Фагоциты удаляют апоптотическую клетку или ее части
Уклонение от апоптоза
Нарушение механизма клеточной смерти ключевой признак онкологического заболевания. Опухолевые клетки могут использовать различные механизмы для подавления апоптоза и приобретения устойчивости к апоптотическим агентам. Например, может наблюдается повышенная экспрессия антиапоптотических белков (Bcl-2) или мутации в генах проапоптотических белков (Вах).
Дефекты апоптоза могут позволить эпителиальным клеткам выживать во взвешенном состоянии без прикрепления к внеклеточному матриксу, что способствует метастазированию. Они также способствуют устойчивости перед цитолитическими Т-клетками и натуральными киллерами (NK), атакующими опухоли. Эти дефекты играют важную роль в устойчивости к лечению химиотерапией и лучевой терапией, увеличивая порог смерти клеток и требуя более высоких доз агентов, убивающих опухоль.
Успешное удаление раковых клеток с помощью нехирургических средств в конечном итоге достигается путем индукции апоптоза. Все цитотоксические противораковые средства, которые в настоящее время используются в клинических целях, вызывают апоптотическую гибель злокачественных клеток.

Рисунок 9 | Схематическое представление различных способов, из-за которых апоптотические пути могут быть нарушены
Терапия онкологических заболеваний и апоптоз
Ингибирование апоптоза лежит в основе развития всех опухолей. А значит, наиболее очевидной стратегией лечения является нацеленность на причины, которые подавляют гибель клеток. Для преодоления антиапоптотического эффекта белков Bcl-2 и Bcl-xL в опухолевых заболеваниях существует три стратегии:
- прекращение транскрипции их генов,
- разрушение мРНК с помощью антисмысловых олигонуклеотидов,
- атака мелкомолекулярными препаратами.
Стратегия первая
Следовательно, антиэстрогены, такие как тамоксифен, ингибируют экспрессию Bcl-2 в клеточных линиях рака молочной железы, способствуя развитию чувствительности к цитотоксическим противоопухолевым препаратам, таким как доксорубицин.
Стратегия вторая
Антисмысловые олигонуклеотиды — цель на мРНК. Антисмысловые олигонуклеотиды (Antisense oligonucleotides) представляют собой короткие последовательности одноцепочечной ДНК, которые могут связываться с мРНК, что сопровождается ее разрушением.
Один из перспективных препаратов - облимерсен натрия. Он представляет собой натриевую соль фосфоротиоатного антисмыслового олигонуклеотида. Препарат ингибирует мРНК гена Bcl-2. Он был успешно протестирован в сочетании с другими противораковыми агентами при различных типах рака, таких как множественная миелома, мелкоклеточный рак легких, меланома и неходжкинская лимфома.
Модификация искусственных нуклеотидов делает нуклеотидную цепь устойчивой к расщеплению нуклеазами и повышают период полувыведения в организме. В данном случае использовалось добавление фосфоротиоата (PS) в основную цепь (замена одного из кислородных остатков фосфатной цепи на серу)
Стратегия третья
BH3 миметики — это вещества, связывающиеся с рецепторами белков, на которые действуют сами BH3. Они необходимы для активации апоптоза. Эти белки нейтрализуют антиапоптотическое белки Bcl2 или активируют Bak и Bax. Разработаны BH3-имитирующие молекулы, выполняющие те же функции, что и BH3 белки.
Например, вещество ABT-737, которое ингибирует Bcl2-белки. BH3-белки, взаимодействуют с длинной гидрофобной канавкой в белке Bcl2, тем самым инактивируя последние. Препарат ABT-737 был спроектирован с помощью кристаллической структуры этой канавки.
Р53 в качестве лекарственной цели
Ген белка р53 отключен из-за мутаций примерно у 50% всех злокачественных опухолей. Повышение производства белка р53 в клетке может быть методом противораковой терапии. В нормальных клетках белок p53 обычно поддерживается на низком уровне, поскольку он подвержен ингибированию белком MDM2. В ответ на повреждения ДНК p53 видоизменяется.
Это позволяет ему избежать контроля MDM2 и начать накапливаться в клетке. Содержание гена MDM2 увеличено в некоторых типах опухолей, поэтому активного белка р53 становится меньше. Взаимодействие между p53 и MDM2 является мишенью в противораковой терапии. С этой целью были разработаны препараты, которые блокируют белок-белковые взаимодействия. Среди них Nutlin-3, ингибирующий взаимодействие p53/MDM2.
Большая часть того, что известно об апоптозе, стала понятна только недавно. Основная идея разработки терапевтических препаратов для лечения рака основана на том факте, что поврежденные клетки обычно встают на путь апоптоза, поддерживая нормальное для ткани количество клеток. Однако это явление сильно нарушается в раковых клетках. Обнаружение ключевых участников апоптоза и их взаимодействие с другими значимыми участниками создает условия для поиска новых методов терапии рака.
Читайте также:

