Что такое свойство в химии 8 класс определение кратко
Обновлено: 02.07.2024
Химия – это наука, которая сопутствует нам, где бы мы не находились: дома, в офисе, на природе или в городе. Трудно переоценить ее вклад в нашу жизнь, необходимость понимания и знания основных понятий и законов химии.
Итак, какие же основные понятия и законы включает химия? Сначала дадим определение науке: Химия — наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении.
Основные понятия химии
Основными в химии являются такие понятия, как атом, молекула, элемент, вещество, аллотропия и др.
У истока основных понятий химии стоит атомно-молекулярное учение, которое дает определение молекулы и атома:
Молекула
Это наименьшая частица определенного вещества, которая обладает его химическими свойствами. Состав и химическое строение молекулы определяют ее химические свойства. Все вещества состоят из молекул, а молекулы из атомов.
Атом
Это наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ, это электронейтральная частица, которая состоит из положительно заряженного ядра атома и отрицательно заряженных электронов, вращающихся вокруг ядра.
Молекулы и атомы находятся в постоянном движении.
Химический элемент
В настоящее время известно 118 элементов, 89 из которых найдены в природе, остальные получены искусственно (см. Интересные факты о химических элементах). Что же такое Химический элемент? Это такой вид атомов, который имеет определенный заряд ядра и строение электронных оболочек.
Теперь рассмотрим строение атомного ядра и следующее основное понятие химии.
Атомное ядро
Атомное ядро состоит из протонов (Z) и нейтронов (N), имеет положительный заряд, равный по величине количеству протонов (или электронов в нейтральном атоме) и совпадает с порядковым номером элемента в периодической таблице. Суммарная масса протонов и нейтронов атомного ядра называется массовым числом A = Z + N. Существуют химические элементы (изотопы), имеющие одинаковый заряд ядер, но при этом различные массовые числами, что достигается за счет разного числа нейтронов в ядре.
Вещество
Некая совокупность атомов и молекул, их ассоциатов и агрегатов, которые могут находиться в любом из трех агрегатных состояний, образуют вещество.
Простые вещества состоят из атомов одного вида, а сложные вещества (химические соединения) состоят из атомов разного вида и образуются при химическом взаимодействии атомов разных химических элементов.
Аллотропия
Встречается явление, при котором один химический элемент может образовывать нескольких простых веществ, различных по свойствам и строению. Это явление называется Аллотропией. Аллотропные модификации характерны, например, для кислорода (O2 и O3), фосфора (белый, красный, черный фосфор), углерода (алмаз, графит), серы (моноклинная, ромбическая, пластическая), олова (белое, серое, ромбическое олово).
Химическая формула
В 1814 г Й. Берцелиус предложил использовать химическую формулу — запись состава веществ с помощью химических знаков и индексов.
Химическое вещество характеризуется атомной массой, а молекулы — молекулярной массой.
Относительная атомная масса (Ar)
Это отношение средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1 /12 массы атома 12 C.
Относительная молекулярная масса (Mr)
Это величина, показывающая, во сколько раз масса молекулы данного вещества больше 1 /12 массы атома углерода 12 C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, составляющих химическое соединение, с учетом индексов.
Моль вещества (n)
Это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12 C.
Число структурных единиц, содержащихся в 1 моле вещества равно 6,02 • 10 23 .Эточисло называется числом Авогадро (NA)
Молярная масса (M) показывает массу 1 моля вещества и равна отношению массы вещества к соответствующему количеству вещества.
Химический эквивалент
Для более удобного сравнения способности различных элементов к соединению введено понятие химического эквивалента. Это одно из важнейших понятий химии, дадим ему определение:
Химическим эквивалентом вещества (Э) называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Масса 1 эквивалента вещества называется эквивалентной массой (mэкв). Масса одного моля эквивалента элемента — это молярная масса эквивалента MЭ(X).
Молярную массу эквивалента химического элемента, простых и сложных веществ (Mэкв(X)) рассчитывают по формуле:
где M(X) – молярная масса; вал – суммарная валентность.
Например, молярная масса эквивалента алюминия составляет Mэкв(Са) = 40/2 = 20 г/моль.
Молярные массы эквивалента кислорода и водорода постоянны и составляют:
Эквивалентную массу соединения можно определить по его химической формуле, например,
М экв(оксида) = М(оксида)/(число атомов кислорода ∙ 2);
М экв(основания) = М(основания)/число гидроксильных групп;
М экв(кислоты) = М(кислоты)/число протонов;
М экв(соли) = М(соли)/(число атомов металла ∙ валентность металла).
Пример, определим эквивалент (Э) и эквивалентную массу Мэкв (Х) фосфора, серы и брома в соединениях PHз, Н2S и HBr.
В PHз 1 моль атомов водорода соединяется с 1/3 моль фосфора, поэтому эквивалент фосфора равен Э(N) = 1/3 моль
В Н2S 1 моль атомов водорода соединяется с 1/2 моль серы, поэтому эквивалент серы равен Э(S) = 1/2 моль
В HBr 1 моль атомов водорода соединяется с 1 моль брома, поэтому эквивалент брома равен Э(Br) = 1 моль.
Найдем эквивалентные массы:
Мэкв (Р) = 31/3 = 10,33 г/моль;
Мэкв (S) = 32/2 = 16 г/моль;
Мэкв (Br) = 80/1 = 80 г/моль.
Аналогично можно дать определение понятию эквивалентный объем.
Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества. Так как эквивалент водорода равен 1 моль, а в 22,4 л Н2 содержатся 2 эквивалента водорода; тогда эквивалентный объем водорода равен 22,4/2=11,2 л/моль, для О2 эквивалентный объем равен 5,6 л/моль.
Определить эквивалент вещества можно также по его соединению с другим веществом, эквивалент которого известен.
Определить молярную массу эквивалента (эквивалентную массу) можно исходя из закона эквивалентов, который рассмотрен немного ниже.
Основные законы химии
Нижеперечисленные законы принято считать основными законами химии.
Закон эквивалентов
По закону эквивалентов химические элементы соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов:
где m1 и m2 — массы реагирующих или образующихся веществ, М экв1 и М экв2 — эквивалентные массы этих веществ.
Примеры расчета молярной массы эквивалента представлен в задачах 5-7 раздела Задачи к разделу Основные понятия и законы химии
Закон сохранения вещества
В 1756 г. М.В. Ломоносов, после длительных испытаний, пришел к важному открытию: вес всех веществ, вступающих в химическую реакцию, равен весу всех продуктов реакции.
Этот закон отражается в законе сохранения массы, который заключается в следующем: масса веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Вещества не исчезают и не возникают из ничего, а происходит химическое превращение. Закон является основой при составлении химических реакций и количественных расчетов в химии.
Закон постоянства состава
В 1808 Ж. Пруст сформулировал закон, который гласит, что независимо от способа получения все индивидуальные вещества имеют постоянный количественный и качественный состав.
Закон кратных отношений
В 1803 г Д. Дальтон открыл закон, заключающийся в том, что если два химических элемента образуют несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
Закон объемных отношений
В 1808 г Гей-Люссак сформулировал закон, который гласил:
Газовые законы
Важную роль в развитии химической науки сыграли газовые законы (справедливы только для газов).
В 1811 г. Авогадро ди Кваренья (Закон Авогадро) доказал, что- в равных объемах любых газов при постоянных условиях (температуре и давлении) содержится одинаковое число молекул. В одинаковых условиях одно и то же число молекул занимают равные объемы, а 1 моль любого при T=273°К и p=101,3 кПа газа занимает объем 22,4 л, который называется молярным объемом газа (Vm).
Независимо друг от друг трое ученых вывели следующие законы:
закон Бойля-Мариотта при Т= const: P1V1 = P2V2;
закон Шарля при V = const:P1 / T1 = P2 / T2
При объединении этих трех законов получаем:
Если условия отличаются от нормальных, то применяют уравнение Клапейрона – Менделеева:
pV = nRT = (m/M)RT, где
p — давление газа, V — его объем, n — количество молей газа, R — универсальная газовая постоянная (8,314 Дж/(моль*К).
Количество газа при нормальных условиях рассчитывают по формуле:
Плотность газов при заданных давлении и температуре прямо пропорциональна их молярной массе:
ρ = m/V = pM/(RT) = (p/RT)M.
Относительная плотность газов показывает, во сколько раз один газ тяжелее другого. Плотность газа В по газу А определяется следующим образом:
Это основные законы химии. В заключение приведем Закон парциальных давлений (закон Дальтона). Парциальное давление в смеси равно тому давлению газа, которым он обладал бы, если бы занимал такой же объем, какой занимает вся смесь при той же температуре. При условии, что в газовой смеси нет химического взаимодействия, общее давление газовой смеси равно сумме парциальных давлений газов, входящих в эту смесь:
Состав газовых смесей может выражаться количеством вещества (n), массовыми (ωn), объемными (φn) и молярными (χ) долями:
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12 С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12 С.
- Постоянная Авогадро (Na = 6*10 23 моль -1 ) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12 С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12 С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
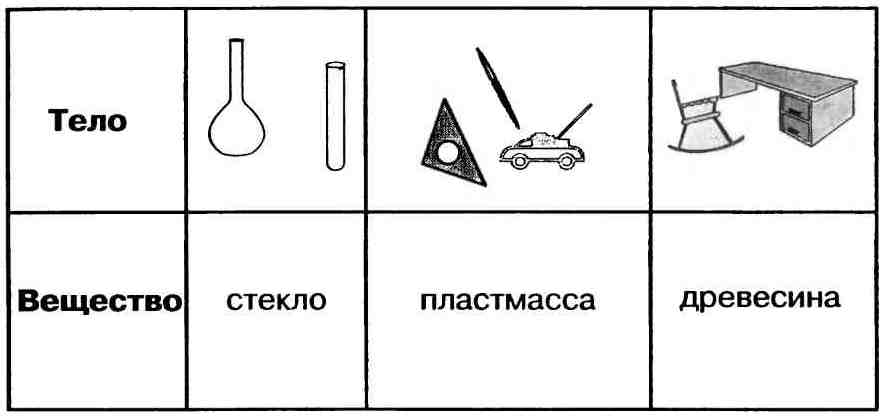
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
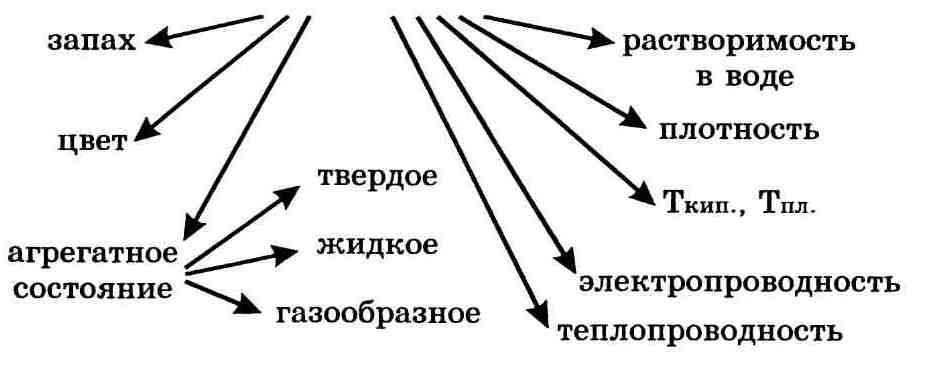
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Иначе химические явления называют химическими реакциями .
Каждое вещество обладает строго определёнными свойствами.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.
Физические свойства :
m - масса, V - объём, ρ - плотность.
Масса может быть выражена в граммах, объем в миллилитрах (если это жидкость) или литрах (если это газ).
1 мл = 1 см3, 1 л = 1 дм3, 1000 л = 1 м3
Поэтому плотность измеряют в г/мл, г/см3 (если это жидкость), или в г/л, г/дм3 (если это газ).
Если принять V = 1, то плотность - это масса единичного объёма вещества.
Так же можно сказать, что химические свойства - это те химические реакции, которые характеризуют группу веществ (класс веществ). Например, мы будем в дальнейшем изучать свойства воды, свойства класса оксидов, свойства класса алканов и т.д.
ООсновы атомно – молекулярного учения
Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Существование атомов было доказано эмпирическим путём в конце 16 – начале 17 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения .
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились. Его суть можно свести к ряду важных положений, которые необходимо запомнить.
Все вещества, существующие в природе, представляют собой совокупность очень большого числа частиц (атомов, молекул или ионов). В зависимости от типа частиц все вещества условно подразделяют на две группы: вещества молекулярного строения и вещества немолекулярного строения (атомного или ионного).
Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии.
В твёрдом агрегатном состоянии вещества, составляющие его частицы находятся относительно упорядоченно (кристаллическое состояние), их кинетическая энергия (энергия движения) существенно меньше чем потенциальная (энергия покоя). В газообразном состоянии, частицы свободно движутся в предоставленном им объёме и их кинетическая энергия существенно выше чем потенциальная.
В жидкости же потенциальная энергия частиц примерно равна их кинетической энергии. Это связано с тем, что часть частиц жидкости находится относительно упорядоченно в составе так называемых кластеров (англ. cluster — скопление). Другие же частицы свободно перемещаются по объёму жидкости. Чем ниже температура жидкости, тем больше в ней кластеров и наоборот.
Следует отметить, что существуют еще два дополнительные "состояния". Это жидкокристаллическое состояние и состояние плазмы .
Цитоплазматическая мембрана клетки - типичный пример жидкого кристалла. Молекулы фосфолипидов в биологической мембране относительно упорядоченно распределяются в двух слоях, но при этом могут в пределах слоя свободно перемещаться, а также "перескакивать" из одного слоя в другой.
Жидкие кристаллы имеют широкое применение в технике (напр., ЖК-мониторы компьютеров).
Плазма в своём составе содержит свободные электроны, катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы).
Так как плазма содержит заряженные частицы, то она проводит электрический ток и на неё можно воздействовать внешним магнитным полем. Различают низкотемпературную и высокотемпературную плазму.
Изучает свойства плазмы наука физика.
Вещество из одного агрегатного состояния может переходить в другие агрегатные состояния при изменении внешних условий - температуры (T) и давления (P). Такие переходы принято называть фазовыми переходами .
Так, при повышении температуры, твердое вещество превращается в жидкость, а жидкость при ещё большей температуре превращается в газ. Дальнейшее повышение температуры переводит газ в плазму. При таких переходах вещество в другие вещества не превращается. Напомним, что такие явления мы называем физическими. Поэтому фазовые переходы - это физические явления.
При понижении температуры происходят обратные фазовые переходы - газ превращается в жидкость, а жидкость переходит в твердое состояние.
Фазовые переходы имеют названия.
Твердое ---> Жидкое (плавление, обратный переход - кристаллизация)
Жидкое ---> Газообразное (испарение, обратный переход - конденсация)
Газообразное ---> Плазма (ионизация, обратный переход - деионизация)
Твердое ---> Газообразное (сублимация или возгонка, обратный переход - десублимация)
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии в зависимости от условий (температуры и давления).
Поэтому, например, такая фраза как: "Вода - жидкое вещество", является некорректной. Если мы говорим об агрегатном состоянии вещества, то следует обязательно уточнить условия в которых находится вещество - температуру и давление. Такая фраза как: "При нормальном атмосферном давлении и комнатной температуре, вода - жидкое по агрегатному состоянию вещество", является правильной.
С точки зрения физики, что более точно, вещество - это форма материи, состоящая из частиц, обладающих массой покоя. Существуют частицы, не обладающие массой покоя, например, фотоны. Материя, состоящая из частиц, не обладающих массой покоя называется поле .
Протоны, нейтроны, электроны - это частицы, обладающие массой покоя, следовательно это частицы вещества. Но химия не изучает вещество, состоящее, к примеру, из электронов (электронный газ), или вещество, состоящее из нейтронов (нейтронный газ). Это удел физики.
Химия изучает вещества, состоящие из атомов, молекул или ионов.
Ввиду этого вещество условно можно подразделить на физическое (электронный газ в проводнике, нейтронный газ и т.д.) и химическое (состоящее из атомов, молекул, ионов, свободных радикалов).
Читайте также:

