Что представляют собой белки ферменты приведите примеры таких белков кратко
Обновлено: 02.07.2024
Вопрос 1. Чем объясняется многообразие функций белков?
Уникальные свойства белков заложены в колоссальном разнообразии пространственного строения их молекул. Это разнообразие белков определяется огромным числом возможных сочетаний аминокислотных остатков в длинных, состоящих, как правило, из нескольких сотен остатков, полипептидных цепях белков. Как известно, в состав белков может входить 20 видов аминокислот. Белки образуют различные соединения с различными веществами. Кроме того, белки могут иметь пространственную структуру молекулы. Установлено, что белки могут иметь различные размеры и форму. Многие белки содержат в своём составе такие металлы, как железо, цинк, медь и др. Все это способствует тому, что белки выполняют множество функций.
Вопрос 3. Какую роль играют белки-гормоны?
Белки-гормоны контролирует физиологическую активность тканей и органов и всех жизненных процессов всего организма. Так, в организме человека соматотропин участвует в регуляции роста тела, инсулин поддерживает на постоянном уровне содержание глюкозы в крови.
Вопрос 4. Какую функцию выполняют белки-ферменты?
Белки-ферменты играют роль катализаторов, т. е. ускоряют химические реакции в сотни миллионов раз. Ферменты обладают строгой специфичностью по отношению к веществу, вступающему в реакцию. Каждая реакция катализируется своим ферментом.
Вопрос 5. Почему белки редко используются в качестве источника энергии?
Мономеры белков - аминокислоты — ценное сырье для построения новых белковых молекул. Поэтому полное расщепление полипептидов до неорганических веществ происходит редко. Следовательно, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками только в исключительных случаях, когда организм испытывает недостаток жиров или углеводов.
Катализаторы — это вещества, изменяющие скорость химической реакции или вызывающие её, но не входящие в состав продуктов реакции.
Вопрос 2. Что такое иммунитет?
Иммунитет — это способ защиты организма от действия различных веществ и организмов, вызывающих деструкцию его клеток и тканей, характеризующийся изменением функциональной активности преимущественно иммуноцитов с целью поддержания гомеостаза внутренней среды.
Вопрос 3. Какие белки вам известны? Каковы их функции?
Кератин, коллаген, эластин — строительная, структурная функция;
Гемоглобин — транспортная ф.;
Актин и миозин — сократительная, двигательная ф.;
Гормоны (инсулин, соматотропин и др.) — регуляторная ф.;
Иммуноглобулины, тромбин, фибриноген и др. — защитная ф.;
Пепсин, каталаза, трипсин — каталитическая ф.
Вопрос 4. Какие функции белков вам известны?
Белки выполняют самые разнообразные функции в клетках: определяют их структуру и форму, изменяют скорость протекания химических реакций, обеспечивают передачу химических сигналов, осуществляют разные виды клеточного движения, а также перенос веществ через мембраны и т. п.
Вопрос 5. Чем объясняется многообразие функций белков?
Многообразие функций белков объясняется разнообразием форм и состава самих белков.
Вопрос 6. Что представляют собой белки — ферменты? Приведите примеры таких белков.
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию.
Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры. Обычно эти молекулы имеют третичную (глобула) или четвертичную (несколько соединенных глобул) белковую структуру. Сначала они синтезируются в линейном виде. А потом сворачиваются в требуемую структуру. Для обеспечения активности биокатализатору необходимо определенное строение. Ферменты, как и другие белки, разрушаются при нагреве, экстремальных значениях pH, агрессивных химических соединений.
Основные свойства ферментов:
специфичность: способность фермента действовать только на специфический субстрат, например, липазы — на жиры;
каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Примеры белков — ферментов: пепсин, каталаза, трипсин, амилаза, протеазы, липазы, глутаматдегидрогеназа, аланинаминотрансфераза (АЛТ), лейцинаминопептидаза (ЛАП), фруктозо — 1,6 — дисфосфат — альдолаза (ФДФ — А) и др.
Вопрос 7. Как реализуется белками защитная функция?
Защитная функция белков в организме заключается в предотвращении проникновения чужеродных веществ, которые могут нанести существенный вред организму. Если же это произошло, специализированные белки способны их обезвредить. Эти защитники называются антителами или иммуноглобулинами. Связывание их с белками возбудителей подавляет функциональную активность последних и останавливает развитие инфекции. Антитела обладают уникальным свойством: они способны отличать чужеродные белки от собственных белков организма.
Кроме того, в ответ на заражение вирусом клетка вырабатывает специальные белки — интерфероны, которые препятствуют размножению носителя инфекции.
Многие организмы используют для защиты или нападения специфические пептиды и белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. Часто эти вещества обладают ферментативной активностью (холерный токсин, коклюшный токсин) или же они могут нарушать структуру клеточных мембран (белки ядов змей и насекомых).
Вопрос 8. Что вам известно о гормонах? Есть ли среди них вещества белковой природы? Приведите примеры.
Гормоны — мельчайшие элементы, вырабатываемые нашим организмом. Это органические биологически активные вещества, которые вырабатываются собственными железами внутренней секреции организма. Поступая в кровь, связываясь с рецепторами определенных клеток, они регулируют физиологические процессы, обмен веществ.
Белкам — гормонам присуща регуляторная функция. Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах. Например, инсулин регулирует содержание сахара в крови.
Примеры гормонов белковой природы (белки и полипептиды) — гормоны гипоталамуса, гормоны гипофиза (соматотропин, кортикотропин, пролактин, вазопрессин и окситоцин, гонадотропный гормон, полипептидные низкомолекулярные гормоны, адренокортикотропный гормон, кортикотропин (АКТГ)); щитовидной железы (тироксин, кальцитонин); гормон паращитовидных желез; гормоны поджелудочной железы (глюкагон и инсулин); гормон почек (эритропоэтин) и др.
Виды белков их функции в организме.
Структурные белки. Влияют на структуру самой клетки, ее форму. Всеми своими свойствами, качествами и даже функциями каждый вид тканей обязан именно структурным белкам. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
Транспортные белки. Транспортные белки обеспечивают транспортировку питательных и других полезных веществ по всему организму. Например, клеточные мембраны пропускают внутрь клетки не все подряд. И даже некоторые полезные вещества туда не могут проникнуть. Транспортные белки имеют способность проникать сквозь мембраны клеток и проносить с собой эти самые вещества. Гемоглобин — переносчик кислорода и других веществ.
Рецепторные белки. Рецепторные белки наряду с транспортными белками обеспечивают проникновение полезных веществ внутрь клеток. Располагаются рецепторные белки на поверхности мембран, то есть снаружи клеток. Они связываются с поступающими к ним питательными веществами и помогают им проникать внутрь. Важность этого вида белка переоценить невозможно, так как без них внутриутробное развитие может происходить совершенно неправильно или даже полностью прекратиться.
Сократительные белки. Человек двигается благодаря сокращению мышечных тканей. Эту способность им обеспечивают сократительные белки. Как отдельные клетки, так и организм в целом приходит в движение при помощи этого вида белков. Например, миозин, актин и др.
Регуляторные белки. Организм человека ведет свою жизнедеятельность благодаря множеству различных биохимических процессов внутри него. Все эти процессы обеспечивают и регулируют регуляторные белки. Одним из них является инсулин, также половые гормоны.
Защитные белки. Находясь в окружающей среде, организм постоянно контактирует с самыми разными веществами, микроорганизмами и так далее, попадает в самые разные условия. Сохранность здоровья в таких случаях обеспечивают иммунные клетки, которые и являются защитными белками. Также к последним относят прокоагулянты, которые обеспечивают нормальную свертываемость крови. Гаммаглобулин, иммуноглобулин — антитела (защита от инфекций).
Ферменты. Еще один вид белков — ферменты. Они отвечают за правильное протекание биохимических реакций внутри клеток во всем организме. За контроль метаболизма отвечают белки — протеазы.
Вопрос 10. Почему белки называют молекулами жизни?
Более 4 млрд. лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными блоками живых организмов. Своим бесконечным разнообразием всё живое обязано именно уникальным молекулам белка.
Белки — это природные органические соединения, которые обеспечивают все жизненные процессы любого организма. Из белков построены хрусталик глаза и паутина, панцирь черепахи и ядовитые вещества грибов. С помощью белков мы перевариваем пищу и боремся с болезнями. Благодаря особым белкам по ночам светятся светлячки, а в глубинах океана мерцают таинственным светом медузы.
Белковых молекул в живой клетке во много раз больше, чем всех других (кроме воды, разумеется!). Белки считаются основным материалом для "строительства" клеток. Учёные выяснили, что у большинства организмов белки составляют более половины их сухой массы. И разнообразие видов белков очень велико — в одной клетке такого маленького организма, как бактерия Escherichia соli насчитывается около 3 тыс. различных белков.
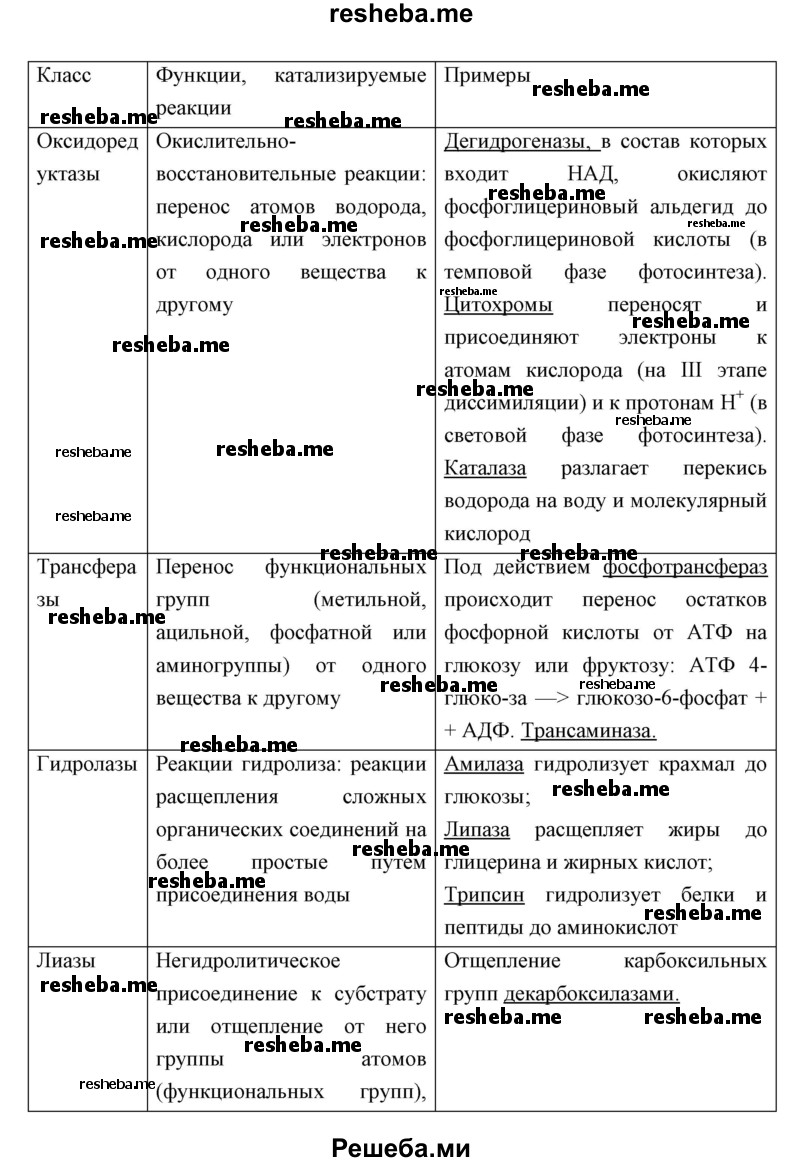
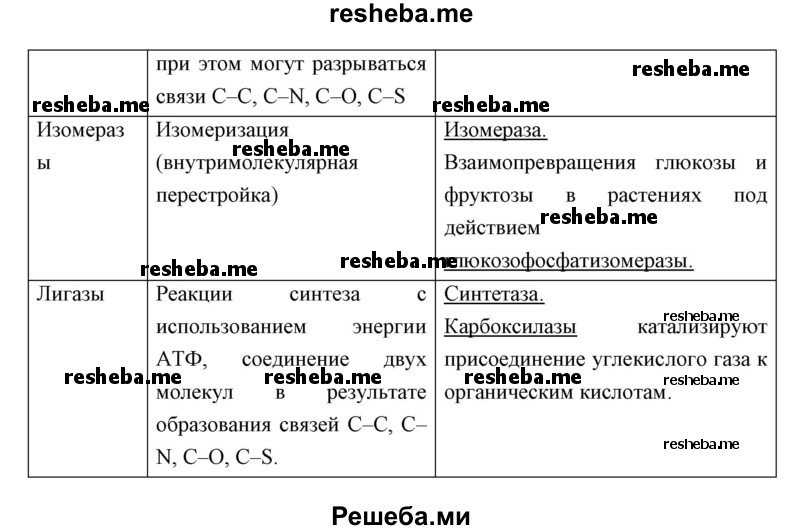
Вопрос 11. Используя дополнительные источники информации, найдите сведения о функциях белков ферментов различных классов. Результат оформите в виде таблицы.
Вопрос 12. Найдите в приведённом тексте ошибки. Укажите номера предложений, в которых сделаны ошибки. Исправьте их.
1) Большое значение в строении и жизнедеятельности организмов имеют белки. 2) Это биополимеры, мономерами которых являются азотистые основания. 3) Белки входят в состав плазматической мембраны. 4) Все белки выполняют в клетке ферментативную функцию. 5) Молекулы белка несут наследственную информацию о признаках организма.6) Молекулы белка входят в состав рибосом.
Ответ. Ошибки сделаны в предложениях под номерами: 2, 4, 5.
2)Это биополимеры, мономерами которых являются аминокислоты, соединенные между собой пептидной связью.
4)Не все белки выполняют в клетке ферментативную функцию. ИЛИ…. Все белки выполняют в клетке различные функции.
5) Молекулы белка не несут наследственную информацию о признаках организма. ИЛИ…Наследственная информация о признаках организма зашифрована в нуклеиновых кислотах.
Вопрос 13. Почему в запасных тканях семян растений (эндосперме, семядолях), даже очень богатых углеводами или жирами, обязательно присутствуют белки?
Семена у растений наиболее надежно обеспечивают их размножение и распространение. В семени содержится необходимый для прорастания зародыша запас питательных веществ. Белки при необходимости используются ими для получения аминокислот и энергии. Белки являются основным строительным материалом клеток. Также белки в сухом состоянии денатурируются значительно медленнее, чем белки оводненные, инактивирование ферментов в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие семена могут выдержать нагревание до гораздо более высоких температур, чем те же споры или семена в увлажненном состоянии.
Цель: показать наличие белков в биологических объектах.
Оборудование: штатив с пробирками, водяная баня, кристаллизатор со льдом, мерный стакан на 50 мл.
Реактивы: куриное яйцо, концентрированная азотная кислота, раствор аммиака, гидроксид натрия, раствор медного купороса, вода.
Ход работы:
1. Приготовьте раствор белка.
2. Ксантопротеиновая реакция. В пробирку налейте 2—3 мл раствора белка и добавьте несколько капель азотной кислоты. Соблюдайте технику безопасности при работе с химическими реагентами! Нагрейте содержимое пробирки, при этом образуется жёлтый осадок. Охладите смесь и добавьте раствор аммиака до перехода жёлтой окраски в оранжевую.
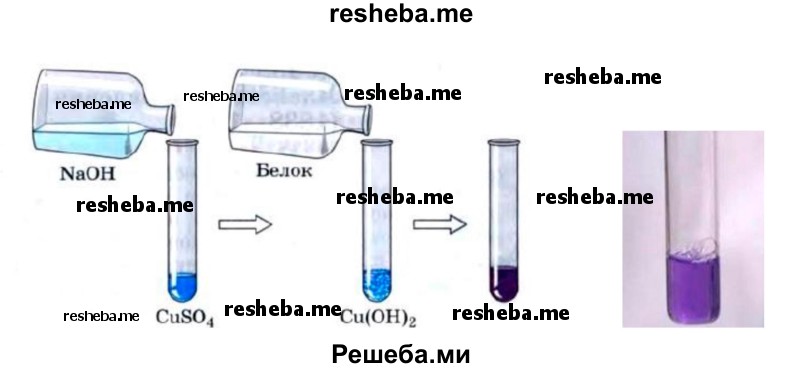
3. Биуретовая реакция. В пробирку налейте 2—3 мл раствора белка и 2—3 мл раствора гидроксида натрия, затем 1—2 мл раствора медного купороса. Появляется фиолетовое окрашивание.
4. Запишите результаты эксперимента и сделайте вывод.
Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот — триптофана, фенилаланина, тирозина, содержащих в своем составе ароматическое ядро. Ряд белков при добавлении к ним концентрированной азотной кислоты при нагревании дают желтое окрашивание, которое может переходить в оранжевое в щелочной среде.
Реакция вызвана нитрованием бензольного ядра указанных циклических аминокислот и образованием нитросоединений желтого цвета.
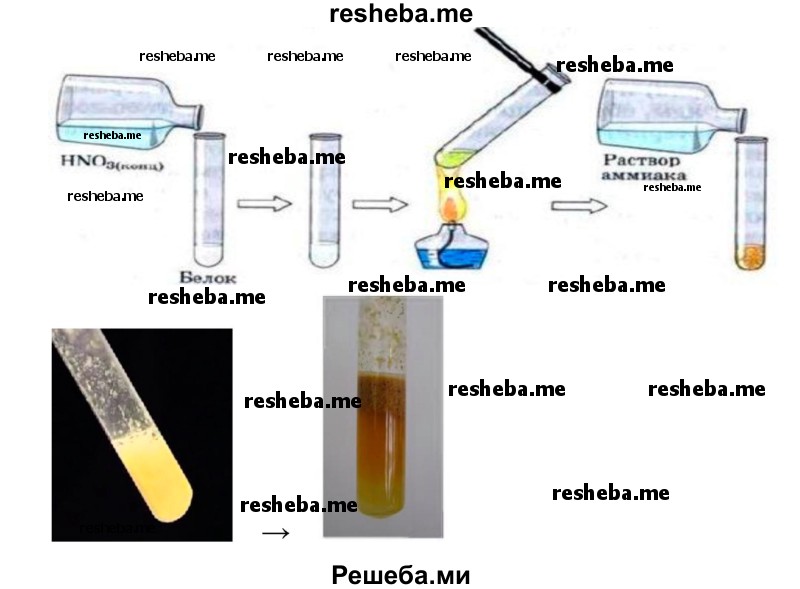
Взаимодействие с концентрированной азотной кислотой — белый осадок, нагревание — появлением желтой окраски, добавление аммиака — появление оранжевой окраски.
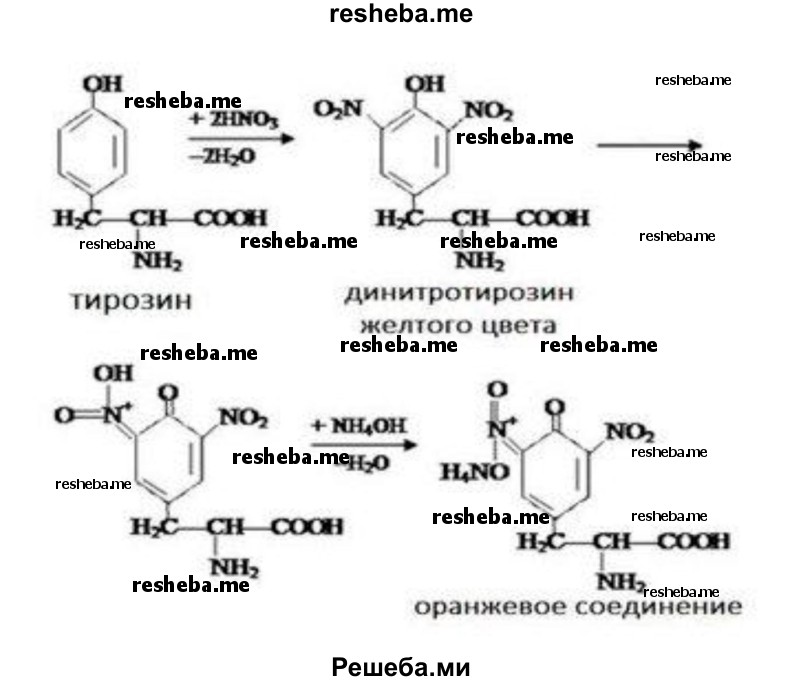
Ксантопротеиновую реакцию дают почти все белки. Ксантопротеиновая реакция обуславливает появление желтого окрашивания при попадании концентрированной азотной кислоты на кожу, ногти. Эту реакцию могут давать и более простые ароматические соединения (например, фенолы). Исключение составляют клупеин и сальмин (из группы протаминов) и желатина, в молекуле которых почти полностью отсутствуют ароматические аминокислоты.
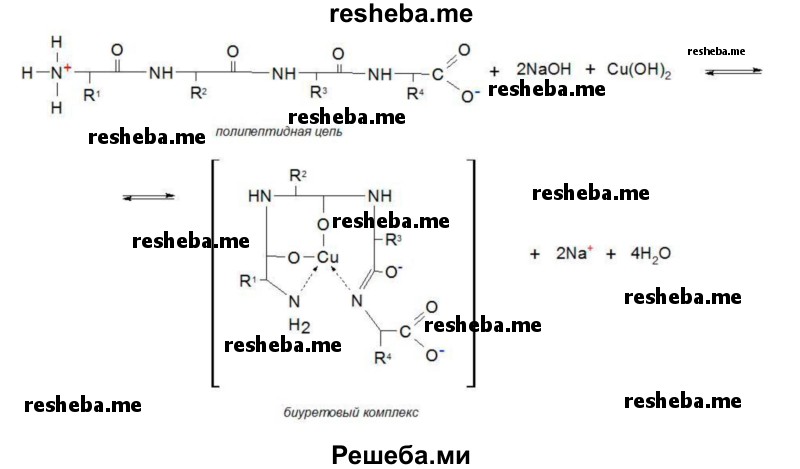
Биуретовая реакция является универсальной на пептидную связь в белках. Вещества, имеющие в своем составе не менее 2 — х пептидных связей дают эту реакцию.
Реакция состоит в том, что в щелочной среде в присутствии сернокислой меди белки и полипептиды дают сине — фиолетовое или красно — фиолетовое окрашивание в зависимости от длины пептида вследствие образования комплексных соединений меди с пептидной группой. Продукты гидролиза белков (пептоны) могут давать розовое, красное окрашивание.
Щелочная среда приводит к появлению отрицательного заряда вследствие диссоциации ОН — группы, благодаря этому кислород взаимодействует с медью с образованием солеобразной связи, а медь в свою очередь с атомами азота связана через дополнительно координационные связи за счет использования их неподеленных электронных пар. Это ведет к образованию стабильного комплекса.
Вывод: Ксантопротеиновая и биуретовая реакции — качественные реакции на белки. С помощью этих реакций можно доказать наличие белков в биологических объектах.
В каждой клетке организме постоянно происходят сотни различных биохимических процессов. Все они сопровождаются распадом и окислением питательных веществ, поступающих извне.
Процессы сложные, многосоставные, и об их особенностях можно рассказывать долго. Но все они протекают быстро благодаря катализаторам биохимических реакций, которыми являются белки-ферменты.
Что они собой представляют? Какова их роль, свойства, функции? Об этом сейчас речь и пойдет.
Определение
Итак, белок-фермент – это совокупность сложных молекул белка и рибосом либо их целые комплексы. Именно они ускоряют все происходящие в живых системах химические реакции. Происходит это, разумеется, определенным образом.
Ферменты по отношению к субстратам весьма специфичны. Аденозинтрифосфатазы, например, катализируют исключительно отщепление остатков фосфорной кислоты от аденозинтрифосфорной. Другой пример – киназа фосфорилазы. Она, в свою очередь, переносит к субстрату остатки только фосфорной кислоты.

Регуляция активности
Белки-ферменты могут действовать по-разному. Их активность регулируется двумя типами веществ:
- Активаторы. Вследствие их воздействия активность повышается. При ассоциации с ДНК эти вещества усиливают транскрипцию определенного гена. Яркий пример – Gal8. Он активирует гены, которые ответственны за усвоение дрожжами галактозы.
- Ингибиторы. Они, как можно предположить, активность понижают, задерживая течение физико-химических и физиологических процессов. В качестве примера можно привести гидрохинон. Это ароматическое органическое соединение является ингибитором окисления бензальдегида.
К слову, синтезируются белки-ферменты на рибосомах. Эти органеллы производят их из аминокислот, основываясь на генетическую информацию.

Состав
Есть еще множество вопросов, касающихся белков-ферментов, расщепляющие различные вещества, поступающие в организм. Почему, например, их молекулы больше, чем у субстратов? И каким вообще образом аминокислоты, которые сами не могут ускорять химические реакции, создают мощнейшие каталитические системы, соединяясь в специфические последовательности?
Но зато медицине многое известно об их составе. Каждый фермент представляет собой соединение собственно белковых частей и связанные с ними активные центры. В их молекулах принято отличать активный А-центр – это место в пространственной структуре, с которым контактирует субстрат S. Также есть белковая часть – ее именуют либо апоэнзимом, либо апоферментом.
Можно еще объяснить иначе. Ферменты образованы из полипептидов – это такие вещества, которые состоят из остатков аминокислот. А те, в свою очередь, являются органическими соединениями, содержащие в себя как аминные, так и карбоксильные группы.
Специфика воздействия
Состоящие из остатков аминокислот белки-ферменты обеспечивают одну либо несколько однотипных реакций (каждый).
К примеру, жиры внутри клеток и в пищеварительном тракте расщепляются липазой. Это водорастворимый фермент, не действующий на белки и полисахариды. В то же время вещество, расщепляющее гликоген или крахмал, не оказывает никакого эффекта на жиры.
Интересно, что каждый молекула фермента осуществляет от нескольких тысяч до миллионов действий в минуту. В ходе этих процессов белок не расходуется вообще. Наоборот, он образует симбиоз с реагирующими веществами, ускоряя их превращения. После окончания он выходит из реакции в неизменном виде.
Свойства
Их тоже надо рассмотреть, изучая роль белков-ферментов. Вообще, свойства этих веществ можно выделить в такой список:
- Способность путем высаливания осаждаться из растворов.
- Амфотерность.
- Электрофоретическая подвижность.
- Способность к кристаллизации.
- Высокая специфичность действия.
- Зависимость реакции от рН-среды, активаторов, ингибиторов и температуры.
Последние качества обусловлены регулируемой активностью ферментов. Благодаря этой специфике удается изменять скорость превращения веществ вы зависимости от условий среды, в которых они находятся.
Интересно, что у некоторых белков-ферментов, расщепляющих жиры, углеводы и прочие элементы, есть стереохимическая специфичность. Так называется их способность катализировать превращение лишь одного стереоизомера субстрата. К примеру, фумароза способна расщепить исключительно транс-изомер-фумаровую кислоту. Взаимодействовать с cis-изомером она уже не будет.
Зависимость от температуры
Она довольно весомая. С повышением температуры на каждые десять градусов скорость ферментативной реакции увеличивается примерно в два-три раза.
Но, если сравнивать с минеральными катализаторами, то закономерность эта дает о себе знать только в конкретном температурном интервале, который может варьироваться от 0°C до 37-40 °C.
Когда же фермент начинает работать на максимуме? Наибольшая активность проявляется тогда, когда и температура достигает предела в 40 °C. Если она поднимется еще выше, то начнется денатурация.
Ферменты, подчиняющиеся данной закономерности, принято называть термолабильностью. Это – ключевое качество, отличающие белки от минеральных катализаторов.
Но есть среди ферментов термостабильные соединения, на которые высокие температуры негативно не воздействуют. Более того, некоторые из них их выдерживают, и даже под их влиянием проявлять максимальную активность. К таковым относится миокиназа мышц. Она сохранит активность даже в том случае, если температура достигнет 100 °C.
При 0 °C ферментативная реакция практически прекращается. Но это ингибирование обратимо. При нормальном температурном режиме активность вещества восстановится. Это доказывают ферменты, которые были выделены из туши мамонтов, годами находившихся в условиях ледникового периода. При создании нормальной температуры они проявляли хорошую активность.
А некоторые ферменты и при низкой температуре ее демонстрируют. Например, амилаза картофеля. При -4 °C она действует в разы более активно, чем при плюсовых показателях. Кстати, этим обусловлен сладковатый вкус слегка замерзшей картошки.

Классификация
Рассказывая об особенностях и функциях белков-ферментов, нужно отметить, что на данный момент известно более 2000 их видов. Но количество постоянно увеличивается.
Условно ферменты делятся на 6 групп. В качестве критерия классификации выступает характер реакций, который они вызывают.
Также стоит упомянуть, что процесс синтеза или расщепления какого-либо вещества в клетке обычно делится на ряд химических операций. Каждая из них выполняется отдельным белком-ферментом. Группы таких элементов составляют некий биохимический конвейер.
Обратные связи
Всем вышеперечисленным не ограничиваются свойства белков-ферментов. Не был отмечен вниманием еще один немаловажный нюанс.
Плохо, если его слишком много. Потому что в таком случае активность начального фермента начинает тормозиться. Ничем не лучше, если конечного продукта мало. Потому что тогда фермент активируется.
Собственно говоря, таким образом множество биохимических процессов и происходит. Это – обратные связи, обеспечивающие саморегуляцию. Если задуматься и провести параллель, то такие же принципы прослеживаются в работе современной технике. В природных механизмах, в живых клетках, все аналогично.
Сходство с минеральными катализаторами
Что же, исходя из вышесказанного, можно понять, какую функцию выполняют белки-ферменты. Теперь нужно немного поговорить об их сходствах с минеральными катализаторами. Можно выделить такой перечень:
- Ферменты проявляют свое действие в крайне небольших концентрациях. Амилаза способна ускорить гидролиз крахмала, будучи разведенной в пропорциях 1:1000000.
- В ходе катализируемой белком реакции он сам не расходуется, покидая ее в неизменном виде (это уже упоминалось ранее).
- Ферменты не смещают химическое равновесие. Эти вещества могут ускорить как обратную, так и прямую реакцию. Направленность определит концентрация исходных субстратов, а также конечных продуктов.
- Ферменты не способны инициировать реакцию. Они только влияют на скорость химических превращений.
- Они уменьшают уровень энергии активации. Ферменты могут обеспечить течение реакции, обойдя так называемый энергетический барьер.
Последний факт особенно интересен. Такая особенность обусловлена тем, что фермент в ходе своей реакции начинает взаимодействовать с субстратом, образуя промежуточное соединение – фермент-субстратный комплекс.
Что же происходит? Конформация субстрата меняется, ковалентные связи напрягаются, а потому энергии, необходимой для разрыва, требуется меньше.
Как можно видеть, казалось бы сложный процесс на самом деле можно очень просто объяснить, если вникнуть в подробности.
Белки являются сложными органическими соединениями или биополимерами, содержащих в составе водород, углерод, азот и кислород, а в редких случаях — серу.
Мономерами белков являются аминокислоты.
В жизни любого организма белки играет важную роль (и в клетке тоже). При неисчерпаемом разнообразии белков, им характерна определенная специфичность.
Белки и нуклеиновые кислоты — материальная база всего существующего богатства организмов окружающей среды. От сухой массы клетки их доля может составлять от 50 до 80%.
Каково строение молекулы белка?
Молекулы белков — это длинные цепи, которые состоят из 50-1500 остатков аминокислот. Между собой они соединены прочной ковалентно-углеродной (пептидной) связью. Как результат — образование первичной структуры белка или полипептидной цепи.
Молекула белка представляет собой полипептид с молекулярной массой от 5 до 150 тысяч (в некоторых случаях даже больше).
В составе простых белков присутствуют только аминокислоты. Сложные белки помимо аминокислот могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), окрашенные химические соединения (хромопротеиды), углеводы (гликопротеиды) и др.
Химические, функциональные и морфологические свойства клетки определяются специфическими белками, которые в ней присутствуют.
Набор аминокислот, их количество и последовательность расположения в полипептидной цепи — формирующие составляющие специфичность белка.
Если в составе белковой молекулы заменить одну аминокислоту, или поменять последовательность расположения аминокислот, то в результате может произойти изменение функций белка в клетке. Все это и является причиной большого разнообразия строения белка (белковой молекулы первичной структуры).
Становится понятным, почему живой организм для выполнения своих функций использует особенные виды белков. В этом отношении его возможности являются неограниченными.
Свойства белков определяются также и пространственным расположением полипептидных цепей. Полипептидные цепи в живой клетке являются скрученными или согнутыми, для них характерная вторичная или третичная структура.
Спирально закрученная белковая цепочка — это вторичная структура. Удержание витков спирали осуществляется за счет водородных связей, которые образуются между CO- и NH-группами, расположенными на соседних витках.
Дальнейшее закручивание спирали приводит к специфической конфигурации каждого белка, то есть — к третичной структуре. Ее образование происходит за счет связей между белковыми радикалами аминокислотных остатков. Это связи:
- ковалентная дисульфидная (S- S-связь) между остатками цистеина;
- водородная;
- ионная;
- гидрофобные взаимодействия.
Гидрофобные взаимодействия в количественном соотношении можно считать наиболее важными. Они появляются в результате того, что неполярные боковые цепи аминокислот пытаются объединиться друг с другом без смешения с водной средой. При этом происходит свертывание белка таким образом, что его гидрофобные боковые цепи прячутся внутрь молекулы: так они получают защиту от воды. Наружу выставлены, при этом, боковые гидрофильные цепи.
Есть определенные специфичные для любого белка моменты:
- количество молекул аминокислот с гидрофобными радикалами;
- количество молекул цистеина;
- характер их взаиморасположения в полипептидной цепи.
Сохранение определенной формы молекулы обеспечивает взаимное расположение групп атомов, необходимое для проявления активности белка в качестве катализатора, его гормональные функции и др. По этой причине стойкость макромолекул не является случайным свойством, а важный и необходимый способ стабилизации организма.
Проявление биологической активности белка характерно только при наличии третичной структуры. Замена даже одной аминокислоты в полипептидной цепи приводит к изменениям в конфигурации белка, а также к снижению его биологической активности и даже исчезновению.
В некоторых случаях возможно объединение в единый комплекс двух, трех и более белковых молекул с третичной структурой. В итоге получаем четвертичную структуру белка.
Пример четвертичной структуры белка — гемоглобин. Он состоит из четырех субъединиц и небелковой части (гема). Только в такой форме он может выполнять свои функции.
Белковые субъединицы в четвертичной структуре не имеют химической связи. Но сама структура при этом довольно крепкая за счет действия слабых межмолекулярных сил.
Третичная и четвертичная структуры могут меняться в результате разрыва водородных и ионных связей. Это происходит под влиянием различных физических и химических факторов:
- обработки щелочами, кислотами, ацетоном, спиртом;
- высокой температуры;
- давления и др.
Денатурация — это нарушение естественной или нативной белковой структуры.
Денатурация приводит к снижению растворимости белка, изменению формы и размеров молекул, утрате ферментативной активности и т.д. При этом, процесс денатурации является обратимым: при возвращении нормальных условий происходит непроизвольное обновление естественной (природной) структуры белка. Этот процесс получил название ренатурации.
Первичная белковая структура определяет особенности строения белка и функционирование белковой макромолекулы. От строения перейдем к функциям белков.
Функции белков в клетке
Выделяют как минимум 3 основных функции белка в клетке:
- Строительная функция белков или пластическая. Одна из важнейших функций, так как белки являются составными компонентами клеточных мембран и органелл. В основном из белка состоят стенки кровеносных сосудов, сухожилия, хрящи высших животных.
- Двигательная. Ее обеспечивают особенные сократительные белки, за счет которых приходят в движение жгутики и реснички, перемещение хромосом в ходе деления клеток, сокращение мускулатуры, движение органов растений, а также изменения положений разнообразных структур организма в пространстве.
- Транспортная. Эта функция обеспечивается способностью белков к связыванию и переносу с течением крови химических соединений.
Теперь пройдемся по другим функциям белков кратко.
Белок крови гемоглобин осуществляет перенос кислорода из легких в клетки других органов и тканей. В мышцах такую функцию выполняет миоглобин.
Белки сыворотки крови осуществляют перенос липидов и жирных кислот, а также различных биологически активных веществ.
Говорить о белках и их функциях невозможно, не отметив защитную функцию белков. Клетка способна вырабатывать особые белки — иммуноглобулины. Это происходит, когда в нее проникают различные чужеродные вещества вроде антигенов-белков или высокомолекулярных полисахаридов бактерий, вирусов. Иммуноглобулины или антитела устраняют чужеродные вещества и обеспечивают иммунологическую защиту организма.
Функционирование иммунной системы организма осуществляется благодаря распознаванию антигенов антигенным детерминантом (характерным участком их молекул). Таким образом чужеродные вещества связываются и обеззараживаются.
Внешняя защитная функция может выполняться также белками, которые являются токсичными для других организмов. К примеру, белок змей.
Стоит выделить и сигнальную функцию белков. Молекулы белков, способные к изменению третичной структуры в ответ на действия факторов окружающей среды, встроены в поверхность клеточной мембраны. Таким образом осуществляется восприятие сигналов из внешней среды и передача команд в клетку.
Есть еще регуляторная функция, которая присуща белкам-гормонам, влияющим на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, а также принимают участие в росте, размножении и прочих жизненно важных процессов.
Инсулин — самый известный гормон, отвечающий за снижение уровня сахара в крови. При недостатке инсулина уровень сахара в крови повышается, что приводит к возникновению сахарного диабета. Разнообразные белки-ферменты также выступают в роли главных регуляторов биохимических процессов в организме (каталитическая функция).
Белки — энергетический материал. В результате расщепления 1 грамма белка до конечных продуктов происходит выделение 17,6 кДж энергии, которая используется в большинстве жизненно важных процессов в клетке.
Функции белков в таблице:

Разобравшись со строением и функциями белков, переходим к ферментам.
Ферменты и их роль в клетке
Ферменты или энзимы — это особые белки, которые присутствуют в любом организме и выполняют функцию биологических катализаторов.
Протекание химических реакций в живой клетке зависит от умеренной температуры, нормального давления и нейтральной среды. Такие условия обеспечивают довольно медленное течение реакций синтеза или распада веществ в клетке. Однако именно ферменты ускоряют реакции путем снижения энергии активации, при этом не происходит изменений их общего результата. Чтобы придать молекулам реакционную способность, в случае наличия ферментов необходимо гораздо меньше энергии.
При прямом или косвенном участии ферментов протекают все процессы в живом организме.
Составляющие компоненты пищи — белки, углеводы, липиды и др. — под влиянием ферментов расщепляются до простейших соединений. Позже из них синтезируются новые, присущие данному виду макромолекулы. В случае нарушения образования и активности ферментов возникают тяжелые заболевания.
Ферментативный катализ протекает в соответствии с теми же законами, что и неферментативный катализ в химической промышленности. Но у ферментативного катализа есть и определенные отличия. Ему характерная высокая степень специфичности — фермент катализирует только одну реакцию или действует в отношении только одного типа связи.
Все это обеспечивает регулирование жизненно важных процессов, которые происходят в клетке и организме: фотосинтеза, дыхания, пищеварения и др.
Только одно вещество катализирует расщепление фермент уреаза. Это вещество — мочевина. При этом, фермент не действует каталитически на структурно родственные соединения.
Теория активного центра — важный момент для понимания того, каков механизм действия ферментов с характерной им высокой специфичностью. Согласно этой теории, молекула фермента содержит один или несколько участков, где катализ осуществляется благодаря тесному (во множестве мест) контакту между молекулами фермента и субстрата (специфического вещества). Активным центром выступает функциональная группа (например, OH — группа аминокислоты серина) или отдельная аминокислота.
Действие катализатора нуждается в объединении нескольких аминокислотных остатков, которые располагаются в определенной последовательности. В среднем требуется от 3 до 12 остатков.
Формирование активного центра может происходить также в результате связи ферментов с ионами металлов, витаминами и прочими соединениями небелковой природы. Это коферменты или кофакторы.
Форма активного центра и его химическое строение таковы, что подразумевают связь только с определенными субстратами за счет их идеального соответствия друг другу — взаимодополняемости или комплементарности.
Другие аминокислотные остатки обеспечивают большой молекуле фермента определенную глобулярную форму — она нужна для эффективной работы самого центра.
Вокруг большой молекулы фермента образуется сильное электрическое поле. Это поле обеспечивает ориентацию молекул субстрата и их ассиметричная форма. Происходит ослабевание химических связей, и начальная затрата энергии на катализируемую реакцию сокращается. При этом, скорость реакции увеличивается.
За одну минуту одна молекула фермента каталазы расщепляет свыше 5 млн. молекул перекиси водорода, возникающая при окислении в организме различных соединений.
Наблюдается изменение конфигурации активного центра некоторых ферментов в присутствии субстрата. Чтобы обеспечить наибольшую каталитическую активность, этот фермент специально ориентирует свои функциональные группы.
При присоединении молекул субстрата к ферменту, в определенных пределах наблюдается изменение их конфигурации. Это позволяет увеличить реакционную способность функциональных групп центра. Распад комплекса фермента и субстрата происходит на заключительном этапе химической реакции — с образованием конечных продуктов и свободного фермента. Происходит освобождение активного центра, в результате чего он снова может принимать новые молекулы субстрата.
Множество факторов определяют скорость реакций с участием ферментов. К ним относятся:
- концентрация фермента;
- природа субстрата;
- давление;
- температура;
- кислотность среды;
- наличие ингибиторов и др.
Скорость биохимических реакций минимальна при температуре около 0 по Цельсию. Такое свойство широко применяется в различных отраслях, в частности — в медицине и сельском хозяйстве.
Для снижения интенсивности биохимических реакций и продления жизни, органы человека, планируемые к пересадке (почки, селезенка, печень, сердце), охлаждают. Быстрое замораживание пищевых продуктов предотвращает размножение микроорганизмов и инактивирует ферменты, в результате чего пищевые продукты не разлагаются.
Эта статья поможет вам разобраться в свойствах и функциях белков (функции белков представлены в таблице).
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).

Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.

Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 10 20 . Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).

Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.

Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Свойства белков
Купить проверочные работы
по биологии




Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н + определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
| Функция | Примеры и пояснения |
|---|---|
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).

Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.

Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.

Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
- оксиредуктазы (перенос атомов водорода, кислорода или электронов от одного вещества к другому — дегидрогеназа),
- трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому — трансаминаза),
- гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта — амилаза, липаза),
- лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи С–С, С–N, С–О, С–S — декарбоксилаза),
- изомеразы (внутримолекулярная перестройка — изомераза),
- лигазы (соединение двух молекул в результате образования связей С–С, С–N, С–О, С–S — синтетаза).
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1.
Читайте также:
- Почему у нас разные фамилии кратко
- Принципы педагогической деятельности в доу по воспитанию гражданственности
- Какой принцип используют оптические цифровые носители информации кратко
- Какое перемещение воздушных масс господствует над территорией нашей страны кратко
- Как можно повысить эффективность деятельности предприятия или организации по мнению авторов школы

