Что означает физическая величина молярная масса и чем она отличается от физических величин кратко
Обновлено: 06.07.2024
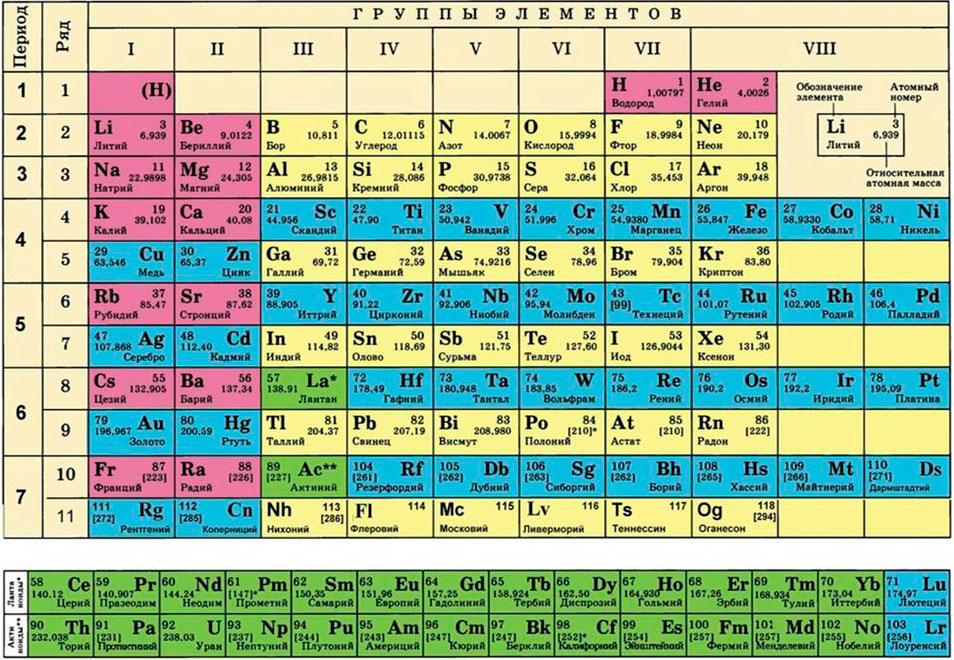
Что означает физическая величина "молярная масса" и чем она отличается от физических величин "относительная молекулярная масса" и "относительная атомная масса"?
Молярная масса - это масса 1 моль этого вещества, тоесть г/моль
Относительная молекулярная масса - масса одной молекулы этого вещества
Относительная атомная масса - масса одного атома этого вещества
9. 2,3,6,5. 10. 2,3. 11.3,2,1.
Определите тип химической связи и составьте схему образования связи в следующих веществ: а) MgCl2 б)F2 в)HBr
При взаимодействии 200г магнетита с избытком соляной кислоты получено 40л (н.у.) оксида углерода(IV). Определитель массовую долю
ПОМОГИТЕ РЕШАЕТСЯ ОЦЕНКА(((( ДАЮ 30 БАЛЛОВРассчитайте объем (н.у.) водорода который выделится в реакции металлического натрия, в
При горении 20 г фосфора содержит 2 % примеси ,израсходовано некоторое количество кислорода .Какое количество кислорода ?
Моль – это количество вещества, содержащее столько же частиц (атомов, молекул и др.), сколько содержится атомов углерода в 0,012 кг (12 г) углерода, масса которого равна 12 а. е. м.
1 моль любого вещества содержит 6,02 * 10 23 частиц (атомов, молекул, ионов и др.). Эту величину называют числом Авогадро.
Молярная масса – это масса одного моля вещества. Её обозначают буквой M и выражают обычно в граммах на моль (г/моль).
Молярная масса численно совпадает с относительной атомной или относительной молекулярной массой вещества.

ГДЗ (готовое домашние задание из решебника) на Вопрос №2, § 36 по учебнику Химия. 8 класс: учебник для общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. 4 издание. Просвещение, 2016-2021г.
Условие
Что означает физическая величина "молярная масса" и чем она отличается от физических виличин "относительная молекулярная масса" и "относительная атомная масса"?

Моль
Моль — это количество вещества из 6,02214076⋅10 23 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ. В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅10 23 и обозначают NA.
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
N = ν⋅ NA =2 ⋅ 6,022⋅10 23 = 12,044⋅10 23 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅10 23 молекул воды?
ν⋅ = N / NA = 24,088⋅10 23 / 6,022⋅10 23 = 4 моля.

Моль и молярная масса: простое объяснение с примерами
Молярная масса
Итак, молярная масса равна массе порции вещества m к количеству молекул ν в его порции:
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
Моль и молярная масса: простое объяснение с примерами
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть масса 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
§36. Количество вещества. Моль. Молярная масса

3. Рассчитайте молярные массы воды H₂O, углекислого газа CO₂, серной кислоты H₂SO₄, сероводорода H₂S.
4. Дано уравнение реакции Согласно этому уравнению по аналогии с таблицей 6 составьте таблицу, показывающую соотношение между массой реагирующих веществ в граммах, числом атомов и количеством вещества.

5. Составьте 2-3 уравнения известных вам химических реакций и поясните, в каких массовых и количественных соотношениях реагируют вещества.
ТЕСТОВЫЕ ЗАДАНИЯ
1. Медь, взятая количеством вещества 6 моль, имеет массу
1) 60 г 2) 192 г 3) 384 г 4) 400 г
3)
2. Масса 0,1 моль алюминия равна
1) 0,1 г 2) 2,7 г 3) 260 г 4) 540 г
2)
3. Количество вещества, соответствующее 32 кг оксида железа (III), - это
1) 10 моль 2) 20 моль 3) 100 моль 4) 200 моль
4)
4. Количество вещества, соответствующее 560 г карбоната кальция CaCO₃, - это
1) 0,56 моль 2) 5,6 моль 3) 6,5 моль 4) 10 моль
2)
Читайте также:

