Что изучает химия 8 класс кратко
Обновлено: 30.06.2024
Химия – наука для любопытных! Мы с вами уже узнали о том, что химия изучает вещества и их превращения.
Теперь пришло время разобраться: что же такое вещество, какие вещества бывают, из чего они состоят, какими свойствами обладают, и как они могут изменяться под воздействием различных факторов. Все это вы узнаете в процессе изучения такого интересного предмета, как химия.
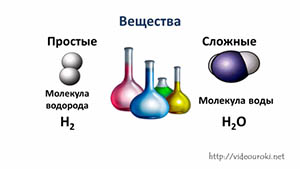
Вещество – это то, из чего состоят тела, то есть совокупность одинаковых атомов и молекул.
Каждое вещество имеет свои определенные свойства, присущие только ему. Например, плотность, цвет, пластичность, запах, вкус и другие.
Тело имеет форму и объем. Это его основные характеристики.
Чтобы было понятнее, рассмотрим простой пример.
Пластилин – это вещество. Оно имеет свои, присущие только ему, свойства.
Если мы возьмем кусок пластилина и разделим его на две части, то мы получим тот же самый пластилин.
Его свойства при этом останутся неизменными. Он по-прежнему будет мягким, липким и пластичным.
А вот если мы придадим ему определенную форму, скажем, слепим пластилиновую ворону или собаку (кому что больше нравится), то мы получим физическое тело.
В окружающем мире много примеров тел и веществ, из которых они состоят.
Телефон – тело, а пластмасса, стекло и медь, из которых он сделан, – вещества.

Стол и древесина. Ваза и глина. А какие примеры тел и веществ можете привести вы?
Химия – это наука, которая изучает все разнообразие веществ в нашем мире, а также их превращения под воздействием тех или иных факторов.
Для чего же это нужно человеку? – спросите вы.
Давайте поговорим и об этом. Человек в процессе своего развития постоянного познает окружающий его мир, стремится сделать свою жизнь безопаснее и комфортнее.
Трудно представить, как бы развивался человек и мир вокруг него без знаний и открытий, которые делают замечательные ученые-химики.
Создание новых тканей, техники, лекарств и многих других необходимых нам вещей было бы невозможным без химической науки.
Таким образом, химия – это наука, без которой не может быть технического прогресса и дальнейшего развития человечества.
И как знать, может быть, кто-то из вас станет гениальным ученым-химиком и получит Нобелевскую премию за свое исследование или открытие.
Пройти тест и получить оценку можно после входа или регистрации
Когда появилась химия?
В древности люди пользовались дарами природы, производили орудия труда и предметы быта, шили одежду, готовили еду из натуральных материалов и веществ.
Как известно из истории, многие ученые в древности пытались получить золото путем смешивания различных металлов. Их стали называть алхимиками.
Золото синтезировать им так и не удалось, зато именно эти опыты привели к бурному развитию химии.

В настоящее время технический прогресс требует от ученых-химиков получения все новых и новых материалов.
Химия как наука также претерпела значительные изменения. В первую очередь, поменялись цели и задачи предмета.
Сегодня перед химиками на первый план выходит не изучение веществ и их превращений, а создание новых синтетических материалов с заданными свойствами.
Пройти тест и получить оценку можно после входа или регистрации
Химия как наука
Как мы уже упомянули выше, развитию химии способствовало стремление человека создать золото синтетическим путем.
Почему же для человека так важен был именно этот металл?
В древности полагали, что золото обладает удивительными свойствами.
Некоторые народы считали его чудодейственным целительным металлом.
В первую очередь, металлы ценили за свои свойства: долговечность, ковкость, пластичность.
Для придания им прочности люди стали синтезировать различные соединения на основе металлов.
Произошло и становление химии как науки, основными задачами которой на первом этапе были выработка одинаковых взглядов на химические явления и формирование единых подходов к исследованию.
В процессе своего развития химия выделилась в отдельную науку, изучающую вещества и их превращения.
Об этом мы с вами уже говорили в начале нашего урока.
В процессе обучения мы еще не раз поговорим о целях и задачах химической науки, о ее развитии и достижениях.
Вы сможете сами понять и оценить, насколько важной и нужной является химия.
Конспекты по химии 8 класс собраны по порядку на этой странице. Они помогут вам наглядно показать учебный материал на своих уроках, а ученик с их помощью сможет самостоятельно изучить любую тему урока по видео или конспекту. Это готовые материалы для учителя химии, которые можно удобно использовать на каждом своем уроке.
1. Предмет химии. вещества
Химия 8 класс

2. Роль химии в нашей жизни
Химия 8 класс

3. Знаки химических элементов
Химия 8 класс
4. Химическая формула. Относителная атомная и молекулярная масса
Химия 8 класс

5. Основные сведения о строении атома. состав атомных ядер
Химия 8 класс

6. Порядковый номер элемента. Изотопы
Химия 8 класс
7. Структура периодической таблицы элементов
Химия 8 класс

8. Строение электронных оболочек атома
Химия 8 класс

9. Ионная связь
Химия 8 класс

10. Ковалентная неполярная связь
Химия 8 класс

Получайте новое первыми










Лицензия на право ведения образовательной деятельности №5251 от 25.08.2017 г.
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
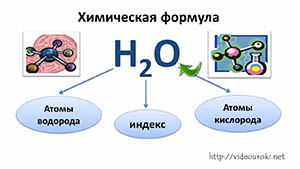
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12 С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12 С.
- Постоянная Авогадро (Na = 6*10 23 моль -1 ) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12 С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12 С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Основные понятия химии.
Определение.
Наука о веществах, их свойствах и превращениях
Это то, из чего состоят физические тела
Определенный вид атомов с одинаковым зарядом ядра
(состоящая из положительно заряженного ядра и одного или несколько отрицательно заряженных электронов;
Наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ)
Состоит из одного или нескольких видов атомов
Свойство атомом замещать или присоединять в соединениях определенное число атомов другого элемента
Это условный заряд атомов химического элемента в соединении (Са +2 О -2 , Са +2 Сl 2 -1 )
Образованы атомами одного химического элемента
Образованы атомами разных химических элементов
Это признаки, по которым одни вещества отличаются от других
Хим - кие явления или химические реакции
Явления, в результате которых их одного вещества образуется другое
Явления, в результате которых изменяются размеры, форма тел или агрегатное состояние
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разную массу
Способность атомов одного химического элемента образовывать несколько простых веществ
Относительная атомная масса
Масса атома (выраженная в углеродных единицах)
Относительная молекулярная масса
Масса молекулы вещества
(выраженная в углеродных единицах)
Количество вещества ( ν = m/М) ( ν = N/N а )
Масса 1 моля вещества (М = m/ν) ( ν = V/V а )
Массовая доля вещества в смеси
Отношение массы вещества к массе смеси
Молярная доля вещества в смеси
Отношение количества одного в-ва к сумме всех в-в
Объемная доля вещества в смеси
Отношение количества одного в-ва к сумме всех в-в
Отношение массы данного объема газа к массе такого же объема другого газа. D = m 1 /m 2
Это сложные вещества, состоящие из двух элементов, один из которых кислород (в степени окисления – 2 )
Это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионоа (КОН)
Это сложные вещества, состоящие из атомов водорода и кислотного остатка (Н 3 РО 4 )
Это сложные вещества, состоящие из ионов металлов и кислотных остатков (К 3 РО 4 )
Условная запись химической реакции с помощью химических формул и математических законов.
Это такие реакции, в результате которых из одного или нескольких простых веществ образуется одно сложное
Это такие реакции, в результате которых из одного сложного вещества образуется два и более новых в – в
Это такие реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе
Это реакции, в результате которых два сложных вещества обмениваются своими составными частями
Химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном ( 2 SО 2 + О 2 = 2 SО 3 )
Ионные уравнения реакций
Реакции между ионами
2К + + 2ОН - + Са +2 + SО 4 -2 = Са +2 + 2ОН - + 2К + + SО 4 -2
Это вещества, изменяющие скорость химических реакций, но по окончании их остающиеся качественно и количественно неизменными
Биологические катализаторы белковой природы
Вещества, растворы которых проводят электрический ток.
Вещества, растворы которых не проводят электрический ток
Основные классы неорганических соединений
Простые вещества
Сложные вещества
Оксиды
Оксиды металлов Оксиды неметаллов
(основные оксиды) (кислотные оксиды)
Основания Кислоты
Способы получения:
Оксидов –
- взаимодействие простых веществ с кислородом
- термическое разложение оснований, кислот, солей
- взаимодействие простых веществ и солей с кислотами
- взаимодействие металлов или их оксидов с водой
- действие щелочей на водные растворы солей
- электролиз раствора солей
- взаимодействие простых веществ с водородом
- взаимодействие воды с кислотными оксидами(ангидридами)
- окисление простых веществ
- взаимодействие солей с кислотами
- взаимодействия кислот и оснований
КОН + НСl = КСl + Н 2 О
- взаимодействия кислот и основными оксидами
- взаимодействия щелочей с кислотными оксидами
- взаимодействия кислотных и основных оксидов
- взаимодействия щелочей с солями
3КОН + Fe Сl 3 = 3КСl + Fe (ОН) 3 ↓
- взаимодействия кислот с солями
- взаимодействия двух солей
- взаимодействия простых веществ
Контрольная работа
Приведены схемы реакций.
Составьте уравнения химических реакций и укажите их тип.
а) оксид серы(IV ) + вода = сернистая кислота
б) серная кислота + цинк = сульфат цинка + водород
в) гидроксид железа(II ) = оксид железа(II) + вода
2. Вычислите массовую долю алюминия и серы в сульфиде алюминия.
3. Вычислите массу натрия, необходимого для получения 10,7г хлорида
натрия в избытке хлора.
4.Сколько граммов сульфата меди и сколько граммов воды надо взять,
чтобы приготовить 250 грамм 25%-ного раствора его?
Приведены схемы реакций.
Составьте уравнения химических реакций и укажите их тип.
а) азотная кислота + гидроксид хрома(III) = нитрат хрома(III) + вода
б) гидроксид алюминия = оксид алюминия + вода
в) оксид углерода(IV) + вода = угольная кислота
2. Вычислите массовую долю железа и кислорода в оксиде железа (III)
3. Рассчитайте объем водорода полученного при взаимодействии 48 г магния с избытком соляной кислоты.
4. Сколько граммов нитрата цинка и сколько граммов воды надо взять, чтобы приготовить 50
Контрольная работа
1. Составьте уравнения химических реакций, соответствующих схеме:
С → СО → СО 2 → Н 2 СО 3 → Nа 2 СО 3 → СО 2
2. Опишите способы распознавания газов: водорода и аммиака, помещенных в цилиндр без этикеток.
3. Какой объем водорода (н.у.) потребуется для взаимодействия с оксидом железа (III) массой 640 кг, содержащего 25% примесей? Какое количество вещества воды при этом образуется?
4. Рассчитайте массу цинка, который нужно растворить в соляной кислоте, чтобы получить водород, необходимый для восстановления оксида меди(II) массой 20г до металла.
5. При сливании 400г 9,8%-ного раствора серной кислоты с раствором, содержащим избыток хлорида бария, получили осадок, масса которого:
а) 93,2г б)39,2г в)186,6г г)23,3г
1. Составьте уравнения химических реакций, соответствующих схеме:
S → SО 2 → SО 3 → Н 2 SО 4 → СаSО 4 → Са(ОН) 2
2. Опишите способы распознавания газов: кислорода и углекислого газа, помещенных в цилиндр без этикеток.
3. Какой объем воздуха (н.у.) потребуется для взаимодействия с 270г алюминия, содержащего 20% примесей? Какое количество вещества оксида алюминия при этом получится?
4. При восстановлении улем, при высокой температуре, смеси карбоната цинка и оксида цинка (масса смеси 53 кг) получен цинк массой 39 кг. Рассчитайте массовую долю оксида цинка в исходной смеси.
5. При сливании 25г 16%-ного раствора гидроксида натрия с раствором, содержащим избыток хлорида железа (III), получили осадок, масса которого:
а) 3,57г б) 7,14г в) 2,38г г) 4,76г
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 30 человек из 19 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Дистанционные курсы для педагогов
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 612 886 материалов в базе
Материал подходит для УМК
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 11.08.2019 4121
- DOCX 32.6 кбайт
- 65 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Аносова Любовь Васильевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Время чтения: 2 минуты
Новые курсы: преподавание блогинга и архитектуры, подготовка аспирантов и другие
Время чтения: 16 минут
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
Онлайн-тренинг: нейрогимнастика для успешной учёбы и комфортной жизни
Время чтения: 2 минуты
ГИА для школьников, находящихся за рубежом, может стать дистанционным
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Читайте также:

