Сообщение по теме производство аммиака
Обновлено: 03.07.2024
Производство аммиака: краткая характеристика ( реферат , курсовая , диплом , контрольная )
Муниципальное образовательное учреждение Новосафоновская средняя общеобразовательная школа
Производство аммиака: краткая характеристика
Прокопьевский район 2006
Содержание
1.Способы получения аммиака
2. Современный процесс получения аммиака Список использованной литературы
Введение
Фактический выход каждого конкретного химического процесса может зависеть от целого ряда факторов, главные из них — температура, давление, присутствие катализатора, чистота исходных материалов, эффективность извлечения конечного продукта. Промышленное производство веществ подразумевает отличное знание теоретических закономерностей протекания химических реакций (энергетика химических реакций, химическая кинетика и катализ, химическое равновесие).
Все перечисленные ниже факторы важны, в особенности, если речь идёт о таких многотоннажных производствах, таких, как, например, производство аммиака.
Проектировщики химических предприятий создают сверхмощные установки по производству аммиака. Так, например, созданы установки, производящие 1000−1200 тонн аммиака в сутки. В настоящее время во всём мире ежегодно производится около 5 млн. тонн аммиака.
1. Способы получения аммиака
аммиак цианамидный процесс десульфуратор
Первым промышленным процессом, который использовался для получения аммиака, был цианамидный процесс. При нагревании извести СаО и углерода получали карбид кальция СаС2. Затем карбид нагревали в атмосфере азота и получали цианамид кальция СаСN2; далее аммиак получали гидролизом цианамида:
СаСN2(тв) + 3Н2О = 2NН3^ + СаСО3(тв) Этот процесс требовал больших затрат энергии и экономически был невыгоден.
В 1908 г. Немецкий химик Ф. Габер обнаружил, что аммиак можно получать из водорода и атмосферного азота на железном катализаторе. Первый завод по производству аммиака этим методом использовал водород, который получали электролизом воды. В последствии водород стали получать из воды путём восстановления коксом. Такой способ получения водорода намного экономичнее. После открытия Габера стремительно стало расти производство аммиака, это неудивительно, поскольку огромные количества аммиака необходимы для получения азот содержащих удобрений. На изготовление их используется приблизительно 80% всего получаемого в мире аммиака. Вместе с азотсодержащими удобрениями в почву вносится в растворимой форме азот, в котором нуждается большинство растений. Остальные ?20% производимого аммиака используются для получения полимеров, взрывчатых веществ, красителей и других продуктов.
Современный процесс получения аммиак основан на его синтезе из азота и водорода с использованием специального катализатора:
N2 + 3Н2 — 2NН3 ^ + 45,9 кДж (1)
Поскольку данная реакция обратимая, возникает вопрос: при каких температурах и давления выгоднее всего добиваться максимального выхода продукта? Так как реакция экзотермическая, то исходя из принципа Ле Шателье ясно, что чем ниже температура процесса, тем больше равновесие будет сдвигаться в сторону образования аммиака, и можно предположить, что следует максимально понижать температуру. Но в действительности всё обстоит сложнее: при низких температурах реакция практически не идёт, поэтому приходится принимать компромиссное решение. Поскольку для установления оптимального состояния равновесия реакции требуется низкая температура, а для достижения удовлетворительной скорости — высокая температура, на практике процесс проводят при температуре? 400 — 500 оС.
Но даже при такой высокой температуре для достижения достаточной скорости реакции требуется присутствие специального катализатора. В качестве катализатора используется губчатое железо, активированное оксидами калия и алюминия.
Из уравнения реакции видно, что общее число молей уменьшается от 4 до 2. Согласно принципу Ле Шателье в таком случае процесс выгодно проводить, повышая давление. Но этот вывод лишь качественный, анна практике нужно точно знать, насколько увеличится выход NН3 (на 10% или всего на 0,1%) при увеличение давления. В таблице 1 количественно показано влияние температуры и давления на выход аммиака (процентное содержание аммиака в равновесной смеси) по реакции.
Фактический выход каждого конкретного химического процесса может зависеть от целого ряда факторов, главные из них — температура, давление, присутствие катализатора, чистота исходных материалов, эффективность извлечения конечного продукта. Промышленное производство веществ подразумевает отличное знание теоретических закономерностей протекания химических реакций (энергетика химических реакций, химическая кинетика и катализ, химическое равновесие).
Все перечисленные ниже факторы важны, в особенности, если речь идёт о таких многотоннажных производствах, таких, как, например, производство аммиака.
Проектировщики химических предприятий создают сверхмощные установки по производству аммиака. Так, например, созданы установки, производящие 1000-1200 тонн аммиака в сутки. В настоящее время во всём мире ежегодно производится около 5 млн. тонн аммиака.
1. Способы получения аммиака
аммиак цианамидный процесс десульфуратор
Первым промышленным процессом, который использовался для получения аммиака, был цианамидный процесс. При нагревании извести СаО и углерода получали карбид кальция СаС2. Затем карбид нагревали в атмосфере азота и получали цианамид кальция СаСN2; далее аммиак получали гидролизом цианамида:
СаСN2(тв) + 3Н2О = 2NН3↑ + СаСО3(тв)
Этот процесс требовал больших затрат энергии и экономически был невыгоден.
В 1908 г. Немецкий химик Ф. Габер обнаружил, что аммиак можно получать из водорода и атмосферного азота на железном катализаторе. Первый завод по производству аммиака этим методом использовал водород, который получали электролизом воды. В последствии водород стали получать из воды путём восстановления коксом. Такой способ получения водорода намного экономичнее. После открытия Габера стремительно стало расти производство аммиака, это неудивительно, поскольку огромные количества аммиака необходимы для получения азот содержащих удобрений. На изготовление их используется приблизительно 80% всего получаемого в мире аммиака. Вместе с азотсодержащими удобрениями в почву вносится в растворимой форме азот, в котором нуждается большинство растений. Остальные ≈20% производимого аммиака используются для получения полимеров, взрывчатых веществ, красителей и других продуктов.
Современный процесс получения аммиак основан на его синтезе из азота и водорода с использованием специального катализатора:
N2 + 3Н2 ↔ 2NН3 ↑ + 45,9 кДж (1)
Поскольку данная реакция обратимая, возникает вопрос: при каких температурах и давления выгоднее всего добиваться максимального выхода
продукта? Так как реакция экзотермическая, то исходя из принципа Ле Шателье ясно, что чем ниже температура процесса, тем больше равновесие будет сдвигаться в сторону образования аммиака, и можно предположить, что следует максимально понижать температуру. Но в действительности всё обстоит сложнее: при низких температурах реакция практически не идёт, поэтому приходится принимать компромиссное решение. Поскольку для установления оптимального состояния равновесия реакции требуется низкая температура, а для достижения удовлетворительной скорости — высокая температура, на практике процесс проводят при температуре ≈ 400 – 500 оС.
Но даже при такой высокой температуре для достижения достаточной скорости реакции требуется присутствие специального катализатора. В качестве катализатора используется губчатое железо, активированное оксидами калия и алюминия.
Из уравнения реакции видно, что общее число молей уменьшается от 4 до 2. Согласно принципу Ле Шателье в таком случае процесс выгодно проводить, повышая давление. Но этот вывод лишь качественный, анна практике нужно точно знать, насколько увеличится выход NН3 (на 10% или всего на 0,1%) при увеличение давления. В таблице 1 количественно показано влияние температуры и давления на выход аммиака (процентное содержание аммиака в равновесной смеси) по реакции.
Из этой таблицы видно, что повышение температуры при любом давлении заметно снижает содержание аммиака в газовой смеси, однако при температурах ниже 500 оС скорость реакции очень мала, поэтому на практике процесс обычно проводят при температуре 450 оС.
2. Современный процесс получения аммиака
Вторая стадия промышленного синтеза аммиака предполагает конверсию метана (промышленное получение водорода). Конверсия метана — это обратимая реакция, протекающая при 700 – 800 оС и давлении 30 – 40 атм с помощью никелевого катализатора при смешивании метана с парами воды:
СН4 + Н2О ↔ СО + 3Н2 (2)
Образовавшийся по данной реакции водород, казалось бы, уже можно использовать для синтеза аммиака по реакции (1) — для этого необходимо запустить в реактор воздух содержащий азот. Так и поступают на стадии (3), однако на этой стадии происходят другие процессы.
Происходит частичное сгорание водорода в кислороде воздуха:
2Н2 + О2 = Н2О(пар)
СО, образующегося на двух предыдущих стадиях, до СО2 проводят именно по этой реакции:
СО + Н2О(пар) ↔ СО2 + Н2 (3)
КОН + СО2 = К2СО3.
СО + 3Н2 ↔ СН4 +Н2О
Газовую смесь, которая теперь содержит ≈ 75% водорода и 25% азота, подвергают сжатию; давление её при этом возрастает от 25 – 30 до 200 – 250 атм. В соответствии с уравнением Клайперона-Менделеева такое сжатие приводит к очень резкому повышению температуры смеси. Сразу же после сжатия приходиться охлаждать до 350 – 450 оС. Именно этот процесс и описывается с точностью реакцией (1).
Список использованной литературы
АММИАК: ИСТОРИЯ, СОВРЕМЕННОСТЬ И ПЕРСПЕКТИВЫ РАЗВИТИЯ В РОССИИ
Аммиак – один из важнейших продуктов химической промышленности, на котором полностью базируется производство азотных удобрений и азотных соединений. Его производство осуществляют более 80 стран. Мировой выпуск аммиака составляет около 173 млн т/год (2017 г.). Сегодня Россия располагает мощностями в размере более 19 млн т/год (более 10% мирового производства аммиака) и входит в число мировых лидеров, уступая только Китаю.
Промышленное производство аммиака в России берет свое начало с конца 1925 г., когда было начато строительство первого завода по производству синтетического аммиака по технологии итальянской фирмы Casale на Чернореченском химзаводе им. М.И. Калинина. Первая партия аммиака была получена 9 февраля 1928 г. на установке, состоящей их трех колонн диаметром 400 мм, работающих под давлением 74,0 аПа. Производительность каждого аппарата составляла 8 т жидкого аммиака в сутки. В 1932 г. вступил в строй Березниковский завод синтетического аммиака мощностью 30 тыс. т/год, а в 1933 г. – Новомосковский азотно-туковый завод. Проектная мощность этих заводов составляла 25 т/сутки, и для производства азотоводородной смеси использовался метод каталитической конверсии полуводяного газа с водяным паром.
В 1938 г. были введены в строй еще три завода по выпуска аммиака: Горловский, Днепропетровский и Кемеровский, где разделяли коксовый газ методом глубокого охлаждения (–200 о С), а в 1940 г. был введен в строй Чирчикский электрохимический комбинат, где водород получали электролизом воды.
Таким образом, накануне Второй мировой войны в стране работали восемь азотных заводов мощностью 400 тыс. т по производству синтетического аммиака в год. Выработка аммиака в 1940 г. составила 338 тыс. т, что позволило стране занять третье место в мире после Германии и Японии.
Производство аммиака из природного газа в стране получило начало только в 1958 г., при этом в отечественной азотной промышленности для получения азотоводородной смеси использовалась парокислородная каталитическая конверсия природного газа при низком давлении, высокотемпературная кислородная конверсия под давлением 3 МПа и парокислородная каталитическая конверсия синтез-газа производства ацетилена. Впоследствии был внедрен метод двухступенчатого каталитического метода конверсии метана под давлением 3–4 МПа. В настоящее время этот метод является основным методом получения конвертируемого газа для производства аммиака.
В ходе развития производства аммиака значительно выросли единичные мощности агрегатов. Так, если в 1940-х годах они составляли 30 т/сутки, то к началу XXI в. уже 1 360–1 420 т/сутки. В настоящее время –2 700–3 000 т/сутки.
К началу текущего столетия основу производства аммиака в России составляли агрегаты поколения 1970-х годов. Всего в России был построен 31 аммиачный агрегат, в том числе: агрегатов АМ-70 – 6 шт., АМ-76 – 11 шт., ТЕК – 10 шт., Сhemico – 4 шт. На начало 2001 г. установленная мощность по аммиаку в России составляла 14,168 млн т в год, или 63,5% от общей мощности по аммиаку в странах СНГ. В 2000 г. в России было произведено 10,2 млн т аммиака.
Из построенных на территориях бывшего СССР 42-х аммиачных агрегатов третьего поколения мощностью 1 360–1 420 т/сутки более половины (24 шт.) спроектировал бывший Государственный институт азотной промышленности и продуктов органического синтеза (ГИАП). Остальные агрегаты были спроектированы фирмами Toyo Engineering Company (ТЕС, Япония), Creusot Loire (Франция) и Chemico (США). Возраст агрегатов, спроектированных ГИАПом, составлял на начало 2001 г. от 13 до 28 лет. Возраст агрегатов, спроектированных иностранными фирмами, – от 19 до 27 лет (табл. 1).
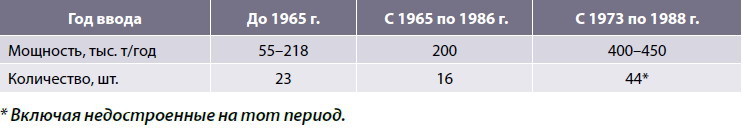
Таблица 1. Классификация аммиачных установок по поколениям (по территории бывш. СССР)
Наиболее активное развитие производство аммиака получило в 1980–1990-х годах, когда на территории СССР были введены 42 агрегата третьего поколения, в том числе 32 на территории России (табл. 2–3).

Таблица 2. Ввод агрегатов третьего поколения по годам, шт.
Все агрегаты третьего поколения были спроектированы по одной и той же технологии, которая включает:
- двухступенчатую десульфуризацию природного газа;
- первичный реформинг природного газа в трубчатой печи;
- вторичный реформинг с воздухом в шахтном реакторе;
- двухступенчатую конверсию монооксида углерода на среднетемпературном и низкотемпературном катализаторах;
- очистку газа от СО2 абсорбцией (МЭА-процесс в установках ГИАПа, Карсол или Бенфилд-процесс в импортных установках);
- метанирование остатков моно- и диоксида углерода;
- синтез аммиака при давлении 27–30 МПа;
- приготовление пара при давлении около 10,5 МПа.
Агрегаты, спроектированные по этой технологии, имели среднегодовое потребление энергии от 10,7 до 11,2 Гкал на тонну аммиака.
Ниже приводятся данные по вводу агрегатов аммиака по предприятиям (табл. 3).
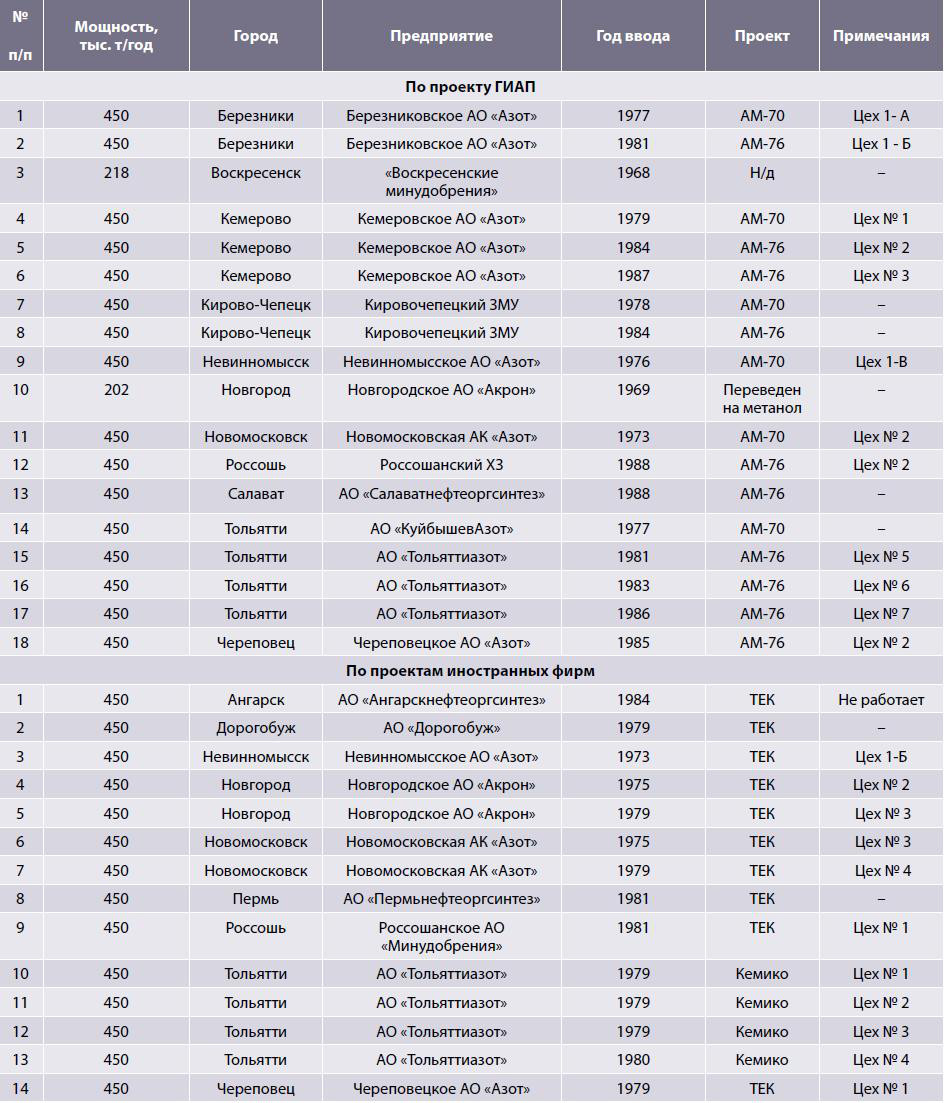
Таблица 3. Перечень аммиачных агрегатов, построенных в России
Начиная с 1991 г. с 1991 г. и вплоть до 1998 г. наблюдалась четкая тенденция к снижению среднегодового показателя использования проектной мощности аммиачных агрегатов. По сравнению с далеко не лучшим пятилетием 1986–1990 гг. этот показатель снизился к 1998 г. в среднем в 1,23 раза, а недогрузка мощностей составила более 30%. С 1999 г. ситуация начала изменяться в положительную сторону, и в 2000 г. показатели использования проектной мощности начали увеличиваться по всем группам агрегатов, что было обусловлено как улучшением конъюнктуры на рынках аммиака и азотных удобрений, так и более надежным снабжением сырьем и энергией (табл. 4).
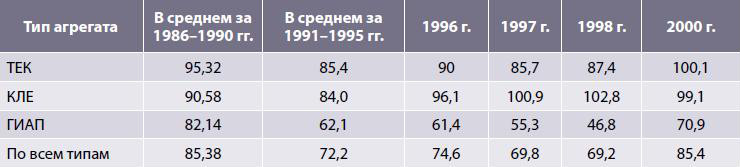
Таблица 4. Среднегодовые показатели использования проектной мощности, %
Таким образом, на начало XXI в. в России была создана мощная промышленность по производству аммиака в объеме 13,2 млн т /год, размещенная во всех регионах страны, за исключением Дальнего Востока, при этом более 60% приходилось на Поволжский, Центральный и Западно-Сибирский экономические районы.
К 2010 г. страна располагала 14,4 млн т мощностей по производству аммиака, на которых было выпущено 13,3 млн т продукта.
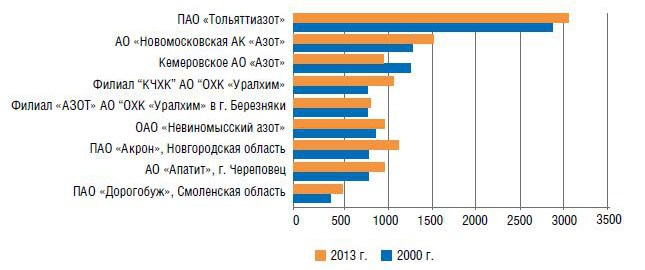
Рис. 1. Размещение производственного потенциала по выпуску аммиака в России по предприятиям в 2000 и 2013 гг., тыс. т/год
За последние пять лет в стране предприятия – производители аммиака провели коренную реконструкцию действующих агрегатов аммиака, а также осуществили ряд новых вводов. В итоге к началу 2019 г. в стране суммарная мощность производств продукта составила более 19,4 млн т, размещенных на 16 предприятиях, а общий объем выпуска аммиака в 2018 г. составил 17,7 млн т.
Модернизацию и расширение мощностей по выпуску аммиака провели:
Как отмечалось выше, основной проблемой производства аммиака в России является норма расхода газа. На выработку 1 т продукта российские агрегаты потребляли около 1,3 тыс. куб. м/т природного газа. Это связано с тем, что большинство российских агрегатов являются устаревшими (введены в эксплуатацию в 1973–1988 гг.) и значительно уступают используемым в передовых странах по энерго- и материалоемкости и экологическим требованиям.
Однако в настоящее время, благодаря вводам новых высокоэффективных производственных мощностей, а также модернизации или техперевооружению уже имеющихся, норма расхода газа уменьшилась и в среднем по России стала составлять 1,1 тыс. куб. м/т.
За последние шесть лет производство аммиака в России существенно выросло. Так, ежегодно наращивая объемы производства аммиака, отечественные производители за этот период увеличили производство на 22,7% (рис. 2).
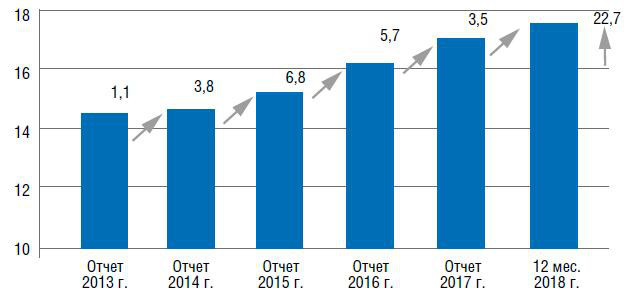
Рис. 2. Динамика производства аммиака в России в 2013–2018 г., млн т (есть исправления на рис.)
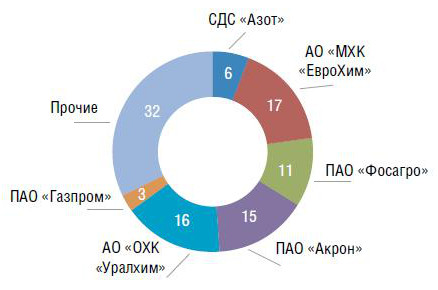
Рис. 3. Структура производства аммиака по холдингам за 2018 г.,%
В структуре рынка аммиака преобладает внутренний рынок, доля экспортных поставок не превышает 25%. Однако за последние годы темпы роста экспорта превышали темпы роста потребления продукта на внутреннем ранке (рис. 4).
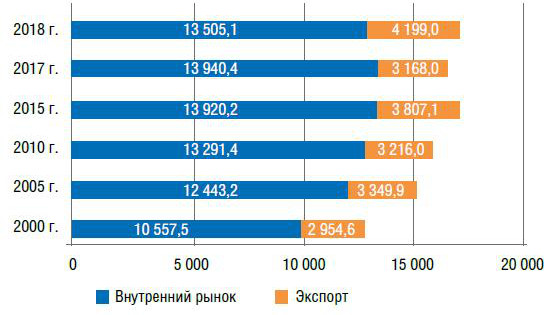
Рис. 4. Динамика рынка аммиака за 2000–2018 гг., тыс. т
Основное направление использования аммиака в стране – сырье для производства азотной кислоты, азотных удобрений, метанола и капролактама. Кроме того, он применяется в медицине, холодильной технике, биотехнологии и других областях промышленности.
Увеличение объемов внутреннего рынка аммиака в России происходит в основном за счет строительства новых производств удобрений и расширения действующих перерабатывающих производств, таких как карбамид и других азотных продуктов. Так, 35% потребляемого в России аммиака используется для производства карбамида, чуть меньше – в производстве слабой азотной кислоты (27%) и аммиачной селитры (около 17%). На производство всех видов сложных удобрений приходится около 17% потребляемого в России аммиака (рис. 5).
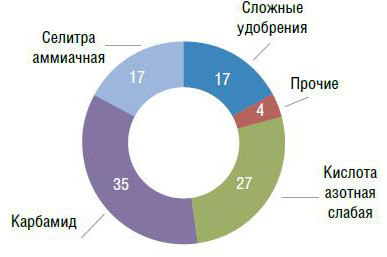
Рис. 5. Структура потребления аммиака на внутреннем рынке, %
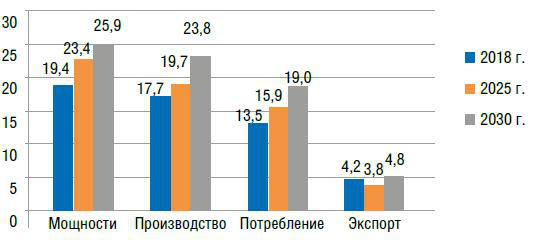
Рис. 6. Прогноз развития рынка аммиака на период до 2030 г. (реалистичный вариант), млн т
Основной перспективной задачей, стоящей перед производителями аммиака, является наращивание выпуска конкурентоспособной продукции для реализации на внутреннем и внешнем рынках. Для этого уже в ближайшие годы будет продолжены работы по реконструкции и модернизации действующих мощностей, направленные на снижение материальных и энергетических затрат, повышение надежности оборудования и оптимизации других затрат в производстве аммиака.
В перспективе предусматривается увеличение выпуска на базе собственных ресурсов сырья. При этом темпы роста производства аммиака составят 133% от уровня текущего года.
Развитие производства аммиака предполагается осуществлять за счет прироста выпуска его как на действующих мощностях, так и за счет строительства новых современных производств.
Однако в перспективе снижение себестоимости аммиака в результате мероприятий по модернизации и вводу новых мощностей произойдет не в полной мере, что делает неприемлемым установление внутренней цены на природный газ на уровне мировой цены.
Сегодня внутренняя цена природного газа обеспечивает конкурентоспособность отечественных продуктов азотной промышленности на мировом рынке. В то же время при мировом уровне внутренней цены на природный газ отечественные продукты азотной промышленности становятся неконкурентоспособными на мировом рынке.
Поэтому необходимо обеспечить снижение издержек в азотном производстве путем проведения модернизации мощностей, прежде всего аммиака, поскольку он служит исходным сырьем для получения азотных удобрений – аммиачной селитры и карбамида, причем расходный коэффициент по природному газу на тонну аммиака необходимо снизить не менее чем на 20%.
Перспективы развития отечественной аммиачной промышленности в среднесрочной перспективе будут зависеть от многих факторов: роста цен на сырье и энергоносители, транспортных тарифов, наличия средств на реконструкцию, улучшения платежеспособности отечественных потребителей.

Аммиак (NH3) – соединение азота и водорода. Это лёгкий газ с резким запахом. Получение аммиака в промышленности и лабораториях необходимо для производства удобрений, полимеров, азотной кислоты и других веществ.
В промышленности
Аммиак промышленным путём получают из азота, соединяя его с водородом. Азот берут из воздуха, водород – из воды. Впервые метод разработал немецкий химик Фриц Габер. Промышленный способ получения аммиака стали называть процессом Габера.
Реакция проходит с уменьшением объёма и выделением энергии в виде тепла:
Реакция обратима, поэтому необходимо соблюсти несколько условий. При высоком давлении и низких температурах объём полученного аммиака увеличивается. Однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
Опытным путём были найдены необходимые условия для проведения реакции:
- температура – 500°C;
- давление – 350 атм;
- катализатор – оксид железа Fe3O4 (магнетит) с примесями оксидов серебра, калия, кальция и других веществ.
При таких условиях получившийся газ содержит 30 % аммиака. Чтобы избежать обратной реакции, вещество быстро охлаждают. При низких температурах получившийся газ превращается в жидкость. Неизрасходованные газы – азот и водород – возвращаются обратно в колонну для синтеза. Такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.
Чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
В лаборатории
Для получения аммиака в лаборатории используется реакция щелочей на соли аммония:
Также аммиак лабораторным путём можно получить из хлорида аммония, нагретого вместе с гашёной известью, или разложением гидроксида аммония:

Рис. 2. Получение аммиака в лаборатории.
Полностью осушить аммиак можно с помощью смеси извести с едким натрием, через которую пропускают полученный газ. Для этой же цели жидкий аммиак смешивают с металлическим натрием и подвергают дистилляции.
Аммиак легче воздуха, поэтому для его сбора пробирку держат вверх дном.
Применение
Аммиак используется в разных отраслях:
- в сельском хозяйстве – для производства азотсодержащих удобрений;
- в промышленности – для производства полимеров, взрывчатых веществ, искусственного льда;
- в химии – для изготовления азотной кислоты, соды;
- в медицине – в качестве нашатырного спирта.
Что мы узнали?
Аммиак получают промышленным и лабораторным путём. Для получения в промышленных масштабах используется азот и водород. Смешиваясь под высокой температурой, давлением и под действием катализатора, простые вещества образуют аммиак. Чтобы реакция при высокой температуре не пошла в обратную сторону, газ охлаждают. В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.
Читайте также:

