Сообщение об оксиде h2o
Обновлено: 17.05.2024
Вода, или оксид (окись) водорода Н2О – важнейшая среда, в которой проходят все химико-биологические реакции. На 65-70 % организмы животных и человека состоят из воды. Ее содержание в растениях еще выше – 90 %. Вода – это основа жизни.
Строение воды
Вода – неорганическое соединение с формулой Н2О. Она состоит из кислородного атома, который связан с двумя водородными атомами. Угол между атомами Н-О-Н составляет 104,5˚.
Кислород – электроотрицательный элемент, к которому смещены общие электронные пары. На кислороде возникает частично отрицательный заряд, а на водороде – частично положительный. Вода – электрический диполь. Многие свойства воды обусловлены ее полярностью.
Молекулы воды между собой образовывают водородные связи, которые объясняют высокую плотность и температуру кипения. Чем выше температура реакции, тем меньшее количество связей образуется.
Физические свойства воды
- Температура кипения 100˚С (при давлении 101,3 кПа).
- Температура замерзания 0˚С.
- Максимальная плотность воды (характерна при 4˚С) 1 г/см3.
Лед всегда всплывает в водоемах или стаканах с водой. Это связано с тем, что плотность горячей и холодной воды отличается. Лед обладает меньшей плотностью, чем жидкая вода.
Воде свойственна высокая теплоемкость, поэтому она медленно нагревается и остывает. С помощью теплофизических свойств воды регулируется климат. Водные бассейны регулируют температуру на нашей планете. Вода задерживает до 60 % теплового излучения нашей планеты, не позволяя ей охлаждаться.
Теплопроводность воды небольшая. Вода в водоемах нагревается не с помощью молекулярной теплопроводности, а путем перемешивания с помощью волн и течений. Если вода не перемешивается, то она нагревается частями и образуется термическая слоистость (стратификация).
Физсвойства воды отражаются в агрегатных состояниях:
- Н2О – молекула парообразной воды (гидроль);
- (Н2О)2 – молекула жидкой воды (дигидроль);
- (Н2О)3 – молекула твердой воды (тригидроль).
В химии физические свойства воды отражаются в количестве связей между молекулами. В парах находятся отдельные молекулы, в жидкостях между ними образуются водородные связи. Если вода находится в состоянии льда, то каждая молекула соединена с соседними молекулами с помощью четырех водородных связей.
Растворимость веществ в воде
- Хорошо растворимые – в 100 мл воды растворяется более 1 г вещества (сахар).
- Малорастворимые – в 100 мл воды растворяется 0,01-1 г вещества (гипс).
- Нерастворимые – в 100 мл воды растворяется менее 0,01 вещества (хлорид серебра (I)).
Большинство твердых веществ при нагревании растворяется быстрее. Растворимость газов повышается при понижении температуры и повышении давления.
Растворение многих веществ в воде сопровождается образованием оболочки из молекул воды. Данный комплекс называется гидратом. После кристаллизации в составе таких комплексов сохраняется часть молекул воды, образуя кристаллогидрат:
Растворы
- насыщенные (вещество в растворе больше не растворяется при определенной температуре);
- ненасыщенные (вещество продолжает растворяться при определенной температуре).
Химические свойства воды
- Со щелочными и щелочно-земельными металлами
- 2 Na + 2 H2O = 2 NaOH + H2↑
- С металлами при нагревании
- Fe + 4 H2O = Fe3O4 + 4 H2↑
- С неметаллами при нагревании
- С + Н2О = СО↑ + Н2↑
- С оксидами активных металлов
- Li2O + H2O = 2 LiOH
- С оксидами неметаллов
- SO3 + H2O = H2SO4
Вода может разлагаться под действием электрического тока или температуры в 2000˚С.
2 Н2О → 2 Н2↑ + О2↑
- SO3 + H2O = H2SO4
Вода – важнейший компонент такой реакции как гидролиз. Гидролиз – взаимодействие соли с водой, в результате которого происходит ионный обмен между молекулами.
Очистка воды
Вода – самое распространенное вещество на нашей планете. Она наполняет океаны, моря, озера. Пары воды входят в состав воздуха. Природная вода всегда содержит различные примеси. В зависимости от целей использования применяют различные способы очистки воды.
В питьевой воде не должны содержаться примеси и болезнетворные бактерии. Чтобы вода из озер и рек была пригодна для питья, ей дают отстояться в специальных бассейнах. Затем ее фильтруют через слой песка. Очищенную от нерастворимых веществ воду обрабатывают хлором, озоном или ультрафиолетовыми лучами.
Для очищения воды от растворенных в ней веществ используют перегонку, или дистилляцию. Этим способом получают дистиллированную воду. Ее применяют в лабораториях, аптеках, охладительных системах машин и т. д.
Применение воды
Воду используют в промышленности, сельском хозяйстве и быту. В химическом производстве она является важнейшим сырьем для получения водорода. При получении оснований и кислот применяется способность воды вступать в реакции с некоторыми оксидами. Также вода часто выступает в роли растворителя.
Развитие промышленности привело к тому, что многие водоемы загрязнены отходами производства. Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию природных ресурсов.
Вода – важный ресурс для всего живого на планете. Если ее запасы на Земле иссякнут, то растения, животные и человек погибнут. Вода является более ценным природным богатством, чем нефть и газ, железо и уголь и т. д. Это связано с тем, что воду невозможно ничем заменить.
ВОДА – оксид водорода H2O.
В течение многих столетий вода считалась простым веществом. Лишь в 1783 французский химик Антуан Лоран Лавуазье (1743–1794) сумел разложить ее. Он показал, что вода состоит из водорода и кислорода, а в 1789 дал первую оценку ее количественного состава: 15% водорода и 85% кислорода. В дальнейшем количественный анализ воды проводили многие ученые. Долгое время образцовыми считались результаты французского химика и физика Жозефа Луи Гей-Люссака (1778–1850), полученные около 1808: 13,27% водорода и 86,73% кислорода. Только в 1821 шведский химик Йенс Якоб Берцелиус (1779–1848) и французский физик и химик Пьер Луи Дюлонг (1785–1838) сделали более правильный анализ воды и нашли, что она содержит 11,1% водорода и 88,9% кислорода, что очень близко к современным значениям (11,19% водорода и 88,81% кислорода).
Изучая объемные отношения реагирующих газов, Гей-Люссак показал, что один объем кислорода и два объема водорода при взаимодействии дают два объема водяного пара (при температуре выше 100° С). На основании этих результатов с учетом закона Авогадро был сделан вывод, что две частицы водяного пара образуются из одной частицы кислорода и двух частиц водорода. Таким образом была выведена формула воды H2O.
На нашей планете вода играет очень важную роль. В природе она совершает непрерывный круговорот. Под влиянием солнечной энергии жидкая вода (главным образом, в теплых морях и океанах) превращается в пар, который поднимается в верхние слои атмосферы. Это происходит благодаря тому, что водяной пар легче воздуха. Так происходит образование облаков, которые ветрами переносятся в другие части планеты, где в виде дождя и других осадков вода попадает на поверхность земли. Здесь она образует ручьи и реки, которые возвращают испаренную воду в океаны (рис. 1).

Чистой воды в природе нет. Даже наиболее чистая дождевая вода при падении через атмосферу растворяет газы и захватывает пыль. При ее испарении всегда остается небольшой остаток – около 0,03 г на литр. На поверхности земли вода дополнительно растворяет многие твердые вещества. Часть ее впитывается в почву. В глубине земли продолжается растворение различных веществ, так что при выходе на поверхность вода иногда образует минеральные источники. Ключевая и колодезная вода от растворенных в ней солей часто бывает жесткой.
Речная (пресная) вода содержит до 0,5 г растворенных солей в одном литре. В конце концов, все это попадает в море. Таким образом, море, испаряя чистую воду, получает взамен воду с растворенными в ней веществами. Количество солей, поставляемое реками в моря и океаны, огромно. Так, река Дон ежегодно вносит в Азовское море около 16 млн. т солей, Дунай в Черное море – 9 млн. т.
В океанской воде содержится около 35 г солей в литре. Столько же имеется в водах большинства морей. Однако для закрытых морей встречаются отклонения от средней солености, связанные с числом впадающих рек, средней температурой и другими факторами. Балтийское море содержит лишь 3–8 г солей на литр, а Красное – до 45 г. В соленых озерах содержание солей может быть намного больше: в Мертвом море – 228 г в одном литре, в оз. Эльтон – 270 г. В морской воде растворен, в основном, хлорид натрия; кроме того, имеются и другие соли натрия, магния, кальция.
Для научной работы, а также для фармацевтических и других целей, воду перегоняют (рис. 2). Для этого ее превращают в пар, который затем охлаждают, получая чистую дистиллированную воду. Примеси остаются в перегонном сосуде.

Молекула воды имеет угловое строение с длиной связи О–Н 96 пм и валентным углом Н-О-Н 104,5°. Молекула воды полярна, ее дипольный момент равен 1,86 Д.(Д –дебай, 1 Д = 3,34·10 -30 Кулон·м).
| H2O | D2O | |
| t плав.,°С | 0,0 | 3,8 |
| t кип., °С | 100,0 | 101,4 |
Свойства воды служат точкой отсчета для многих физических величин. Так, температуры замерзания и кипения воды лежат в основе шкалы Цельсия. Один литр – это объем 1 кг чистой воды, взвешенной при +4 °С (при этой температуре вода имеет максимальную плотность).
Многие физические свойства воды аномальны по сравнению с другими жидкостями. Одной из причин этого служат малые размеры молекул воды – минимальные среди всех жидких веществ при обычных условиях. Однако наиболее важным свойством воды является ее способность образовывать прочные водородные связи.
В водяном паре при температуре кипения и атмосферном давлении присутствует около 1% димеров, в которых молекулы воды объединены в пары водородными связями. В жидком и твердом состоянии каждая молекула воды образует четыре водородные связи: две как донор протонов и две – как акцептор протонов. Водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 3.).

Если бы водородных связей не было, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов. Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. При 0°С плотность льда (0,9168 г/см 3 ) меньше, чем плотности жидкой воды (0,9998 г/см 3 ), поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Чтобы превратить воду в пар, надо затратить много энергии – около 44 кДж/моль. При обратном переходе пара в жидкую воду выделяется то же количество теплоты.
Вода устойчива при нагревании вплоть до 1000°С. При более высоких температурах она частично разлагается на водород и кислород. Эти же продукты образуются при электролизе воды.

Под действием УФ-излучения вода распадается на ионы Н + и ОН – , а под действием ионизирующего излучения радиоактивных веществ – образует Н2, Н2О2 и свободные радикалы Н*, ОН*, НО2*.
Вода вступает в химическое взаимодействие со многими простыми веществами. Большинство таких реакций протекает при высокой температуре. Только наиболее активные металлы (щелочные и щелочноземельные) и неметаллы (галогены) реагируют с водой при комнатной температуре. Однако при одновременном воздействии воды и окислителей даже при обычной температуре происходит разрушение металлов средней активности (таких как железо) в результате коррозии.
Очень сильными восстановителями вода восстанавливается до водорода, очень сильными окислителями – окисляется до кислорода.
Вода взаимодействует со многими основными оксидами с образованием гидроксидов. В реакциях воды с большинством кислотных оксидов образуются кислоты.
РЕАКЦИИ ВОДЫ
| С простыми веществами: | |
| металлами | неметаллами |
| 2Na + 2H2O = 2NaOH + H2 | Cl2 + H2O⇋ HCl + HClO |
| 2Fe + 3H2O = Fe2O3 + 3H2 (600 °C) | H2O + C ⇋ CO + H2 (800–1000 °C) |
| С оксидами: | |
| основными | кислотными |
| CaO + H2O = Ca(OH)2 | SO3 + H2O = H2SO4 |
| Na2O + H2O = 2NaOH | N2O5 +H2O = 2HNO3 |
| Термическое разложение: 2Н2О⇋ 2Н2 + О2 | |
Некоторые сложные вещества полностью разлагаются водой – подвергаются необратимому гидролизу:
Вода хорошо растворяет многие вещества, имеющие ионное строение (соли, щелочи), а также вещества, молекулы которых полярны. Наличие в жидкой воде ассоциатов (элементов кристаллической структуры) наряду с большим дипольным моментом молекул приводит к высокой диэлектрической проницаемости воды (ε = 78,3 при 25 °С). Это вызывает заметное ослабление кулоновского притяжения в водной среде, а, следовательно, способствует электролитической диссоциации ионных и полярных ковалентных соединений. При этом полярные молекулы воды участвуют в процессе гидратации за счет притяжения соответствующих полюсов полярных молекул воды к образующимся катионам и анионам. В ряде случаев образующиеся связи являются настолько прочными, что можно говорить о возникновении аквакомплексов. Аквакомплексы обнаружены не только в водных растворах, но и во многих кристаллических структурах.
Твердые вещества, как правило, лучше растворяются при нагревании. При этом вещества с очень прочной кристаллической решеткой мало растворимы в воде. К ним относятся хлориды, бромиды и иодиды серебра и свинца, сульфаты щелочноземельных металлов и свинца, большинство гидроксидов, сульфидов, ортофосфатов и карбонатов металлов.
Газы обычно плохо растворяются в воде. Исключение составляют газообразные вещества, взаимодействующие с водой, например аммиак, хлороводород или диоксид серы. Растворимость всех газов возрастает при увеличении давления и, как правило, понижается при нагревании.
В жидкой воде одна из каждых 10 миллионов молекул диссоциирует, образуя ионы: катионы водорода Н + и гидроксид-ионы ОН – :
Н2О ⇋ Н + + ОН –
Чистая вода содержит одинаковую молярную концентрацию катионов водорода Н + и гидроксид-ионов ОН – , и среда ее нейтральна. Однако при растворении многих веществ в воде концентрации ионов Н+ и ОН– изменяются. Если увеличивается концентрация катионов водорода, среда становится кислотной. При увеличении концентрации гидроксид-ионов среда становится щелочной. Определить характер среды можно с помощью индикаторов.
| Индикатор | Кислотная среда | Нейтральная среда | Щелочная среда |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
Основания диссоциируют в водном растворе с образованием гидроксид-ионов, создавая щелочную среду:
NaOH = Na + + OH – (сильное основание)
NH3 . H2O ⇋ NH4+ + OH– (слабое основание)
При диссоциации кислот в растворе образуются катионы водорода, и среда становится кислотной.
H2SO4 = 2H+ + SO4 2– (сильная кислота)
H2CO3 ⇋ H + + HCO3 – (слабая кислота)
| Вещества | Сильные | Слабые |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2 | NH3 |
| Кислоты | HCl, HBr, HI, H2SO4, HNO3 | H3PO4, H2CO3, H2S |
Соли при растворении в воде диссоциируют на катионы металла и анионы кислоты. Растворы многих солей имеют кислотную или щелочную среду за счет обратимого гидролиза по катиону или по аниону (см. ГИДРАТАЦИЯ, ГИДРАТЫ, ГИДРОЛИЗ).
Вода является жизненно важным веществом. Она является обязательным компонентом всех живых существ. Организм взрослого человека массой 65 кг содержит до 40 кг воды. Вода является растворителем, составной частью клеток, участником биохимических реакций. Она играет важную роль в терморегуляции. У взрослого человека суточная потребность в воде составляет примерно 2,4 кг. Сюда включается вода, поступающая в организм с твердой и жидкой пищей, в виде напитков, а также вода, образующаяся в результате дыхательных процессов (около 300 г).
Человек чрезвычайно остро ощущает изменения содержания воды в организме и может прожить без воды лишь несколько суток. Потеря 10–20% воды опасна для жизни. В то же время избыток воды приводит к перегрузке сердечно-сосудистой системы, потере солей.
Очень важен минеральный состав питьевой воды. Человек употребляет для питья воду, содержащую от 0,02 до 2 г минеральных веществ на 1 л. Большое значение имеют вещества, находящиеся в малых концентрациях, но играющие важную роль в физиологических процессах организма. Например, длительное употребление питьевой воды, содержащей фтора менее 0,6 мг/л, ведет к кариесу зубов, а потребление воды с концентрацией фтора более 1 мг/л вызывает флюороз.
Если в питьевую воду попадают возбудители инфекционных заболеваний, она может явиться фактором их распространения. Многие возбудители кишечных инфекций сохраняют свою жизнеспособность в воде в течение нескольких месяцев.
При определении качества питьевой воды немаловажное значение имеют свойства, воспринимаемые органами чувств (органолептические свойства): температура, прозрачность, цвет, запах, вкус, жесткость. Питьевая вода должна быть безопасной в эпидемиологическом отношении, безвредной по химическому составу, благоприятной по органолептическим свойствам. Чтобы использовать для питья природную воду, ее обычно очищают. С этой целью применяют как физические (фильтрование, отстаивание), так и химические (хлорирование, озонирование) методы.
В 1 мл питьевой воды должно быть не более 100 микроорганизмов (число бактерий группы кишечных палочек – не более 3). Не менее жесткие ограничения накладываются на содержание химических веществ.
| Алюминий 0,5 | Полифосфаты 3,5 |
| Бериллий 0,002 | Свинец 0,03 |
| Железо 0,3 | Селен 0,001 |
| Марганец 0,1 | Стронций 7,0 |
| Медь 1,0 | Сульфаты 500,0 |
| Молибден 0,25 | Фтор 0,7–1,5 (для различных климатических районов) |
| Мышьяк 0,05 | Хлориды 350,0 |
| Нитраты 45,0 | Цинк 5,0 |
| Полиакриламид 2,0 |
Общая жесткость питьевой воды должна быть не выше 7,0 ммоль/л, а сухой остаток – 1000 мг/л. Значения рН не должны выходить за пределы 6,0–9,0.
Ресурсы питьевой воды не безграничны. Проблема обеспечения питьевой водой растущего народонаселения является одной из наиболее острых экологических проблем современности. На возобновляемые водные ресурсы – речной сток воды – оказывает влияние не только растущее загрязнение окружающей среды, но и глобальное потепление климата Земли. Хотя в ряде районов России увеличение количества атмосферных осадков и повышение температуры воздуха в холодное время года благоприятно отражаются на стоке воды рек, на северо-западе и юге нашей страны наметилась тенденция к уменьшению количества ежегодно возобновляющихся водных ресурсов.
Для предотвращения водного кризиса, помимо усиления административных мер по охране природных ресурсов, необходимо экологическое образование население. Это должно помочь правильному восприятию взаимосвязей между всеми сферами Земли, включая ее водную оболочку.
Кольман Я., Рём К.-Г. Наглядная биохимия (перевод с нем.) – М., Мир, 2000
Третьяков Ю.Д. и др. Неорганическая химия. Химия элементов: Учебник для вузов: В 2 книгах. М.: Химия, 2001.
Химия и общество (перевод с англ.) – М., Мир, 1995
Человек и среда его обитания. Хрестоматия. – М., Мир, 2003
Портал Проза.ру предоставляет авторам возможность свободной публикации своих литературных произведений в сети Интернет на основании пользовательского договора. Все авторские права на произведения принадлежат авторам и охраняются законом. Перепечатка произведений возможна только с согласия его автора, к которому вы можете обратиться на его авторской странице. Ответственность за тексты произведений авторы несут самостоятельно на основании правил публикации и законодательства Российской Федерации. Данные пользователей обрабатываются на основании Политики обработки персональных данных. Вы также можете посмотреть более подробную информацию о портале и связаться с администрацией.
© Все права принадлежат авторам, 2000-2022. Портал работает под эгидой Российского союза писателей. 18+
Самое важное и распространенное на нашей планете вещество, безусловно, вода. Что может сравниться с ней по значимости? Известно, что жизнь на Земле стала возможна только с появлением жидкости. Что же собой представляет вода (оксид водорода) с химической точки зрения? Из чего состоит и какими свойствами обладает? Попробуем разобраться в данной статье.

Водород и его соединения
Самый легкий атом во всей периодической системе - водород. Он же занимает двойственное положение, располагаясь как в подгруппе галогенов, так и и первой группе щелочных металлов. Чем объясняются такие особенности? Электронным строением оболочки его атома. У него всего один электрон, который свободно может как уходить, так и присоединять себе еще один, формируя пару и завершая внешний уровень.
Именно поэтому основные и единственные степени окисления данного элемента +1 и -1. Он легко вступает во взаимодействие с металлами, образуя гидриды - твердые нелетучие солеподобные соединения белого цвета.
Однако также легко водород формирует и летучие молекулы веществ, взаимодействуя с неметаллами. Например:
В целом соединений водород формирует достаточно много. Однако самым важным веществом, в состав которого он входит, является оксид водорода, формула которого Н2О. Это самое известное соединение, которое узнает по формуле даже ученик начальных классов, еще не знакомый с химией. Ведь вода (а это и есть высший оксид водорода) - не только распространенное вещество, но и источник жизни на нашей планете.
Само название элемента отражает его главную сущность - водород, то есть "рождающий воду". Как и любой другой оксид, данный также является бинарным соединением, обладающим рядом физических, химических свойств. Кроме того, имеются и особые характеристики, отличающие воду от всех других соединений.
Также важным классом соединений, которые образует водород, являются кислоты, как органические, так и минеральные.

Химические свойства водорода
С точки зрения химической активности, водород - достаточно сильный восстановитель. Во многих реакциях он проявляет именно такие свойства. Однако при взаимодействии с еще более сильными металлами, он становится окислителем.
Очень важным в промышленности является взаимодействие водорода с оксидами металлов. Ведь это один из способов получения последних в чистом виде. Водородотермия - это металлургический метод синтеза чистых металлов из их оксидов путем восстановления водородом.
Реакция водорода с оксидом имеет следующий общий вид: MexOy + H2 = H2O + Me.
Конечно, это далеко не единственный способ синтеза чистых металлов. Существуют и другие. Однако восстановление оксидов водородом - энергетически достаточно выгодный и несложный производственный процесс, нашедший себе широкое применение.
Также интересна та особенность, что при смешении с воздухом газ водород способен образовывать сильно взрывчатую смесь. Ее название гремучий газ. Для этого смешивание следует производить из расчета два объема водорода на один кислорода.
Вода - оксид водорода
То, что данный оксид очень важный, мы уже несколько раз упомянули. Теперь давайте охарактеризуем его с точки зрения химии. Действительно ли данное соединение относится именно к этому классу неорганических веществ?
Для этого попробует немного иначе записать формулу: H2O = НОН. Суть та же, количество атомов прежнее, однако, теперь очевидно, что перед нами гидроксид. Какими свойствами должен он обладать? Рассмотрим диссоциацию соединения:
Следовательно, свойства кислотные, так как в растворе присутствуют катионы водорода. К тому же основными они быть не могут, ведь щелочи формируют только металлы.

Поэтому еще одно название, которое имеет водорода оксид - кислородсодержащая кислота самого простого состава. Раз такие сложные переплетения характерны для данной молекулы, следовательно, и свойства ее будут особенными. А свойства отталкиваются от строения молекулы, поэтому его и разберем.
Строение молекулы воды
Впервые о данной модели задумался Нильс Бор, ему и принадлежит первенство и авторство в этом вопросе. Им были установлены следующие особенности.
- Молекула воды - диполь, так как элементы, входящие в ее состав сильно отличаются по значению электроотрицательности.
- Форма ее треугольная, в основании - водороды, а в вершине - кислород.
- Благодаря такому строению, данное вещество способно формировать водородные связи, как между одноименными молекулами, так и с другими соединениями, имеющими в составе сильно электроотрицательный элемент.
Посмотреть, как схематически выглядит рассматриваемый водорода оксид, можно на фото ниже.
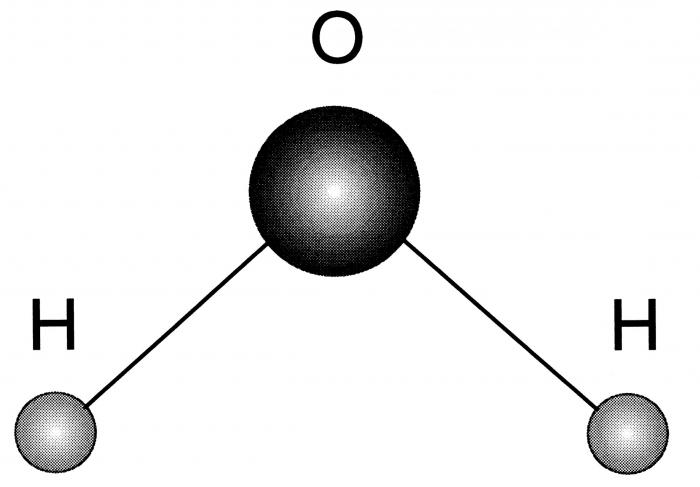
Физические свойства оксида водорода
Можно обозначить несколько основных характеристических черт.
- Агрегатное состояние: газообразное - пар, жидкое, твердое - снег, лед.
- Температура кипения - 100 0 С (99,974).
- Температура плавления - 0 0 С.
- Вода способна сжиматься при нагревании в интервале температур от 0-4 0 С. Этим объясняется образование льда на поверхности, который имеет меньшую плотность и сохранение жизни под толщей оксида водорода.
- Высокое значение теплоемкости, однако очень низкая теплопроводность.
- В жидком состоянии водорода оксид проявляет вязкость.
- Особенным свойством можно назвать поверхностное натяжение и формирование отрицательного электропотенциала на поверхности воды.
Как мы отмечали выше, особенности свойств зависят от строения. Так и здесь. Способность формировать водородные связи привела к подобным чертам данного соединения.
Водорода оксид: химические свойства
С точки зрения химии, активность воды достаточно высока. Особенно если речь идет о реакциях, сопровождаемых нагреванием. С чем способен вступать во взаимодействие оксид водорода?
- С металлами, которые в ряду напряжений стоят до водорода. При этом с самыми активными (до алюминия) не нужны особые условия, а обладающие более низкой восстановительной способностью реагируют только с паром. Те же, что стоят после водорода, вообще не способны вступать в подобные взаимодействия.
- С неметаллами. Не со всеми, однако с большинством. Например, в атмосфере фтора вода сгорает фиолетовым пламенем. Также реакция возможна с хлором, углеродом, кремнием и другими атомами.
- С оксидами металлов (основными) и кислотными (неметаллов). Образуются, соответственно, щелочи и кислоты. Среди металлов к таким реакциям способны представители первых двух групп главных подгрупп, кроме магния и бериллия. Неметаллы, образующие кислотные оксиды, взаимодействуют с водой все. Исключением является речной песок - SiO2.
Уравнение реакций оксида водорода в качестве примера можно привести следующее: SO3 + H2O = H2SO4.

Распространение в природе
Мы уже выяснили, что данное вещество - самое распространенное в мире. Обозначим процентное содержание в объектах.
- Около 70% от массы тела человека и млекопитающих животных. Некоторые представители фауны состоят из оксида водорода примерно на 98% (медузы).
- 71% Земли покрыт водой.
- Наибольшая масса составляет воды Мирового океана.
- Около 2% содержится в ледниках.
- 0,63% сосредоточено под землей.
- 0,001% приходится на атмосферу (туман).
- Тело растений состоит на 50% из воды, некоторых видов даже больше.
- Многие соединения встречаются в виде кристаллогидратов, содержащих связанную воду.
Продолжать данный список можно долго, ведь сложно вспомнить хоть что-нибудь, в состав чего не входит вода или когда-то не входила. Либо образовалось без участия этого оксида.

Способы получения
Получение оксида водорода промышленного значения не имеет. Ведь проще использовать готовые источники - реки, озера и прочие водоемы, чем затрачивать огромное количество энергии и реактивов. Поэтому в лаборатории уместно лишь получение дистиллированной, особо чистой воды.
Для этих целей используют определенные аппараты, такие как перегонные кубы. Такая вода необходима для проведения многих химических взаимодействий, так как неочищенная содержит большое количество посторонних примесей, солей, ионов.
Биологическая роль
Сказать, что вода используется везде, не сказать ничего. Немыслимо представить свою жизнь без этого соединения. С самого утра и до самой ночи человек постоянно использует его как в бытовых, так и промышленных целях.
Свойства оксида водорода подразумевают использование его как универсального растворителя. Причем не только в лаборатории. Но и в живых существах, где ежесекундно происходят тысячи биохимических реакций.

Также вода сама является участником многих синтезов, она же служит побочным продуктом, образующимся в результате них. Каждый человек на Земле за 60 лет пропускает через себя около 50 тонн этого удивительного вещества!
Оксид водорода используется:
- во всех отраслях промышленности;
- медицине;
- химических синтезах;
- во всех видах производств;
- бытовых нуждах;
- сельском хозяйстве.
Сложно определить область жизни, в которой можно обойтись без воды. Единственными живыми существами, не имеющими оксид водорода в своем составе и живущими без него, являются вирусы. Именно поэтому человеку сложно бороться с этими организмами.
Читайте также:

