Сообщение о сероводороде применении значении в жизни человека
Обновлено: 05.07.2024
Сероводород из-за своей токсичности находит ограниченное применение.
В аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы.
В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод.
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов.
Используют в органическом синтезе для получения тиофена и меркаптанов.
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
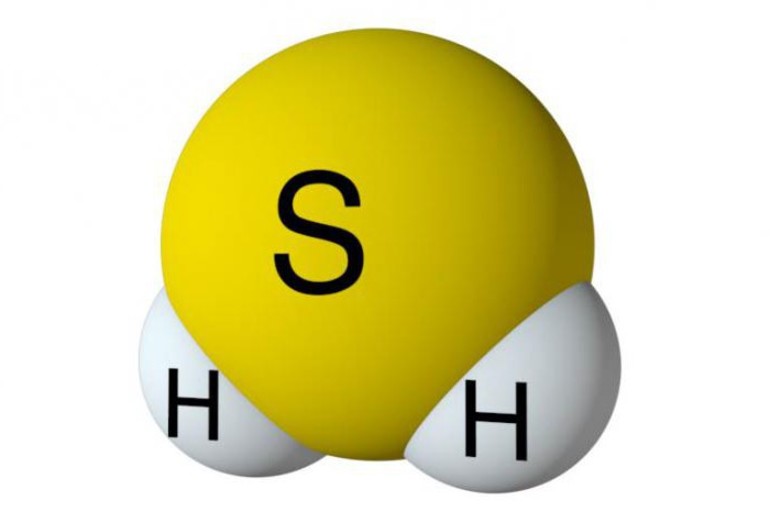
Сернистый водород, или гидросульфит, представляет собой сладковатый газ без цвета с запахом тухлых яиц. Он является двоичным соединением серы и водорода, для обозначения применяется формула H2S. Ядовитый и огнеопасный газ используется в производстве серы, сульфидов и серной кислоты, применяется для лечебных ванн.
Общее описание
Вещество в природных условиях встречается в смеси нефтяных газообразных углеводородов, содержится в составе вулканических выделений. В водной среде находится в форме раствора, например, в Черном море содержится в толще воды на глубине более 200 м. Гидросульфит выделяется в процессе разложения белков, которые имеют в составе цистеин или метионин (аминокислоты с содержанием серы). Малое количество сернистого водорода выделяется из кишечных газов животных и человеческих организмов.
Физические характеристики

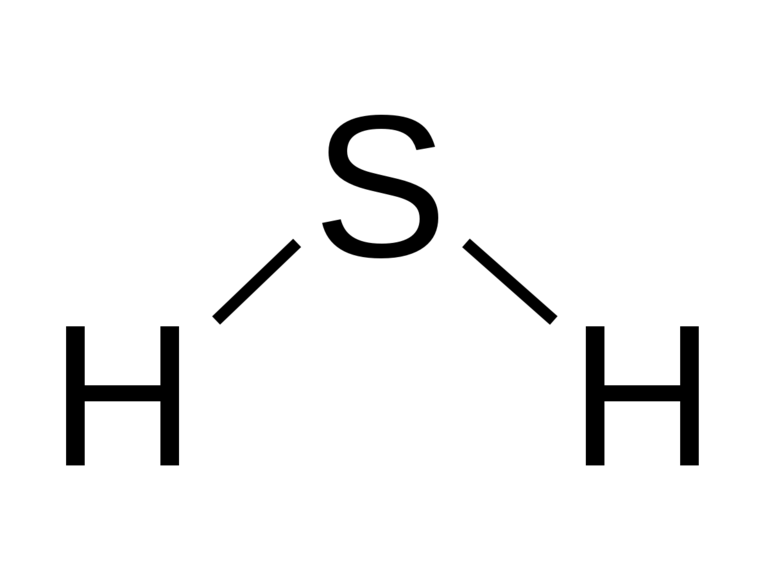
Вещество относится к термически устойчивым соединениям в агрегатном состоянии, при повышении температуры свыше +400ºС разделяется на простые компоненты — Н2 и S. Молекула вещества представляется в изогнутой форме и отличается полярностью (μ = 0,34 . 10 -29 Кл . м). Водороды не обнаруживаются в дигидросульфидах, в отличие от воды, поэтому в нормальных условиях вещество в жидкое состояние не преобразуется.
Физические свойства сероводорода:
- При растворении дигидросульфида в водной среде получается малая по силе сероводородная кислота, которая становится сверхпроводником при понижении температуры до -70ºС и показателе давления 150 ГПа.
- В жидком состоянии H2S обладает сниженной электропроводимостью, по сравнению с водной средой, так как сернистый водород отличается слабой диэлектрической проницаемостью. В таком виде соединение получает свойства органического раствора, который почти не растворяет лед.
- Твердый дигидросульфид отличается плотностью молекулярного строения, при этом у всех частиц есть 12 расположенных рядом соседей (связи явно различаются со структурным сцеплением льда).
- Плавится серный водород при показателе 2,5 кДж/моль, а испаряется в случае достижения условий 18,7 кДж/моль.
- Вещество весит больше воздуха и подвергается сжатию при достижении температуры -60,2ºС. Полное сжатие проходит при -85,7ºС.
В воздушной среде происходит горение вещества с образованием воды и серного диоксида, реакция выражается уравнением: 2H2S + 3O2 = 2SO2 + 2H2O. Если в огонь поместить холодный твердый предмет, то окисление идет до свободной серы, которая образует остаток желтого цвета: O2 + 2H2S = 2S + 2H2O. Чтобы растворить 2,5 объема сернистого водорода, потребуется всего 1 объем жидкости, при этом раствор будет называться сероводородной водой. Смесь становится мутной при содержании на воздухе и на свету, так как происходит кислотная реакция между гидросульфидом и воздухом.
Химические свойства
В результате охлаждения насыщенного раствора можно получить кристаллогидрат H2S . 6H2O. Растворимость сероводородного компонента в органике происходит более активно, чем в воде. В одной порции спирта растворяется 7 частей сероводорода. Интенсивность растворимости достигает максимума при температуре 350ºС, что объясняется получением полисульфидов.
В воде вещество окисляется йодом с выделением свободной серы, а в газовой среде сера окисляет йодистый водород до появления свободного йода по схеме:
- I2 + H2S = S + 2HI.
- S + 2HI = I2 + H2S + 6 кДж.

В газово-воздушной среде при температуре ниже -50ºС образуется молярное соединение H2S . I2. Константа диссоциации сероводородной кислоты слабее угольной, децинормальная смесь имеет кислотность pH = 4.1. Сера с водородом не вступает во взаимодействие в обычных обстоятельствах, только при увеличении температуры идет реакция: S + H2 = H2S + 21 кДж.
Химические свойства сероводорода позволяют выступать ему в качестве восстановителя, примером служит список реакций:
- Br 2 + H 2 S -2 = 2HBr + S 0 .
- 4Cl 2 + 4H 2 O +H 2 S -2 = H 2 S + 6SO 4 + 8HCl.
- 2FeCl 3 + H2S -2 = S 0 + 2FeCl 2 + 2HCl.
Серебро получает черный оттенок, если реагирует с сероводородом, что является результатом взаимного влияния растворимых сульфидов и дигидросульфидов в химии. Средние соли с содержанием аниона S 2- носят название сульфидов, а кислые массы с анионом HS относятся к классу гидросульфидов. Соли имеют различную цветность, несмотря на то, что ионы являются бесцветными. Сульфиды в воде почти не растворяются, а гидросульфиды реагируют и образуют водные растворы.
Соли кислоты
Вещества растворяются в воде, если находятся в таблице щелочных металлов. Остальные соединения подобного типа не взаимодействуют с водой. Сульфиды выпадают в осадок в результате реакции гибридизации, когда вводятся металлические соли или соль сероводородной кислоты.
У щелочноземельных и щелочных металлов есть гидросульфиды М 2+ (Н S) 2 и M + HS. Нестойкими являются гидросульфиды Ca 2+ Sr 2+ . Растворимые сульфиды героизируются в воде, так как относятся к слабым солям кислоты. Часто такая реакция является необратимой с появлением осадка в виде нерастворимого гидроксида.
Получение вещества
Практическое получение сероводорода проходит в реакции сульфида железа и разбавленных кислот. Другим удобным методом является нагревание сплавленной серы в виде порошка до 170ºС в сочетании с частицами асбеста и парафином. Концентрация смеси составляет 3:2:5, соответственно. В охлажденном состоянии взаимодействие прекращается, а активизируется реакция с повышением температуры.
Начальный сплав заготавливается заранее и расходуется в случае необходимости, при этом 1 г дает 150 г сероводорода. Для получения чистого вещества смесь пропускается вместе с серными парами над разогретыми глыбами пемзы, при этом температура равняется 100ºС, а давление составляет 90 атм. Температурная диссоциация сероводорода наступает при 400ºС и достигает апогея при достижении 1700ºС.
Вред сероводорода
Взрывоопасной является смесь вещества с воздухом, при этом температура 300ºС ведет к воспламенению и дальнейшему взрыву в случае содержания 5−46% H2S. Ядовитость вещества часто недооценивается и деятельность с ним без защитных средств ведет к отравлению. Всего 0,1% концентрация сероводорода в атмосфере помещения вызывает неприятные последствия для организма.
После вдыхания сероводородных паров наступает потеря обоняния, затем обморок или паралич дыхания, что ведет к смерти человека. Помогает быстрое удаление пострадавшего из проблемного помещения. Симптомами отравления является головная боль, нарушение сознания и тошнота. Иногда обмороки наступают позднее, когда человек уже не работает с газом. Средства защиты необходимы, при этом требуется тщательно запахнуть респираторы и другие предметы предохранения.
Применение дигидросульфида
Сероводород в качестве сульфидов используется в технике, например, с его применением изготавливаются люминофоры, полупроводники. В этом производстве задействуются сульфиды кадмия и цинка. В качестве основы смазок берется дисульфид молибдена.
Польза от применения сероводорода:

- в области неорганической химии вещество применяется в качестве реагента для выделения осадка тяжелых металлов, если их сульфиды относятся к категории слаборастворимых;
- в медицине используется в виде искусственных и природных ванн и вводится в состав минеральных вод;
- серный водород участвует в производстве сульфидов, элементарной серы и серной кислоты;
- используется в синтезе меркаптанов и тиофена.
В последние годы рассматривается возможность применения вещества из глубин моря. Его планируется использовать в области сероводородной энергетики в виде химического и электронного сырья.
В нормальном состоянии
Эндогенный дигидросульфид в небольшой массе производится клетками живых организмов и является важным компонентом многих биологических действий. Вещество является третьим из найденных ранее трансмиттеров после угарного газа и азотной окиси. Этот тип соединения выделяется в организме с помощью цистеина и относится к группе спазмолитиков и вазодилататоров. Он активно действует на ЦНС, повышает трансмиссию нейронов и способствует функционированию памяти.

Впоследствии вещество окисляется до ионов сульфитов в митохондриях с помощью тиосульфат-редуктазы, затем превращается в ионы сульфатов при воздействии специального фермента. Из организма в конечном виде выводится мочевыми протоками.
В организме человека эндогенный сероводород считается важным фактором для защиты от заболеваний сердца и сосудов, благодаря аналогичности со свойствами азотной окиси. Несмотря на схожесть, действие сероводорода и оксида азота различаются, хотя они оба оказывают кардиопротективное действие. Азот активирует гуанилатциклазу, а дисульфид приводит в тонус чувствительные каналы поставки калия в гладких мышцах.
Исследования показывают, что для поддержания сосудистого тонуса важно сочетание азота, сероводорода и угарного газа. Окись азота в условиях физиологической нормы расширяет крупные артерии и вены, а серный водород отвечает за расслабление периферических сосудов крови. В организме выявляется взаимодействие сигнальных путей азота и сероводорода, что говорит о зависимости спазмолитического, цитопротекторного и противовоспалительного действия газов друг от друга.
В теле человека серный водород реагирует с внутриклеточными ферментами, при этом образуется HSNO (нитрозотиол). Веществу отводится ведущая роль контроля внутриклеточной концентрации энзимов.
При патологических изменениях
В случае инфаркта выявляется дефицит эндогенного сероводородного газа, что негативно сказывается на состоянии сосудов. Сниженная биологическая доступность серного водорода и окиси азота ведет к некрозу мышцы сердца. Дефицит сероводорода способствует высвобождению большого числа радикалов и наступает экссудативный внутриклеточный стресс.
При недостатке серного водорода активность ферментов изменяется и угнетается биологическое воспроизводство азота. В это время применяется сероводородная терапия прекурсорами вещества или донорами, например, диалил-трисульфидами для увеличения содержания газа в крови и мышцах больного. В результате опасность патологии и повреждений сердечной мышцы становится минимальной.

В организме серный водород может запасаться в виде сульфат-серы. Это промежуточный компонент, который образуется при взаимодействии избыточного вещества с кислородом и используется при необходимости. Порции запасного сероводорода вступают в реакцию с кислородом и активизируют выработку азота, что уменьшает число свободных радикалов.
При заболевании Альцгеймера снижается уровень сероводородного компонента в сосудах мозга, как и у пациентов с недугом Паркинсона. Введение прекурсоров вещества дает улучшение самочувствия вплоть до полного избавления от характерных симптомов. При синдроме Дауна, наоборот, содержание сероводорода обнаруживается в очень завышенной концентрации.
Использование при анабиозе
Теоретически и практически доказано, что продукция сернистого водорода у особей, которые впадают в зимнюю спячку, повышается в несколько раз. Дыхание замедляется и составляет около 10 движений в минуту, а температура тела снижается на 2º. На опытах с мышами было установлено, что гипотермия мозга при этом уменьшает повреждение в органе при инсульте или травматическом воздействии.

Если бы удалось воспроизвести такое действие в организме человека, то сероводородная гибернация стала бы полезным открытием в клинике спасения жизней после травм, инсультов и инфарктов, а также для хранения органов от донора.
Исследования показывают, что эндогенный серный водород влияет на скорость метаболизма, регулирует естественным способом уровень обменных процессов. Последние опыты показали, что эффект гибернации не возникает у крупных животных, а развивается исключительно у мышей. Анабиозу с помощью сероводородного компонента нельзя подвергнуть свиней или овец, что было практически доказано. Клинические испытания действия сероводорода на человека в части анабиоза были начаты, но неожиданно прекратились медицинской компанией без объяснения причин.

Сероводород — ядовитый газ, придающий тухлым яйцам их характерный запах, — выполняет важную физиологическую функцию в организме млекопитающих, участвуя в регуляции кровяного давления. Фермент цистатионин-гамма-лиаза производит сероводород в стенках кровеносных сосудов. Мыши, лишенные этого фермента, с возрастом начинают страдать гипертонией.
Все живые организмы используют разнообразные химические вещества для регуляции своей жизнедеятельности и передачи всевозможных сигналов (управляющих команд) как внутри клетки, так и между клетками. Каждый физиологический или биохимический процесс, имеющий функциональное значение (например, любая биохимическая реакция, превращающая вещество А в вещество Б) буквально опутан сложной сетью сигнально-регуляторных взаимодействий. Даже у самых простых организмов — бактерий — на одну биохимическую реакцию приходится в среднем 10–20 регуляторных процессов, которые управляют протеканием этой реакции (включают ее и выключают, ускоряют и замедляют в зависимости от ситуации); см.: Н. А. Колчанов. Ловчие сети эволюции.
В роли веществ-регуляторов могут выступать самые разные молекулы: белки и пептиды (например, инсулин и другие белковые гормоны, транскрипционные факторы, G-белки, эндорфины и др.), нуклеиновые кислоты (например, малые регуляторные РНК), нуклеотиды (например, циклический аденозинмонофосфат), аминокислоты и их производные (адреналин, дофамин, глицин и т. д.), стероиды (например, тестостерон и другие половые гормоны). Всё это — органические вещества с более или менее сложными молекулами. Часто для передачи сигналов и регуляции жизненных процессов используются ионы металлов (например, кальция). Синтез всех этих веществ и транспортировка их в разные части организма, естественно, находятся под контролем других биологических регуляторов, так что всё в итоге связывается в огромную сложную сеть регуляторных взаимодействий.
Несколько более экзотично выглядит использование в качестве сигнальных и регуляторных веществ совсем простых молекул, например этилена (H2C=CH2), который у растений играет роль самого настоящего гормона (см.: О. Н. Кулаева. Этилен в жизни растений). Но этилен все-таки органическое вещество, хотя и очень простое.
Еще более удивительно, что у млекопитающих, как выяснилось в последние десятилетия, полноправными физиологическими регуляторами могут служить неорганические растворенные газы, а именно угарный газ (CO) и оксид азота (NO).
Статья американских и канадских биохимиков, опубликованная в журнале Science, добавила к этой странной компании еще один газ, которому, казалось бы, совсем уж не место в утонченной и замысловатой паутине сигнально-регуляторных каскадов организма млекопитающих. Как выяснилось, млекопитающие вполне целенаправленно используют для регуляции кровяного давления сероводород (H2S) — ядовитый газ с резким запахом тухлых яиц, образующийся, в частности, при гниении органики. Но в небольших количествах он, оказывается, весьма полезен для здоровья.
В клетках млекопитающих сероводород вырабатывается ферментом цистатионин-гамма-лиазой (cystathionine gamma-lyase), основная функция которого — производство аминокислоты цистеина из цистатионина (см. рисунок).
Ранее уже было установлено, что сероводород вызывает расслабление гладкой мускулатуры кровеносных сосудов. Это, в свою очередь, ведет к снижению кровяного давления. Была известна и природа этого эффекта: сероводород взаимодействует со встроенными в мембраны мышечных клеток калиевыми каналами — белками, регулирующими прохождение ионов калия (K + ) через мембрану. Сероводород открывает калиевые каналы, что и приводит к расслаблению гладкой мускулатуры сосудов.
Чтобы ответить на этот вопрос, исследователи создали генно-модифицированных мышей, лишенных гена цистатионин-гамма-лиазы. Мыши получились вполне живые и на первых порах даже здоровые. До семинедельного возраста они росли и развивались точно так же, как обычные лабораторные мыши. Однако начиная с семи недель они начали страдать гипертонией. В возрасте 12 недель артериальное давление у них достигло 135 мм ртутного столба — на целых 18 мм больше, чем у контрольных мышей того же возраста. По мышиным меркам это серьезная гипертония. Причина ее заключалась в резко пониженной концентрации сероводорода в стенках сосудов и плазме крови у генно-модифицированных мышей по сравнению с контрольными. Внутривенное введение источника сероводорода (гидросульфида натрия, NaHS) временно вылечивало генно-модифицированных мышей. У контрольных мышей от этой процедуры давление тоже снижалось, но не так сильно.
Разумеется, изъятие из мышиного генома гена цистатионин-гамма-лиазы привело не только к снижению концентрации H2S, но и к целому ряду других биохимических изменений (как мы помним, этот фермент выполняет несколько функций). Поэтому ученым пришлось провести несколько дополнительных сложных экспериментов, чтобы доказать, что гипертония вызвана именно недостатком сероводорода, а не чем-нибудь еще.
Кроме того, ученые в общих чертах расшифровали регуляторный каскад, управляющий производством сероводорода в клетках эндотелия (внутренней выстилки) кровеносных сосудов (см.: endothelium). Стимуляция клеток эндотелия различными гормонами, такими как ацетилхолин и брадикинин, ведет к формированию инозитол 1,4,5-трифосфата, что, в свою очередь, приводит к росту внутриклеточной концентрации ионов кальция. Ионы кальция в комплексе со специальным белком — кальмодулином активируют фермент цистатионин-гамма-лиазу, и в результате концентрация H2S в клетках эндотелия растет. Тот же самый регуляторный каскад служит и для активации белков, синтезирующих оксид азота (NO), который тоже обладает сосудорасширяющим действием.
Эти результаты, полученные на мышах, наверняка справедливы и для человека, у которого тоже, конечно, есть цистатионин-гамма-лиаза и все остальные компоненты этого регуляторного каскада.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

О СЕРОВОДОРОДЕ Он имеет жуткий запах и обладает удушающим действием на человека. Жрецы использовали ее для проведения разных обрядов и священных курений, а военные добавляли в состав различных горючих смесей.
Сероводород всегда образуется при гниении остатков растительных и животных организмов и расписании других органических веществ, в которые входит сера . Поэтому неприятный запах сероводорода распространяется от выгребных ям , сточных вод и особенно от тухлых яиц. Но в больших количествах в природе сероводород не накапливается, поскольку он легко окисляется кислородом воздуха и разлагается. Из-за характерного запаха и (при достаточных концентрациях), наблюдаемого эффекта, этот газ часто ассоциировали с признаком присутствия потусторонней силы.
Сероводород встречается в вулканических газах, а также в воде некоторых минеральных источников - Пятигорска и Мацесты (на Кавказе) , Любеня-Великого ( Львовская область ) и других.

Природные сероводородные воды используются для лечения.
Воздействие сероводородных вод и грязей
Сероводородные воды и грязи очень полезны . Их часто используют в санаториях. Сероводородные грязи , их часто называют сульфидные, активно помогают при лечении многих заболеваниях, среди которых: кожные заболевания (в том числе и псориаз), заболевания центральной нервной системы, гинекологические заболевания, заболевания сердечно-сосудистой и костно-мышечной системы.
Действие сульфидных вод связано в основном с тем, что в воде присутствуют свободные сульфиды водорода, которые обладают активными химическими свойствами. Проникает он в организм через кожу, слизистые оболочки тела, дыхательные пути. Выводится сероводород из организма довольно быстро, газ окисляется в печени после чего выходит из человека.
Сероводородные ванны очищают поверхность кожи от кислот, щелочей, солей, микро-организмов и продуктов метаболизма. также под влиянием этих ванн ускоряются процессы заживления мышечной ткани, кожи, они оказывают противовоспалительное действие.
При этом сульфидные воды могут оказать неблагоприятное влияние на организм.
Так или иначе, сероводород очень давно и хорошо знаком людям .
И в чём-то древние были правы : эффект от сероводорода может быть очень ощутим: от целебного до неприятного и даже губительного. Это вещество может быть использовано во благо: считается, что сероводородные ванны благотворно действуют на кожу, а минеральная вода с содержанием сероводорода оздоравливает желудочно-кишечный тракт. Вспомните знаменитые кавказские здравницы на минеральных водах.
По степени воздействия на организм вредные вещества подразделяются на четыре класса опасности: 1-й – вещества чрезвычайно опасные; 2-й – вещества высокоопасные; 3-й – вещества умеренно опасные; 4-й – вещества малоопасные.

Сероводороду (H 2 S) — наиболее активному из серосодержащих соединений — присвоен второй класс опасности. По данным ВОЗ (Всемирной Организации Здравоохранения), он входит в перечень самых распространённых и наиболее опасных загрязнителей окружающей среды наряду с дихлорметаном, формальдегидом, стиролом, толуолом,мышьяком, окисью углерода, свинцом, фтором, ртутью т.п. Сероводород считается одним из самых нежелательных компонентом нефтепереработки.
Смертельная концентрация этого газа в воздухе очень мала – всего 0,1%. Такое количество сероводорода может привести человека к летальному исходу за 10 минут. Стоит лишь немного увеличить концентрацию – и смерть наступает мгновенно, после первого же вдоха. Для примера: в канализационной системе концентрация сероводорода иногда достигает 16%.
Если речь идёт о незамкнутом помещении, сероводород не действует так резко и внезапно, не застаёт жителей врасплох. Однако, человеку свойственно привыкать к любому запаху, это некоторая защитная реакция нашего организма (например, жители мегаполисов не замечают специфический запах в метро, не замечают запах выхлопных газов, но при этом очень впечатляются свежестью приморского воздуха, будучи в отпуске). Именно с этим явлением сталкиваются периодически жители больших городов по всему миру, и в частности, Москвы, где в некоторых районах подобный запах – привычное дело.
Поскольку экзогенный (вызываемый внешними причинами) сероводород попадает в организм через дыхательные пути, первый удар всегда принимает слизистая оболочка. Этот газ плохо действует и на глаза: может вызвать конъюнктивит, спровоцировать светобоязнь, раздражение слизистой оболочки глаз, снижение остроты зрения.
Что касается исследования эндогенного сероводорода у людей, есть основания считать, что эндогенный сероводород борется с гипертонией . Этот газ способствует расслаблению гладкой мускулатуры сосудов, в результате чего увеличивается их просвет (сосуды расширяются), снижается давление, улучшается циркуляция крови.
Помимо оздоровления сосудистой стенки, сероводород защищает ее от разрушительного действия метаболитов и активного кислорода – побочных продуктов обмена веществ. связывая и обезвреживая их, после чего метаболиты сероводорода выводятся почками с мочой.
Буквально в последние годы стали появляться публикации относительно способности сероводорода противостоять бактерицидному действию антибиотиков. Также учёные доказали, что сероводород участвует в реакции, защищающей ДНК от повреждений. Разумеется, все эти лестные отзывы учёных о сероводороде обосновывают лишь микроскопические количества вещества, естественным образом образующемся в нашем организме.

Сероводород может использоваться для выделения водорода из воды, с лечебной целью, в качестве резервного топлива и др.
В энергетическом отношении (по теплоте сгорания) 1 м3 сероводорода эквивалентен 1,49 м3 бытового газа
3 Так, например, некоторые учёные даже предполагают, что Чёрное море (где слои воды, расположенные глубже 150-200 м содержат растворённый сероводород), получило своё название именно благодаря эффекту преломления различных предметов через толщу воды и растворённого в ней сероводорода – находясь глубоко в воде, предметы окрашиваются в чёрный цвет.
Характерной особенностью Черного моря является полное (за исключением ряда анаэробных бактерий) отсутствие жизни на глубинах свыше 150-200 м за счет насыщенности глубинных слоев воды сероводородом.

1

Давным-давно известно, что в нижних пластах Черного моря очень большая концентрация сероводорода (H 2 S), что делает воду этого моря полностьюнепригодной для любой формы жизни, а Черное море – одним из самых больших хранилищ сероводорода на нашей планете. Как нам известно, сероводород является очень токсичным газом, который в очень небольших дозах используется для лечебных целей, и имеет тяжелый запах тухлого яйца, в больших же дозах однократное вдыхание его может повлечь мгновенную смерть. Вследствие этого в нижних слоях вод Черного моря, помимо анаэробных серных бактерий, не может существовать ни одно живое существо. Нам очень повезло в том, что пласты воды в этом море не смешиваются, поскольку, если бы пласты воды смешались, это могло сделаться бы одной из крупнейших катастроф со времени окончания Ледникового периода. Отчего такие огромные залежи сероводорода образовались в Черном море, ни один человек в настоящее время в точности сказать не может. По самый распространенной версии произошло это так: черное море являлось озером, около 7500 лет назад – причем, самым глубоким озером с пресной водой, уровень которого был ниже современного почти на 100 метров. После того как закончился последний период повысился уровень мирового океана, и в будущее море хлынули соленые воды из самых глубоких озер, вся живность вымерла, и именно продуктом ее разложения стал сероводород.
Ход реакции окисления H 2 S наблюдали жители Ялты во время землетрясения в 1927 году . Сейсмические толчки всколыхнули глубоководный сероводород к поверхности. Электропроводность водного раствора H 2 S выше, чем у чистой морской воды. Поэтому электрические грозовые разряды чаще всего попадали именно в участки поднятого с глубины сероводорода. Однако значительный слой чистой поверхностной воды гасил цепной ход реакции.




Раффлезия – самый большой цветок

Именно в честь двоих путешественников ученые и дали название самому большому на Земле цветку Раффлезия Арнольди.
Читайте также:


