Сообщение о селене химия 9 класс
Обновлено: 05.07.2024

Смотрите так же:
СТРУКТУРА
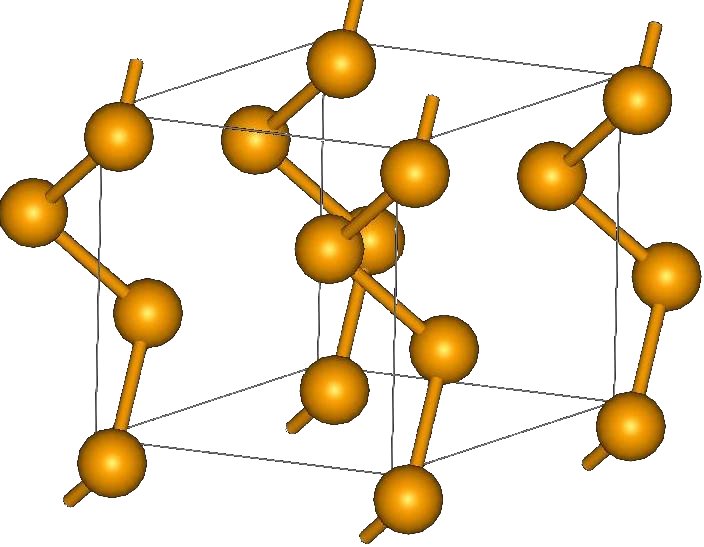
Кристаллическая структура селена
Существует две модификации селена:
1. Кристаллическая (моноклинный селен a- и b-форм, гексагональный селен g-формы).
2. Аморфная (порошкообразная, коллоидная и стекловидная формы селена).
Модификация аморфный красного цвета селен – это одна из неустойчивых модификаций элемента. Порошкообразная и коллоидная формы селена получаются путем восстановления вещества из раствора селенистой кислоты H2SeO3.
Черный стекловидный селен можно получить путём нагревания элемента любой модификации до температуры 220 градусов Цельсия с быстрым охлаждением. Гексагональный селен имеет серый цвет. Эту модификацию, наиболее устойчивую термодинамически, можно получить также путем нагревания до температуры плавления с дальнейшим охлаждением до температуры 180-210 градусов Цельсия. Необходимо некоторое время выдерживать такой температурный режим.
СВОЙСТВА

Черный, стеклообразный аморфный и красный аморфный селен
Температура плавления вещества – 217 (α-Se) и 170–180 градусов Цельсия (β-Se), а закипает он при температуре 685 0 .
Степени окисления, что селен проявляет в реакциях: (-2), (+2), (+4), (+6), он устойчив к воздуху, кислороду, воде, соляной кислоте и разбавленной серной кислоте.
Поддается растворению в азотной кислоте высокой концентрации, “царской водке”, более длительно растворяется в щелочной среде с окислением. Является диамагнетиком.
ЗАПАСЫ И ДОБЫЧА

Поскольку селен примешен к сере, элемент извлекают из сульфата железа. Для этого даже делать особо ничего не надо. 34-ый металл накапливается в пылеочистительных камерах сернокислотных заводов. Забирают селен и из установок электролиза меди. После него остается анодный шлам. Из него-то и выделяют 34-ый элемент. Достаточно обработать шлам растворами гидроксида натрия и диоксида серы. Полученный селен нужно очистить. Для этого используют метод дистилляции. После, металл подсушивают.
ПРОИСХОЖДЕНИЕ

Отличные глянцевые кристаллы из горящих угольных отвалов. Ширина изображения – 1,8 мм. Германия, Северный Рейн-Вестфалия, Аахен, Альсдорф, шахта Анна
Содержание селена в земной коре — около 500 мг/т. Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se, S)3, хастит CoSe2, платинит PbBi2(S, Se)3, ассоциирующие с различными сульфидами, а иногда также с касситеритом. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4·10 -4 мг/л.
ПРИМЕНЕНИЕ

Одним из важнейших направлений его технологии, добычи и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. В современной технологии полупроводников применяются селениды многих элементов, например, селениды олова, свинца, висмута, сурьмы, селениды лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз). Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл). Полупроводниковые свойства селена в чистом виде широко использовались в середине 20-го века для изготовления выпрямителей, особенно в военной технике по следующим причинам: в отличие от германия, кремния, селен малочувствителен к радиации, и, кроме того, селеновый выпрямительный диод обладает уникальным свойством самовосстанавливаться при пробое: место пробоя испаряется и не приводит к короткому замыканию, допустимый ток диода несколько снижается, но изделие остается функциональным. К недостаткам селеновых выпрямителей относятся их значительные габариты.
Селен применяется как мощное противораковое средство, а также для профилактики широкого спектра заболеваний. Согласно исследованиям прием 200 мкг селена в сутки снижает риск заболеваемости раком прямой и толстой кишки — на 58 %, опухолями простаты на 63 %, раком легких — на 46 %, снижает общую смертность от онкологических заболеваний на 39 %.
Малые концентрации селена подавляют гистамин и за счет этого оказывают антидистрофический эффект и противоаллергическое действие. Также селен стимулирует пролиферацию тканей, улучшает функцию половых желез, сердца, щитовидной железы, иммунной системы.
В комплексе с йодом селен используется для лечения иододефицитных заболеваний и патологий щитовидной железы.
Соли селена способствуют восстановлению пониженного артериального давления при шоке и коллапсе
Химия помогает узнать больше об окружающем мире. Работа с таблицей Менделеева начинается с изучения химических элементов. Селен всё ещё представляется для людей одним из самых загадочных и многоликих минеральных веществ. Его обнаружили не только в природе, но и в теле человека.
- История элемента
- Нахождение в природе и получение
- Строение атома и структура
- Физические особенности
- Химические свойства
- Меры безопасности
- Сферы применения
- Значение для человека
- Полезные продукты

История элемента

В 1873 году Уиллоуби Смит доказал, что электрическое сопротивление элемента зависит от освещённости. Через несколько лет были разработаны первые продукты в виде ячеек на основе селена, которые использовали в фотофоне, созданном А. Г. Беллом. С помощью химического элемента можно было изменять электропроводимость световых лучей, которые отражались от зеркала под влиянием звука. Полезное свойство селена позволило использовать его в разных измерителях освещённости.
В первой половине XX века начали производить выпрямители на основе этого элемента, которые заменили медно-закисные изделия. Полупроводниковые диоды широко использовали до 1970-х годов.
Когда начали происходить массовые отравления работников на селеновых заводах и животных, поедавших траву около этих предприятий, люди поняли, что химический элемент токсичен. В середине прошлого века учёные раскрыли биологическое значение вещества для живых организмов.
Нахождение в природе и получение

Основным источником неметалла выступают шламы свинцовых камер и пыль, которая образуется при обжиге сульфидов с соответствующим веществом. Сырьё обрабатывают концентрированной серной кислотой с нитратом натрия. В результате реакции образуется селенистая кислота с формулой H2SeO3 и в небольшом объёме селеновая кислота (H2SeO4). Затем селенистую кислоту обрабатывают сернистым газом и получают элементарный селен и серную кислоту.
Чтобы очистить полученный осадок, его сжигают в кислороде, который насыщают парами азотной кислоты. В результате получается чистый диоксид селена. В раствор SeO2 добавляют соляную кислоту, а затем пропускают через него сернистый газ, осаждая нужный элемент. Полученное вещество переплавляют, фильтруют через стеклоткань или активированный уголь. Последняя стадия очистки элемента подразумевает дистилляцию в вакууме.
Строение атома и структура
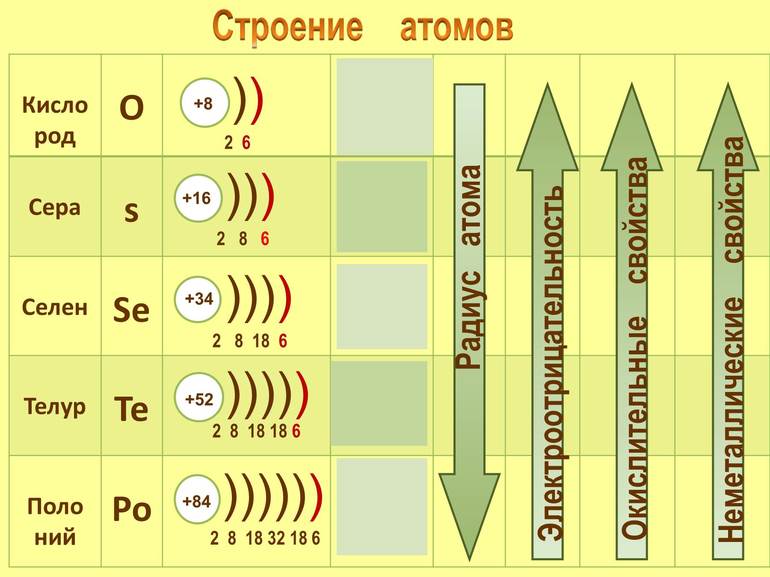
Селен состоит в 4-м периоде VI группы химических элементов. Неметалл имеет порядковый номер 34, его обозначение в таблице — Se. Атомная масса составляет 78,96 а. е. м., электронная формула селена — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4 . Атом химического элемента имеет ядро с положительным зарядом +34. В него входят 34 протона, 45 нейронов и 34 электрона, которые движутся по 3-м орбитам.
Элемент отличается интересной конфигурацией. На внешнем энергетическом уровне располагаются 6 валентных отрицательно заряженных частиц. Поскольку в атоме селена есть два неспаренных электрона, это говорит о его ковалентности.
Вещество может быть представлено в двух модификациях:
- кристаллическая (моноклинный и гексагональный селен);
- аморфная.
Во втором случае неметалл имеет порошкообразную, коллоидную или стекловидную форму. Аморфная модификация неустойчива. Красный порошкообразный или коллоидный селен образуется при восстановлении из раствора селенистой кислоты. Чтобы получить стекловидную форму чёрного цвета, вещество любой модификации нагревают до температуры 220 °C, а потом сразу же охлаждают.
Гексагональный селен тёмно-серого оттенка устойчив в термодинамических условиях. Любую форму вещества нагревают до температуры плавления и затем охлаждают до 180−200°C, выдерживая этот показатель определённый период.
Физические особенности
Селен относится к группе халькогенов. Неметалл представляет собой хрупкое и непрозрачное вещество чёрного цвета. В неустойчивой форме он имеет оттенок киноварь. Обладает металлическим блеском.
Основные характеристики селена в гексагональной модификации:
- твёрдость по шкале Мооса — 2;
- плотность — 4,8 г/см 3 ;
- температура плавления — 217 °C;
- температура кипения — 685−688°C;
- цвет черты — красный.

Гибкий материал относится к диамагнетикам. Он характеризуется высоким оптическим рельефом и анизотропией. Цвет минерала в воздухе — белый. В иммерсии (микроскопическое наблюдение) оттенок становится темнее и может быть серовато-коричневым. Только на просвет химический элемент приобретает красную окраску.
Химические свойства

Так как неметалл характеризуется двумя неспаренными электронами, степень окисления селена равна +2. Но у вещества есть вакантные орбитали на четвёртом уровне 4d-подуровня. Это говорит о том, что элемент может находиться в возбуждённом состоянии, при котором степень окисления меняется на +4.
По химическим свойствам неметалл близок к теллуру и сере, занимая промежуточное место между ними. Однако в соединениях со степенью окисления -2 он служит сильным восстановителем, а с показателем +6 — окислителем. Простое вещество селен отличается меньшей активностью, чем сера. Элемент способен гореть в воздухе самостоятельно. Окисление неметалла происходит только при нагревании. Вещество горит синим пламенем. Бурные реакции с селеном наблюдаются при взаимодействии с щелочными металлами.
Химический элемент может образовывать с кислородом несколько оксидов. SeO2 и SeO3 выступают ангидридами селеновой и селенистой кислот, с которыми получают селенат и селенит. Также неметалл может образовывать SeO и SeO5. Диоксид селена (SeO2) представляет собой кристаллическое вещество. Он хорошо растворяется в воде и считается довольно устойчивым соединением.
Меры безопасности

Если вещество в форме металлического порошка попало в организм через рот, тогда у человека возникнут сильные боли в животе и диарея. Пострадавшему не потребуется помощь, если объём токсичного материала не превышал 1 г. Через какое-то время симптомы пройдут самостоятельно.
На кожном покрове могут возникнуть ожоги или аллергическая реакция в виде дерматита при контакте с солями неметалла. Диоксид селена вызывает резкую боль и онемение. Соединения химического элемента могут сильно раздражить слизистые оболочки. Также они вызывают покраснения, а при попадании в органы зрения — режущую боль, слезотечение и конъюнктивит.
Сферы применения
Селен, а также его соединения и сплавы широко используются в качестве полупроводника для выпрямителей переменного тока. В современной технологии применяют селениды висмута, олова, свинца, сурьмы.
Неметалл используется и в других областях:

- Это вещество необходимо при создании фототехники.
- В виде источника излучения для дефектоскопии применяют радиоактивный изотоп селен-75.
- Селен может использоваться как наполнитель в резиновой промышленности.
- В металлургии элемент необходим для придания полученным сплавам мелкозернистой структуры.
- В стекольной промышленности вещество используется для обесцвечивания или окрашивания прозрачного материала в красные или розовые оттенки. Обычно для этого выбирают металлическую форму элемента или селенистокислый натрий. Селеном окрашены рубиновые звёзды Московского Кремля.
- Материал применяется и в производстве керамических изделий, которым он придаёт красноватые оттенки. Также этим веществом окрашивают эмали.
Хотя селен относится к токсичным веществам, он может использоваться и в сфере медицины благодаря своим антиоксидантным свойствам. Неметалл выступает мощным противораковым средством. Препараты с селеном применяют в профилактике развития различных болезней. В малых концентрациях вещество подавляет гистамин. Селен обладает противоаллергическим и антидистрофическим эффектом. Соли неметалла избавляют от гипотонии при шоке и коллапсе.
Значение для человека

Селен — жизненно необходимый для живых организмов микроэлемент. Он содержится в активных центрах некоторых белков в виде аминокислот селеноцистеина. Объём вещества в человеческом организме составляет 10−14 мг. Основная часть находится в печени, почках, селезёнке, яичках и семенных канатиках у мужчин. В небольших количествах микроэлемент присутствует в костном мозге, сердце, лёгких, коже, волосах и ногтях.
Вещество взаимодействует с различными витаминами и ферментами. Он обнаружен в составе более 30 биологических соединений. Благодаря учёным удалось узнать о пользе и вреде селена для организма человека:

- Микроэлемент восстанавливает работу нервной и эндокринной системы.
- Препараты с этим веществом усиливают иммунитет.
- Селен улучшает функцию сосудов и препятствует развитию сердечно-сосудистых патологий.
- Сильный антиоксидант тормозит старение организма и выводит из него чужеродные вещества.
- Неметалл снижает возможность развития злокачественных опухолей.
- Он улучшает работу половых желёз и стимулирует репродуктивную функцию.
- Селен нормализует процессы обменов в человеческом организме и защищает его от возможного токсического действия кадмия, ртути, свинца, серебра и таллия.
- Вещество уменьшает боли при воспалениях.
Микроэлемент также участвует в обмене белков, жиров и углеводов. Без него не обходятся окислительно-восстановительные процессы. Из занимательных фактов о селене нужно отметить, что он контролирует весь цикл жизни клетки.
Полезные продукты
Для людей суточная норма селена составляет 70−110 мкг. Объём зависит от возраста и половой принадлежности человека. Для взрослых мужчин максимальное количество вещества в день составляет 140 мкг.
Селеном богаты продукты как животного, так и растительного происхождения:

- злаковые культуры;
- масло оливы;
- орехи;
- томаты;
- маслины;
- чеснок;
- грибы;
- рыба и другие морепродукты;
- говяжьи почки и печень;
- морская соль;
- ржаной хлеб;
- яйца курицы.

Повышенное содержание микроэлемента в человеческом организме может вызвать тошноту, рвоту или понос. В некоторых случаях развивается депрессия. На избыток вещества указывают такие симптомы, как желтушность и шелушение кожи, разрушение ногтей, выпадающие волосы, отсутствие аппетита, постоянная усталость и расстройства ЦНС. Если в организме повышается объём ртути, меди или сульфатов, тогда наблюдается недостаток селена. К дефициту элемента может привести применение медикаментозных средств от малярии.
Селен выполняет важную роль не только в различных сферах жизни человека, но и в его организме. С правильным рационом получится поддерживать объём вещества на нужном уровне.
Что мы знаем о селене? На школьных уроках химии нам рассказывали о том, что селен – химический элемент, мы могли решать различные химические уравнения и наблюдать реакции с его участием. Но элементов в таблице Менделеева так много, что весь объем информации охватить невозможно. Поэтому все изложено довольно кратко.

Что такое селен
Селен (элемент Selenium) – это химический элемент, аналог серы, который относится к 16 группе (согласно более ранней классификации – к 6-й) таблицы Менделеева. Атомный номер элемента – 34, а атомная масса составляет 78,96. Элемент проявляет преимущественно неметаллические свойства. В природе селен – это комплекс, состоящий из шести изотопов, как правило, сопутствует сере. То есть встречается в местах добычи серы. Итак, загадочный селен - что это такое и чем он так ценен? Он обладает множеством полезных свойств.
История открытия селена
Данный химический элемент был открыт шведским химиком и минералогом Йёнсом Якобом Берцелиусом в 1817 году.

В научной литературе есть история открытия минерала, рассказанная самим учёным.
Он рассказывает, что в то время он вместе с другим учёным по имени Юхан Готлиб Ган (получившим известность как первооткрыватель марганца и изучившим его свойства) проводил исследования метода производства серной кислоты в городе Грипсхольм.
В ходе лабораторных опытов в серной кислоте были найдены осадки красного с примесью светло-коричневого оттенка вещества. При взаимодействии с паяльной трубкой от осадочных материалов исходил легкий редечный запах и образовывался свинцовый королёк. Берлинский учёный Мартин Клапрот утверждал, что наличие характерного запаха говорит о наличии теллура. Коллега Берцелиуса еще отметил, что на рудниках, где добывается данная сера для кислоты (в Фалюне) также чувствуется аналогичный запах.
В надежде найти редкий недавно открытый металл (теллур) в растворе, учёные принялись за более детальное исследование осадка, но всё было тщетно. После Берцелиус собрал все продукты, которые накопились за несколько месяцев получения серной кислоты путем сжигания серы, и также принялся исследовать.
Исследования показали, что новый, ранее неизвестный элемент имеет схожие свойства с теллуром, но таковым не является. Так периодическая таблица получила новый элемент - селен.
Происхождение названия элемента
История происхождения наименования нового элемента довольно интересна. Периодическая таблица Менделеева определяет новый элемент как Selenium (Se). Название своё получил по названию нашего естественного спутника.
Свойства селена
Формула селена – Se. Температура плавления вещества – 217 (α-Se) и 170–180 градусов Цельсия (β-Se), а закипает он при температуре 685 0 .
Степени окисления, что селен проявляет в реакциях: (-2), (+2), (+4), (+6), он устойчив к воздуху, кислороду, воде, соляной кислоте и разбавленной серной кислоте.
Поддается растворению в азотной кислоте высокой концентрации, "царской водке", более длительно растворяется в щелочной среде с окислением.
Формы селена
Существует две модификации селена:

- Кристаллическая (моноклинный селен a- и b-форм, гексагональный селен g-формы).
- Аморфная (порошкообразная, коллоидная и стекловидная формы селена).
Модификация аморфный красного цвета селен. Что это такое? Одна из неустойчивых модификаций элемента. Порошкообразная и коллоидная формы селена получаются путем восстановления вещества из раствора селенистой кислоты H2SeO3.
Черный стекловидный селен можно получить путём нагревания элемента любой модификации до температуры 220 градусов Цельсия с быстрым охлаждением.
Гексагональный селен имеет серый цвет. Эту модификацию, наиболее устойчивую термодинамически, можно получить также путем нагревания до температуры плавления с дальнейшим охлаждением до температуры 180-210 градусов Цельсия. Необходимо некоторое время выдерживать такой температурный режим.
Оксид селена
Есть ряд оксидов, которые образуются путем взаимодействия селена и кислорода: SeO2, SeO3,SeO, Se2O5. При этом SeO2 и SeO3 – это ангидриды селенистой (H2SeO3) и селеновой (H2SeO4) кислот, которые образуют соли селенит и селенат. Оксид селена SeO2 (хорошо растворяется в воде) и является самым устойчивым.
Интересные опыты над селеном
Перед тем, как начинать опыты с этим элементом, стоит помнить, что любые соединения с селеном ядовиты, поэтому необходимо принимать все меры безопасности, к примеру, надевать защитные средства и проводить реакции в вытяжном шкафу.

Цвет селена проявляется в ходе приятной глазу реакции. Если через колбу с селенистой кислотой пропустить сернистый газ, который является хорошим восстановителем, то полученный раствор станет желтым, потом оранжевым и в итоге - кроваво-красным.
Слабый раствор даст возможность получить аморфный коллоидный селен. В случае, если концентрация селенистой кислоты будет высокой, то в ходе реакции будет оседать от красного до тёмно-бордового оттенка порошок. Это будет аморфный порошкообразный селен элементарной формы.
Для того, чтобы привести вещество в стеклообразное состояние, необходимо его нагреть и резко охладить. Цвет изменится на черный, а вот красный оттенок можно будет заметить, только если смотреть на просвет.
Кристаллический моноклинный селен получить будет немного сложнее. Для этого нужно взять небольшое количество красного порошка и перемешать с сероуглеродом. К сосуду со смесью необходимо подключить обратный холодильник и кипятить в течение 2 часов. Вскоре начнет образовываться светло-оранжевая жидкость с лёгким зеленым оттенком, которую нужно будет медленно испарить в ёмкости под фильтровальной бумагой.
Применение селена
Селен добавляется в стеклянную массу с целью обесцвечивания стекла, устранения зеленоватого оттенка, который даёт примесь соединений железа. Для получения рубинового стекла в стекольной промышленности используется соединение селена и кадмия (кадмоселит CdSe). В производстве керамики кадмоселит придаёт ей красный цвет, а также окрашивает эмали.

Немного селена используется в качестве наполнителя в резиновой промышленности, а также в сталелитейной – для того, чтобы полученные сплавы имели мелкозернистую структуру.
Большинство полупроводниковой техники изготавливается с использованием селена. Это и стало главной причиной роста стоимости такого вещества, как селен. Цена возросла от 3,3 до 33 долларов за 1 килограмм в 1930 и 1956 годах соответственно.
Стоимость селена на мировом рынке в 2015 году составила 68 долларов за 1 кг. Тогда как в 2012 килограмм этого металла стоил около 130 долларов за один килограмм. Спрос на селен (цена тому подтверждение) падает из-за высокого предложения.
Вещество также широко используется при производстве фототехники.
Наличие селена в организме человека
Наш организм содержит приблизительно 10-14 миллиграммов этого вещества, которое сосредоточено в большей степени в таких органах, как печень, почки, сердце, селезенка, яички и семенные канатики у мужчин, а также в ядрах клеток.
Потребность человеческого организма в таком микроэлементе как селен невысока. Всего 55-70 микрограммов для взрослых. Предельной суточной дозой считается 400 микрограммов. Тем не менее есть болезнь, называемая болезнь Кешана, которая возникает при дефиците этого элемента. Примерно до 60-х годов селен считался ядовитым веществом, которое оказывает негативное воздействие на организм человека. Но после детального исследования были сделаны обратные выводы.
Часто при выявлении патологического содержания селена врачи могут назначать специальные препараты, содержащие комбинацию цинк-селен-магний, вещества, которые в комплексе восполнят недостаточность его в организме. Разумеется, не исключая продукты, которые содержат селен.

Воздействие на организм
Селену принадлежит очень важная роль в процессе жизнедеятельности организма:
Конечно же, нельзя обойти вниманием такое важное свойство микроэлемента, как помощь в борьбе с опасными вирусами: ВИЧ/СПИД, гепатиты, лихорадка Эбола.
Благодаря наличию селена вирус задерживается внутри клетки; вещество предупреждает распространение вируса по организму. Но если селена недостаточно, то его функция не срабатывает должным образом.
Приём селена в комплексе с йодом поможет остановить прогрессирующее заболевание щитовидной железы (нехватка тироксина), а в некоторых случаях стимулирует регресс болезни (чаще у детей).
Также в медицине селен используется в целях профилактики сахарного диабета, поскольку он ускоряет потребление глюкозы организмом.
Дефицит селена

Важно знать, что злейшим врагом этого вещества является, конечно же, углеводы – мучное, сладкое. В сочетании с ними селен очень плохо усваивается организмом и от этого может возникать его недостаток.
Каковы же признаки дефицита? Прежде всего стоит отметить, что при дефиците селена будет снижаться работоспособность и общее настроение.
Нехватка селена ослабляет иммунитет, вследствие чего организм становится более восприимчивым к различным заболеваниям как психического, так и физического плана.
Также при дефиците этого вещества в организме нарушается процесс усвоения витамина Е.
Основными признаками недостатка селена являются: боли в мышцах и суставах, преждевременная усталость, анемия, обостряются болезни почек и поджелудочной железы.
Но если вы почувствовали какой-то из симптомов, ни в коем случае не следует заниматься медикаментозным самолечением. Обязательно необходимо посетить врача и проконсультироваться по поводу необходимости приёма тех или иных препаратов. Иначе можно самостоятельно вызвать избыток селена, что хуже в некоторых случаях. К примеру, если человек с онкологическим заболеванием будет бесконтрольно принимать селен, химия (химиотерапия) может не подействовать.
Избыток селена
Перенасыщенность селеном также производит негативный эффект на организм. Основными признаками профицита являются: поражение волос и ногтей, повреждение зубов, усталость и постоянные нервные расстройства, потеря аппетита, появление дерматитов, артритов, а также желтушность и шелушение кожи.
Но если вы не работаете на мощностях по добыче селена, или не живете около мест, где добывают это вещество, то можно не бояться избытка селена в организме.
Продукты богатые селеном

Больше всего селена содержится в мясе и печени – свиной, говяжьей, куриной, утиной или печени индейки. К примеру, в 100 граммах печени индейки содержится 71, а в свиной – 53 микрограмма селена.
В 100 граммах мяса осьминога содержится 44,8 мкг селена. Также в рацион стоит включить такие продукты, как креветки, красную рыбу, яйца, кукурузу, рис, фасоль, ячневую крупу и чечевицу, пшеницу, горох, капусту брокколи, неактивные хлебопекарские дрожжи (обработанные разогретой до 60 градусов водой). Не стоит забывать об орехах – фисташки, миндаль, грецкий орех и арахис также содержат селен, пусть и в небольших количествах.
Стоит также помнить о том, что при обработке продуктов вещество теряется, консервы и концентраты содержат в два раза меньше селена, чем свежие продукты. Поэтому, по возможности, необходимо употреблять как можно больше свежих продуктов с содержанием селена.

Селен -это жизненно важный элемент для человека, это мощный антиоксидант-защитник, который является необходимой составляющей небольшой группы белков, каждый из которых играет важную роль в нашем здоровье. Селен стал особенно известен за последние пару десятилетий, благодаря различным исследованиям о том, что из-за систематической недостачи селена в продуктах питания, существует риск развития рака.
Презентация по химии на тему "Селен" (9 класс)

Презентация по химии на тему "Селен" (9 класс)

1.Цель 2.Элемент 3.История 4.Происхождение названия 5.Физические свойства 6.Химические свойства 7.Нахождение в природе 8.Распространение в природе 9.Получение 10.Применение 11.Селен и организм человека 12.Заключение
Презентация по химии на тему "Селен" (9 класс)

Презентация по химии на тему "Селен" (9 класс)

Презентация по химии на тему "Селен" (9 класс)

Презентация по химии на тему "Селен" (9 класс)

Сохранился рассказ самого Берцелиуса о том, как произошло это открытие: Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королёк. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалуне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура. Тогда я собрал всё, что образовалось при получении серной кислоты путём сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию. Я нашёл, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого луна.
Презентация по химии на тему "Селен" (9 класс)

Происхождение названия Название происходит от греч. σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
Презентация по химии на тему "Селен" (9 класс)

Презентация по химии на тему "Селен" (9 класс)

Химические свойства С кислородом Селен образует ряд оксидов: SeO, Se2O3, SeO2, SeO3. Два последних являются ангидридами селенистой H2SeO3 и селеновой H2SeО4 кислот (соли -селениты и селенаты). Наиболее устойчив SeO2. С галогенами Селен дает соединения SeF6, SeF4, SeCl4, SeBr4, Se2Cl2 и другие. Сера и теллур образуют непрерывный ряд твердых растворов с Селеном. С азотом Селен дает Se4N4, с углеродом -CSe2. Известны соединения с фосфором Р2Sе3, Р4Sе3, P2Se5. Водород взаимодействует с Селеном при t>=200 °С, образуя H2Se; раствор H2Se в воде называется селеноводородной кислотой. При взаимодействии с металлами Селен образует селениды. Получены многочисленные комплексные соединения Селена. Все соединения Селена ядовиты.
Презентация по химии на тему "Селен" (9 класс)

Нахождение в природе Натуральный селен. Содержание селена в земной коре — около 500 мг/т. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4•10−4 мг/л. На территории Кавказских Минеральных Вод встречаются источники с содержанием Se от 50 мкг/дм3.
Презентация по химии на тему "Селен" (9 класс)
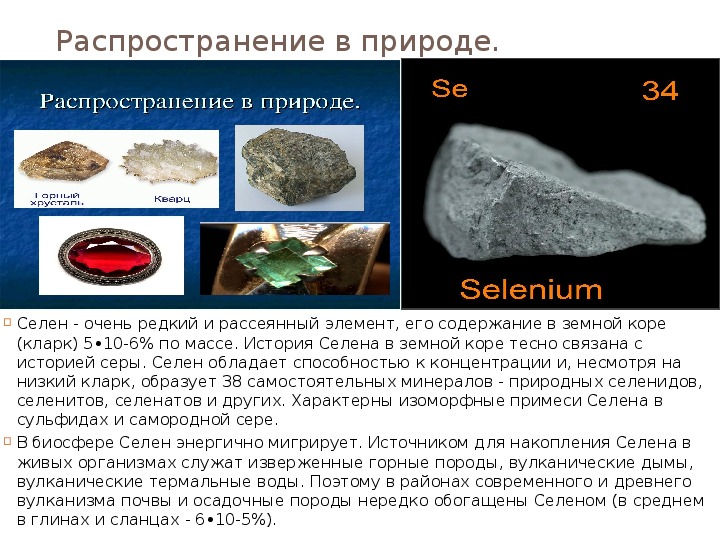
Распространение в природе. Селен - очень редкий и рассеянный элемент, его содержание в земной коре (кларк) 5•10-6% по массе. История Селена в земной коре тесно связана с историей серы. Селен обладает способностью к концентрации и, несмотря на низкий кларк, образует 38 самостоятельных минералов - природных селенидов, селенитов, селенатов и других. Характерны изоморфные примеси Селена в сульфидах и самородной сере. В биосфере Селен энергично мигрирует. Источником для накопления Селена в живых организмах служат изверженные горные породы, вулканические дымы, вулканические термальные воды. Поэтому в районах современного и древнего вулканизма почвы и осадочные породы нередко обогащены Селеном (в среднем в глинах и сланцах - 6•10-5%).
Презентация по химии на тему "Селен" (9 класс)

Презентация по химии на тему "Селен" (9 класс)

. Для получения рубинового стекла в стекольной промышленности используется соединение селена и кадмия (кадмоселит CdSe). В производстве керамики кадмоселит придаёт ей красный цвет, а также окрашивает эмали. Немного селена используется в качестве наполнителя в резиновой промышленности, а также в сталелитейной – для того, чтобы полученные сплавы имели мелкозернистую структуру. Большинство полупроводниковой техники изготавливается с использованием селена. Это и стало главной причиной роста стоимости такого вещества, как селен. Вещество также широко
Презентация по химии на тему "Селен" (9 класс)
Применение Селен применяется как мощное противораковое средство, а также для профилактики широкого спектра заболеваний. Согласно исследованиям, прием 200 мкг селена в сутки снижает риск заболеваемости раком прямой и толстой кишки на 58 %, опухолями простаты — на 63 %, раком легких — на 46 %, снижает общую смертность от онкологических заболеваний на 39 %.Малые концентрации селена подавляют гистамин и за счет этого оказывают антидистрофический эффект и противоаллергическое действие. Также селен стимулирует пролиферацию тканей, улучшает функцию половых желез, сердца, щитовидной железы, иммунной системы.В комплексе с йодом селен используется для лечения иододефицитных заболеваний и патологий щитовидной железы.Соли селена способствуют восстановлению пониженного артериального давления при шоке и коллапсе.
Презентация по химии на тему "Селен" (9 класс)
Селен и организм человека В организме человека содержится 10—14 мг селена, боо́льшая его часть сконцентрирована в печени, почках, селезенке, сердце, яичках и семенных канатиках у мужчин,а также в ядрах клеток.Суточная потребность человека в селене составляет 70-100 мкг.Согласно данным эпидемиологических исследований 1990-х годов, более чем у 80 % россиян наблюдается дефицит селена,так называемая болезнь Кешана.Примерно до 60-х годов селен считался ядовитым веществом, которое оказывает негативное воздействие на организм человека.
Презентация по химии на тему "Селен" (9 класс)

Но после детального исследования были сделаны обратные выводы. Часто при выявлении патологического содержания селена врачи могут назначать специальные препараты, содержащие комбинацию цинк-селен-магний, вещества, которые в комплексе восполнят недостаточность его в организме. Разумеется, не исключая продукты, которые содержат селен . Селен является составным компонентом более 30 жизненно важных биологически активных соединений организма. При дефиците селена иод плохо усваивается организмом.При попадании металлического порошкового селена в количестве 1 грамма перорально вызывает боль в животе в течение двух суток и учащённый стул, со временем симптомы проходят.Соли селена при непосредственном соприкосновении с кожей вызывают ожоги и дерматиты. Диоксид селена при контакте с кожей способен вызывать резкую боль и онемение. При попадании на слизистые оболочки соединения селена могут вызывать раздражение и покраснение, при попадании в глаза резкую боль, слезотечение и конъюктивит.
Презентация по химии на тему "Селен" (9 класс)

Заключение Дефицит селена ведет к усилению перекисного окисления липидов - неферментативному цепному процессу, неадекватное развитие которого грозит грубым и необратимым повреждением мембран клеток, т.е. развитию типовых процессов поражения клетки, лежащих в основе возникновения многих патологических состояний. Из-за неравномерного распределения элемента в различных регионах земного шара, в связи с экологическими факторами, в ряде стран выявляются болезни, связанные с его недостатком (Канада, США, Австралия, Германия, Франция, Китай, Финляндия и др.). Дефицит селена может вызвать заболевания разных органов и систем, протекающие, как правило, на фоне пониженной кислотности; является причиной преждевременного старения и уменьшения продолжительности жизни человека и животных.
Читайте также:

