Сообщение о галогенах интересные факты
Обновлено: 03.07.2024
Галогены – элементы, находящиеся в VIIA группе. Они взаимодействуют со многими неорганическими и органическими соединениями. К ним относятся:
- фтор F;
- хлор Cl;
- бром Br;
- йод I;
- астат At.
Галогены широко распространены в природных условиях.
Строение галогенов
На наружном уровне галогенов располагается шесть спаренных и один неспаренный электрон. До устойчивого состояния элементам недостает одного электрона, поэтому они относятся к сильным окислителям. Молекулы галогенов состоят из двух атомов.
У галогенов в соединениях, как правило, отрицательная степень окисления:
В некоторых соединениях для них характерна положительная степень окисления:
Фтор – самый электроотрицательный элемент, который окисляет даже кислород. Таким образом, существует фторид кислорода OF2.
Закономерности галогенов
Для получения галогенов в свободном состоянии, необходимо оценить способность ионов к окислению. В ряду F-Cl-Br-I увеличивается атомный радиус. Значит, иону сложнее удерживать электроны и, таким образом, окислительные свойства в ряду уменьшаются.
В ряду F-Cl-Br-I уменьшается электроотрицательность. Следовательно, фтор – самый активный элемент. У него самый маленький атомный радиус, поэтому он активно притягивает к себе электроны.
Физические свойства
Для галогенов характерна молекулярная решетка. С этим связаны низкие температуры плавления и кипения, которые по мере увеличения атомной массы повышаются.
В ряду химических элементов F-Cl-Br-I повышается плотность вещества. В нормальных условиях галогены выглядят следующим образом:
- фтор – светло-желтый газ;
- хлор – желто-зеленый газ;
- бром – оранжевая жидкость;
- йод – темно-фиолетовые кристаллы.
Галогены ядовиты и издают неприятный аромат. Они практически не растворимы в воде. Только фтор может реагировать с водой.

Способы получения
Получение хлора
В промышленности хлор получают путем электролиза.
- Электролиз расплава хлорида натрия
- 2 NaCl → 2Na + Cl2
- К (-): Na+ + 1 e → Na 0
- А (+): 2 Cl- - 1 e → Cl2 0
- Электролиз раствора хлорида натрия
- 2NaCl + 2H2O → H2 + 2NaOH + Cl2
- К (-): 2H2O + 2 e → H2 0 + 2OH -
- А (+): 2Cl - - 1 e → Cl2 0
В лаборатории хлор получают при реакции соляной кислоты и сильных окислителей.
Получение фтора
Фтор получают с помощью электролиза расплава.
Получение брома
Бром получают с помощью окисления.
Получение йода
Йод получают с помощью окисления.
Химические свойства
Галогены – окислители, которые реагируют с металлами и неметаллами.
- С серой
- S + Cl2 → SCl2
- С фосфором
- 2Р + 3Cl2 → 2РCl3
- 2Р + 5Cl2 → 2РCl5
- С углеродом
- 2F2 + C → CF4
- С металлами
- 2Fe + 3Cl2 → 2FeCl3 Для ряда химических элементов F-Cl-Br характерно образование галогенидов железа (III), а для йода — железа (II). При реакциях с медью продукты аналогичны.
- С водородом
- F2 + Н2 → 2НF
- С галогенами (более активные вытесняют менее активные галогены)
- Cl2 + F2 → 2ClF
В реакциях со сложными веществами галогены ведут себя как окислители.
Применение галогенов
Костная ткань и зубная эмаль включают соединения фтора. При недостатке фтора зубная эмаль разрушается. В состав плазмы крови входят различные хлориды. Соединения брома регулируют процессы торможения и возбуждения нервной системы. Йод регулирует работу щитовидной железы, а также контролирует обмен веществ.
Фторид кислорода используется в производстве ракетного топлива. Соединения фтора входят в состав зубных паст. С помощью молекулярного хлора обеззараживают воду, а также используют для отбеливания тканей, бумаги, древесины. Поваренная соль – хлорид натрия, который добавляется в пищу. А хлорид калия применяется в качестве удобрения.
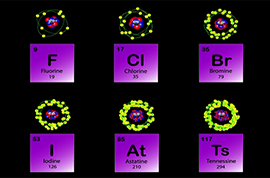
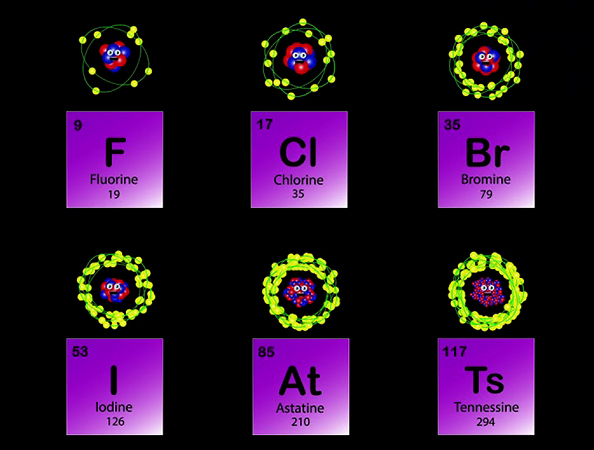
Атомы галогенов
На незавершенном энергетическом уровне у элементов 7 группы не хватает единственного электрона. Они яркие окислители, особенно, фтор. Их восстановительные свойства, ближе к астату, увеличиваются. Каждый галоген является самым сильным окислителем в своем периоде.
Остальные члены группы, как металлы, легко отдают крайние электроны, от 1 до 7. Радиус атома у последнего астата большой. Его отрицательно заряженные частицы дальше всех находятся от положительного ядра.
Свойства простых веществ
Галогены настолько активны, что встречаются в природе только в связанном виде. Они взаимодействуют с водородом, металлами. Галогеноводороды являются едкими газами, источающими резкий запах. Они хорошо растворяются в воде. Их растворы представляют собой кислоты (без кислорода).
Фтор-разрушающий
- Бескислородная кислота фтора (плавиковая) находит широкое применение в целлюлозной, химической, авиационной отраслях промышленности.
- Фреон является рабочим веществом в кондиционерных, холодильных установках.
- Тефлон, лучше платины или золота, устойчив к агрессивным средам.

Орудие в руках художника
В музее Литвы г. Каунас хранятся около 30 уникальных художественных произведений. Их автор художник М. Чюрленис. Он использовал технику рисования на стекле. Предварительно на гладкую поверхность наносится тонкий слой парафина. Затем по нему процарапывают сам рисунок. Стекло опускают в раствор плавиковой кислоты.
Проблема деградации личности при употреблении алкогольных напитков волновала правителей прежних времен. Особо отличившихся жестоко наказывали при всеобщем обозрении. Несчастному человеку давали выпить бесцветную смесь кислот. Большая часть в смертельном растворе – это хлороводород.
Жидкий неметалл и его соли
Бром впервые выделили из раствора золы морских водорослей. При действии хлором жидкость окрасилась в красно-бурый цвет. Соединения бора находят применение в фотографии, медицине. Бромид натрия входит в состав дубильных растворов, для придания твердости кожи.

Соль лития удаляет лишнюю воду из их минеральных масел, предохраняет от коррозии в холодильных установках и кондиционирует воздух. Кристаллы бромида калия используют для изготовления оптических линз. Такие приспособления в приборах ночного видения, хорошо пропускают ИФ-лучи.
Йод в гормонах, морской капусте…
Получают водоросль ламинарию из природных растворов, содержащих йод – соленой воды морей, озер, попутных нефтяных жидкостей. В человеческом организме дефицит галогена вызывает нарушения обменных процессов. В соответствующих районах медики советуют использовать в пищу йодированную соль.

В гормоне тироксине, вырабатываемом щитовидной железой, галогена содержится до 65%. Недостаток его вызывает Базедову болезнь. При приеме препаратов йода улучшаются показатели домашнего скота, увеличиваются:
- Надой молока у коров.
- Яйценоскость кур.
- Рост шерсти овец.
- Откорм свиней.
При ликвидации последствий разрушительных аварий на АЭС пострадавшим рекомендуют употреблять небольшие дозировки раствора йода. Доказано, что при этом из организма выводятся радионуклеотиды.
Неустойчивый астат
Предсказанный еще Д.И. Менделеевым, галоген смогли синтезировать только в 1940 г. Элемент очень похож на йод, но только металлический по характеру. Все искусственные изотопы астата радиоактивные и короткоживущие. Синтез элемента впервые был осуществлен американцами. Путем бомбардировки ядра атома висмута альфа-частицами.
Некоторые интересные факты из истории химии
Открытие галогенов
Открытие фтора
Выделение газообразного фтора из фторсодержащих веществ оказалось одной из самых трудных экспериментальных задач. Фтор обладает исключительной реакционной способностью; причем часто его взаимодействие с другими веществами происходит с воспламенением и взрывом.
Первыми жертвами фтора были два члена Ирландской Академии наук братья Георг и Томас Нокс. Томас Нокс скончался от отравления фтороводородом, а Георг стал инвалидом. Следующей жертвой стал бельгийский химик П. Лайет. Мученическую смерть при проведении опытов по выделению фтора принял французский химик Джером Никлес. Отравились, надышавшись небольшими количествами фтороводорода, а также получили серьезные ожоги французские химики Жозеф Гей-Люссак, Луи Тенар и английский химик Гемфри Дэви. При попытках выделить фтор при помощи электролиза его соединений нанесли ущерб своему здоровью французский химик Эдмон Фреми и английский электрохимик Георг Гор. Только в 1886 году французскому химику Анри Муассану сравнительно безболезненно удалось получить фтор. Муассан случайно обнаружил, что при электролизе смеси жидкого безводного HF и гидродифторида калия (KHF2) в платиновом сосуде на аноде выделяется светло-желтый газ со специфическим резким запахом. Однако, когда Муассан докладывал Парижской академии наук о своем открытии, один глаз ученого был закрыт черной повязкой:
Нобелевская премия по химии была присуждена Муассану в 1906 г "в признание большого объема исследований - получения элемента фтора и введения в лабораторную и промышленную практику электрической печи, названной его именем".
Открытие хлора
Первооткрывателем хлора оказался шведский аптекарь Карл Шееле, химическая интуиция которого была поистине поразительной, по словам французского химика Жана Батиста Дюма, Шееле "не мог прикоснуться к какому-либо телу без того, чтобы сделать открытие". В 32 года он был удостоен звания члена Стокгольмской академии наук, хотя был всего лишь аптекарским помощником, в том же году он получил место управляющего аптекой, принадлежавшей вдове Маргарите Соннеман, которая за два дня до смерти Шееле стала его женой.
Вот как описал Шееле свой опыт, выполненный в 1774 году: "Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, окрасившим его в желтый цвет: Газ имел желто-зеленый цвет, пронзительный запах":
Современное обозначение этой реакции таково: MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O.
В 1812 году французский химик Гей-Люссак дал этому газу современное название - хлор, что в переводе с греческого означает желто-зеленый.
Открытие брома
Бром был открыт двадцатичетырехлетним лаборантом Антуаном-Жеромом Баларом. Балар изучал маточные рассолы южных соляных болот Франции. Во время одного из опытов, когда он подействовал на рассол хлором, он заметил появление весьма интенсивной желтой окраски, вызванной реакцией взаимодействия содержащегося в растворе бромида натрия с хлором. Через несколько лет напряженной работы Балар выделил необходимое количество темно-бурой жидкости, названной им муридом. В Парижской Академии наук Гей-Люссак и Тенар подтвердили открытие Баларом нового простого вещества, но нашли название неудачным и предложили свое - "бром", что в переводе с греческого означало зловонный.
Впоследствии французский химик Шарль Жерар, не получивший кафедру химии во Французском колледже, которую передали Балару, высоко оценив открытие им брома, не смог удержаться от резкого восклицания : "Это не Балар открыт бром, а бром открыл Балара!"
Открытие иода
В 1811 году французский химик-технолог и фармацевт Бернар Куртуа открыл иод. Друзья его рассказывают любопытные подробности этого открытия. У Куртуа был любимый кот, который во время обеда сидел обычно на плече своего хозяина. Куртуа часто обедал в лаборатории. В один из дней во время обеда кот, чего-то испугавшись, прыгнул на пол, но попал на бутылки, стоявшие около лабораторного стола. В одной бутылке Куртуа приготовил для опыта суспензию золы водорослей (содержащей иодид натрия) в этаноле, а в другой находилась концентрированная серная кислота. Бутылки разбились и жидкости смешались. С пола стали подниматься клубы сине-фиолетового пара, которые оседали на окружающих предметах в виде мельчайших черно-фиолетовых кристалликов с металлическим блеском и едким запахом. Это и был новый химический элемент иод.
(Факты взяты из следующих книг: М. Джуа. История химии. 1975.; Б. Д. Степин, Л. Ю. Аликберова. Книга по химии для домашнего чтения. 1995. К. Манолов. Великие химики. (том 1, том 2), 1976.).
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
Что такое галогены
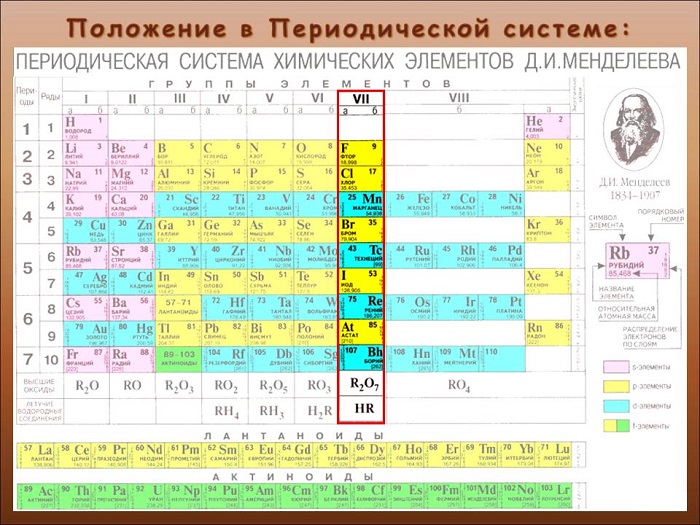
Перечень и общая характеристика галогенов
С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.
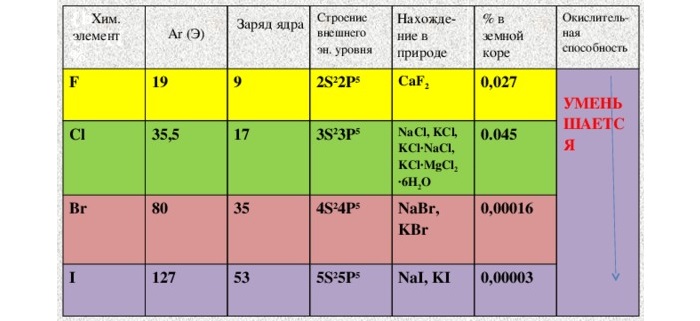
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Физические свойства

Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Общее уравнение:
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):

Небольшая подборка интересных сведений о галогенах. Можно использовать на уроке, внеклассном мероприятии.
Интересные сведения о галогенах
1. Жертвами этого элемента становились многие ученые: кто-то умирал от отравления, кто-то становился инвалидом… Отравились, а также получили серьезные ожоги французские химики Жозеф Гей-Люссак, Луи Тенар и английский химик Гемфри Дэви. Выделить простое вещество - светло-желтый газ со специфическим резким запахом,
образованное этим элементом, оказалось одной из самых трудных экспериментальных задач. Лишь в 1886 году французскому химику Анри Муассану сравнительно безболезненно удалось получить его. Что получил Муассан?
А) бром Б) хлор В) фтор Г) йод
Ответ: Нобелевская премия по химии была присуждена Муассану в 1906 г за большой объем исследований по получению фтора. Фтор обладает исключительной реакционной способностью; причем часто его взаимодействие с другими веществами происходит с воспламенением и взрывом. Первыми жертвами фтора были братья Георг и Томас Нокс. Следующей жертвой стал бельгийский химик П. Лайет. Мученическую смерть при проведении опытов по выделению фтора принял французский химик Джером Никлес, нанесли ущерб своему здоровью французский химик Эдмон Фреми и английский электрохимик Георг Гор.
2. У французского химика Бернарда Куртуа был любимый кот, который во время обеда сидел обычно на плече своего хозяина. Куртуа часто обедал в лаборатории. Однажды кот, чего-то испугавшись, прыгнул на пол, но попал на бутылки, стоявшие около стола. В одной из бутылок находилась суспензия золы водорослей, а в другой – концентрированная серная кислота. Бутылки разбились и с пола стали подниматься клубы сине-фиолетового пара, которые оседали на окружающих предметах в виде черно-фиолетовых кристаллов с металлическим блеском. Какой элемент был открыт?
А) углерод Б) бром В) йод Г) марганец
Ответ: Французский химик Бернард Куртуа в 1811 году открыл химический элемент йод (iodes-фиолетовый). Именно этот важный элемент отвечает за работу человеческого сердца, нервной системы, поддержание иммунитета, за интеллектуальный потенциал, правильный обмен веществ и гормональный баланс.
А) йод Б) бром В) фтор Г) сероводород
Читайте также:

