Сообщение о бинарных соединениях воды
Обновлено: 05.07.2024
Бинарные соединения, несмотря на кажущуюся простоту их химического состава, представляют собой следующий после простых веществ принципиально важный объект изучения природы вещества. С химической точки зрения, этот класс веществ обладает и качественно иными характеристиками, с которыми не приходится сталкиваться при изучении простых веществ. Во-первых, помимо внешних факторов, влияющих на состояние и свойства вещества (температура и давление), здесь появляется и внутренний фактор — состав, и связанная с ним проблема постоянства и переменности состава, имеющая фундаментальное значение в химии. Во-вторых, при описании бинарных соединений впервые формируются такие базисные понятия, как валентность, степень окисления, поляризация химической связи. Здесь, в отличие от простых веществ, появляются гетерополярная составляющая химической связи и все эффекты, связанные с разностью электроотрицательностей компонентов.
Исключительно важную роль играют бинарные соединения с классификационной точки зрения. Многие из них относятся и к так называемым характеристическим соединениям, отражающим типичные степени окисления и их сравнительную стабильность. К таким соединениям относятся прежде всего оксиды, летучие водородные соединения, а также галогениды.
Содержание
Номенклатура
Бинарные соединения — это собирательная группа веществ, которые имеют различное химическое строение. Поэтому их номенклатура может варьироваться в зависимости от генетической принадлежности.
Названия простых бинарных веществ, как правило, образуются добавлением к названию более электроотрицательного элемента суффикса -ид. При необходимости к названиям элементов добавляют кратные приставки или указывают в скобках степень окисления электроположительного элемента без пробела:
- SiC — карби́д кре́мния
- KBr — броми́д ка́лия
- CS2 — дисульфи́д углеро́да или сульфид углерода(IV)
В сложных бинарных соединениях суффикс -ид добавляется к названиям элементов, находящихся в низших степенях окисления:
- PCl3O — окси́д-трихлори́д фо́сфора
- CrO2Cl2 — диокси́д-дихлори́д хро́ма
- СCl2O — окси́д-дихлори́д углеро́да или хлорангидридугольной кислоты, больше известный как фосген.
Многие широко известные бинарные соединения носят тривиальные названия, среди них уже приведенный выше фосген, вода H2O аммиак NH3, веселящий газ N2O и другие.
Свойства
Группа бинарных соединений включает в себя очень большое число веществ, и, естественно, все эти вещества различаются по физическим свойствам. Среди бинарных соединений есть представляющие собой при нормальных условиях газы (например, аммиак, фосфин), жидкости (например, тетрахлорид титана TiCl4, дисульфид углерода CS2) и твердые вещества (например, нитрид бора BN, карбид кремния SiC)
Химическая связь в бинарных соединениях — ковалентная полярная (в соединениях неметаллов и некоторых амфотерных элементов) или ионная (в солях бескислородных кислот).
Многие бинарные соединения гидролизуются водой, например фосфин или хлорид алюминия.
Получение
Часто бинарные соединения можно получить прямым взаимодействием простых веществ между собой:
Другие бинарные вещества могут получаться более сложным путем — через реакции обмена или окислительно-восстановительные реакции:
Применение
В силу того, что к данной группе веществ можно отнести очень большое их количество, можно сказать, что бинарные соединения применяются практически во всех областях деятельности человека, от приготовления пищи до использования в качестве сырья для крупнотоннажных производств. Ниже приведены примеры использования некоторых веществ, относящихся к бинарным соединениям.
Аммиак
В химической промышленности аммиак используется в качестве прекурсора для получения азотной кислоты и для производства химических удобрений. Кроме того, аммиак используется в большом количестве разнообразных химических синтезов, в том числе в тонком органическом синтезе. В жидком аммиаке химически растворяются многие вещества, например, калий, натрий, сера. Аммиак применялся в качестве хладагента в первых холодильниках, и до недавнего времени превалировал в промышленных холодильных установках.
Гексафторид урана
Летучий гексафторид урана UF6 применяется для разделения изотопов урана в процессе его обогащения, а также как фторирующий агент.
Карбид вольфрама
Карбид вольфрама в силу своей исключительной твердости находит очень широкое применение в производстве разнообразного режущего инструмента. А в силу своей химической инертности -- в производстве химического оборудования для работы в агрессивных средах.Пример:печи,ножи,лабораторное оборудование полный бред)
Оксид диазота
Хлороводород
Водный раствор хлороводорода (соляная кислота) широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамата натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Литература
Андреева Л. Л., Лидин Р. А., Молочко В. А. Химические свойства неорганических веществ. Учебное пособие для вузов. — М.: Химия, 1996
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Бинарные соединения" в других словарях:
Нестехиометрические соединения — Бертоллиды (термин в память К.Л. Бертолле) соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Это нестехиометрические бинарные соединения переменного состава, зависящего от способа получения. Многочисленные… … Википедия
НИКЕЛЬОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — содержат связь NiЧС. Связь Ni с орг. лигандом может осуществляться по s и p типу (соотв. s и p комплексы). s К о м п л е к с ы. Соед. Ni с s связью NiЧС относятся в осн. к типам [Ni(R2)L2] и [NiX(R)L2] (R = Alk или Аr, L = PR 3, амины и др., Х… … Химическая энциклопедия
МЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ — (металлиды), обладают металлич. св вами, в частности электрич. проводимостью, что обусловлено металлич. характером хим. связи. К М. с. относятся соед. металлов друг с другом интер металлиды и мн. соед. металлов (в осн. переходных) с неметаллами.… … Химическая энциклопедия
полупроводниковые материалы — полупроводники, применяемые для изготовления электронных приборов и устройств. Используют главным образом кристаллические полупроводниковые материалы (например, легированные монокристаллы кремния или германия, химические соединения некоторых… … Энциклопедический словарь
Химическая номенклатура — страдает беспринципностью и синонимизмом, благодаря чему она трудна для изучения (ср. отзыв о ней Дюма Орто). Древние называли различные вещества частью по их происхождению, частью по месторождению, частью же употребляли для них случайные… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Плутоний — 94 Нептуний ← Плутоний → Америций Sm ↑ Pu … Википедия
Неорганическое вещество — или неорганическое соединение это химическое вещество, химическое соединение, которое не является органическим, то есть оно не содержит углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые… … Википедия
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ — кристаллы, образованные из молекул, связанных друг с другом слабыми ван дер ваальсовыми силами или водородной связью (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ, МЕЖАТОМНОЕ ВЗАИМОДЕЙСТВИЕ). Внутри молекул между атомами действует более прочная, обычно… … Физическая энциклопедия
Фосфиды — Фосфиды бинарные соединения фосфора с другими менее электроотрицательными химическими элементами, в которых фосфор проявляет отрицательную степень окисления. Получение Большинство фосфидов представляют собой соединения фосфора с типичными… … Википедия
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Слайды и текст этой презентации
Автор презентации Беземская И.В.

Автор презентации Беземская И.В.
Автор презентации Беземская И.В.
Бинарными
называют вещества, состоящие из
д в у х химических элементов.
Автор презентации Беземская И.В.

З а д а н и е: определите степени окисления элементов в указанных соединениях
+1 - 2 + 4 - 2 + 5 - 2 + 6 - 2 + 4 -2 + 3 -2
K2O СO2 P2O5 SO3 SiO2 Al2O3
Автор презентации Беземская И.В.

Какое бинарное соединение самое
важное в природе и в жизни человека?
Автор презентации Беземская И.В.
Антуан Де Сент-Экзюпери
Автор презентации Беземская И.В.

Автор презентации Беземская И.В.

Автор презентации Беземская И.В.
Автор презентации Беземская И.В.

ВОДА
ВАЖНЕЙШЕЕ
БИНАРНОЕ
СОЕДИНЕНИЕ
Автор презентации Беземская И.В.
Автор презентации Беземская И.В.
обобщить и расширить знания о воде, полученные при изучении физики, биологии, химии, географии, экологии и использовать их для решения проблемных задач.
Автор презентации Беземская И.В.
ВОПРОСЫ
для обсуждения
Автор презентации Беземская И.В.

Тема исследования:
Состав, строение и физические свойства воды.
Автор презентации Беземская И.В.
качественный и количественный состав
молекулы воды
24 июня 1783 г. А. Лавуазье и П. Лаплас
синтез воды из “горючего воздуха”
Автор презентации Беземская И.В.
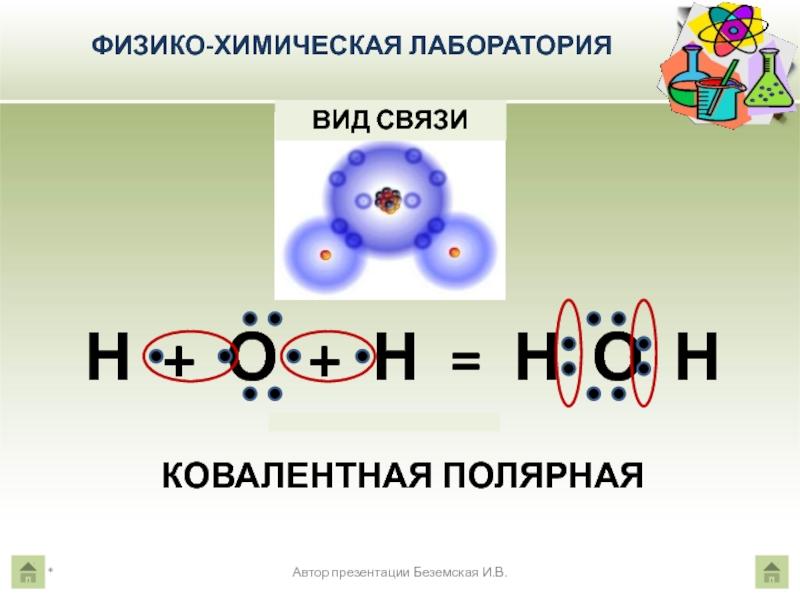
Автор презентации Беземская И.В.

Объемная модель молекулы воды
Молекулярная формула молекулы воды
Автор презентации Беземская И.В.

Автор презентации Беземская И.В.

Автор презентации Беземская И.В.
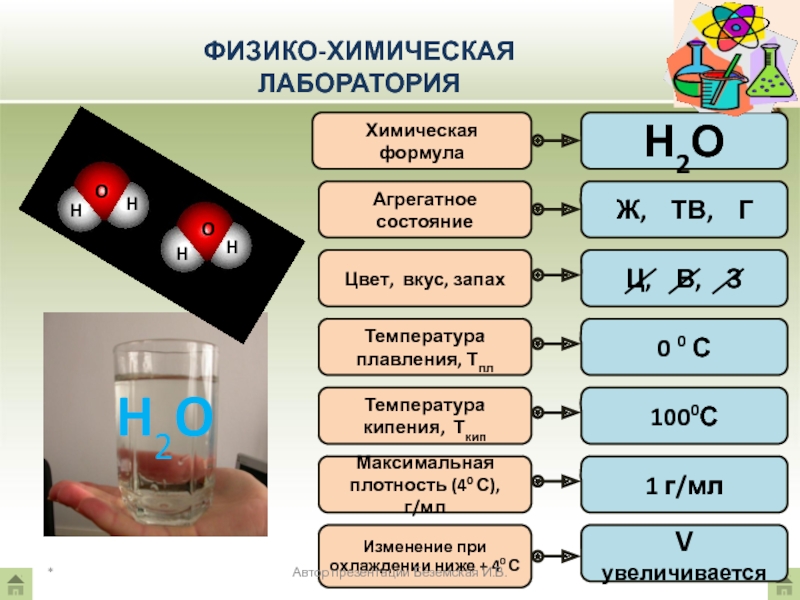
Цвет, вкус, запах
Температура плавления, Тпл
Температура
кипения, Ткип
Максимальная плотность (40 С), г/мл
Изменение при охлаждении ниже + 40 С
Автор презентации Беземская И.В.

При замерзании V воды увеличивается и вода разрывает сосуд
Автор презентации Беземская И.В.

Как называется процесс разложения воды на кислород и водород под действием электричества?
Какой газ, получаемый при разложении воды, можно использовать как топливо?
Каким преимуществом обладает этот газ перед другими видами топлива?
экологически чистое топливо
Автор презентации Беземская И.В.

max ρ (Н2О) = 1 г/мл
max ρ (льда) = 0,92 г/мл
Лед плавает на поверхности водоема
При замерзании V воды увеличивается и вода разрывает сосуд
У воды самая большая теплоемкость (в 3100 раз больше, чем у воздуха, в 4 раза больше, чем у горных пород)
Между молекулами воды – водородная связь
Автор презентации Беземская И.В.

Теперь отдохнем. Минута отдыха. Вода, вода, кругом вода. Сейчас мы поплаваем. Скоро будет дан старт к заплыву, а пока разминаемся. Поплыли – кроль, брасс, баттерфляй, по-собачьи, на спине. Не заплывать за буйки!
Автор презентации Беземская И.В.

Тема исследования:
Значение воды в природе
Выяснить роль воды в :
- жизни растений,
- животных и человека
Автор презентации Беземская И.В.
Вода – уникальный растворитель: почвенное питание растений, обменные процессы.
Автор презентации Беземская И.В.
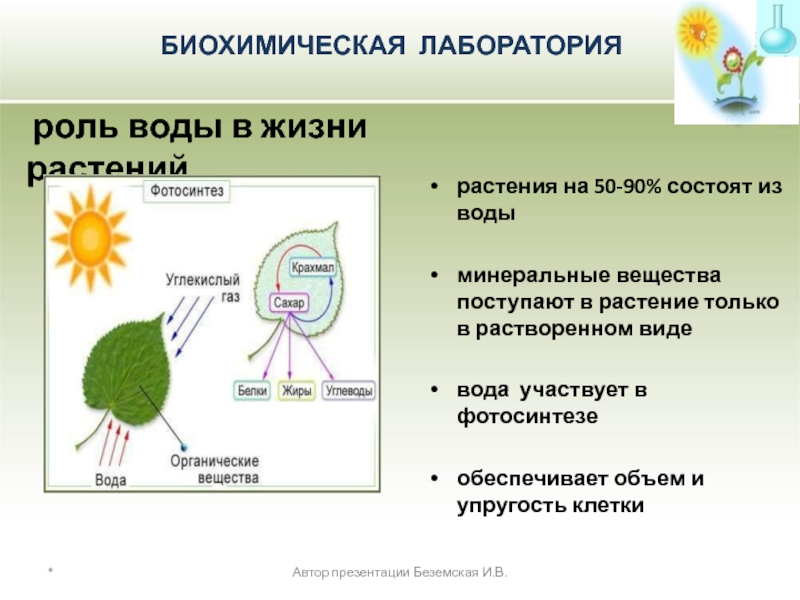
растения на 50-90% состоят из воды
минеральные вещества поступают в растение только в растворенном виде
вода участвует в фотосинтезе
обеспечивает объем и упругость клетки
роль воды в жизни растений
Автор презентации Беземская И.В.
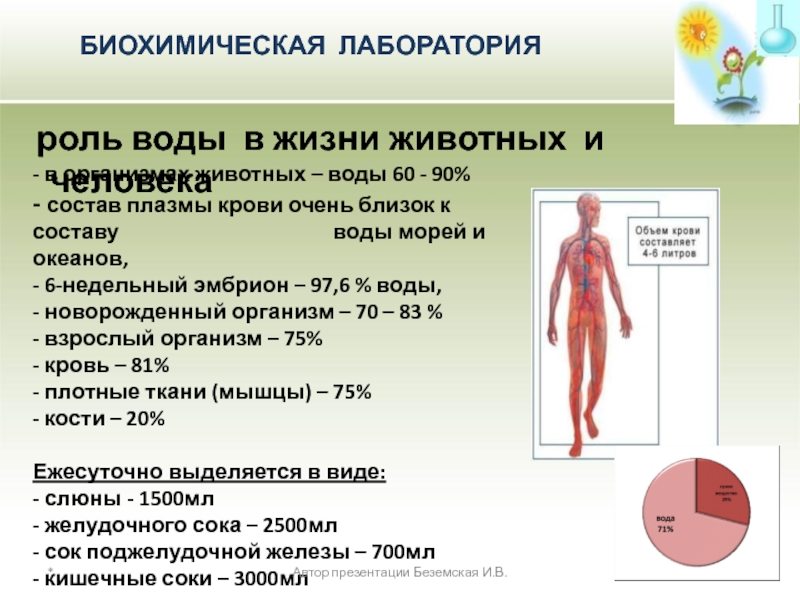
роль воды в жизни животных и человека
- в организмах животных – воды 60 - 90%
- состав плазмы крови очень близок к составу воды морей и океанов,
- 6-недельный эмбрион – 97,6 % воды,
- новорожденный организм – 70 – 83 %
- взрослый организм – 75%
- кровь – 81%
- плотные ткани (мышцы) – 75%
- кости – 20%
Ежесуточно выделяется в виде:
- слюны - 1500мл
- желудочного сока – 2500мл
- сок поджелудочной железы – 700мл
- кишечные соки – 3000мл
Автор презентации Беземская И.В.
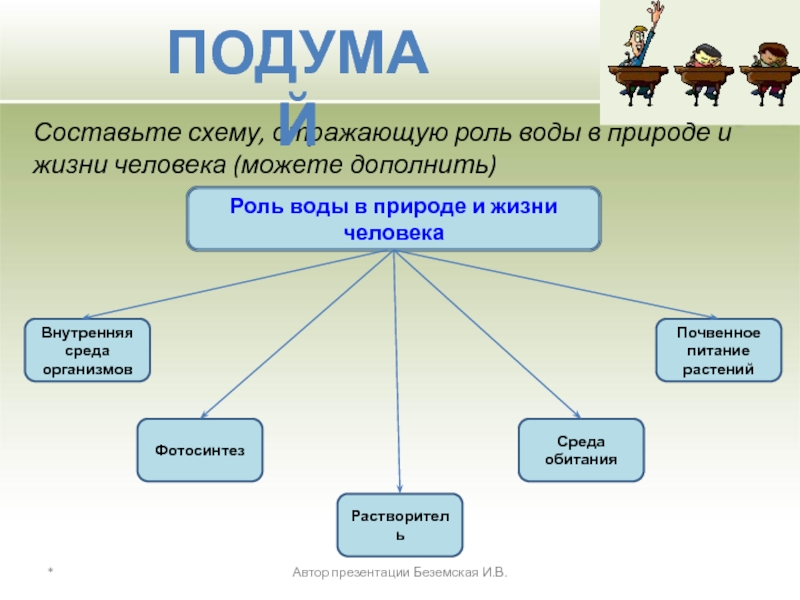
Роль воды в природе и жизни человека
Составьте схему, отражающую роль воды в природе и жизни человека (можете дополнить)
Внутренняя среда организмов
Почвенное питание растений
Автор презентации Беземская И.В.
Автор презентации Беземская И.В.

При потере воды в количестве 6% от массы тела у человека повышается температура, при потере 10% - нарушается глотательный рефлекс, начинаются галлюцинации, а при потере 15% жидкости человек умирает, как вы думаете почему?
кровь густеет настолько, что сердце не может её толкать
Посмотрите ваши расчёты. Какова для вашего организма критическая норма потери воды - это величина 15 %.
Автор презентации Беземская И.В.

Автор презентации Беземская И.В.

Автор презентации Беземская И.В.

Водная оболочка Земли — гидросфера— составляет 71% земной поверхности. В связанном состоянии вода находится и в земной коре — литосфере
Запасы воды на Земле (в литосфере и гидросфере) составляют 2,7 млрд. км3
Пресные воды составляют порядка 2,5 % общего планетарного запаса воды. Большая часть воды находится не в открытых водоемах, а в земной коре: 110—190 млн. км3. Эти воды подразделяются на два типа в соответствии с глубиной их залегания – подземные и поверхностные воды
В атмосфере в виде паров содержится
13 000 км3 воды
содержание воды в природе
Автор презентации Беземская И.В.

Представим, что круговорот воды исчез …
Автор презентации Беземская И.В.
Гидросфера, атмосфера, литосфера связаны между собой единым глобальным процессом
круговоротом воды в природе
В Российской Федерации устанавливается государственная собственность на водные объекты. Водный кодекс РФ, статья 34
Автор презентации Беземская И.В.
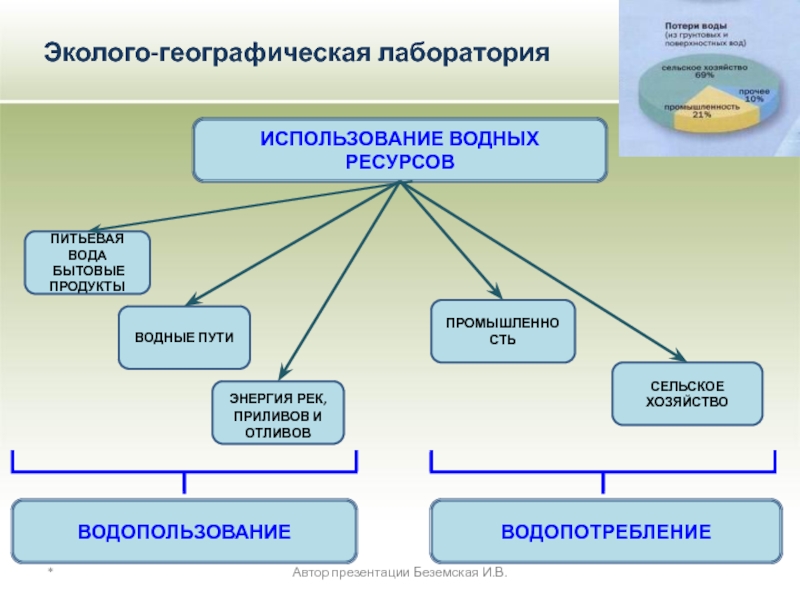
ИСПОЛЬЗОВАНИЕ ВОДНЫХ РЕСУРСОВ
ПИТЬЕВАЯ ВОДА
БЫТОВЫЕ ПРОДУКТЫ
ЭНЕРГИЯ РЕК,
ПРИЛИВОВ И ОТЛИВОВ
Автор презентации Беземская И.В.

Промышленность нашей страны ежесекундно потребляет столько воды, сколько несет ее Волга. На получение 1 т
стали расходуется 150 т воды
бумаги — 250 т воды
синтетических волокон — 4000 т воды
Вода обязательно требуется для процессов схватывания и твердения вяжущих материалов — цемента, гипса, извести.
Автор презентации Беземская И.В.
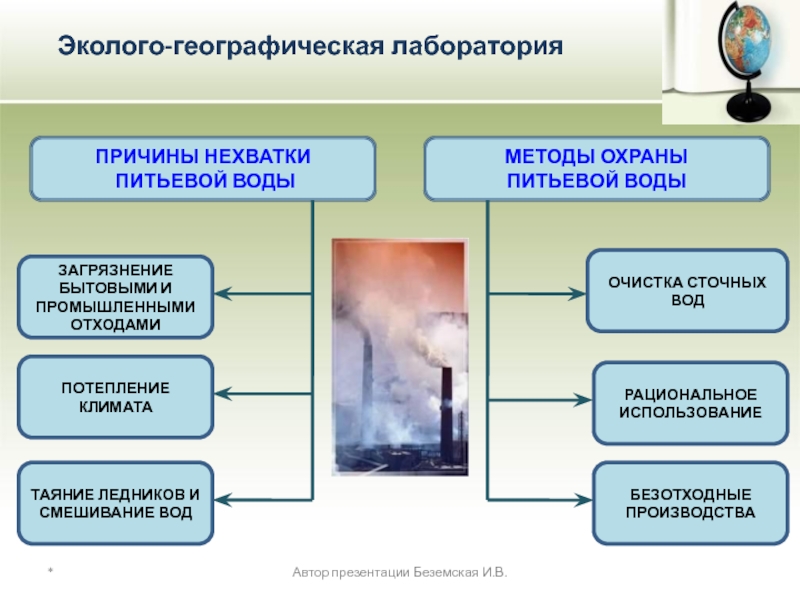
ПРИЧИНЫ НЕХВАТКИ
ПИТЬЕВОЙ ВОДЫ
МЕТОДЫ ОХРАНЫ
ПИТЬЕВОЙ ВОДЫ
ЗАГРЯЗНЕНИЕ БЫТОВЫМИ И ПРОМЫШЛЕННЫМИ ОТХОДАМИ
ТАЯНИЕ ЛЕДНИКОВ И СМЕШИВАНИЕ ВОД
ОЧИСТКА СТОЧНЫХ ВОД
Автор презентации Беземская И.В.

Требования, предъявляемые к питьевой воде:
- должна быть бесцветной, чистой,
должна иметь хороший вкус и не иметь запаха.
в ней не должны содержаться химические и биологические примеси
хлорирование и озонирование
Автор презентации Беземская И.В.

В моря впадает множество рек. Почему же тогда моря не переполняются и не заливают сушу?
Суша не заливается водой, потому что в природе существует круговорот воды – процесс испарения воды с поверхности Земли и всех водоемов: морей и океанов. За один год испаряется огромное количество воды, однако столько же ее возвращается обратно в виде снега и дождя.
Автор презентации Беземская И.В.

Как вода помогает обогревать помещения в холодную погоду?
В котельной нагревают воду. По трубам горячая вода поступает в дома, где попадает в батареи и через них отдает свое тепло окружающему их воздуху.
Автор презентации Беземская И.В.
Автор презентации Беземская И.В.

Николай Наумов.
Воде
Ты можешь быть мягкой и жесткой, Ты можешь дать жизнь и отнять, Ты можешь, вращая турбины, Полночную тьму разгонять. Ты можешь согреть мегаполис И льдами сковать полюса, Ты сладостью душу напоишь И солью прольешься в глаза… Знакома от пара до снега, Как солнце и воздух нужна Природе, Земле, Человеку – Живая, Святая Вода.
Бинарные соединения - это вещества, которые образованы двумя различными химическими элементами. Этот термин применяют при обозначении качественного и количественного состава неорганических соединений.
Бинарные химические соединения считаются важным объектом в изучении природы веществ. При их описании используют следующие понятия: поляризация связи, степень окисления, валентность. Данные химические термины позволяют понять суть образования химической связи, особенности строения неорганических веществ.
Рассмотрим основные классы бинарных соединений, особенности их химического строения и свойства, некоторые области их промышленного применения.

Оксиды
Данный класс неорганических веществ является самым распространенным в природе. Среди известных представителей этой группы соединений выделим:
- оксид кремния (речной песок);
- оксид водорода (вода);
- углекислый газ;
- глина (оксид алюминия);
- железняки (оксиды железа).
Такие бинарные соединения - это сложные вещества, в составе которых обязательно присутствует кислород, проявляющий степень окисления -2.
Агрегатное состояние оксидов
Соединения меди, кальция, железа являются кристаллическими твердыми веществами. Такое же агрегатное состояние имеют оксиды некоторых неметаллов, например шестивалентной серы, пятивалентного фосфора, кремния. Жидкостью при нормальных условиях является вода. Подавляющее большинство кислородных соединений неметаллов являются газами.
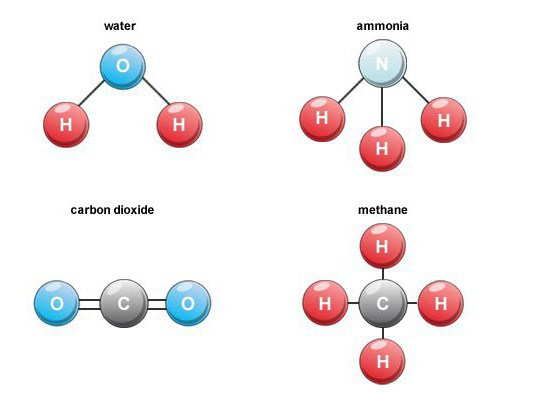
Особенности образования
Многие бинарные кислородные соединения образуются в природе. Например, при сгорании топлива, дыхании, гниении органических веществ формируется углекислый газ (оксид углерода 4). В воздухе его объемное содержание составляет около 0,03 процентов.
Подобные бинарные соединения - это продукты деятельности вулканов, а также составная часть минеральной воды. Углекислый газ не поддерживает горения, поэтому данное химическое соединение применяется для тушения пожаров.
Летучие водородные соединения
Такие бинарные соединения - это важная группа веществ, в составе которых присутствует водород. Среди представителей, имеющих промышленное значение, отметим метан, воду, сероводород, аммиак, а также галогеноводороды.
Часть летучих водородных соединений присутствует в почвенных водах, живых организмах, поэтому можно вести речь об их геохимической и биохимической роли.
Чтобы составлять бинарные соединения такого вида, на первое место ставят водород, имеющий валентность. В качестве второго элемента выступает неметалл, имеющий отрицательную степень окисления.
Для расстановки индексов в бинарном соединении между валентностями определяется наименьшее общее кратное. Количество атомов каждого элемента определяют путем деления его на валентности каждого элемента, входящего в состав соединения.
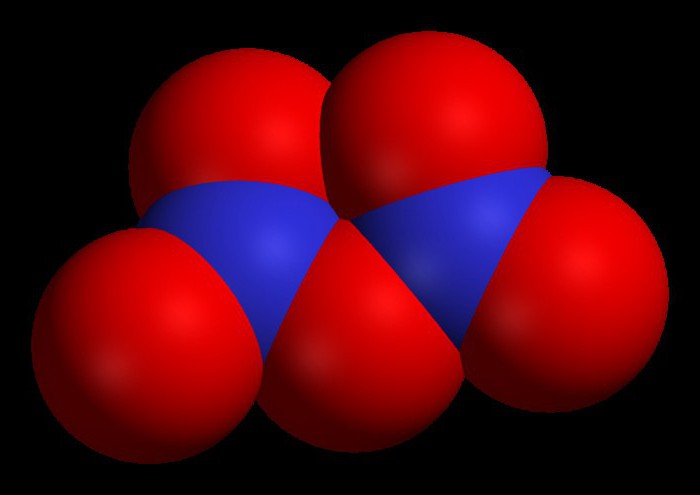
Хлороводород
Рассмотрим формулы бинарных соединений: хлороводорода и аммиака. Именно эти вещества имеют значение для современной химической промышленности. HCl при нормальных условиях является газообразным соединением, хорошо растворимым в воде. После растворения газообразного хлороводорода образуется соляная кислота, используемая во многих химических процессах и производственных цепочках.
Это бинарное соединение содержится в желудочном соке человека и животных, является барьером для болезнетворных микробов, проникающих с пищей в желудок.
Среди основных областей применения соляной кислоты выделим получение хлоридов, синтез хлорсодержащих продуктов, травление металлов, очистку труб от оксидов и карбонатов, кожевенное производство.
Аммиак, имеющий формулу NH3, является бесцветным газом, обладающим специфическим резким запахом. Его неограниченная растворимость в воде позволяет получать нашатырный спирт, востребованный в медицине. В природе данное бинарное соединение образуется в процессе гниения органических продуктов, в составе которых присутствует азот.

Классификация оксидов
Кислородсодержащее бинарное соединение металла, имеющего валентность 1 или 2, является основным оксидом. Например, к этой группе относят оксиды щелочных и щелочноземельных металлов.
Оксиды неметаллов, а также металлов с валентностью больше 4, являются кислотными соединениями.
В зависимости от химических свойств представителей данного класса делят на солеобразующие и несолеобразующие группы.
Среди типичных представителей второй группы отметим угарный газ (CO), оксид азота 1 (NO).
Формирование систематических названий соединений
Например, SO3 – триоксид серы, N2O4 – тетроксид диазота, I2CL6 – гексахлорид диода.
Если в бинарном соединении присутствует химический элемент, способный проявлять разные степени окисления, после названия соединения в круглых скобках указывают состояние окисления.
К примеру, два соединения железа отличаются по названию: FeCL3 - оксид железа (3), FeCL2 – оксид железа (2).
Для гидридов, в частности неметаллических элементов, пользуются тривиальными названиями. Так, H2O – вода, HCL – хлороводород, HI – йодоводород, HF – плавиковая кислота.
Катионы
Положительным ионам тех элементов, которые способны образовывать только один устойчивый ион, дают такие же названия, как и у самих символов. К ним относятся все представители первой и второй групп периодической системы Менделеева.
Например, катионы натрия и магния имеют вид: Na + , Mg 2+ . Переходные элементы способны образовывать несколько видов катионов, поэтому в названии необходимо указывать валентность, проявляемую в каждом отдельном случае.
Анионы
У простых (одноатомных) и комплексных (многоатомных) анионов применяется суффикс –ид.
Распространенным оксоанионом определенного элемента является суффикс –ам. Для оксоаниона элемента, находящегося в формуле с меньшей степенью окисления, применяется суффикс –ит. Для минимального состояния окисления используется приставка гипо-, а для максимального значения – пер-. Например, ион О 2- является оксид-ионом, а О - - пероксидом.
Существуют и разнообразные тривиальные названия гидридов. Например, N2H4 именуют гидразином, а PH3 называют фосфином.
Серосодержащие оксоанионы имеют следующие названия:
- SO 4 2- - сульфат;
- S2O3 2- - тиосульфат;
- NCS - - тиоцианат.
Для определения количества атомов каждого элемента находят наименьшее кратное между валентностями, при делении получают индексы.
У таких соединений высокая температура плавления и кипения, хорошая растворимость в воде, при нормальных условиях они являются твердыми веществами. Например, хлориды натрия и калия входят в состав морской воды.
Поваренную соль люди применяют с древних времен. В настоящее время использование этого бинарного соединения не ограничивается употреблением в пищу. При электролизе водного раствора хлорида натрия получают металлический натрий и газообразный хлор. Эти продукты используются в различных производственных процессах, например для получения гидроксида натрия, хлороводорода.
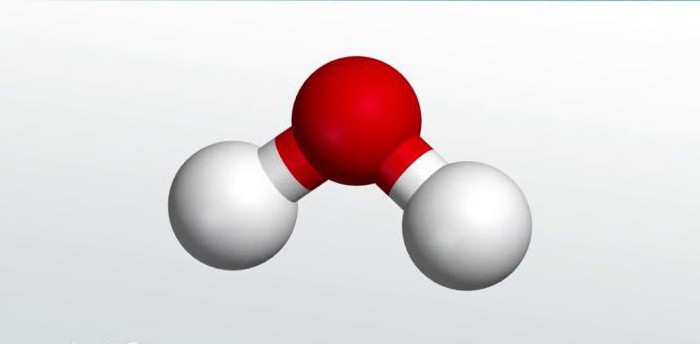
Значение бинарных соединений
К данной группе относится огромное количество веществ, поэтому можно с уверенностью говорить о масштабности их использования в разных сферах человеческой деятельности. Аммиак в химической промышленности применяют в качестве прекурсора при изготовлении азотной кислоты, производстве минеральных удобрений. Именно это бинарное соединение применяют в тонком органическом синтезе, долгое время использовали в холодильных установках.
Благодаря уникальной твердости карбида вольфрама, это соединение нашло применение в изготовлении многообразного режущего инструмента. Химическая инертность этого бинарного соединения позволяет применять его в агрессивных средах: лабораторном оборудовании, печах.
Все бинарные соединения имеют ковалентный либо ионный характер химической связи, молекулярную, ионную или атомную кристаллическую решетку.
Заключение
При составлении формул бинарных соединений необходимо соблюдать определенный алгоритм действий. Сначала записывается элемент, который проявляет положительную степень окисления (имеет меньшее значение электрической отрицательности). При определении значения степени окисления у второго элемента из восьми вычитают номер группы, в котором он находится. Если полученные числа отличаются между собой, определяется наименьшее общее кратное, затем вычисляются индексы.
Помимо оксидов, к данным соединениям причисляют карбиды, силициды, пероксиды, гидриды. Карбиды алюминия и кальция используют для лабораторного получения метана и ацетилена, пероксиды используют в химической промышленности в качестве сильных окислителей.
Такой галогенид, как фтороводород (плавиковая кислота), используется в электротехнике при паянии. Среди самых важных бинарных соединений, без которых трудно представить себе существование живых организмов, лидирует вода. Особенности строения этого неорганического соединения подробно изучаются в школьном курсе химии. Именно на ее примере ребята получают представления о последовательности действий при составлении формул бинарных соединений.
В заключение отметим, что сложно найти такую сферу современной промышленности, область человеческой жизни, где бы ни применялись разнообразные бинарные соединения.
Читайте также:
- Пусть сообщение записано русскими буквами алфавит русского языка состоит из 32 знаков исключая е
- Сообщение о бироне по истории 8 класс
- Устное народное музыкальное творчество сообщение 5 класс
- Сообщение на тему имя числительное очень интересная часть речи 6 класс
- Население и культура африки сообщение 3 класс

