Сообщение на тему применение
Обновлено: 17.05.2024
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Живое человеческое тело содержит от 55 % до 78 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить около 3-ех литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и т. д.
Вода является растворителем для многих веществ. Она используется для очистки, как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине.
Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены.
Многие виды спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и др.
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Известные науке химические элементы образуют примерно 1 млн. неорганических и более 20 млн. органических веществ. В лабораториях синтезируется 200–250 тыс. новых соединений. Все они нашли широкое применение в различных сферах деятельности человека, начиная от медицины и заканчивая машиностроением, оборонным комплексом.
Применение неорганических веществ
К неорганическим относят соединения, которые не содержат углерод, а также углеродосодержащие вещества, традиционно относящиеся к неорганическим (карбиды, оксиды и др.).

Применение данных соединений достаточно распространено в повседневной деятельности человека, и без них невозможно полноценное ведение хозяйства, лечение, производство и т.п.
Пищевая сода
Гидрокарбонат натрия (NaHCO3 ) – представляет собой мелкий порошок белого цвета, без запаха, растворимый в воде. Используется преимущественно в кулинарии, для выпечки. Это обусловлено тем, что во время нагревания сода легко разлагается с выделением углекислого газа.
Кроме этого гидрокарбонат натрия используется для придания пышности омлету, смягчения мяса, усиления аромата чая или кофе, добавления сладости плодам фруктов, очищения продуктов от нитратов и т.д.
Кальцинированная сода
Na2CO3 — применяется для бытовых нужд:
- мытья посуды (из фаянса, фарфора, керамики в том числе);
- чистки раковин, ванн, плитки;
- стирки (замачивание, кипячение натуральных тканей);
- смягчения жесткой воды;
- удобрения кислых дерново-подзолистых почв.
Для использования необходимо развести раствор от 10 до 100 °С.
20-100 г на 10 л
50-100 г на 10 л
Поваренная соль (NaCl) – незаменимая приправа при приготовлении первых, вторых блюд, консервации и даже выпечки. Суточная норма натрия для организма человека составляет 1 г, но употребление значительно превышает эту норму (4-6 г). Осторожнее к потреблению данного продукта следует относиться людям, страдающим повышенным давлением, склонным к появлению отеков.
Серная кислота
Сильная двуосновная кислота (H2SO4) представляет собой бесцветную тяжелую маслянистую жидкость, не обладающую запахом. Широко распространено использование средства в различных отраслях промышленности:
- сельском хозяйстве (производство минеральных удобрений);
- химической (изготовление красителей, химволокна, взрывчатых веществ);
- пищевой (пищевая добавка E513)$
- металлообрабатывающей;
- в промышленном органическом синтезе (реакции дегидратации, гидратации, сульфирования, алкилирования).
Так же соединения серы используется в качестве электролита в свинцовых аккумуляторах.
Оксид цинка
Цинковые белила (ZnO) – представляет собой белый порошок, меняющий цвет при нагревании. Применение продукта известно в медицине, химической промышленности в качестве наполнителя или пигмента:
- при производстве красок и эмалей;
- при изготовлении бумаги, резины, пластмассы, косметики и парфюмерии;
- в составе мазей и присыпок.
Данное соединение обладает фотокаталитической активностью, что нашло свое применение при изготовлении самоочищающихся поверхностей, бактерицидных покрытий для помещений больниц и подобных учреждений.
Медный купорос
Сульфат меди II (CuSO4) – бесцветное кристаллическое соединение, растворимое в воде. При реакции с воздухом или водой образуется голубой пентагидрат.
Применяется вещество как основа для других соединений или в качестве индикатора влажности помещения. Медный купорос – эффективное средство в борьбе с вредителями, грибковыми заболеваниями. Но есть и безвредное применение - изготовление минеральных красок, меднение ванн, пищевые добавки (консервант).
основные соли азотной кислоты : нитрат натрия, нитрат магния, нитрат аммония
Азотсодержащие удобрения (селитры).
Соли фосфорной кислоты: Фосфат кальция
Гидрофосфат кальция
Суперфосфат
Прокаленный песок: Оксид кремния (IV)
Производство керамических изделий.
Твердые и жидкие соли карбоновых кислот: Пальмитат натрия/калия
Стеарат натрия/калия
Мыла
Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла.
Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком.
Кислые соли натрия, например: Гидрокарбонат натрия.
Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства.
Соединения аммония например: Карбонат аммония
Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением:
(NH4)2CO3 => 2NH3 + CO2 + H2O
Карбоновые кислоты : Этановая (уксусная) кислота
Используется для консервирования овощей. Концентрированные растворы вызывают ожоги.
Твердый Активированный уголь
Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений.
Раствор пищевого спирта: Этанол (этиловый спирт).
C2H5OH
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом.
Жидкие трехатомные спирты: Глицерин
Используется в парфюмерии и пищевой промышленности.
Изомерные соединения алканов: Тетрахлорид углерода CCl4
Сырье для получения удобрений (нитратов калия, натрия, аммония).
Сырье для получения азотной кислоты.
Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом.
В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание.
Аллотропное соединение кислорода: Озон O3
Дезинфекция (очистка) воды.
Дезинфекция (очистка) воды.
Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 о С
Основной компонент природного газа. Горючее для газовых плит.
Раствор Лимонной кислоты
Используется для удаления накипи с внутренней поверхности чайника.
Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов.
Изомерные соединения алкенов и их производных: Хлоропрен (2-хлорбутадиен-1,3)
Изопрен (2-метилбутадиен-1,3)
Бутадиен (дивинил)
Сырье для производства каучука.
Спиртовой раствор Йода
Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин.
Применение органических веществ
Органические вещества – это класс химических соединений, объединяющий все вещества, в состав которых входит углерод.

Предельные (насыщенные) углеводороды, атомами водорода: СН4 – метан (основа природного газа), С2Н6 – этан, С3Н8 – пропан, С8Н18 – октан (основа бензина).
Широко распространено применение данной группы органических соединений в химической промышленности (для производства пластмасс, синтетических волокон и т.д.) и медицине.
Соединения служат исходными веществами для получения ряда готовых продуктов:
- растворителей (спиртов, дихлорэтана, эфира);
- полимеров (полиэтилена, поливинилхлорида, полиизобутилена);

Этилен (Н2С=С Н2) используется для получения, тефлона, этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Алкены применяются и для ускорения процесс созревания фруктов.
Алкины (ацетиленовые углеводороды)
Ацетилен – необходим в качестве исходного продукта в органическом синтезе при производстве:
- полимеров (каучука, поливинилхлорида и др.);
- растворителей (1,1,2,2-тетрахлорэтана , 1,1,2-трихлорэтена);
- уксусной кислоты.
Температура пламени вещества достигает 3150°С, что нашло свое применение при резке металла и в сварке.

Алкоголи – производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу ОН.
Метанол (СН3ОН) –применяется в производстве муравьиной кислоты и формальдегида. Рассматривается как вариант для применения в качестве моторного топлива.
Этанол (С2Н5ОН)- востребован в виде исходного соединения для получения уксусной кислоты, сложных эфиров, карбоновых кислот. Вещество служит основой производства спиртосодержащей продукции и антисептических средств.
Этиленгликоль – компонент необходимый в производстве пластмасс, антифризов, органическом синтезе.
Глицерин – незаменим в разных отраслях промышленности, в том числе текстильной, пищевой, фармакологии.
Основное использование соединений приходится на химическую промышленность, медицину (производство синтетических смол, красителей, антисептиков, взрывчатых веществ и т.д.).
Метаналь – используется при получении фенолформальдегидных и карбамидных смол, синтезе лекарственных средств, как дезинфицирующее средство.
Этаналь - нашел свое применение в органическом синтезе.
Карбоновые кислоты
Соединения, карбоксильной группы –СООН.
Муравьиная кислота (НСООН) –применяется в фармацевтической и пищевой промышленности. Уксусная кислота (СН3СООН) - востребована для производства искусственных волокон на основе целлюлозы и в пищевой промышленности.
Бензойная кислота (С6Н5СООН) – незаменима в фармацевтике для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов.
Сложные эфиры
Применяются в пищевой и парфюмерной отраслях в качестве отдушек. А также обеспечивают эластичность и пластичность пластмасс и резины.
Также широко распространено в пищевой промышленности, медицине применение глюкозы, аминов, аминокислот. Целлюлоза основной компонент при изготовлении бумаги, пленок, искусственных волокон и т.д.
Много соединений еще не изучено до конца, и возможно, благодаря науке человек сможет заменить натуральные продукты на искусственные, органических соединений природного происхождения применяется все меньше.
Вода – одно из самых важных веществ в природе. Без неё не обходится ни один живой организм, более того, благодаря ей они и возникли на нашей планете. В разных странах человек расходует от 30 до 5 000 кубических метров воды в год. Какую пользу из неё извлекают? Какие способы получения и применения воды существуют?
Она окружает нас повсюду
Вода – самое распространенное вещество на Земле и точно не последнее в космосе. В зависимости от состава и свойств, она бывает жесткая и мягкая, морская, солоноватая и пресная, легкая, тяжёлая и сверхтяжёлая.
Это оксид водорода – неорганическое соединение, при нормальных условиях жидкое, не имеет ни запаха, ни вкуса. При небольшой толщине слоя жидкость бесцветна, с его увеличением может приобретать голубоватый и зеленоватый оттенки.

Она способствует протеканию многих химических реакций, ускоряя их. В теле человека вода составляет около 70 %. Находясь в клетках всех животных и растений, она способствует обмену веществ, терморегуляции и другим жизненно важным функциям.
В трех агрегатных состояниях она окружает нас повсюду, участвуя в круговороте веществ в природе. В виде водяного пара она присутствует в воздухе. Из него она попадает на поверхность Земли в виде атмосферных осадков (льда, тумана, дождя, инея, снега, росы и т. д.). Она попадает в реки и океаны сверху, просачивается в них сквозь грунт. Через какое-то время испаряется с их поверхности, вновь попадая в атмосферу и замыкая круг.
Основной ресурс Земли
Все поверхностные и подземные воды нашей планеты, включая атмосферный пар, объединяются в понятие гидросфера, или водная оболочка. Её объем составляет почти 1,4 миллиона кубических километров.
Около 71 % приходится на Мировой океан – непрерывную оболочку, которая окружает всю сушу Земли. Он делится на океаны Тихий, Атлантический, Северный Ледовитый, Индийский, Южный (по некоторым классификациям) океаны, моря, заливы, проливы и т. д. Мировой океан наполняет соленая морская вода, непригодная для питья.
Вся питьевая вода (пресная) находится в пределах суши. Она составляет всего лишь 2,5-3 % от всего объема гидросферы. Пресные водоемы это: реки, часть озер, ручьи, ледники и горный снег, подземные воды. Они распределены неравномерно. Так, в отдельных частях планеты существуют крайне засушливые и пустынные местности, которые не увлажнялись сотни лет.
Большая часть пресных вод находится в ледниках. В них хранится около 80-90 % всех мировых запасов этого ценного ресурса. Ледники покрывают 16 миллионов квадратных километров суши, они располагаются в приполярных областях и на вершинах высоких гор.

Источник жизни
Вода появилась на Земле миллиарды лет назад, то ли высвободившись в ходе химических реакций, то ли прибыв сюда в составе комет и астероидов. С тех пор она является неотъемлемой частью нашей жизни.
Человек и животные пьют её, растения всасывают корнями (или другими органами) для поддержания сил и энергии. Огромная часть жидкости поступает в организм вместе с продуктами питания.
В целом людям необходимо 5-10 литров воды в день, а в виде жидкости - около двух. Животные и растения могут употреблять её больше. Например, бегемоты пьют около 300 литров в сутки, примерно такое же количество необходимо и эвкалипту.
Применение воды в природе не ограничивается питьем. Для ряда организмов она является местом обитания. В реках и океанах растут водоросли, живут рыбы, планктон, амфибии, членистоногие, некоторые млекопитающие и другие существа.
Способы применения воды
В нашей повседневной жизни ни один день не обходится без воды. При этом обычно используются пресные запасы, количество которых весьма ограничено. Огромные объемы этого ресурса тратятся в быту во время уборки, стирки, мытья посуды, приготовлении пищи.
Кроме того, применение воды необходимо для личной гигиены. С этой целью её используют не только дома, но и во всех рабочих учреждениях, в особенности в больницах. В медицине её также употребляют для лечебных ванн, компрессов, обтираний, добавляют в состав препаратов.
Незаменима она и промышленности. Здесь во многом пригождается её свойство растворять различные вещества, будь то другие жидкости, соли или газы. Её используют для получения азотистой, уксусной, соляной кислот, оснований, спирта, аммиак и т. д. Ежегодно с пресных озер и рек изымается более 1000 кубических километров сырья в производственных целях.
Применение воды связано с такими видами спорта, как фигурное катание, хоккей, плавание, биатлон, гребля, серфинг, водно-моторный спорт. Она необходима при тушении пожара, для ведения сельского хозяйства.

Энергетика
Ещё одна область применения воды – энергетика. На тепловых и электрических станциях вода используется для охлаждения турбин, а также для получения пара. Только для производства одного гигаватта электричества тепловые станции потребляют от 30 до 40 кубических метров воды в секунду.
Применение воды на гидроэлектростанциях основано на других принципах. Здесь электричество вырабатывается за счет скорости течения рек. Станции устанавливают в местах с естественными перепадами высот. Там, где реки не столь стремительны, перепады высот создают искусственно при помощи дамб и плотин.

В Китае, Индии, США, Франции и других странах для производства энергии используют силу приливов. Такие станции (ПЭС) строят на морских побережьях, где уровень воды изменяется несколько раз в день под действием сил притяжения Солнца и Луны.
Морские волны тоже могут давать энергию. Их удельная мощность даже превышает ветровую и приливную. Станций, генерирующих энергию таким способом, пока немного. Первая появилась в 2008 году в Португалии, она обслуживает примерно 1 500 домов. Ещё как минимум одна станция находится в Великобритании на Оркнейских островах.
Сельское хозяйство
Ведение сельского хозяйства невозможно без применения воды. В основном она используется для полива, а также снабжения птиц и скота. Только на разведение десяти тысяч коров может понадобиться 600 кубометров воды. На возделывание риса в среднем уходит 2400 л, на виноград – 600 л, а на картофель – 200 литров.
Часть воды для полива полей и плантаций приходит естественным путем в виде атмосферных осадков. В некоторых странах, например, Великобритании, на них приходится основная доля водоснабжения.
Там, где климат более засушливый, на помощь приходят оросительные системы. Они появились ещё в Месопотамии и Древнем Египте. С тех пор они, конечно, усовершенствовались, но не утратили актуальности. Орошение применяется в странах Азии, Южной Америки и Европы. В горных участках оно террасное, на равнинных участках – паводковое.

Ресурс для отдыха
Одна из самых приятных сфер применения воды человеком – сфера рекреации. Ущерб от такого использования ресурса намного меньше, чем в других областях. К тому же чаще всего люди стремятся поехать не на пресные, а именно на морские водоемы.

На морях и океанах распространен пляжно-купальный отдых. В России популярностью пользуется побережье Черного и Азовского морей. Большинство водоемов дает возможность для развития водного спорта, прогулок на лодках и катера, а также рыбалки.

Распространённость и свойства
Прежде всего, элемент необходим для дыхания активных организмов. Он также принимает участие в разложении мёртвых животных и растений. Содержание кислорода в земной коре составляет почти 50%, содержится в различных минералах в виде оксидов и солей. В связанном виде кислород входит в химический состав воды — его процентное соотношение составляет около 89%, а также в клетки всех живых существ — растений и животных.

Компонент характеризуется высочайшей химической насыщенностью и образует гибридные субстанции, состоящие из связанных атомов двух и более компонентов вместе с почти всей периодической таблицей, за исключением только лишь инертных газов (криптон, аргон, неон, гелий и ксенон). В период изменения акцентируется огромное количество тепла, такая реакция является экзотермичной. Он весьма тяжело приготовить в воде.
С повышением температуры водорастворимость убавляется. При снижении температуры вплоть до — 218*с он становится твёрдым.
При соприкосновении сжатого кислородного газа с распылёнными жирными веществами, полученными из веществ растительного, животного или минерального происхождения, происходит их самовозгорание. Это частый источник пожаров. Во избежание несчастных случаев кислородное оборудование должно быть тщательно обезжирено.
Бесцветное вещество обладает способностью образовывать взрывоопасные смеси и легковоспламеняющиеся газы, где поблизости находится источник открытого огня.
Извлечение вещества

Элемент из атмосферы можно приобрести с помощью специализированных установок. В них воздушное пространство фильтруется, избавляется от водорода и азота, малейших сухих элементов, углекислого газа, а также высушивается от влаги. Рециркулированный воздух сокращается компрессионной машиной, а газ перед нажимом переходит в конденсатор для сжижения. Для перевоплощения жидкого воздуха в газ применяются криоцилиндры либо приспособления для откачки с теплообменником. Этот химический компонент можно приобрести как в лаборатории, так и на промышленном предприятии.
Существует несколько способов получения кислорода в лабораторных условиях:
- С помощью реакции разложения хлората калия.
- За счёт разложения пероксида водорода при его нагревании в присутствии оксида марганца, который действует как катализатор.
- Через разложение перманганата калия.
Производство кислорода в промышленности осуществляется различными способами. Современное оборудование обеспечивает приготовление вещества любой степени чистоты.
Применение элемента
Химический элемент используется для жизнеобеспечения людей, страдающих затруднённым дыханием, а также для лечения некоторых недугов. Примечательно, что при нормальном давлении чистый кислород долго не, может быть, вдыхаем. Это небезопасно для здоровья в любой области. Бывает использование компонента в авиации.
Этот химический элемент используется в стекловаренных печах в качестве компонента, улучшающего горение в них. Кроме того, благодаря веществу промышленность сокращает выбросы оксидов азота до уровня, безопасного для жизни. Теплоэлектростанции, работающие на нефти, природном газе или угле, используют кислород для сжигания топлива. Без него все промышленные предприятия просто не работали бы.
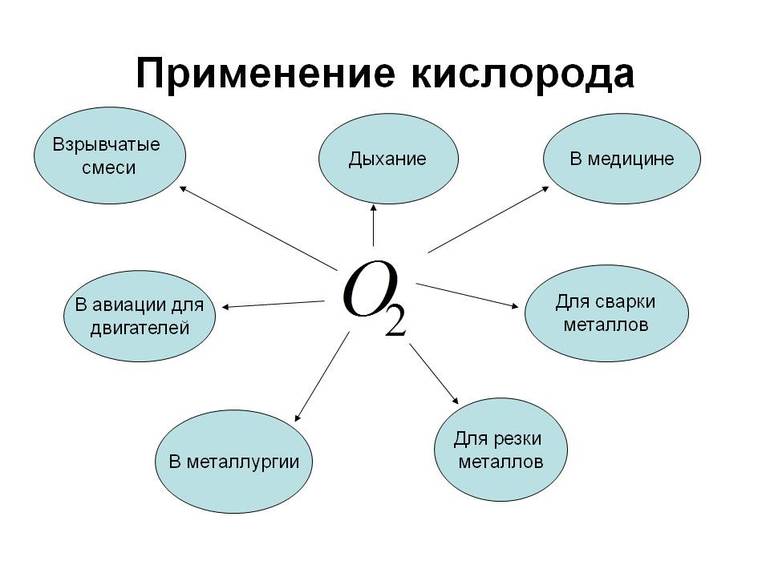
Этот химический элемент используется в спиртовании, делигнификации и других процессах, таких как:
- Отбеливание бумаги.
- Очистка сточных вод, что имеет большое значение.
- Подготовка питьевой воды в быту.
- Интенсификация сжигания отходов мусоросжигательных заводов и др.
В природе существует круговорот кислорода: в процессе фотосинтеза растения на свету превращают углекислый газ и воду в органические соединения. Этот процесс можно назвать выделением. Подобно людям и животным, растения ночью потребляют кислород из атмосферы, а потом растения вырабатывают его днём и расходуют ночью. Применение кислорода по химии 9 класса кратко рассматривают, пишут реферат с рисунками и схемами по теме.
Читайте также:

