Сообщение на тему открытие щелочных металлов
Обновлено: 02.07.2024
Важным химическим продуктом с глубокой древности являлась зола. Мылкий раствор, образующийся при кипячении золы с водой (щёлок), был первым моющим средством, созданным человеком. В Средние века люди научились выделять из золы соединения, которые и делали ее раствор мылким, — соду и поташ (карбонаты натрия и калия). Долгое время названия этих двух солей означали лишь разные виды золы: поташом или кали называли золу, остающуюся после сгорания древесины, соломы, камыша и папоротника (эта зола богата калийными солями), а содой или натроном – золу других травянистых растений, в которых преобладали соли натрия.
На Руси производство поташа существовало уже в XI в. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор после фильтрования выпаривали. Сухой остаток кроме карбоната калия содержал также и другие примеси в виде калийных солей.
В отличие от поташа, сода встречается в природе, например в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при изготовлении красящих веществ и при варке пищи. Плиний Старший писал, что в дельте Нила соду выделяли из речной воды. Сода, получаемая из растительной золы, также содержала большое количество других солей. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или черный цвет.

Химическое различие между содой и поташом окончательно установил в 1758 г. немецкий химик А. С. Маргграф. А в 1807 г. Г. Дэви провёл электролиз расплавов щелочей – гидроксида натрия и гидроксида калия, выделив металлические натрий и калий.
Щелочные металлы в природе
Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. Натрий и калий принадлежат к распространенным элементам: содержание каждого из них в земной коре равно приблизительно 2%. Оба металла входят в состав различных минералов и горных пород силикатного типа. Хлорид натрия содержится в морской воде, а также образует мощные отложения каменной соли во многих местах земного шара. В верхних слоях этих отложений иногда содержатся довольно значительные количества калия, преимущественно в виде хлорида или двойных солей с натрием и магнием. Однако большие скопления солей калия, имеющие промышленное значение встречаются редко. Наиболее важными из них являются соликамские месторождения Пермского края, стассфуртские в Германии и эльзасские – во Франции. Залежи натриевой селитры находятся в Чили. В воде многих озер содержится сода. Наконец, огромные количества сульфата натрия находятся в заливе Кара-Богаз-Гол Каспийского моря, где эта соль и в зимние месяцы осаждается толстым слоем на дне.

Среди соединений натрия важная роль принадлежит карбонату, или соде. Безводный средний карбонат натрия Na2CO3 называют кальцинированной содой, десятиводный кристаллогидрат Na2CO3∙10H2O – стиральной содой, а гидрокарбонат NaHCO3 – питьевой или пищевой содой.
Растворы среднего карбоната имеют сильнощелочную реакцию среды, их используют при стирке белья и при обработке шерсти. Кроме того, кальцинированная сода находит широкое применение в производстве мыла, стекла, сульфита натрия, органических красителей. Растворы гидрокарбоната имеют слабощелочную реакцию среды, поэтому питьевую соду используют в медицине, а также при приготовлении пищи.
Значительно меньше, чем натрий и калий, распространены литий, рубидий и цезий. Чаще других встречается литий, но содержащие его минералы редко образуют большие скопления. Рубидий и цезий содержатся в небольших количествах в некоторых литиевых минералах.
Все известные изотопы франция радиоактивны и быстро распадаются (период полураспада изотопа 223 Fr составляет 21,8 мин.). Первым был открыт изотоп 223 Fr французской исследовательницей М.Пере в 1939 г.В честь своей родины она назвала его францием. Он образуется при распаде актиния и в ничтожном количестве встречается в природе. В настоящее время небольшие количества франция получают искусственно.
Общие химические свойства щелочных металлов
Во внешнем электронном слое атомы щелочных металлов имеют по одному электрону. Во втором внешнем электронном слое у атома лития содержатся два электрона, а у атомов остальных щелочных металлов – по восемь электронов. Имея во внешнем электронном слое только по одному электрону, находящемуся на сравнительно большом удалении от ядра, атомы этих элементов довольно легко отдают этот электрон. Легкость отдачи внешних электронов характеризует рассматриваемые элементы как наиболее типичные представители металлов: металлические свойства выражены у щелочных металлов особенно резко.
- Взаимодействие щелочных металлов с неметаллами
а) взаимодействие с кислородом
Обратите внимание, что только литий окисляется кислородом до нормального оксида:
Основным продуктом окисления натрия является пероксид:
а калий, рубидий и цезий сгорают в кислороде с образованием супероксидов (надпероксидов):
б) взаимодействие с галогенами (продукты взаимодействия галогениды):
в) взаимодействие с серой и фосфором (продукты взаимодействия сульфиды и фосфиды):
г) взаимодействие с водородом (продукты взаимодействия гидриды):
Гидриды щелочных металлов разлагаются водой с образованием щелочи и свободного водорода:
д) взаимодействие с азотом и углеродом
Эти реакции наиболее характерны для лития, который с азотом взаимодействует даже при обычной температуре:
- Взаимодействие щелочных металлов со сложными веществами
а) взаимодействие с водой
Возможность взаимодействия щелочных металлов с водой обусловлена тем, что они находятся в начале ряда напряжений металлов, т.е. обладают очень высокой восстановительной активностью и могут окисляться даже ионами водорода из воды.

В результате реакций образуются растворы щелочей и выделяется водород, который иногда самовоспламеняется:
б) взаимодействие с разбавленными кислотами
2Na + 2HCl = 2NaCl + H2↑
Концентрированную серную кислоту щелочные металлы восстанавливают до сероводорода:
Соли щелочных металлов окрашивают пламя горелки в различные цвета:
Это свойство используется для качественного анализа, т.е. для обнаружения этих катионов.

Получение и применение щелочных металлов
В промышленности натрий получают электролизом расплава смеси хлоридов натрия и кальция (она плавится при более низкой температуре, чем чистый хлорид натрия). Интересно, что первым из расплава выделяется не кальций, а более активный натрий, так как ион Na + в расплаве легче, чем Са 2+ , принимает электроны. Процесс проводят в стальных электролизёрах при 580 ̊ С. Образующийся жидкий натрий всплывает на поверхность расплава и собирается в специальный приёмник.

Ежегодно в мире производится около 200 тыс. тонн металлического натрия, который применяется на атомных электростанциях и в авиадвигателях в качестве теплоносителя, в металлургии – как восстановитель, в лабораторной практике – для абсолютирования (обезвоживания) растворителей.
Литий, как и натрий получают электролизом расплавов, а остальные щелочные металлы вытесняют из расплавленных солей металлическим натрием и кальцием. Например, натрий при 850 ̊ С легко вытесняет более активный калий из расплава его хлорида: KCl + Na → NaCl + K↑
Это объясняется тем, что калий (tкип = 762 ̊ С), более летучий, чем натрий (tкип = 883 ̊ С), испаряется, и в соответствии с принципом Ле-Шателье равновесие реакции смещается вправо. Аналогично из хлорида цезия можно получить цезий: Ca + 2CsCl = 2Cs↑ + CaCl2
Натрий (Natrium)

Натрий представляет собой серебристо-белый металл. Он настолько мягок, что легко режется ножом. Вследствие легкой окисляемости на воздухе его хранят под слоем керосина.
В организме человека натрий в виде его растворимых солей, содержится в основном во внеклеточных жидкостях – плазме крови, лимфе, пищеварительных соках. Осмотическое давление плазмы крови поддерживается на необходимом уровне прежде всего за счет хлорида натрия.
Значительная потеря ионов натрия (они выводятся из организма с мочой и потом) неблагоприятно сказываются на здоровье человека. Поэтому врачи рекомендуют людям есть больше соленого. Однако и избыточное содержание их в пище вызывает негативную реакцию организма, например повышение артериального давления.
Едкие щелочи (NaOH и KOH)
Гидроксиды щелочных металлов называют едкими щелочами. Они представляют собой белые кристаллические вещества, устойчивые к нагреванию, хорошо растворимые в воде (за исключением LiOH), а также в спирте.

Другим способом получения едкого натра служило взаимодействие соды с известью Ca(OH)2 (каустификация соды): Ca(OH)2 + Na2CO3 ⇄ CaCO3 + 2NaOH.
В наше время едкие щелочи получают электролизом растворов солей, например хлоридов. При этом наряду с щелочью образуются другие важные вещества – водород и хлор.
Гидроксиды натрия и калия применяют для очистки нефти и масел, в производстве бумаги, моющих средств, искусственных волокон. Благодаря способности активно поглощать влагу из воздуха (гигроскопичности) NaOH и KOH используются в лабораториях как осушители.
Перекись натрия (Na2O2)

Перекись(или пероксид) натрия образуется при сжигании натрия на воздухе или в кислороде. В заводских условиях перекись натрия готовят нагреванием расплавленного натрия в токе воздуха, освобожденного от СО2. Получающийся продукт имеет слабо-желтоватую окраску, обусловленную примесью соединения NaO2, называемого надперекисью натрия.
Перекись натрия – очень сильный окислитель. Многие органические вещества при соприкосновении с ней воспламеняются.
При осторожном растворении перекиси натрия в холодной воде получается раствор, содержащий гидроксид натрия и перекись водорода. Если нагревать полученный раствор, то вследствие разложения перекиси водорода из него выделяется кислород.
При действии на перекись натрия разбавленных кислот также получается перекись водорода, например: Na2O2 + H2SO4 = H2O2 + Na2SO4
Перекись натрия применяется для отбелки тканей, шерсти, шелка и т.п. Важное значение имеет реакция взаимодействия перекиси натрия с углекислым газом:
На этой реакции основано применение перекиси натрия для регенерации воздуха в изолированных помещениях.
Оксид натрия (Na2O)
Он может быть получен при пропускании над натрием, нагретым не выше 180̊ С, умеренного количества кислорода или нагреванием перекиси натрия с металлическим натрием: Na2O2 + 2Na = 2Na2O
Оксид натрия бурно реагирует с водой с образованием гидроксида натрия и выделением большого количества теплоты:
Калий (Kalium)

По внешнему виду, а также по физическим и химическим свойствам калий очень похож на натрий, но обладает еще большей активностью. Подобно натрию, он имеет серебристо- белый цвет, быстро окисляется на воздухе и бурно реагирует с водой с выделением водорода.
Соли калия очень сходны с солями натрия, но обычно выделяются из растворов без кристаллизационной воды.
Калий принадлежит к числу элементов, необходимых в значительном количестве для питания растений. Хотя в почве находится довольно много солей калия, но и уносится его с некоторыми культурными растениями также очень много. Особенно много калия уносят лен и табак.
Калий отлагается в растениях главным образом в стеблях, поэтому удобрение земли навозом, содержащим солому, отчасти пополняет убыль калия. Но так как стебли перечисленных выше растений используются для промышленных целей, то в конце концов большая часть калия уходит из почвы, и для пополнения его убыли необходимо вносить калийные удобрения.
Источником получения калийных удобрений служат естественные отложения калийных солей. В России такие отложения находятся в районе Соликамска. Пласты соли состоящие главным образом из минералов карналлита KCl∙MgCl2∙6H2O и сильвинита KCl∙NaCl, залегают на большой площади между верховьями Камы и предгорьями Урала.

Как и натрий, калий содержится во всех тканях организма человека. Но, в отличие от натрия, калий в преобладающем количестве находится внутри клеток. Ион калия играет важную роль в некоторых физиологических и биохимических процессах. Определенная концентрация калия в крови необходима для нормальной работы сердца. В организм калий поступает главным образом с растительной пищей; суточная потребность человека в нем составляет 2-3 г.
Литий (Lithium)
В свободном состоянии литий – серебристо-белый металл, мягкий, хотя и жёстче остальных щелочных металлов, а также не такой легкоплавкий (tпл = 181̊ С). Литий настолько лёгок, что не тонет даже в керосине.

По сравнению с другими щелочными металлами литий обладает рядом особенностей. Так, при сгорании на воздухе он дает оксид Li2O, напрямую взаимодействует с азотом, образуя нитрид Li3N, и с углеродом, образуя карбид Li2C2. Некоторые соли лития (карбонат, фторид) малорастворимы в воде, а карбонат и гидроксид лития разлагаются при сильном нагреве с образованием оксида. Все эти свойства говорят о том, что химия лития близка химии магния.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

ИСТОРИЯ ОТКРЫТИЯ
ЩЕЛОЧНЫХ МЕТАЛЛОВ
ОБЗОР ПО ТЕМЕ
ПОДГОТОВИЛА
Макридина Людмила Ивановна

ИСТОРИЯ ОТКРЫТИЯ
ЩЕЛОЧНЫХ МЕТАЛЛОВ
ОБЗОР ПО ТЕМЕ
ПОДГОТОВИЛА
Макридина Людмила Ивановна

ЛИТИЙ (Lithium) 3Li
Литий – самый лёгкий серебристо –
белый металл.
Открыт в 1817 году шведским
химиком
А.Арфведсоном
при анализе минерала
петалита
LiAl[Si4O10]
![Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важн.](https://documents.infourok.ru/8fd74215-39ff-46df-8d64-6351845db02f/slide_04.jpg)
Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6],
позже ставшем важнейшим минералом элемента № 3.
В 1818 году металлический литий
впервые получил английский учёный
Гемфри Дэви.
В 1855 году немецкому химику Бунзену
и независимо от него английскому
физику Матиссену
удалось получить чистый литий
электролизом расплава
хлорида лития.


КАЛИЙ (Kalium) 19K
Калий – серебристо-белый, очень
мягкий и легкоплавкий металл.
Получен при электролизе едкого
кали в 1807г. английским химиком
и физиком Гемфри Деви
и назван им потассием.

РУБИДИЙ (Rubidium) 37Rb
Рубидий – лёгкий и очень мягкий (как воск),серебристо-белый
металл.


Цезий, как известно, был первым элементом, открытым с помощью спектрального анализа, разработанного в 1859 году немецкими учёными –химиком Робертом Бунзеном и физиком
Густавом Кирхгофом.
Учёные, однако имели возможность познакомиться с этим
элементом ещё до 1860 года.
В 1846 году немецкий химик Платтер, анализируя минерал
поллуцит, обнаружил, что сумма известных его компонентов,
составляет лишь 93%, но не сумел точно установить, какой ещё
элемент (или элементы) входит в минерал.
В 1864 году, уже после открытия цезия, итальянец Пизани нашёл
цезий в поллуците и установил, что именно соединения этого
элемента не смог идентифицировать Платтер.

Презентация на тему: " ИСТОРИЯ ОТКРЫТИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ ОБЗОР ПО ТЕМЕ ПОДГОТОВИЛА Макридина Людмила Ивановна." — Транскрипт:
1 ИСТОРИЯ ОТКРЫТИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ ОБЗОР ПО ТЕМЕ ПОДГОТОВИЛА Макридина Людмила Ивановна
2 ИСТОРИЯ ОТКРЫТИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ ОБЗОР ПО ТЕМЕ ПОДГОТОВИЛА Макридина Людмила Ивановна
4 Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si 2 O 6 ], позже ставшем важнейшим минералом элемента 3. В 1818 году металлический литий впервые получил английский учёный Гемфри Дэви. В 1855 году немецкому химику Бунзену и независимо от него английскому физику Матиссену удалось получить чистый литий электролизом расплава хлорида лития.
9 Цезий, как известно, был первым элементом, открытым с помощью спектрального анализа, разработанного в 1859 году немецкими учёными –химиком Робертом Бунзеном и физиком Густавом Кирхгофом. Учёные, однако имели возможность познакомиться с этим элементом ещё до 1860 года. В 1846 году немецкий химик Платтер, анализируя минерал поллуцит, обнаружил, что сумма известных его компонентов, составляет лишь 93%, но не сумел точно установить, какой ещё элемент (или элементы) входит в минерал. В 1864 году, уже после открытия цезия, итальянец Пизани нашёл цезий в поллуците и установил, что именно соединения этого элемента не смог идентифицировать Платтер.

Данный видеофрагмент основывается на изучении щелочных металлов. Профессор Колбочкин рассказывает о строении и свойствах атомов элементов IA группы, физических и химических свойствах щелочных металлов, а также о соединениях этих металлов, об истории открытия лития, натрия и калия. Кроме соответствующих уравнений химических реакций, здесь есть пример решения задачи.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Щелочные металлы"
Щелочные металлы
Сегодня мы поговорим о строении и свойствах атомов элементов I A группы, о физических и химических свойствах щелочных металлов, об основных соединениях щелочных металлов, истории открытия некоторых щелочных металлов и ещё много чего интересного.
Как вы помните, к щелочным металлам относятся элементы I A группы. Это литий, натрий, калий, рубидий, цэзий, франций. Франций является редким радиоактивным элементом.
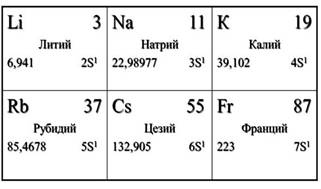
Теперь рассмотрим строение и свойства атомов элементов I A группы. Посмотрев в Периодическую таблицу, мы видим, что на внешнем энергетическом уроне у этих атомов один электрон, потому что все они расположены в I A группе, этот внешний электрон находится далеко от ядра, поэтому он легко отрывается и атом превращается в ион. Для всех элементов этой группы характерна только степень окисления +1.

Все щелочные металлы являются восстановителями из-за способности отдавать электроны. Причём восстановительные свойства сверху вниз в группе увеличиваются, так как увеличиваются радиусы атомов, металлические свойства также усиливаются сверху вниз. Элементы I A группы – типичные металлы.

Строение мы разобрали, а теперь поговорим о физических свойствах щелочных металлов.
Как вы уже знаете, это серебристо-белые мягкие металлы. Наиболее твёрдым является литий, но он также как и все щелочные металлы легко режется ножом.
Посмотрите таблицу, здесь указана температура плавления, температура кипения и плотность щелочных металлов.
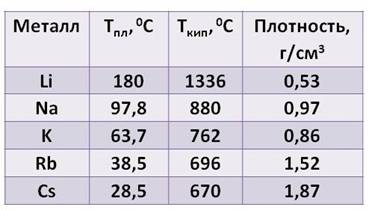
Из таблицы видно:
· плотность их увеличивается от лития к цезию
· температура плавления, в отличие от плотности, уменьшается от лития к цезию
· температура кипения тоже уменьшается от лития к цезию.
Все щелочные металлы лёгкие. Например, плотность лития примерно в два раза ниже плотности воды. А температура плавления цезия меньше температуры человеческого тела.
С физическими свойствами мы разобрались, теперь можем перейти и к химическим свойствам.
Элементы I A группы обладают очень высокой химической активностью. В лабораториях эти металлы хранят под слоем керосина, с которым они не взаимодействуют.
В реакции с кислородом оксид образует только литий, при этом образуется оксид лития, степень окисления лития +1, а кислорода -2. А натрий в реакции с кислородом образует пероксид натрия, в этом соединении, в отличие от оксида, степень окисления кислорода -1, а натрия степень окисления +1.

В реакцию с азотом при обычной температуре вступает только литий, при этом образуется нитрид лития, в этих бинарных соединениях степень окисления азота -3, а лития +1. Остальные щелочные металлы реагируют с азотом тольлко при нагревании.

В реакции с водородом щелочные металлы образуют гидриды. Так в реакции водорода с натрием образуется гидрид натрия. Степень окисления натрия +1, а водорода -1.

С галогенами щелочные металлы образуют галогениды. Так в реакции калия с бромом образуется бромид калия, где степень окисления калия +1, брома -1, в реакции натрия с хлором образуется хлорид натрия, где степень окисления натрия +1, а хлора -1.

С серой эти щелочные металлы образуют сульфиды. Например в реакции лития с серой образуется сульфид лития, где степень окисления лития +1, а серы -2.

Как вы помните, все щелочные металлы активно реагируют с водой с образованием щелочей, при этом вода восстанавливается до водорода.
Например, в результате взаимодействия натрия с водой образуется газ водород, который можно собрать методом вытеснения воздуха.

Так в реакии натрия с водой образуется щёлочь – гидроксид натрия и выделяется водород.

Причём скорость взаимодействия металла с водой будет увеличиваться от лития к цэзию, ведь металлические и восстановительные свойства также усиливаются.
Все щелочные металлы легко растворяются в растворах кислот с образованием соответствующих солей и водорода. Однако эти реакции проводят редко из-за того, что идут побочные реакции с водой. Например, в реакции калия с соляной кислотой образуется соль – хлорид калия и газ водород, в реакции натрия с серной кислотой образуется соль – сульфат натрия и газ водород.

Сами щелочные металлы получают путём электролиза расплавленных хлоридов или гидроксидов. Например, твёрдый хлорид натрия под действием электрического тока разлагается на металл натрий и газ – хлор.

Вы убедились, что щелочные металлы обладают высокой химической активностью, поэтому в свободном виде они не встречаются, а только в виде соединений.
Познакомимся с некоторыми из них.
Оксиды щелочных металлов – твёрдые вещества, обладают ярко выраженными основными свойствами, они реагируют с водой, кислотами и кислотными оксидами. Так, в реакции оксида лития с водой образуется гидроксид лития, в реакции оксида натрия с серной кислотой образуется соль – сульфат натрия и вода, в результате взаимодействия оксида калия с оксидом углерода четыре, образуется соль – карбонат калия.
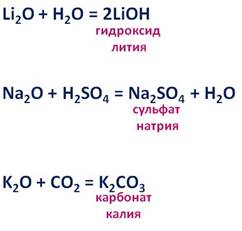
Оксиды натрия и калия получают, прокаливая пероксиды с соответствующими металлами. Это окислительно-восстановительная реакция, при которой кислород меняет свою степень окисления с минус -1 до -2, а натрий повышает свою степень окисления с 0 до +1.

Гидроксиды элементов I A группы – твёрдые белые вещества, хорошо растворимые в воде с образованием щелочей, очень гигроскопичны, поэтому расплываются на воздухе. Растворы щелочей мыльные на ощупь. При растворении их в воде выделяется большое количество теплоты. Гидроксиды щелочных металлов – сильные основания, они реагируют с кислотами, кислотными оксидами, солями, амфотэрными оксидами и гидроксидами.
Например, в рекции гидроксида калия с серной кислотой, образуетсся соль – сульфат калия и вода. В реакции гидроксида натрия с кислотным оксидом серы (VI) – образуется соль – сульфит натрия и вода. В результате взаимодействия гидроксида натрия с солью сульфатом меди (II) , образуется соль – сульфат натрия и нерастворимое основание гидроксид меди (II). В реакции гидроксида калия с амфотэрным оксидом цинка, образуется соль – цинкат калия и вода. В результате взаимодействия гидроксида калия с амфотэрным гидроксидом цинка в водной среде , образуется комплексная соль – тэтрагидроксоцинкат натрия.
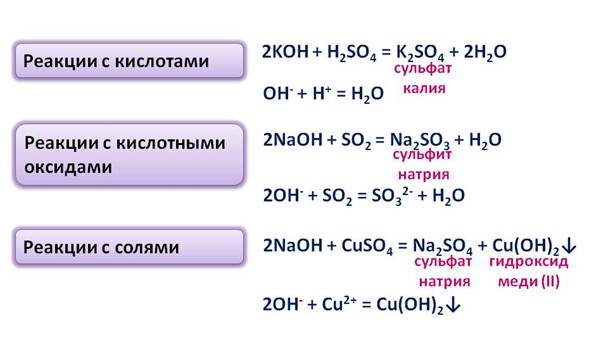

Естественно, что гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов с водой или их оксидов с водой. При зиимодействии натрия с водой образуется гидроксид натрия и водород, в результате реакции оксида натрия с водой также образуется гидроксид натрия.

Рассморим свойства и применения соединений щелочных металлов.
Например, гидроксид натрия – NaOH – в технике известен как едкий натр, каустическая сода, а также каустик, а вот гидроксид калия – KOH называют в технике едкое кали. Оба этих гидроксида разъедают ткани и бумагу, поэтому их называют едкими щелочами.
Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, производства мыла и волокон, а едкое кали – для производства жидкого мыла.

Соли щелочных металлов – твёрдые кристаллические вещества с ионным типом кристаллической решётки. В прошлом из-за соли нередко вспыхивали войны и народные волнения (соляные бунты), а в некоторых странах куски соли служили разменной монетой.
Рассмотрим наиболее значимые соли.
Кристаллическую соду – Na2CO3 ∙ 10 H2O – используют при производстве стекла, бумаги, мыла, в быту и стиральных порошках.
Питьевую соду – NaHCO3 используют в быту и пищевой промышленности, а также в медицине.
Поташ, или карбонат калия – K2CO3 используют при производстве жидкого мыла, в качестве удобрения и получения тугоплавкого стекла.
Кристаллогидрат сульфата натрия, или глауберова соль –
Na2SO4 ∙ 10 H2O применяется для производства соды и стекла, в качестве слабительного средства.
Поваренная соль, или хлорид натрия – NaCl используется при производстве соляной кислоты, гидроксида натрия, хлора, натрия и соды, для консервирования, как приправа к пище, при производстве мыла. Хлорид натрия – галит содержится в моской воде и при высыхании морей образует мощные пласты каменной соли.
Биологическая роль ионов натрия и калия очень велика. Так, ионы натрия содержатся в крови и лимфе, ионы калия – основной внутриклеточный ион.

Соотношение концентраций этих ионов регулирует давление крови, обеспечивает перемещение растворов солей из корней в листья растений. В организме человека концентрация ионов калия внутри клеток выше, чем ионов натрия. В межклеточном постранстве, наоборот, концентрация ионов натрия выше, чем ионов калия. Различные концентрации этих ионов внутри и снаружи клеток позволяет регулировать водные потоки через мембраны. Кроме этого, калий поддерживает работу сердечной мышцы.

Взрослому человеку в сутки необходимо три с половиной грамма калия. Калий содержится в кураге, сое, фасоле, зелёном горошке, черносливе, изюме и других продуктах.

Ребята, решите интересную задачу. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
В условии задачи нам сказано, что в 100 г кураги содержится 2,034 г калия, а в сутки человеку необходимо 3,5 г калия. Найти необходимо массу кураги. Для решения этой задачи составим выражение: 2 г калия содержится в 100 г кураги, 3,5 г калия содержится в Х граммах кураги, найдём Х. Для этого 3,5 умножим на 100 и разделим на 2,034, получаем 172 г. Для того, чтобы получить суточную норму калия человеку необходимо съесть 172 г кураги.

Калий нужен и растениям. Он является одним из элементов питания. Ежегодно большое количество калия уходит из почвы. Недостаток калия в почве, понижает интенсивность фотосинтеза. Это приводит:
· к уменьшению содержания сахаров в корнеплодах свёклы и крахмала в зерне
· отмиранию листьев растений
· повышению восприимчивости к грибковых и бактериальным заболеваниям
· снижению всхожести семян.
Поэтому для получения высоких урожаев сельскохозяйственных культур необходимо внесение калийных удобрений, таких солей калия, как хлорид, нитрат, карбонат, сульфат калия.

Соли щелочных металлов окрашивают пламя в различные цвета: литий – в карминово-красный цвет, натрий – в жёлтый, калий, рубидий и цэзий – в фиолетовый.

Для того чтобы это доказать, проведём лабораторный опыт. Возьмём лучинку и закрепим на ней спираль из проволоки. Обмакнём её сначала в соляную кислоту, затем в сухую соль натрия и поднесём к пламени спиртовки. Пламя, окрашивается в жёлтый цвет.
Сейчас возмём лучинку со спиралью из проволоки, обмакнём в кислоту, но теперь поместим в сухую соль калия и поднесём к пламени спиртовки. Пламя окрашивается в фиолетовый цвет.
Открытии щелочных металлов. Так, литий был открыт в 1817 году шведским химиком Арфвэдсоном и назван литием, так как литос от греческого означает камень, потому что он был обнаружен в камне.

Натрий и калий был получен английским химиком Дэви в 1807 году при электролизе едких щелочей. Натрий от арабского натрун означает сода, а калий от арабского алкали – щёлочь.

Сделаем вывод: щелочные металлы – это элементы I А группы, у них один электрон на внешнем энергетическом уровне. Все они – восстановители, проявляют степень окисления равную +1. Это мягкие металлы и легко режутся ножом, у них сравнительно невысокие температуры плавления, они обладают высокой химической активность, реагируют с простыми и сложными веществами . Их получают в результате электролиза расплавов, встречаются в природе только в виде соединений, соединения щелочных металлов имеют большое значение в жизни человека и в народном хозяйстве.
Читайте также:

