Сообщение на тему неорганические соединения
Обновлено: 02.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Шилов Дмитрий Алексеевич
Учитель химии: Воронаев Иван
Основные классы неорганических веществ…………..3 стр.
Простые вещества………………………………………. 4 стр.
Бинарные соединения……………………………………12 стр.
Список литературы………………………………………14 стр.
Введение
Классификация неорганических веществ базируется на их химическом составе – наиболее простой и постоянной во времени характеристике. Химический состав вещества показывает, какие элементы присутствуют в нём и в каком числовом отношении для их атомов. Символы и названия химических элементов приведены в Периодической системе химических элементов Д. И. Менделеева.
Элементы условно делятся на элементы с металлическими и неметаллическими свойствами. Первые из них всегда входят в состав катионов многоэлементных веществ (металлические свойства), вторые – в состав анионов (неметаллические свойства). В соответствии с Периодическим законом вы периодах и группах между этими элементами находятся амфотерные элементы, проявляющие в той или иной мере металлические и неметаллические (амфотерные, двойственные) свойства. Элементы VIII А-группы продолжают рассматривать отдельно (благородные газы), хотя для Kr , Xe и Rn обнаружены явно неметаллические свойства (элементы He , Ne , Ar химически инертны).
Основные классы неорганических веществ . Соответственно делению элементов классифицируют простые вещества, одноэлементные по составу и представляющие собой формы нахождения элементов в свободном виде. Все двух- и многоэлементные вещества называют сложными веществами, а многоатомные простые вещества и все сложные вещества вместе – химическими соединениями (в них атомы одного или разных элементов соединены между собой химическими связями).
Классификация сложных веществ первых трёх классов по составу основана на обязательном наличии в них самого распространённого в природе элемента – кислорода, и на самом распространённом соединении кислорода – воде.
Первый класс сложных веществ – это оксиды, соединения катионов элементов (реальных или формальных) с кислородом (- II ); их общая формула Э х О у . К оксидам не относятся соединения кислорода с фтором (простейшее из них О - II F 2 - I ), а также пероксиды и надпероксиды ( Na 2 O 2 , KO 2 ), включающие анионы из химически связанных атомов кислорода О 2 2- и О 2 - .
Второй класс сложных веществ – гидроксиды, получающиеся при соединении оксидов с водой (чаще формально, реже реально). По химическим свойствам различают кислотные (Н х ЭО у ), основные и амфотерные [ M ( OH ) n ] гидроксиды, соответствующие кислотным, основным и амфотерным оксидам.
Третий класс сложных веществ – соли, продукты взаимодействия (реального и формального) гидроксидов. Разные типы гидроксидов реагируют между собой и образуют кислородсодержащие соли, имеющие общую формулу М х (ЭО у ) n и состоящих из катионов М n + и анионов (кислотных остатков) ЭО у х- . Такие соли называют средними солями, а если они содержат два химически разных катиона – двойными. При наличии водорода в составе кислотного остатка соли называются кислыми, а при наличии гидроксогрупп ОН – (иногда и ионов О 2– ) – основными солями.
Четвёртый класс сложных веществ – бинарные соединения, их существование и образование логически не вытекает из цепочки первых трёх классов (оксиды – гидроксиды – соли). Классификация бинарных соединений не связана с наличием в них кислорода (– II ) и не основана на соединении такого кислорода – воде. Фактически это обширный класс сложных неорганических веществ, не относящихся к оксидам, гидроксидам и солям и имеющих разнообразные химические свойства.
Неорганические вещества – соединения, образуемые всеми химичес-кими элементами (кроме большинства органических соединений углерода). Неорганические вещества делятся по химическому составу на простые и сложные.
Металлы – простые вещества элементов с металлическими свойствами (низкая электроотрицательность). Типичные металлы:
I А-группа Li , Na , K, Rb, Cs
IIA -группа Mg , Ca , Sr , Ba
При обычных условиях все металлы (за исключением ртути) – твёрдые вещества с характерным металлическим блеском. Большинство металлов имеют серебристо-белый цвет, хотя и есть исключения. Так медь – металл розово-красного цвета, золото – жёлтого. Многие физические свойства металлов изменяются в широких пределах. Например, осмий (самый тяжелый металл) имеет плотность в 42 раза большую, чем литий (самый лёгкий металл). В больших интервалах меняются температуры плавления металлов: наибольшая она у вольфрама (3420 о С), наименьшая – у ртути (–38,9 о С). Взаимодействуют с неметаллами с образованием бинарных соединений, то есть веществ, состоящих из двух элементов. Металлы обладают высокой восстановительной способностью по сравнению с типичными неметаллами. В электрохимическом ряду напряжений они стоят значительно левее водорода, вытесняют водород из воды (магний – при кипячении):
2М + 2Н 2 О = 2МОН + Н 2(г) (М = Li , Na , K, Rb, Cs)
М + 2Н 2 о = М(ОН) 2 + Н 2(г) (М = Mg , Ca , Sr , Ba )
Простые вещества элементов Cu , Ag , Ni также относят к неметаллам, так как у их оксидов CuO , Ag 2 O , NiO и гидроксидов Cu ( OH ) 2 , Ni ( OH ) 2 преобладают основные свойства.
Неметаллы. Простые вещества элементов с неметаллическими свойствами (высокая электроотрицательность). Типичные неметаллы:
VIIA - группа F 2 , Cl 2 , Br 2 , I 2
VIA - группа O 2 , S, Se
VA - группа N 2 , P , As
IVA - группа С, Si
При обычных условиях они могут быть газами (водород, кислород, гелий, хлор), жидкостями (бром), твёрдыми веществами (углерод, сера, фосфор). Неметаллы, находящиеся в твёрдом состоянии, как правило хрупкие. Характерными свойствами неметаллов являются низкие теплопроводность и электропроводность. Неметаллы образуют простые вещества, молекулы которых могут быть одноатомными (Не, Ne и другие благородные газы), двухатомными (Н 2 , О 2 , I 2 ), многоатомными ( O 3 , P 4 , S 8 ), полимерными ( S х , Р х ). Неметаллы обладают высокой окислительной способностью по сравнению с типичными металлами.
Амфигены. Амфотерные простые вещества, образованные элементами с амфотерными (двойственными) свойствами (электроотрицательность промежуточная между металлами и неметаллами). Типичные амфигены:
VII -группа Ве
VI Б-группа Cr
II Б-группа Zn
IIIA -группа Al , Ga
IVA -группа Ge , Sn , Pb
Амфигены обладают более низкой восстановительной способностью по сравнению с типичными металлами. В электрохимическом ряду напряжений они примыкают слева к водороду или стоят за ним справа.
Аэрогены. Благородные газы, одноатомные простые вещества элементов VIIIA -группы: He , Ne , Ar , Kr , Хе, Rn . Из них He , Ne и Ar химически пассивны (соединения с другими элементами не получены), а Kr , Хе и Rn проявляют некоторые свойства неметаллов с высокой электроотрицатель-ностью.
Сложные вещества . Образованы атомами разных элементов. Делятся по составу и химическим свойствам на: оксиды, гидроксиды, соли, бинарные соединения.
I . Оксиды . Оксид – это соединение какого-либо элемента с кислородом. Степень окисления кислорода в оксидах всегда равна (- II ). Оксиды делятся по составу и химическим свойствам на: солеобразующие (основные, кислотные, амфотерные, двойные) и несолеобразующие (пероксиды безразличные, солеобразные,).
Основные оксиды. Продукты полной дегидратации (реальной или условной) основных гидроксидов, сохраняющие химические свойства последних. Из типичных металлов только Li , Mg , Ca , Sr образуют оксиды Li 2 О, Mg О, Ca О, Sr О при сжигании на воздухе. Оксиды Na 2 O , K 2 O , Rb 2 О, Cs 2 О и Ва 2 О получают другими способами. К основным оксидам относят также CuO , Ag 2 O и NiO . Получение основных оксидов:
2 Mg + O 2 = 2 MgO
2 Cu + О 2 = 2 Cu О.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na 2 О, К 2 О крайне труднодоступны.
2С uS + 3 O 2 = 2 CuO + 2 SO 2
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
Cu(OH) 2 = CuO + H 2 O ( при t o )
Этим методом нельзя получить оксиды щелочных металлов.
Разложение солей кислородсодержащих кислот
ВаСО 3 = ВаО + СО 2 (при t o )
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами. Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O ( при t o )
Кислотные оксиды. Продукты полной дегидратации (реальной или условной) кислотных гидроксидов, сохраняющие химические свойства последних. Представляют собой оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
2ZnS + 3O 2 = 2ZnO + 2SO 2 ( при t o )
Большинство кислотных оксидов непосредственно взаимодействуют с водой с образованием кислот:
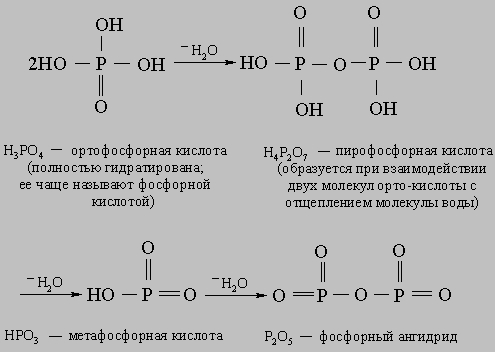
Наряду с современной номенклатурой для кислотных оксидов до сих пор широко используется старинная система названий, как ангидридов кислот – продуктов отщепления воды от соответствующих кислот => СО 2 – ангидрид угольной кислоты, а SO 3 – ангидрид серной кислоты. Из типичных неметаллов только S , Se , P , As , С, Si образуют оксиды S О 2 , Se О 2 , Р 2 О 5 , As 2 О 3 , СО 2 , и Si О 2 при сжигании в воздухе. Остальные кислотные оксиды получают другими способами.
И с к л ю ч е н и е: у оксидов NO 2 и CIO 2 нет соответствующих кислотных гидроксидов, но их считают кислотными, так как NO 2 и CIO 2 реагируют со щелочами, образуя соли двух кислот, а CIO 2 и с водой, образуя две кислоты: а) 2 NO 2 + 2 N аОН = N а NO 2 + NaNO 3 + Н 2 О
б) 2 CIO 2 + 2 N аОН(хол.) = N а CIO 2 + N а CIO 3 + Н 2 О
Оксиды CrO 3 и Mn 2 O 7 (хром и марганец в высшей степени окисления) также являются кислотными.
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, щелочами:
Кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции:
Амфотерные оксиды. Продукты полной дегидратации (реальной или условной) амфотерных гидроксидов, сохраняющие химические свойства последних. Типичные амфигены (кроме G а) при сжигании на воздухе образуют оксиды ВеО, Cr 2 О 3 , Zn О, Al 2 О 3 , Ge О 2 , Sn О 2 , Pb О; амфотерные оксиды Ga 2 О 3 , Sn О, Pb О 2 получают другими способами. Обладают двойственной природой: они одновременно способны вступать в реакции, в которых выступают как основные, так и как кислотные оксиды, то есть реагируют как с кислотами, так и с щелочами:
Al 2 O 3 + 2 NaOH + 3Н 2 О = 2 Na [ Al ( OH ) 4 ]
К числу амфотерных оксидов относится оксид алюминия ( III ) Al 2 O 3 , оксид хрома ( III ) Cr 2 O 3 , оксид бериллия ВеО, оксид цинка ZnO , оксид железа ( III ) Fe 2 O 3 и ряд других. Идеально амфотерным оксидом является вода Н 2 О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства).
Амфотерные свойства воды ярко проявляются при гидролизе растворённых в ней солей
Cu 2+ + Н 2 О = Cu ( OH ) + + H +
Двойные оксиды. Образованы либо атомами одного амфотерного элемента в разных степенях окисления, либо атомами двух разных (металлических, амфотерных) элементов, что и определяет их химические свойства. Примеры:
(Fe II Fe 2 III )O 4 , (Pb 2 II Pb IV )O 4 , (MgAl 2 )O 4 , (CaTi)O 3
Оксид железа образуется при сгорании железа на воздухе, оксид свинца – при слабом нагревании свинца в кислороде; оксиды двух разных металлов получают другими способами.
Несолеобразующие оксиды . Несолеобразующие оксиды – это оксиды неметаллов, не имеющие кислотных гидроксидов и не вступающие в реакции солеобразования (отличие от основных, кислотных и амфотерных оксидов). К таким оксидам относятся: СО, NO , N 2 O , SiO , S 2 О и др.
Рассмотрим несолеобразующие оксиды на примере оксида углерода ( II ) СО – угарного газа. Формальная степень окисления углерода 2+ не отражает строение молекулы СО. Оксид углерода является несолеобразующим и не взаимодействует в обычных условиях с водой, кислотами и щелочами. Пероксиды. Щелочные металлы образуют пероксидные соединения – соединения, в которых имеются химические связи кислород – кислород. Связь О – О не прочна, поэтому пероксиды неустойчивые соединения, легко разлагающиеся. Склонность к образованию таких соединений и их устойчивость возрастают от лития к цезию. Щелочные металлы образуют пероксиды состава Ме 2 О 2 и надпероксиды МеО 2 , где Ме – щелочной металл. Пероксиды щелочных металлов разлагаются водой с выделением кислорода:
Действием кислот на пероксиды щелочных металлов можно получить пероксид водорода:
II Гидроксиды . Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде . Основное различие между ними заключается в том, что концентрация ионов ОН – в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее небольшие равновесные концентрации иона ОН – даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
Гидроксиды – соединения элементов (кроме фтора и кислорода) с гидроксогруппами O - II H , могут содержать также кислород O - II . В гидроксидах
степень окисления элемента всегда положительная (от + I до + VIII ). Число гидроксогрупп от 1 до 6. Делятся по химическим свойствам на основные, кислотные и амфотерные.
Основные гидроксиды (основания) . Образованы элементами с металлическими свойствами. Получаются по реакциям соответствующих основных оксидов с водой:
Ме 2 О + Н 2 О = МеОН (Ме = Li , Na , K, Rb, Cs)
МеО + Н 2 О = Ме(ОН) 2 (Ме = Ca, Sr, Ba)
При нагревании реальная дегидратация (потеря воды) протекает для следующих гидроксидов:
Основные гидроксиды замещают свои гидроксогруппы на кислотные остатки по правилу валентности с образованием солей, металлические элементы сохраняют свою степень окисления в катионах солей.
К группе неорганических веществ относятся все вещества, противоположные по своей сути органическим. То есть, этот означает, что в составе неорганических веществ отсутствует углерод. Исключение составляют карбиды, цианиды, карбонаты и оксид углерода.
Все неорганические вещества подразделяются на две большие группы:
Простые вещества
– это вещества, состоящие из атомов одного элемента.
Подразделяются на две большие группы:
Металлы
Металлы - называется группа простых тел, обладающих известными характерными свойствами, которые в типических представителях резко отличают металлы от других химических элементов.
В физическом отношении это по большей части тела твердые при обыкновенной температуре, непрозрачные (в толстом слое), обладающие известным блеском, ковкие, тягучие, хорошие проводники тепла и электричества и прочее. В химическом отношении для них является характерной способность образовать с кислородом основные окислы, которые, соединяясь с кислотами, дают соли.
К металлам относятся: железо, медь, цинк, кальций, калий, алюминий, золото, серебро, натрий, олово, бериллий и т.д.
Неметаллы
Неметаллами называется группа простых тел, обладающих известными характерными свойствами, которые резко отличают неметаллы от других химических элементов.
В физическом отношении это различные тела твердые: твердые, жидкие и газообразные.
К неметаллам относятся: водород, кислород, азот, фосфор, сера, углерод, аргон, неон и т.д.
Сложные вещества
- это вещества, состоящие из атомов двух и более элементов. Подразделяются на четыре большие группы:
Оксиды
Оксиды - это соединения различных химических элементов с кислородом.
В зависимости от химических свойств различают:
Солеобразующие оксиды – это оксиды, дающие при взаимодействии с другими элементами соли. Они подразделяются на 3 группы:
• основные оксиды (оксид натрия Na2O, оксид меди (II) CuO),
• кислотные оксиды (оксид серы SO3, оксид азота NO2),
• амфотерные оксиды (оксид цинка ZnO, оксид алюминия Аl2О3)
Несолеобразующие оксиды - это оксиды, не дающие при взаимодействии с другими элементами соли. Обычно они распадаются до газа и воды.
Пример: оксид углерода СО, оксид азота NO.
Основания
- это вещества, молекулы которых состоят из молекул металла и гидрокс-группы - ОН. Основания образуются при взаимодействии ряда металлов (натрий, калий) или некоторых оксидов (оксид кальция CaO) с водой.
Пример: NaOH, Ca(OH)2, Al(OH)3, Fe(OH)3.
Кислоты
- называется группа соединений с известной, довольно определенной химической функцией. Эта функция выражена в таких типичных представителях этой группы, как серная кислота H2SO4, азотная кислота HNO3, соляная кислота НСl и прочие.
Существует большое количество классификаций кислот, среди которых особый интерес представляют две – по содержанию кислорода и по принадлежности к классу химических соединений.
Классификация кислот по содержанию кислорода:
• безкислородные (HCl, H2S, HBr)
• кислородсодержащие (HNO3, H2SO4, H3PO4).
Классификация кислот по принадлежности к классу химических соединений:
• неорганические (HBr,HCl, H2S, HNO3, H2SO4),
• органические (HCOOH, CH3COOH).
- это химическое соединение, образовавшееся в результате взаимодействия кислоты и основания.
Неорганическими называют соединения, которые не содержат углерод. Также в порядке исключения к ним относят некоторые вещества на основе углерода: карбонаты, карбиды, карбонилы металлов, цианиды и цианаты, оксиды углерода.
Неорганические соединения разделяют на простые (содержат атомы одного элемента) и сложные (образуются из атомов двух и более элементов).
Простые и сложные вещества также подразделяют на классы.
Классы простых веществ — это металлы, неметаллы, амфотерные вещества и благородные газы.
Классы сложных неорганических веществ — основания, оксиды, кислоты и соли.
Основные свойства простых неорганических веществ
Металлы:
- имеют металлический блеск;
- находятся в твёрдом агрегатном состоянии (кроме жидкой ртути Hg);
- обладают тепло- и электропроводностью;
- прочные, пластичные и ковкие (за исключением хрупких: марганец Mn, висмут V, сурьма Sb, кобальт Co, хром Cr);
- в химических реакциях металлы обычно восстановители (легко отдают свои электроны);
- вытесняют водород из кислот.
Неметаллы — химические элементы, не обладающие металлическими свойствами:
- не имеют блеска, ковкости;
- слабо проводят тепло (исключение: графит) и электрический ток — диэлектрики (исключение: графит и чёрный фосфор);
- могут быть в разных агрегатных состояниях: газообразные — водород H 2 , кислород O 2 , хлор C l 2 и др.; жидкие — бром Br2; твёрдые — углерод C, фосфор P;
- в химических реакциях чаще всего выступают в роли окислителей (присоединяют дополнительные электроны);
- входят в состав кислотных остатков.
Амфотерные вещества проявляют и металлические (оснóвные), и неметаллические (кислотные) свойства: бериллий Be, алюминий Al, свинец Pb, цинк Zn, железо Fe, марганец Mn и другие.
Благородные (инертные) газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
- входят в состав воздуха (кроме Rn);
- не имеют цвета, вкуса и запаха;
- вступают в реакции с другими веществами только в специально созданных условиях;
- лучше, чем другие газы, проводят электрический ток, при этом светятся: неон — оранжевый, криптон — зелёный, ксенон — фиолетовый и др.
Основные свойства сложных неорганических веществ
Оксиды — соединения двух химических элементов, один из которых — кислород.
- могут быть газообразными (оксид углерода (IV) C O 2 , оксид азота (IV) N O 2 ), жидкими (оксид водорода H 2 O или вода) и твёрдыми (оксид фосфора (V) P 2 O 5 , оксид алюминия A l 2 O 3 );
- имеют разнообразные окраски: оксид меди (II) CuO — чёрный, оксид кальция CaO (негашеная известь) — белый, оксид хрома (VI) C r 2 O 3 — зелёный и т.п.;
- некоторые ядовиты: оксид углерода (II) CO или угарный газ; диоксид серы S O 2 , диоксид азота N O 2 .
По химическим характеристикам оксиды подразделяют на:
- Несолеобразующие — NO, N 2 O , CO и SiO (им не соответствуют кислоты).
- Солеобразующие:
- оснóвные — оксиды металлов со степенями окисления +1, +2 (оксид натрия NaO, оксид магния MgO), кроме амфотерных; соответствуют основаниям;
- кислотные — оксиды неметаллов (кроме несолеобразующих): оксид серы (VI) S O 3 , оксид фосфора (V) P 2 O 5 и металлов со степенями окисления выше +5: оксид хрома (VI) C r O 3 , оксид марганца (VII) M n 2 O 7 ; соответствуют кислотам;
- амфотерные — оксиды металлов со степенями окисления +2: только Beo, ZnO, SnO, PbO (соответственно, оксиды бериллия, цинка, олова, свинца); +3: все, кроме оксида лантана L a 2 O 3 и +4: оксид марганца (IV) M n O 2 и др.; проявляют и оснóвные, и кислотные свойства;
- двойные — состоят из двух оксидов с разными степенями окисления металла: F e 3 O 4 (железная окалина), P b 2 O 3 (окись свинца).
Основания — соединения катиона металла (амфотерного элемента или иона N H 4 + ) и гидроксид-аниона -OH.
- все находятся в твёрдом виде и не имеют запаха, кроме гидроксида аммония N H 4 O H (нашатырный спирт, аммиачная вода) — он жидкий и с резким характерным запахом аммиака;
- мягкие на ощупь;
- почти все основания белого цвета (гидроксид лития LiOH, гидроксид магния M g ( O H ) 2 и др.), но встречаются и окрашенные: гидроксид меди (I) CuOH — жёлтый, гидроксид меди (II) C u ( O H ) 2 — голубой, гидроксид железа (III) F e ( O H ) 3 — красно-коричневый.
Изменяют окраску индикаторов:
- фенолфталеин (бесцветный) → малиновый;
- метиловый оранжевый → жёлтый;
- лакмус фиолетовый → синий.
В зависимости от отношения к воде основания подразделяют на:
- Растворимые в воде — щёлочи: образуют щелочные металлы 1А группы: гидроксид калия KOH, гидроксид рубидия RbOH и др.; щелочно-земельные металлы 2А группы, начиная с кальция: гидроксид кальция или гашёная известь C a ( O H ) 2 , гидроксид стронция S r ( O H ) 2 и гидроксид бария B a ( O H ) 2 .
- Нерастворимые в воде — образуют все остальные металлы, в том числе амфотерные.
Кислоты — соединения анионов кислотных остатков с катионами водорода, которые могут замещаться на катионы металлов.
- могут находиться в твёрдом (ортофосфорная H 3 P O 4 , борная H 3 B O 3 ), жидком (азотная H N O 3 , серная H 2 S O 4 ) или газообразном (сероводородная H 2 S , соляная HCl) виде;
- едкие (кроме кремниевой H 2 S i O 3 );
- кислые на вкус, бесцветные;
- некоторые имеют резкий запах (HCl — запах хлористого водорода; H N O 3 — резкий неприятный запах; H 2 S — специфический запах тухлых яиц);
- растворимы в воде, кроме кремниевой H 2 S i O 3 и борной H 3 B O 3 ;
- бывают летучие ( H 2 S , H N O 3 , H C l ) и нелетучие ( H 2 S O 4 , H 3 P O 4 ).
Меняют цвет индикаторов:
- метиловый оранжевый → розовый;
- лакмус фиолетовый → красный;
- фенолфталеин остаётся бесцветным.
Соли — соединения одного или нескольких катионов (или подобных ионов, например, N H 4 + и анионов кислотного остатка (одного или нескольких).
- твёрдые кристаллические вещества чаще белого, но бывают разного цвета: сульфиды серебра A g 2 S , свинца (II) PbS и железа (II) FeS — чёрные; соли железа (III) и их концентрированные растворы — бурые; растворы солей меди (II) — синие и т.д.;
- растворы солей хорошо проводят электрический ток;
- по отношению к воде подразделяют на растворимые и нерастворимые (проверяют по таблице растворимости солей).
Генетическая связь классов неорганических соединений
Химические свойства веществ основных классов неорганических соединений дают им возможность вступать в реакции между собой: см. таблицу 1.
1) галогены ( F 2 , C l 2 , B r 2 , J 2 ) : 2 M e + n H a l 2 → 2 M e H a ln - галогенид
2) O 2 (кроме Au, Ag, Pt): C a + O 2 → C a O - оксид
Me+S→ MeS - сульфид металла
4) H 2 с активными Me: 2Na+ H 2 → 2NaH -гидрид натрия
чаще всего не реагируют, кроме:
Me, находящиеся в ряду активности левее Н 2 + :
а) разбавленные сильные кислоты ( H 2 S O 4 , H C l ) → соль+водород:
C a + 2 H C l → C a C l 2 + H 2 ↑
б) H N O 3 и H 2 S O 4 конц → соль+вода+продукт восстановления кислоты:
3 A g + 4 H N O 3 разб → 3 A g N O 3 + N O ↑ + H 2 O
C u + 2 H 2 S O 4 конц → C u S O 4 + S O 2 ↑ + 2 H 2 O
Если металл 1 находится в ряду активности металлов левее, чем металл 2, то: M e 1 + с о л ь 1 → M e 2 + с о л ь 2
2 M g + T i C l 4 → T i + 2 M g C l 2
а) в растворе щелочные и щелочно-земельные металлы металлы реагируют с водой, а не с солью:
Z n C l 2 р а с т в о р + N a ≠
Z n C l 2 р а с т в о р + M g → M g C l 2 + Z n
б) Расплавы нитратов, карбонатов, сульфитов при нагревании разлагаются на оксид и газ, поэтому с Me не реагируют:
C a C O 3 р а с п л а в + B a ≠
C u C l 2 р а с п л а в + Z n → Z n C l 2 + C u
H 2 (T°, давление), C, Si восстанавливают из оксидов металлы, расположенные в ряду активности после Al:
F e 2 O 3 + C T ° → 2 F e + 3 C O
N i O + H 2 T ° → N i + H 2 O
Оксиды металлов, расположенных до Al, образуют карбиды при реакции с С:
C a O + 3 C T º → C a C 2 + C O
Образуется средняя соль:
B a O + C O 2 → B a C O 3
Образуется соль и H 2 O :
Z n O + 2 H C l → Z n C l 2 + H 2 O
только щёлочи: K O H к о н ц + C l 2 →
K C l O + K C l + H 2 O
6 K O H к о н ц + C l 2 T ° →
K C l O 3 + 5 K C l + 3 H 2 O
Для щёлочей → соль и вода:
2 N a O H + S O 2 → N a 2 S O 3 + H 2 O
1) Реакция нейтрализации щёлочей:
B a ( O H ) 2 + H 2 S O 4 → B a S O 4 + 2 H 2 O
2) Растворение нерастворимых оснований:
Z n ( O H ) 2 ↓ + H N O 3 → Z n ( N O 3 ) 2 + 2 H 2 O
3) Амфотерные гидроксиды:
A l ( O H ) 3 + 3 H B r → A l ( B r ) 3 + 3 H 2 O
а) растворимая средняя соль → нерастворимое основание + соль (правило Бертолле):
M g ( O H ) 2 + Z n ( N O 3 ) 2 → Z n ( O H ) 2 ↓ + C a ( N O 3 ) 2
б) кислая соль → средняя соль+вода:
K O H + K H C O 3 → K 2 C O 3 + H 2 O
Более активные галогены вытесняют менее активные из солей:
2 K J + C l 2 → 2 K C l + J 2
Нелетучие оксиды вытесняют летучие из солей:
N a 2 C O 3 + P 2 O 5 → N a 3 P O 4 + C O 2 ↑
1) Для растворимых солей: реакция должна быть необратимой (образование газа, осадка или воды):
B a C l 2 + H 2 S O 4 → B a S O 4 ↓ + 2 H C l
2) Из нерастворимых солей сильные кислоты вытесняют слабые:
C a S i O 3 + H C l → C a C l 2 + H 2 S i O 3
Взаимодействуют, если обе соли растворимые и один из продуктов реакции выпадает в осадок:
P b ( N O 3 ) 2 + K 2 S O 4 → P b S O 4 ↓ + 2 K N O 3
2 H 2 O + 2 F 2 → 4 H F + O 2 ↑
H 2 O + C l 2 → H C l + H C l O
Все кислотные оксиды, кроме S i O 2 +вода → кислота
N 2 O 5 + H 2 O → 2 H N O 3
Возможен гидролиз, кроме солей, которые образованы сильной кислотой и сильным основанием:
K 2 C O 3 + H 2 O ↔ K H C O 3 + K O H
Способность веществ одного класса преобразовываться в вещества другого класса называют генетической связью. Главные принципы генетической связи:
- Вещества должны быть образованы одним и тем же элементом.
- Взаимопревращения должны идти по схеме цепочке, включающей разные формы существования элемента, то есть относящиеся к различным классам неорганических веществ. Такая цепочка называется генетическим рядом. Ряд может быть полным (если начинается и заканчивается одним и тем же элементом) или неполным.
Примеры веществ основных классов неорганических соединений приведены в таблице 2:
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
К неорганическим относятся соединения всех химических элементов, за исключением большинства соединений углерода.
Кислоты, основания и соли. Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти ионы определяют характерные свойства сильных кислот: кислый вкус и способность взаимодействия с основаниями. Основания - это вещества, которые в воде диссоциируют с высвобождением гидроксид-ионов (ОН-). Солями называют ионные соединения, образующиеся при взаимодействии кислот и оснований:
Положительно заряженные ионы. Названия этих ионов образуются следующим образом: после слова ион указывают название элемента и римскими цифрами - степень его окисления. Например, Cu2+ - ион меди(II), Cu+ - ион меди(I). Названия некоторых положительных ионов оканчиваются на -оний: аммоний, NH4+; гидроксоний, H3O+.
Отрицательно заряженные ионы. Названия одноатомных отрицательно заряженных ионов (и соответственно солей), полученных из не содержащих кислорода кислот, оканчиваются на -ид: хлорид-ион, Cl-; бромид-ион, Br-. Названия ионов (и соответственно солей), полученных из кислородсодержащих кислот, в которых центральный элемент имеет меньшую степень окисления, оканчиваются на -ит: сульфит, SO32-; нитрит, NO2-; фосфит, PO33-; а большую - на -ат: сульфат, SO42-; нитрат, NO3-; фосфат, РО43-. Названия ионов, полученных из частично нейтрализованных кислот, образуются прибавлением к названию иона слова кислый либо приставок гидро- или би-: гидрокарбонат (бикарбонат), HCO3-; кислый сульфат, HSO4-.
Соли и ковалентные соединения. Для солей и ковалентных соединений используют названия ионов, которые в них входят: хлорид натрия, NaCl; гидроксид натрия, NaOH. Если элемент может иметь несколько степеней окисления, то после его названия римскими цифрами указывают степень окисления в данном соединении: сульфат железа(II), FeSO4; сульфат железа(III), Fe2(SO4)3. Если соединение образуют два неметалла, то для указания числа их атомов используют приставки ди-, три-, тетра-, пента- и т.д. Например, дисульфид углерода, CS2; пентахлорид фосфора, PCl5, и т.д.
Энциклопедия Кольера. — Открытое общество . 2000 .
Полезное
Смотреть что такое "НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ" в других словарях:
неорганические соединения — neorganiniai junginiai statusas T sritis chemija apibrėžtis Cheminiai junginiai, išskyrus organinius junginius. atitikmenys: angl. inorganic compounds rus. неорганические соединения … Chemijos terminų aiškinamasis žodynas
Неорганические соединения — Неорганические вещества – это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
ХИМИЯ. НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — К неорганическим относятся соединения всех химических элементов, за исключением большинства соединений углерода. Кислоты, основания и соли. Кислотами называются соединения, которые в воде диссоциируют с высвобождением ионов водорода (Н+). Эти… … Энциклопедия Кольера
Соединения природные — вещества, являющиеся промежуточными или конечными продуктами жизнедеятельности организмов. Термин условен, т.к. к С. п. обычно не относят ряд простых продуктов метаболизма (метан, уксусная кислота, этиловый спирт и др.), компоненты,… … Большая советская энциклопедия
Неорганические вещества — Неорганические вещества это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
Неорганические кислоты — Основная статья: Кислота Неорганические (минеральные) кислоты неорганические вещества, обладающие комплексом физико химических свойств, которые присущи кислотам. Вещества кислотной природы известны для большинства химических элементов за… … Википедия
НЕОРГАНИЧЕСКИЕ ПОЛИМЕРЫ — Имеют неорг. главные цепи и не содержат орг. боковых радикалов. Главные цепи построены из ковалентных или ионно ковалентных связей; в нек рых Н. п. цепочка ионно ковалентных связей может прерываться единичными сочленениями координац. характера.… … Химическая энциклопедия
Неорганические тиоцианаты — У этого термина существуют и другие значения, см. тиоцианаты. Тиоцианаты (тиоцианиды, роданиды, сульфоцианиды) соли … Википедия
Неорганические азиды — Азиды химические соединения, производные азотистоводородной кислоты HN3. Содержат одну или несколько групп N3. Содержание 1 Азиды металлов 2 Азиды неметаллов … Википедия
Читайте также:

