Сообщение на тему алкины в медицине
Обновлено: 04.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Государственное бюджетное образовательное учреждение
средняя общеобразовательная школа №225 Адмиралтейского района Санкт-Петербурга
Алкины. Ацетилен
Савельева Елизавета Игоревна
Воронаев Иван Геннадьевич
1. Ацетилен. Особенности его строения и его химические свойства. 4
2. Реакции с ацетиленом и его использование в промышленности 5
Список литературы 8
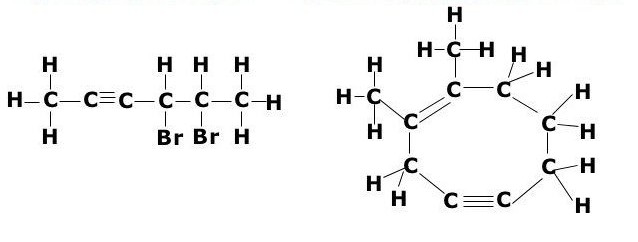
Алки́ны (иначе ацетиленовые углеводороды ) — углеводороды, содержащие ттройную связь между атомами углерода, образующие гомологический ряд с общей формулой C n H 2n-2 . Атомы углерода при тройной связи находятся в состоянии sp -гибридизации.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обусловливает кислотные свойства алкинов в реакциях замещения.
Целью реферата является рассмотрение ацетилена, особенностей его строения, его химические свойства, реакции с ацетиленом и его использование в промышленности.
Ацетилен. Особенности его строения и его химические свойства.
Ацетилен — продукт неполного разложения метана. Этот процесс называют пиролизом. Теоретически ацетилен можно представить как продукт дегидрирования этилена:

На практике ацетилен, кроме пиролизного способа, очень часто получают из карбида кальция:

Особенность строения молекулы ацетилена состоит в том, что между атомами углерода имеется тройная связь, т. е. он является еще более непредельным соединением, чем этилен, молекула которого содержит двойную углерод-углеродную связь.
Ацетилен является родоначальником гомологического ряда алкинов, или ацетиленовых углеводородов.
Ацетилен — это бесцветный газ без запаха, малорастворимый в воде.
Рассмотрим химические свойства ацетилена, которые лежат в основе его применения.
Ацетилен на воздухе горит коптящим пламенем из-за высокого содержания углерода в его молекуле, поэтому для сжигания ацетилена используют кислород:
Температура ацетиленокислородного пламени достигает 3200 °С. Таким пламенем можно резать и сваривать металлы.
Реакции с ацетиленом и его использование в промышленности .
Как и все непредельные соединения, ацетилен активно вступает в реакции присоединения. 1) галогенов (галогенирование), 2) водорода (гидрирование), 3) галогеноводородов (гидрогалогенирование), 4) воды (гидратация).
Реакция гидрохлорирования — присоединения хлороводорода:

Продукт гидрохлорирования ацетилена называют винилхлоридом потому что одновалентный радикал этилена СН2=СН— называют винилом. Винилхлорид — это исходное соединение для получения полимера — поливинилхлорида, который находит широкое применение. В настоящее время винилхлорид получают не гидрохлорированием ацетилена, а другими способами.
Поливинилхлорид получают с помощью уже знакомой вам реакции полимеризации. Полимеризация винилхлорида в поливинилхлорид может быть описана с помощью следующей схемы:

или уравнения реакции:

Реакция гидратации, протекающая в присутствии солей ртути, содержащих катион Hg 2+ , в качестве катализатора, носит имя выдающегося русского химика-органика М. Г. Кучерова и раньше широко использовалась для получения очень важного органического соединения — уксусного альдегида:

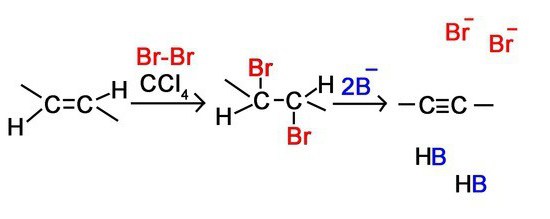
Реакцию присоединения брома — бромирование — используют как качественную реакцию на кратную (двойную или тройную) связь. При пропускании ацетилена (или этилена, или большинства других непредельных органических соединений) через бромную воду можно наблюдать ее обесцвечивание. При этом происходят следующие химические превращения:


Еще одной качественной реакцией на ацетилен и непредельные органические соединения является обесцвечивание раствора перманганата калия.
Ацетилен — важнейший продукт химической промышленности, который имеет широкое применение.
В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы.
Таким образом мы узнали об особенностях строения молекулы ацетилена, химических свойствах ацетилена ,о реакциях ,в которые вступает ацетилен . Также Ацетилен используется в промышленности:
для газовой сварки и резки металлов
как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа,

Алканы, алкены, алкины - это органические химические вещества. Все они построены из таких химических элементов, как карбон и гидроген. Алканы, алкены, алкины - это химические соединения, которые принадлежат к группе углеводородов.
В этой статье мы рассмотрим алкины.
Что это такое?
Эти вещества еще называются ацетиленовыми углеводородами. Строение алкинов предусматривает наличие в их молекулах атомов карбона и гидрогена. Общая формула ацетиленовых углеводородов такая: CnH2n-2. Самым простый простой алкин - этин (ацетилен). Он обладает вот такой химической формулой - С2Н2. Также к алкинам относится пропин с формулой С3Н4. Кроме того, к ацетиленовым углеводородам можно отнести бутин (С4Н6), пентин (С5Н8), гексин (С6Н10), гептин (С7Н12), октин (С8Н14), нонин (С9Н16), децин (С10Н18) и т. д. Все виды алкинов обладают похожими характеристиками. Давайте рассмотрим их подробнее.

Физические свойства алкинов
По своим физическим характеристикам ацетиленовые углеводороды напоминают алкены.
В нормальных условиях алкины, в молекулах которых содержится от двух до четырех атомов карбона, обладают газообразным агрегатным состоянием. Те, в молекулах которых находится от пяти до 16 атомов карбона, при нормальных условиях жидкости. Те, в составе молекул которых от 17 и больше атомов этого химического элемента, - твердые вещества.
Плавятся и кипят алкины при более высокой температуре, чем алканы и алкены.
Растворимость в воде незначительная, но немного выше, чем у алкенов и алканов.
Наиболее широко используемый алкин - ацетилен - обладает такими физическими свойствами:
- не имеет цвета;
- не имеет запаха;
- при нормальных условиях находится в газообразном агрегатном состоянии;
- обладает меньшей плотностью, чем воздух;
- температура кипения - минус 83,6 градусов Цельсия;
Химические свойства алкинов
В этих веществах атомы связаны тройной связью, чем и объясняются основные их свойства. Алкины вступают в реакции такого типа:
- гидрирование;
- гидрогалогенирование;
- галогенирование;
- гидратация;
- горение.
Давайте рассмотрим их по порядку.
Гидрирование
Химические свойства алкинов позволяют им вступать в реакции такого типа. Это вид химического взаимодействия, при котором молекула вещества присоединяет к себе дополнительные атомы водорода. Вот пример такой химической реакции в случае с пропином:
Эта реакция происходит в две стадии. На первой молекула пропина присоединяет два атома гидрогена и на второй - столько же.
Галогенирование
Это еще одна реакция, которая входит в химические свойства алкинов. В ее результате молекула ацетиленового углеводорода присоединяет атомы галогенов. К последним относятся такие элементы, как хлор, бром, иод и др.
Вот пример такой реакции в случае с этином:
Такой же процесс возможен и с другими ацетиленовыми углеводородами.
Гидрогалогенирование
Это также одна из основных реакций, которая входит в химические свойства алкинов. Она заключается в том, что вещество взаимодействует с такими соединениями, как НСІ, НІ, HBr и др. Это химическое взаимодействие происходит в две стадии. Давайте рассмотрим реакцию такого типа на примере с этином:
Гидратация
Это химическая реакция, которая заключается во взаимодействии с водой. Она тоже происходит в два этапа. Давайте рассмотрим ее на примере с этином:
Вещество, которое образуется после первого этапа реакции, называется виниловым спиртом.
В связи с тем, что согласно правилу Эльтекова функциональная группа ОН не может располагаться рядом с двойной связью, происходит перегруппировка атомов, в результате которой из винилового спирта образуется ацетальдегид.
Процесс гидратации алкинов еще называется реакцией Кучерова.
Горение
Это процесс взаимодействия алкинов с кислородом при высокой температуре. Рассмотрим горение веществ этой группы на примере с ацетиленом:
При избытке кислорода ацетилен и другие алкины горят без образования карбона. При этом выделяются только оксид карбона и вода. Вот уравнение такой реакции на примере с пропином:
Горение других ацетиленовых углеводородов также происходит подобным образом. В результате выделяется вода и углекислый газ.
Другие реакции
Также ацетилены способны реагировать с солями таких металлов, как серебро, медь, кальций. При этом происходит замещение гидрогена атомами металла. Рассмотрим такой вид реакции на примере с ацетиленом и нитратом серебра:
Еще один интересный процесс с участием алкинов - реакция Зелинского. Это образование бензола из ацетилена при его нагревании до 600 градусов по Цельсию в присутствии активированного угля. Уравнение этой реакции можно выразить таким образом:
Также возможна полимеризация алкинов - процесс объединения нескольких молекул вещества в одну полимерную.
Получение
Алкины, реакции с которыми мы рассмотрели выше, получают в лаборатории несколькими методами.
Первый - это дегидрогалогенирование. Выглядит уравнение реакции таким образом:
Для проведения такого процесса необходимо нагреть реагенты, а также добавить этанол в качестве катализатора.
Также есть возможность получения алкинов из неорганических соединений. Вот пример:
Следующий метод получения алкинов - дегидрирование. Вот пример такой реакции:
С помощью реакции подобного типа можно получить не только этин, но и другие ацетиленовые углеводороды.
Применение алкинов
Наибольшее распространение в промышленности получил самый простой алкин - этин. Он широко используется в химической отрасли.
- Нужен ацетилен и другие алкины для получения из них других органических соединений, таких как кетоны, альдегиды, растворители и др.
- Также из алкинов можно получить вещества, которые используются при производстве каучуков, поливинилхлорида и др.
- Из пропина можно получить ацетон в результате ракции Кучерова.
- Кроме того, ацетилен используется при получении таких химических веществ, как уксусная кислота, ароматические углеводороды, этиловый спирт.
- Еще ацетилен применяется в качестве топлива с очень высокой теплотой горения.
- Также реакция горения этина используется для сваривания металлов.
- Кроме того, с использованием ацетилена можно получить технический карбон.
- Также это вещество применяется в автономных светильниках.
- Ацетилен и ряд других углеводородов этой группы используются в качестве ракетного топлива благодаря своей высокой теплоте горения.
На этом применение алкинов заканчивается.

Заключение
В качестве завершающей части приводим краткую таблицу о свойствах ацетиленовых углеводородов и их получении.

Определение алкинов, формула, основные химические свойства
Алкины (углеводороды ряда ацетилена) представляют собой химические вещества из группы углеводородов алифатического ряда, которые содержат одну тройную связь -С≡С-.
Общая формула алкинов СnH2n-2.
Самым простым представителем алкинового ряда является ацетилен (этин) С2Н2.
Согласно заместительной номенклатуре IUPAC названия ацетилен углеводородов образуются по названию соответствующих алкана, при этом следует заменить суффикс -ан на -ин (-ин) с обозначением положения тройной связи в цепи углеродных атомов.
Нумерацию атомов карбона начинают с того конца, к которому ближе всего находится тройная связь, например, СН3СН (СН 3) С≡ССН3 - 4-метилпентин-2.
По рациональной номенклатуре углеводороды ацетиленового ряда или алкины называют производными ацетилена, в эмпирической формуле которого атомы водорода замещаютя на радикалы: НС≡С-СН 2 СН 3 - этилацетилен.
Изомерия ацетилен углеводородов связана с положением тройной связи и разветвлением углеродной цепи. Алкины С2-С4 - это газы, С5-С16 - жидкости, а начиная с С17 - твердые субстанции.
Химические свойства алкинов
Химические свойства ацетилен углеводородов обусловленные наличием в структуре их субстанции тройной связи. Ацетиленовая (алкинная) группа -С≡С-Н или -С≡С-R имеет линейное строение, атомы углерода sp-гибридизованные. Они связаны одной σ- и двумя π-связями, при этом максимальные их плотности расположены в двух взаимоперпендикулярных участках, образуя цилиндрическое облако π-электронной плотности. Расстояние -С≡С- равно 1,1205 нм, энергия тройной связи - 836 кДж / моль. Вследствие особенностей строения тройной связи для алкинов характерны реакции окисления, присоединения, полимеризации, изомеризации и замещения. Ацетилен углеводороды присоединяют по связи -С≡С- непосредственно галогены, галогеноводороды – при наличии катализаторов (например, HgCl2, CuCl), образуя дигалогениды и тетрагалогениды.
Указанные реакции используют в производстве трихлорэтилена, тетрахлорэтилена, винилхлорида и других хлоропроизводных соединений. Гидрогенизация алкинов натрием в жидком NH3 приводит к транс-алкенов, водородом над Pd / C - до цис-алкенов. Вода присоединяется в присутствии солей Hg2 + с образованием ацетальдегида для ацетилена и кетонов для всех остальных алкинов (Реакция Кучерова). Прямая гидратация ацетилена возможна при пропускании его в смеси с парами воды при T=300-400° С над фосфатами тяжелых металлов. Реакцию гидратации ацетилена используют в промышленности для получения ацетальдегида и продуктов дальнейших его преобразований - ацетона, уксусной кислоты, спирта и т.д. Спирты взаимодействуют с ацетилен углеводородами в присутствии ROH, BF3 или HgO, алкоксиды щелочных металлов, солей меди при температуре 150-200° С.
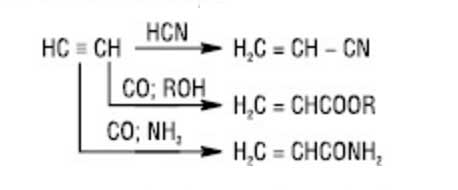
Продукты реакции - виниловые эфиры, которые используются в производстве полимеров, эмульгаторов, смазочных материалов и т.д. Аналогично ацетилен углеводородам присоединяются также карбоновые кислоты (при этом в качестве катализатора применяют HgSO4, ацетаты Cd или Zn на активированном угле), амиды кислот, амины, тиолы и другие с образованием виниловых соединений, например:
Винилацетат широко применяют для получения полимера поливинилацетата (ПВА). Путем присоединения к ацетилену цианидной кислоты или при взаимодействии с СО и спиртами, NH3, а также аминами в присутствии в качестве катализатора Ni (CO) 4 под давлением получают нитрил, амиды или эфиры акриловой кислоты, которые используются в синтезе полимеров:
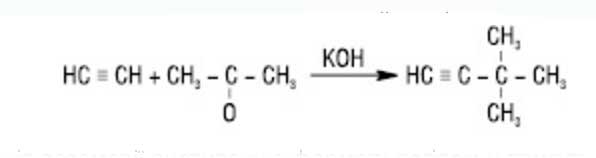
Ацетилен углеводороды в присутствии щелочных катализаторов присоединяют кетоны и альдегиды (реакция Фаворского):
Большую практическую роль играет реакция взаимодействия в присутствии ацетиленидов Cu ацетилена с формальдегидом (реакция Реппе):
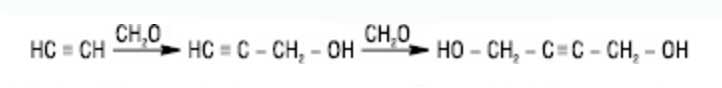
Пропаргиловий спирт (I) - выходное соединение при производстве 1,4-бутиленгликоля. Алкины вступают в реакции циклоприсоединения и Дильса - Альдера. Термическая или каталитическая полимеризация приводит к образованию олигомеров и полимеров. Например, под воздействием солей Cu (I) в водном растворе HCl ацетилен димеризуется в винилацетилен, из которого впоследствии получают хлоропрен. Над активным углем ацетилен тримеризуется в бензол в присутствии в качестве катализатора N и (CN)2; в тетрагидрофуране - в циклооктатетраен (реакция Реппе), в присутствии водорода над Ni - в изобутилен. Из метилацетилена можно получить мезитилен и др. В присутствии окислителя и солей меди (I) ацетилен полимеризуется с образованием полиацетилена - карбина, который считается наряду с алмазом и графитом третьей аллотропная видоизменением углерода с кумулированным строением макромолекул:
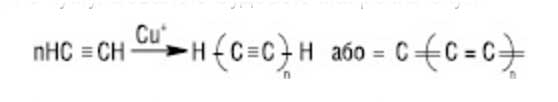
При действии щелочных металлов тройная связь у алкинов перемещается через стадию образования промежуточных но не на конец молекулы. А в присутствии спиртовых растворов щелочи, наоборот, тройная связь перемещается к середине молекулы:

Алкины с конечными тройными связями (R-C≡CH) обладают высокой для углеводородов кислотностью (для ацетилена рКа≈25) и образуют при действии щелочных, щелочно-земельных металлов, амидов металлов, металлических производных, так называемые ацетилениды МС≡СR, энергично реагирующие с водой, регенерирующим ацетилен углеводороды.
Из магнийорганических соединений легко образуются магнийгалогенопроизводные ацетилен углеводородов (Реактивы Иоцича). Ацетилениды Na, Mg, Li применяют в органическом синтезе для введения в молекулу ацетиленовой группы, например:
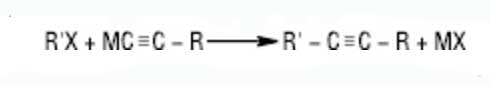
Дизамещенные ацетилениды Cu2C2 и Ag2C2 синтезируются при воздействии на ацетилен аммиачных растворов солей Cu (I) и Ag, соответственно. Образование Cu2C2 красно-бурого цвета применяют для идентификации ацетилена и его гомологов с конечной тройной связью. Ацетилениды тяжелых металлов в сухом виде – это неустойчивые соединения, которые взрываются от сотрясения. В процессе сгорании ацетилена при доступе чистого кислорода выделяется значительное количество тепла (при этом температура пламени достигает 3000 градусов С), что дает возможность применять ацетилен с целью автогенной резки и сварки металлов. Окислители KMnO4 (в нейтральном или щелочной среде), K2Cr2O7, RuO4, SeO2, CrO3 в кислой среде, озон приводят к расщеплению тройной связи с синтезом карбоновых кислот. В некоторых случаях возможно окисление до α-дикетонов. С конечным тройной связью алкины в указанных условиях образуют карбоновую кислоту и СО2.
Методы извлечения ацетилена в промышленности:
Получают ацетиленовые углеводороды в лабораторных условиях в результате действия спиртового раствора щелочи (КОН - спиртовой раствор) на 1,1- или 1,2-дигалогенопроизводные углеводородов:
Алкины, в частности полиацетилен, обнаруженные в природе во многих растениях, грибах (Basidiomycetes) например из подсолнечника выделено желтый пентаинен СН3- (С≡С) 5-СН = СН2.
Алкины (ацетиленовые углеводороды) наркотического действия, усиливается с увеличением молекулярной массы субстанции.
Длительная работа специалистов с ацетиленом в промышленных условиях могут привести к функциональным нарушениям нервной системы. Высокие концентрации ацетилена при незначительном содержании кислорода приводят к отеку легких и потере сознания.
Применение алкинов (ацетиленовых углеводородов) в медицине
Ацетилен - один из базовых сырьевых источников промышленности органического синтеза. При конденсации ацетилена с пирролидоном получают N-винилпирролидона, который легко полимеризуется с синтезом поливинилпирролидона (ПВП):
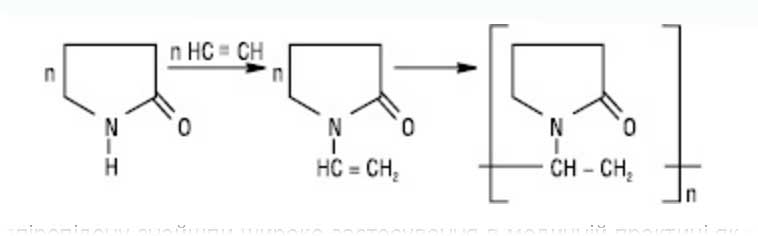
Полимерные соединения на основе винилпирролидона нашли широкое применение в медицинской практике как вещества при производстве лекарственных препаратов, а многие из них сами являются лекарственными. Например низкомолекулярный поливинилпирролидон (12000-13000 молекулярная масса) образует коллоидные растворы в воде и используется в процессе приготовления гемодеза (кровезаменителя), среднемолекулярные поливинилпирролидон (с молекулярной массой 35000-40000) применяется в фармации как связующее вещество для изготовления таблеток.
При сополимеризации винилпирролидона, акриламида и этилкрилата получают биорастворимый полимер, который обеспечивает удлиненное действие лекарственных препаратов (пролонгируя эффект), например, лекарственных пленок для глаз.
Полезно знать
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Алкины – это непредельные углеводороды, молекулы которых содержат тройную связь. Представитель – ацетилен, гомологи его:



Строение алкинов.
Атомы углерода, которые образуют тройную связь, находятся в sp-гибридизации. σ-связи лежат в плоскости, под углом 180 °С, а π-связи образованы путем перекрывания 2х пар негибридных орбиталей соседних атомов углерода.
Изомерия алкинов.
Для алкинов характерна изомерия углеродного скелета, изомерия положения кратной связи.
Пространственная изомерия не характерна.
Физические свойства алкинов.
В нормальных условиях:
С17 и более – твердые вещества.
Температуры кипения алкинов выше, чем у соответствующих алканов.
Растворимость в воде незначительна, немного выше, чем у алканов и алкенов, но все равно очень мала. Растворимость в неполярных органических растворителях высокая.
Получение алкинов.
1. Отщепление 2х молекул галогенводорода от дигалогенавконов, которые находятся либо у соседних атомов углерода или у одного. Отщепление происходит под воздействием спиртового раствора щелочи:

2. Действие галогеналканов на соли ацетиленовых углевородородов:

Реакция протекает через образование нуклеофильного карбаниона:

3. Крекинг метана и его гомологов:



В лаборатории ацетилен получают:

Химические свойства алкинов.
1. Галогенирование. Галогены присоединяются к алкинам в 2 стадии. Например,


Алкины также как алкены обесцвечивают бромную воду, поэтому эта реакция является качественной и для алкинов.
2. Гидрогалогенирование. Галогенводороды присоединяются к тройной связи несколько тружднее, чем к двойной. Для ускорения (активации) процесса используют сильную кислоту Льюиса – AlCl3. Из ацетилена при таких условиях модно получить винилхлорид, который идет на производства полимера – поливинилхлорида, имеющего важнейшее значение в промышлености:

.
Если же галогенводород в избытке, то реакция (особенно у несимметричных алкинов) идет по правилу Марковникова:

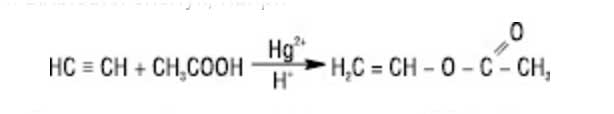
3. Гидратация (присоединение воды). Реакция протекает только в присутствии солей ртути (II) в качестве катализатора:
На 1ой стадии образуется непредельный спирт, в котором гидроксигруппа находится у атома углерода, образующего двойную связь. Такие спирты называются виниловыми или фенолами.
Отличительная черта таких спиртов – неустойчивость. Они изомеризуются в более стабильные карбонильные соединения (альдегиды и кетоны) вследствие переноса протона от ОН-группы к углероду при двойной связи. При этом π-связь рвется (между атомами углерода), и образуется новая π-связь между атомомами углерода и атомом кислорода. Такая изомеризация происходит из-за большей плотности двойной связи С=О по сравнению с С=С.
Только ацетилен превращается в альдегид, его гомологи - в кетоны. Реакция протекает по правила Марковникова:

Эта реакция носит названия – реакции Кучерова.

4. Те алкины, которые имеют концевую тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Такой процесс обусловлен сильной поляризацией связи .
Причиной поляризации служит сильная электроотрицательность атома углерода в sp-гибридизации, поэтому алкины могут образовывать соли – ацетилениды:

Ацетилениды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди). Эти реакции являются качественными на концевую тройную связь:

Полученные соли легко разлагаются под действием HCl, в результате выделяется исходный алкин:

Поэтому алкины легко выделить из смеси других углеводородоров.
5. Полимеризация. При участии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий, могут образовываться различные продукты. Например, под воздействием хлорида меди (I) и хлорида аммония:

Винилацетилен (полученное соединение) присоединяет хлороводород, образуя хлорпрен, который служит сырьем для получения синтетического каучука:

6. Если ацетилен пропускать через уголь при 600 ºС, получают ароматическое соединение – бензол. Из гомологов ацетилена, получают гомологи бензола:


7. Реакция окисления и восстановления. Алкины легко окисляются перманганатом калия. Раствор обесцвечивается, т.к. в исходном соединении есть тройная связь. При окислении происходит расщепление тройной связи с образованием карбоновой кислоты:

В присутствие металлических катализаторов происходит восстановление водородом:

Применение алкинов.
На основе алкинов производят много различных соединений, имеющих широкое применение в промышленности. Например, получают изопрен – исходное соединения для производства изопренового каучука.
Ацетилен используют для сварки металлов, т.к. процесс его горения весьма экзотермичный.
Читайте также:

