Сообщение катализаторы и ингибиторы
Обновлено: 05.05.2024
Есть вещества, которые влияют на скорость химической реакции, не являясь при этом реагентами. Они принимают в реакции самое непосредственное участие, но в результате реакции остаются неизменными. Такие вещества называются катализаторами, если они ускоряют реакцию, и ингибиторами, если замедляют ее.
75% химической промышленности использует каталитические процессы. Среди них - как крупнотоннажные производства: синтез аммиака и его окисление, производство серной кислоты, так и тонкие многостадийные синтезы, например, лекарственных средств.
Все биохимические реакции, протекающие в живых организмах, требуют участия природных катализаторов - ферментов. Ферменты представляют собой крупные белковые молекулы с так называемым активным центром - как правило, это химически связанная с белком молекула небелковой природы или ион металла. Ферменты обладают непревзойденнойактивностью(т.е. скоростью каталитического процесса), ускоряя реакции в миллиарды и триллионы раз при комнатной температуре. При высоких температурах они теряют активность, так как белок денатурируется. Кроме того, ферменты характеризуются чрезвычайной избирательностью (селективностью), превращая лишь строго определенные вещества в строго определенные продукты. Они способны на это благодаря своей уникальной форме, к которой реагенты должны подойти, как ключ к замку.
Многие катализаторы не просто ускоряют реакции, а ведут их по другому пути. Так, реакция окисления аммиака без катализатора:
не представляет никакого интереса для промышленности, а в результате каталитического окисления на платине:
получается ценный продукт - оксид азота(II).
В пищевой промышленности широко используются ингибиторы, предотвращающие гидролиз жиров, реакции окисления и брожения.
Особый случай катализа - аутокатализ, или ускорение реакции одним из ее продуктов. При этом скорость реакции не уменьшается по мере расходования реагентов, а растет. Так, реакция
ускоряется по мере накопления ионов Mn 2+ , образующихся при восстановлении перманганата.
Пероксид водорода
| Условия | Примеры |
| Природа реагирующих веществ | Многие вещества хранятся годами, а перекись водорода разлагается: 2Н2О2 = 2Н2О + О2↑ |
| Их концентрация | Чистая перекись водорода разлагается со взрывом, а в растворе — за несколько месяцев |
| Температура | В прохладном месте раствор Н2О2 сохраняется довольно долго |
| Присутствие катализаторов и ингибиторов | Раствор Н2О2, поступающий в продажу, содержит ингибиторы, чтобы лучше хранился. Но если к нему добавить щепотку MnO2 в качестве катализатора — происходит бурное выделение кислорода |
Кейс
Фрески пишут по сырой штукатурке красками, которые разводятся водой. Высыхая, известь штукатурки плотно соединяется с красочным слоем.
Для приготовления красок, используемых в создании фресок, применяют обычные пигменты. Но при их отборе учитывают одно общее ограничение, обусловленное химическими свойствами основных компонентов грунта.
Задания
1. Разберите данную ситуацию, проведите ее анализ.
2. Из имеющихся у вас пигментов (красная охра, берлинская лазурь, цинковые белила, фиолетовый кобальт, краплак, зеленый крон, желтый крон), предложите художнику те, которые возможны в использовании во фресковой живописи. Докажите это практически.
3. Пригодятся ли знания, полученные из данного кейса, в вашей будущей профессиональной деятельности?
Информационный материал
Стр. 194 – 197 9 класс
Приложение 2 Кальций углекислый
Карбонат кальция СаСО3 – одно из самых распространенных на Земле соединений. Минералы на основе СаСО3 покрывают около 40 млн. км 2 земной поверхности. Мел, мрамор, известняки, ракушечники – все это СаСО3 с небольшими примесями.
Самый важный из этих минералов – известняк. Известняки есть практически везде. В европейской части России известняки встречаются в отложениях почти всех геологических возрастов. В чистом виде известняки – белого или светло – желтого цвета, но примеси придают им более темную окраску. Известняк незаменим в производстве цемента, карбида кальция, соды, всех видов извести (гашеной, негашеной, хлорной), белильных растворов и многих других полезных веществ. Без известняка не обходится ни одно строительство.
Во – первых, из него самого строят, во – вторых, из известняка делают многие строительные материалы.
Приложение 3
Качеству грунта – штукатурке – во фресковой живописи придается очень большое значение, поскольку от него зависит долговечность создаваемых картин. На Руси известь, применяемая для фресок, проходила многолетнюю обработку: в течение трех – восьми лет ее выдерживали в особых ямах, постоянно перелопачивая. Для получения штукатурки известь смешивали с гипсом, мелом, мелкотолченым кирпичом, рубленым льном. Грунт обычно делали двухслойным. На хорошо просохший первый, достаточно толстый слой штукатурки непосредственно перед началом работы художника наносили тонкий второй слой. По нему и выполняли роспись.
Приложение 4.
Химический процесс, лежащий в основе высыхания фресковой живописи – процесс карбонизации, соответствующий уравнению реакции:
Гипсовая известь нерастворимый
в составе грунта карбонат кальция
В результате такого взаимодействия на поверхности росписи возникает тончайшая пленка из нерастворимого в воде карбоната кальция.
Приложение 5. Оксиды – пигменты художественных красок.
Pb3O4 –сурик, получаемыйпережиганием свинцовых белил. Пигмент ярко – красного цвета.
ZnO – при горении парообразного цинка на воздухе появляется сине – зеленое пламя и образуются белые хлопья оксида цинка ZnO. Оксид цинка в виде рыхлого белого порошка используется для изготовления цинковых белил (в отличие от свинцовых белил на воздухе не темнеет и безвреден).
TiO2 –рутил. Применяется для изготовления титановых белил.
Известной популярностью пользуется у художников и зелень Гинье, хромофором которой является гидрат оксида хрома Cr2O3 . (2-3)Н2О, где часть воды химически связана, а часть адсорбирована. Этот пигмент придает окраске изумрудный оттенок.
Приложение 6 Соли - пигменты художественных красок
Кейс
В 1825 – 1827 гг. был получен металл, который ценился дороже золота. Погремушка сыны Наполеона III была сделана из этого металла, а самый богатый королевский двор Европы имел столовые приборы, изготовленные из него.
Задания:
1. О каком металле идёт речь?
2. Каково положение этого металла в Периодической системе химических элементов Д.И.Менделеева.
3. Каково строение атома этого металла?
4. Какими физическими свойствами он обладает?
5. В какие химические реакции вступает это вещество и какие вещества при этом образуются? Напишите уравнения возможных реакций и назовите продукты реакций.
6. Почему при обычных условиях изделия из этого металла устойчивы к воздействию факторов окружающей среды?
7. По какой до конца XIX века этот металл был на вес золота?
8. На каких свойствах этого металла основано его применение в народном хозяйстве?
Есть вещества, которые влияют на скорость химической реакции, не являясь при этом реагентами. Они принимают в реакции самое непосредственное участие, но в результате реакции остаются неизменными. Такие вещества называются катализаторами, если они ускоряют реакцию, и ингибиторами, если замедляют ее.
75% химической промышленности использует каталитические процессы. Среди них - как крупнотоннажные производства: синтез аммиака и его окисление, производство серной кислоты, так и тонкие многостадийные синтезы, например, лекарственных средств.
Все биохимические реакции, протекающие в живых организмах, требуют участия природных катализаторов - ферментов. Ферменты представляют собой крупные белковые молекулы с так называемым активным центром - как правило, это химически связанная с белком молекула небелковой природы или ион металла. Ферменты обладают непревзойденной активностью (т.е. скоростью каталитического процесса), ускоряя реакции в миллиарды и триллионы раз при комнатной температуре. При высоких температурах они теряют активность, так как белок денатурируется. Кроме того, ферменты характеризуются чрезвычайной избирательностью (селективностью), превращая лишь строго определенные вещества в строго определенные продукты. Они способны на это благодаря своей уникальной форме, к которой реагенты должны подойти, как ключ к замку.
Действие катализаторов основано на том, что они уменьшают энергию активации реакции. Хотите узнать об этом подробнее?
Многие катализаторы не просто ускоряют реакции, а ведут их по другому пути. Так, реакция окисления аммиака без катализатора:
4NH3 + 3O2 = 2N2 + 6H2O
не представляет никакого интереса для промышленности, а в результате каталитического окисления на платине:
4NH3 + 5O2 = 4NO + 6H2O
получается ценный продукт - оксид азота(II).
Ингибиторы, наоборот, увеличивают энергию активации реакции. В пищевой промышленности широко используются ингибиторы, предотвращающие гидролиз жиров, реакции окисления и брожения.
Особый случай катализа - аутокатализ, или ускорение реакции одним из ее продуктов. При этом скорость реакции не уменьшается по мере расходования реагентов, а растет. Так, реакция
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
ускоряется по мере накопления ионов Mn 2+ , образующихся при восстановлении перманганата.
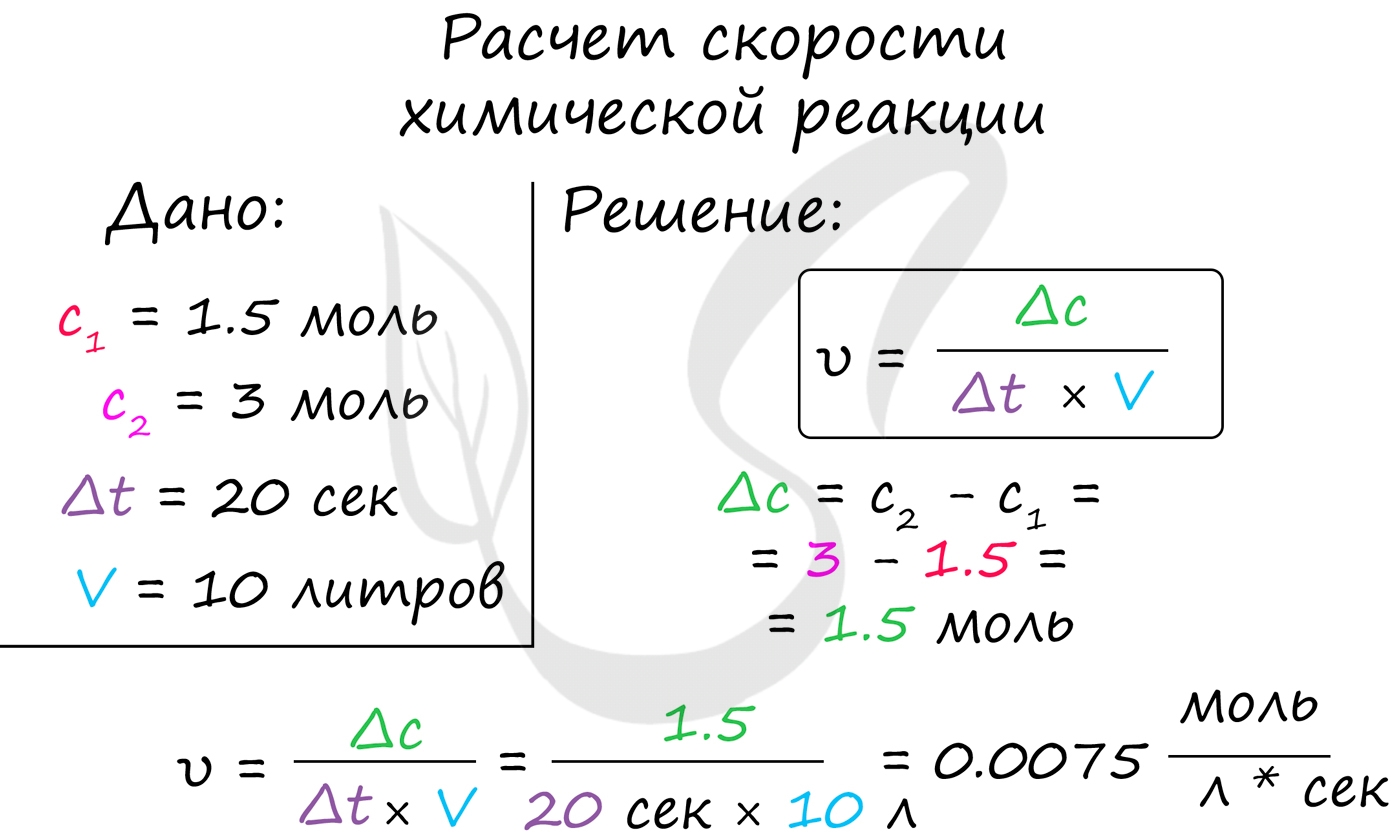
Скорость химической реакции - основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.

Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции - 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо - железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос "какой из металлов Fe или Ca быстрее прореагирует с серой?" мы отдадим предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.

Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос "какой из металлов Li или K быстрее прореагирует с водой?" мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации "прямо пропорционально" скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении - понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Физический смысл константы скорости - k - в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени - a и b.
Записанное выше следствие закона действующих масс нужно не только "зазубрить", но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: "Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!"
Очень часто в заданиях следующей темы - химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь и помните про постулат!

Итак, влияние температуры на скорость реакции "прямо пропорционально": чем выше температура, тем выше скорость реакции - чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая "пропорция".
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: "При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза"

- υ1 - скорость реакции при температуре t1
- υ2 - скорость реакции при температуре t2
- γ - температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?

Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: "Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз".

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) - вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов - белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора - каталитическими.

Ингибитор (лат. inhibere - задерживать) - вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
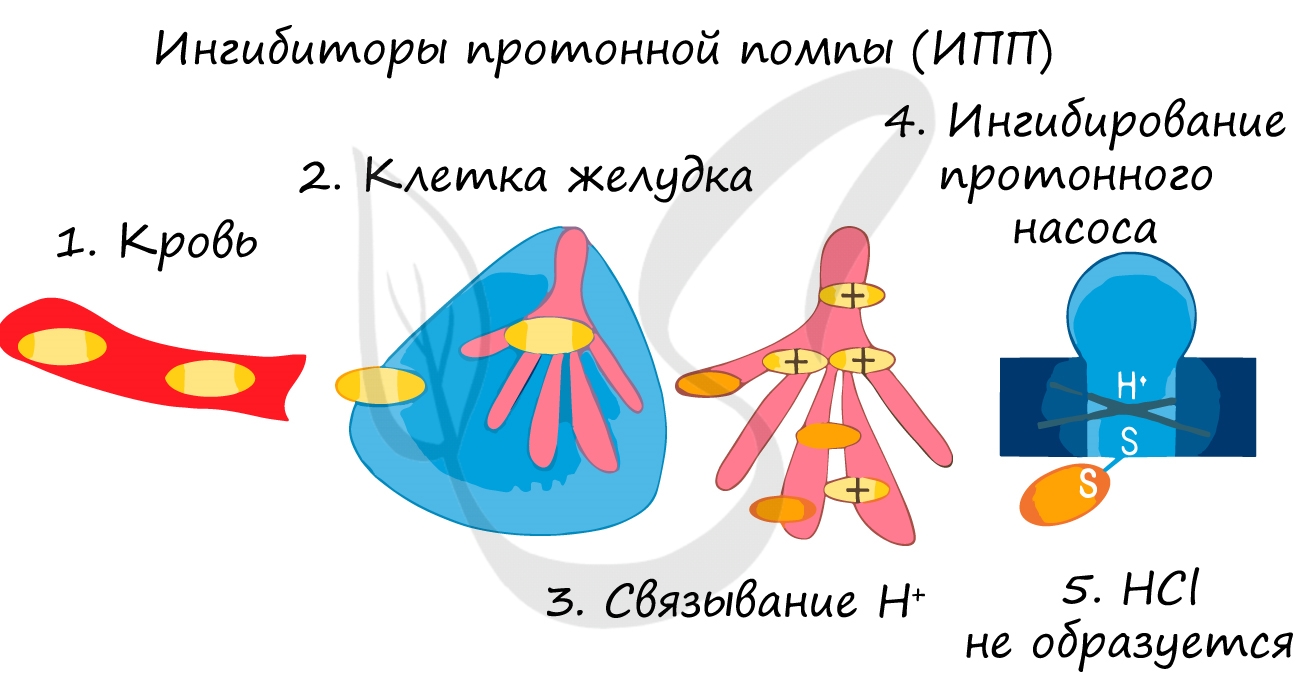
Так при лечении гастрита - воспаления желудка (греч. gaster - желудок) или язв часто назначаются ингибиторы протонной помпы - химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Катализаторы и Ингибиторы являются химическими соединениями. Эти две группы соединений проявляют противоположную активность в биологических и химических системах. Они участвуют в химических реакциях, но непосредственно не используются в них.
Содержание
- Обзор и основные отличия
- Что такое Катализатор
- Что такое Ингибитор
- В чем разница между Катализатором и Ингибитором
- Заключение
Что такое Катализатор?
Катализатор — это химическое соединение, которое может увеличить скорость реакции, но непосредственно не используется в ней. Следовательно, это соединение может продолжать действовать неоднократно. По этой причине для определенной химической реакции требуется только небольшое количество катализатора.

Влияние катализатора на химическую реакцию
Катализатор обеспечивает альтернативный путь химической реакции, уменьшая энергию активации реакции. Здесь катализатор соединяется с реагентом для создания промежуточного продукта, и после завершения требуемой реакции катализатор покидает промежуточное соединение и регенерирует.
Существует два типа катализаторов, как гомогенные, так и гетерогенные катализаторы. В гомогенных катализаторах молекулы находятся в той же фазе, что и молекулы реагента. Однако в гетерогенных катализаторах молекулы находятся в фазе, отличной от фазы молекул реагента. Ферменты являются хорошим примером биологических катализаторов.
Что такое Ингибитор?
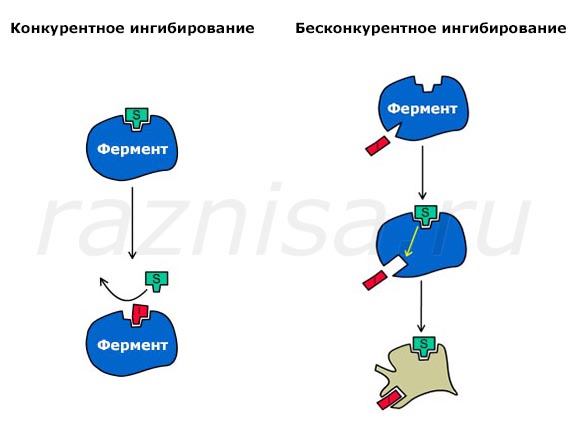
Конкурентное и бесконкурентное ингибирование ферментов (красный — ингибитор, зелёный — субстрат)
В отличие от катализаторов, эти соединения не обеспечивают пути реакции для снижения энергии активации. Роль ингибитора заключается либо в дезактивации катализатора, либо в удалении промежуточных продуктов реакции.
В чем разница между Катализатором и Ингибитором?
Катализатор — это химическое соединение, которое может увеличить скорость реакции не использующийся в ней, в то время как Ингибитор — это химическое соединение, которое может либо остановить, либо снизить скорость химической реакции. Таким образом, это ключевое различие между Катализатором и Ингибитором.
Кроме того, Катализаторы работают путем обеспечения альтернативного пути реакции путем получения промежуточного продукта реакции, в то время как Ингибиторы работают либо путем дезактивации катализатора, либо путем удаления промежуточных продуктов реакции.
Заключение — Катализатор против Ингибитора
Катализатор представляет собой химическое соединение, которое может увеличить скорость реакции, в то время как Ингибитор представляет собой химическое соединение, которое может либо остановить, либо уменьшить скорость реакции химической реакции. Ключевое различие между Катализатором и Ингибитором заключается в том, что Катализатор увеличивает скорость реакции, тогда как Ингибитор останавливает или уменьшает скорость реакции.
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными. Каталитические реакции - реакции, протекающие в присутствии катализаторов.
Содержание
Введение ……………………………………………………………………. 3
Глава 1. Катализаторы и ингибиторы ……………………………………. 4
1.1 Видные деятели химии о катализе ……………………………. 7
Работа содержит 1 файл
Контрольная по КСЕ.doc
по дисциплине: "Концепции современного естествознания"
Темы: “Катализаторы и ингибиторы.
Выполнила: Студентка
Специальность: 078565
Группа: 11-ИГ
Проверила: Сидорова О.В.
Оценка работы: ____________
Пупкино, 2002 г.
Глава 1. Катализаторы и ингибиторы ……………………………………. 4
1.1 Видные деятели химии о катализе ……………………………. 7
Глава 1. Катализаторы и ингибиторы.
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными. Каталитические реакции - реакции, протекающие в присутствии катализаторов. Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) - при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного - снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия. Катализаторы, замедляющие химическую реакцию, называются ингибиторами. В зависимости от того, находится катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
Н О + I = H O + IO
Н O + IO = Н O + O + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации. При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела - катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель. Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы:
1. Диффузия реагирующих веществ к поверхности твердого вещества.
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их.
3. Химическая реакция между реагирующими молекулами.
4. Десорбция продуктов с поверхности катализатора.
5. Диффузия продукта с поверхности катализатора в общий поток.
Примером гетерогенного катализа является окисление SO в SO на катализаторе V O при производстве серной кислоты (контактный метод). Промоторы (или активаторы) - вещества, повышающие активность катализатора. При этом промоторы могут сами и не обладать каталитическими свойствами. Каталитические яды - посторонние примеси в реакционной смеси, приводящие к частичной или полной потере активности катализатора. Так, следы мышьяка, фосфора вызывают быструю потерю катализатором V O активности (контактный метод производства H SO). Многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов. Биохимические реакции в растительных и животных организмах ускоряются биохимическими катализаторами - ферментами. Скорость процесса - чрезвычайно важный фактор, определяющий производительность оборудования химических производств. Поэтому одна из основных задач, поставленных перед химией научно-технической революцией, это поиск путей увеличения скорости реакций. Другая важная задача современной химии, обусловленная резко возрастающими масштабами производства химических продуктов,- повышение избирательности химических превращений в полезные продукты, уменьшение количества выбросов и отходов. С этим связана, кроме того, и охрана окружающей среды и более рациональное использование истощающихся, к сожалению, природных ресурсов. Для достижения всех этих целей нужны верные средства, и такими средствами служат прежде всего катализаторы. Однако изыскивать их не так просто. B процессе познания внутреннего устройства окружающих нас вещей ученые установили определенную градацию, иерархию уровней микромира. Мир, описываемый в нашей книге,- это мир молекул, взаимные превращения которых составляют предмет химии. Нас будет интересовать не вся химия, а только часть ее, посвященная изучению динамики изменения химической структуры молекул. Видимо нет надобности говорить о том, что молекулы построены из атомов, а последние- из ядра и окружающей его электронной оболочки; что свойства молекул зависят от природы составляющих их атомов и последовательности соединения их друг с другому что химические и физические свойства веществ зависят от свойств молекул и характера их взаимосвязи. Будем считать, что все это в общих чертах известно читателю, и потому главный упор сделаем на вопросах, связанных с представлением о скорости химических реакций. [7] Взаимные превращения молекул протекают с самой различной скоростью. Скорость можно изменять, нагревая или охлаждая смесь реагирующих молекул. При нагревании скорость реакции, как правило, возрастает, но это не единственное средство ускорения химических превращений. Существует еще один, более эффективный способ - каталитический, широко используемый в наше время в производстве самых разнообразных продуктов. Первые научные представления о катализе возникли одновременно с развитием атомной теории строения вещества. В 1806 г., через год после того, как один из создателей современной атомистической теории Дальтон сформулировал в “Записках Манчестерского литературного и философского общества” закон кратных отношений, Клеман и Дезорм опубликовали подробные данные об ускорении процесса окисления сернистого газа в присутствии окислов азота при камерном производстве серной кислоты. Шесть лет спустя в “Технологическом журнале” Кирхгоф изложил результаты своих наблюдений об ускоряющем действии разбавленных минеральных кислот на гидролиз крахмала до глюкозы. Этими двумя наблюдениями была открыта эпоха экспериментального изучения необычных для того времени химических явлений, которым шведский химик Берцелиус дал в 1835 г. общее название “катализ” от греческого слова “каталоо” - разрушать. Такова, в двух словах, история открытия катализа, который с полным основанием следует отнести к одному из фундаментальных явлений природы. Теперь я хочу дать современное и наиболее общепринятое определение катализа, а затем и некоторую общую классификацию каталитических процессов, так как именно с этого начинается любая точная наука. Как известно, “физика - это то, чем занимаются физики (то же самое можно сказать и о химии)”. Следуя этому наставлению Бергмана, можно было бы ограничиться утверждением, что “катализ - это то, чем занимаются и химики и физики”. Но, естественно, такого шутливого объяснения недостаточно, и со времен Берцелиуса давалось множество научных определений понятию “катализ”. На наш взгляд наилучшее определение сформулировано Г. К. Вересковым: “Феноменологически катализ можно определить как возбуждение химических реакций или изменение их скорости под действием веществ - катализаторов, многократно вступающих в промежуточные химические взаимодействия с участниками реакции и восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав”. Самое странное в этом определении его заключительная часть - вещество, ускоряющее химический процесс, не расходуется. Если нужно ускорить движение тяжелого тела, его подталкивают и, следовательно, затрачивают на это энергию. Чем больше потрачено энергии, тем большую скорость приобретает тело. В идеальном случае количество затраченной энергии будет точно равно приобретенной телом кинетической энергии. В этом проявляется фундаментальный закон природы - сохранение энергии.
1.1 Видные деятели химии о катализе.
И. Берцелиус (1837):
“Известные вещества оказывают при соприкосновении с другими веществами такое влияние на последние, что возникает химическое действие,- одни вещества разрушаются, другие образуются вновь без того, чтобы тело, присутствие которого вызывает эти превращения, принимало в них какое-либо участие. Мы называем причину, вызывающую эти явления, каталитической силой”.
М. Фарадей (1840):
“Каталитические явления можно объяснить известными свойствами материи, не снабжая ее при этом никакой новой силой”.
П. Рашиг (1906):
“Катализ представляет вызываемое внешними причинами изменение строения молекулы, имеющее следствием изменение химических свойств”.
Э. Абель (1913):
“Я пришел к выводу, что катализ осуществляется в результате реакции, а не простого присутствия вещества”.
Л. Гурвич (1916):
“Каталитически действующие тела, притягивая к себе движущиеся молекулы гораздо сильнее, чем тела, лишенные каталитического действия, тем самым увеличивают силу удара, попадающих на их поверхность молекул”.
Г. К. Боресков (1968):
“Когда-то катализ рассматривался как особое, немного таинственное явление, со специфическими законами, раскрытие которых должно было сразу в общей форме решить задачу подбора. Сейчас мы знаем, что это не так. Катализ по своей сущности - химическое явление. Изменение скорости реакции при каталитическом воздействии обусловлено промежуточным химическим взаимодействием реагирующих веществ с катализатором”.
Если не принимать во внимание неудачную попытку Берцелиуса связать наблюдаемые явления с действием скрытой “каталитической силы”, то, как можно заметить из приведенных выступлений, дискуссия шла в основном вокруг физических и химических аспектов катализа. Длительное время особенно популярной была энергетическая теория катализа, связывающая процесс возбуждения молекул с резонансной миграцией энергии. Катализатор вступает во взаимодействие с реагирующими молекулами, образуя неустойчивые промежуточные соединения, которые распадаются с выделением продукта реакции и химически неизменного катализатора. Современные наши знания лучше всего отражены в высказывании Борескова. Здесь, однако, возникает вопрос, а не может ли катализатор, поскольку он сам химически участвует в реакции, создать новое равновесное состояние? Если бы это было так, то идея о химическом участии катализатора немедленно вступала бы в противоречие с законом сохранения энергии. Чтобы избежать этого, ученые были вынуждены принять, а затем и экспериментально доказать, что катализатор ускоряет реакцию не только в прямом, но и в обратном направлениях. Те же соединения, которые изменяют и скорость и равновесие реакции, в строгом смысле этого слова не являются катализаторами. [7] Мне остается добавить, что обычно в присутствии катализатора имеет место ускорение химических реакций, и это явление называют “положительным” катализом в отличие от “отрицательного”, при котором введение катализатора в реакционную систему вызывает снижение скорости. Строго говоря, катализ всегда повышает скорость реакции, но иногда ускорение одной из стадий (например, появление нового пути обрыва цепей) приводит к наблюдаемому торможению химической реакции. Я буду рассматривать только положительный катализ, который принято подразделять на следующие типы:
а) гомогенный, когда реакционная смесь и катализатор находятся или в жидком или в газообразном состоянии;
б) гетерогенный - катализатор находится в виде твердого вещества, а реагирующие соединения в виде раствора или газообразной смеси; (Это наиболее распространенный тип катализа, осуществляемого, таким образом, на границе раздела двух фаз.)
в) ферментативный - катализатором служат сложные белковые образования, ускоряющие течение биологически важных реакций в организмах растительного и животного мира. (Ферментативный катализ может быть как гомогенным, так и гетерогенным, но из-за специфических особенностей действия ферментов целесообразно выделение этого вида катализа в самостоятельную область.)
Читайте также:

