Сообщение испарение и конденсация
Обновлено: 02.07.2024
У всех веществ есть три агрегатных состояния – твердое, жидкое и газообразное, которые проявляются при особых условиях.
Фазовый переход – это переход вещества от одного состояния к другому.
Примерами такого процесса являются конденсация и испарение.
Если создать определенные условия, можно превратить любой реальный газ (например, азот, водород, кислород) в жидкость. Для этого необходимо понижение температуры ниже некоторого минимума, называемого критической температурой. Она обозначается T к р . Так, для азота значение этого параметра равно 126 К , для воды – 647 , 3 К , для кислорода – 154 , 3 К . При поддержании комнатной температуры вода может сохранять как газообразное, так и жидкое состояние, а азот и кислород – только газообразное.
Испарение – это фазовый переход вещества в газообразное состояние из жидкого.
Молекулярно-кинетическая теория объясняет этот процесс постепенным перемещением с поверхности жидкости тех молекул, чья кинетическая энергия больше, чем энергия их связи с остальными молекулами жидкого вещества. Вследствие испарения средняя кинетическая энергия оставшихся молекул уменьшается, что, в свою очередь, приводит к снижению температуры жидкости, если к ней не подведен дополнительный источник внешней энергии.
Конденсация – это фазовый переход вещества из газообразного состояния в жидкое (процесс, обратный испарению).
Во время конденсации молекулы пара возвращаются обратно в жидкое состояние.

Рисунок 3 . 4 . 1 . Модель испарения и конденсации.
Динамическое равновесие
Если сосуд, в котором находится жидкость или газ, закупорен, то в таком случае его содержимое может находиться в динамическом равновесии, т.е. скорость процессов конденсации и испарения будет одинаковой (из жидкости будет испаряться столько молекул, сколько возвращается обратно из пара). Такая система получила название двухфазной.
Насыщенный пар – это пар, который находится со своей жидкостью в состоянии динамического равновесия.
Существует зависимость между количеством молекул, испаряющихся с поверхности жидкости в течение одной секунды, и температурой этой жидкости. Скорость процесса конденсации зависит от концентрации молекул пара и скорости их теплового движения, которая, в свою очередь, также находится в прямой зависимости от температуры. Следовательно, можно сделать вывод, что при равновесии жидкости и ее пара концентрация молекул будет определяться равновесной температурой. При повышении температуры необходима высокая концентрация молекул пара, чтобы испарение и конденсация стали одинаковыми по скорости.
Поскольку, как мы уже выяснили, концентрация и температура будут определять давление пара (газа), мы можем сформулировать следующее утверждение:
Давление насыщенного пара p 0 определенного вещества не зависит от объема, но находится в прямой зависимости от температуры.
Именно по этой причине изотермы реальных газов на плоскости включают в себя горизонтальные фрагменты, которые соответствуют двухфазной системе.
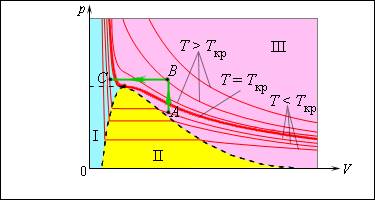
Если температура будет расти, увеличатся и давление насыщенного пара, и его плотность, а вот плотность жидкости, наоборот, будет снижаться из-за теплового расширения. При достижении критической для данного вещества температуры плотность жидкости и газа уравниваются, после прохождения этой точки физические различия между насыщенным паром и жидкостью исчезают.
Возьмем насыщенный пар и будем сжимать его изотермически при T T к р . Его давление будет постепенно возрастать, пока не сравняется с давлением насыщенного пара. Постепенно на дне сосуда появится жидкость, и между ней и ее насыщенным паром возникнет динамическое равновесие. По мере уменьшения объема будет происходить конденсация все большей части пара при неизменном давлении (на изотерме это состояние соответствует горизонтальному участку). После того, как весь пар перейдет в жидкое состояние, давление начнет резко увеличиваться при дальнейшем уменьшении объема, поскольку жидкость сжимается слабо.
Необязательно проходить двухфазную область, чтобы совершить переход от газа к жидкости. Процесс можно провести и в обход критической точки. На изображении такой вариант показан при помощи ломаной линии A B C .

Рисунок 3 . 4 . 3 . Модель изотермы реального газа.
Воздух, которым мы дышим, при некотором давлении всегда включает в себя водяные пары. Это давление, как правило, меньше, чем давление насыщенного пара.
Относительная влажность воздуха – это отношение парциального давления к давлению насыщенного водяного пара.
В виде формулы это можно записать так:
Для описания ненасыщенного пара допустимо использовать и уравнение состояния идеального газа с учетом обычных для реального газа ограничений: не слишком большого давления пара ( p ≤ ( 10 6 – 10 7 ) П а ) и температуры выше значения, определенного для каждого конкретного вещества.
Для описания насыщенного пара применимы законы идеального газа. Однако при этом давление для каждой температуры должно быть определено по кривой равновесия для данного вещества.
Чем выше температура, тем выше давление насыщенного пара. Эту зависимость из законов идеального газа вывести нельзя. При условии постоянной концентрации молекул давление газа будет постоянно возрастать прямо пропорционально температуре. Если пар является насыщенным, то с ростом температуры будет расти не только концентрация, но и средняя кинетическая энергия молекул. Из этого следует, что чем выше температура, тем быстрее растет давление насыщенного пара. Этот процесс происходит быстрее, чем рост давления идеального газа при условии постоянной концентрации молекул в нем.
Что такое кипение
Выше мы указывали, что испарение идет в основном с поверхности, но оно также может происходить и из основного объема жидкости. Любое жидкое вещество включает в себя мелкие газовые пузырьки. Если внешнее давление (т.е. давление газа в них) уравнять с давлением насыщенного пара, то произойдет испарение жидкости внутри пузырьков, и они начнут наполняться паром, расширяться и всплывать на поверхность. Этот процесс называется кипением. Таким образом, температура кипения зависит от внешнего давления.
Жидкость начинает кипеть при такой температуре, при которой внешнее давление и давление ее насыщенных паров будут равны.
Если атмосферное давление нормальное, то для кипения воды нужна температура 100 ° С . При ней давление насыщенных водяных паров будет равно 1 а т м . Если мы будем кипятить воду в горах, то из-за уменьшения атмосферного давления температура кипения снизится до 70 ° С .
Жидкость может кипеть только в открытом сосуде. Если его герметично закрыть, то нарушится равновесие между жидкостью и ее насыщенным паром. Узнать температуру кипения при различных значениях давления можно с помощью кривой равновесия.
Кривые равновесия состояний вещества
На изображении выше с помощью изотерма реального газа показаны процессы фазовых переходов – конденсации и испарения. Эта схема является неполной, поскольку вещество может принимать также и твердое состояние. Достижение термодинамического равновесия между фазами вещества при заданной температуре возможно лишь при определенном давлении в системе.
Кривая фазового равновесия – это зависимость между равновесным давлением и температурой.
Примером такой зависимости может быть кривая равновесия жидкости и насыщенного пара. Если мы построим кривые, отображающие равновесие между фазами одного вещества, на плоскости, то мы увидим определенные области, которые соответствуют разным агрегатным состояниям вещества – жидкому, твердому, газообразному. Кривые, построенные в системе координат, называются фазовыми диаграммами.

Рисунок 3 . 4 . 4 . Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область I I – жидкость, область I I I – газообразное вещество.
Равновесие между газообразной и твердой фазой вещества отображает так называемая кривая сублимации (на рисунке она обозначена как 0 T ), между паром и жидкостью – кривая испарения, которая заканчивается в критической точке. Кривая равновесия между жидкостью и твердым телом называется кривой плавления.
Тройная точка – это точка, в которой сходятся все кривые равновесия, т.е. возможны все фазы вещества.
Многие вещества достигают тройной точки при давлении меньше 1 а т м ≈ 10 5 П а . Они плавятся при нагревании в атмосферном давлении. Так, у воды тройная точка имеет координаты T т р = 273 , 16 К , p т р = 6 , 02 · 10 2 П а . Именно на ней основана абсолютная температурная шкала Кельвина.
У некоторых веществ достижение тройной точки происходит и при давлении выше 1 а т м .
Например, для углекислоты нужно давление в 5 , 11 а т м и температура T т р = 216 , 5 К . Если давление равно атмосферному, то для поддержания ее в твердом состоянии нужна низкая температура, а переход в жидкое состояние становится невозможен. Углекислота в равновесии со своим паром при атмосферном давлении называется сухим льдом. Это вещество не способно плавиться, а может только испаряться (сублимировать).
Испарение — это переход вещества из жидкого состояния в газообразное (пар), происходящее со свободной поверхности жидкости.
Испарение.
Испарение — это переход вещества из жидкого состояния в газообразное (пар), происходящее со свободной поверхности жидкости.
Сублимацию, или возгонку, т.е. переход вещества из твердого состояния в газообразное, также называют испарением.
Из повседневных наблюдений известно, что количество любой жидкости (бензина, эфира, воды), находящейся в открытом сосуде, постепенно уменьшается. Жидкость не исчезает бесследно — она превращается в пар. Испарение — это один из видов парообразования. Другой вид — это кипение.
Механизм испарения.
Как происходит испарение? Молекулы любой жидкости находятся в непрерывном и беспорядочном движении, причем, чем выше температура жидкости, тем больше кинетическая энергия молекул. Среднее значение кинетической энергии имеет определенную величину. Но у каждой молекулы кинетическая энергия может быть как больше, так и меньше средней. Если вблизи поверхности окажется молекула с кинетической энергией, достаточной для преодоления сил межмолекулярного притяжения, она вылетит из жидкости. То же самое повторится с другой быстрой молекулой, со второй, третьей и т. д. Вылетая наружу, эти молекулы образуют над жидкостью пар. Образование этого пара и есть испарение.
Поглощение энергии при испарении.
Поскольку при испарении из жидкости вылетают более быстрые молекулы, средняя кинетическая энергия оставшихся в жидкости молекул становится все меньше и меньше. Это значит, что внутренняя энергия испаряющейся жидкости уменьшается. Поэтому если нет притока энергии к жидкости извне, температура испаряющейся жидкости понижается, жидкость охлаждается (именно поэтому, в частности, человеку в мокрой одежде холоднее, чем в сухой, особенно при ветре).
Однако при испарении воды, налитой в стакан, мы не замечаем понижения ее температуры. Чем это объяснить? Дело в том, что испарение в данном случае происходит медленно, и температура воды поддерживается постоянной за счет теплообмена с окружающим воздухом, из которого в жидкость поступает необходимое количество теплоты. Значит, чтобы испарение жидкости про исходило без изменения ее температуры, жидкости необходимо сообщать энергию.
Количество теплоты, которое необходимо сообщить жидкости для образования единицы массы пара при постоянной температуре, называется теплотой парообразования.
Скорость испарения жидкости.
В отличие от кипения, испарение происходит при любой температуре, однако с повышением температуры жидкости скорость испарения возрастает. Чем выше температура жидкости, тем больше быстро движущихся молекул имеет достаточную кинетическую энергию, чтобы преодолеть силы притяжения соседних частиц и вылететь за пределы жидкости, и тем быстрее идет испарение.
Скорость испарения зависит от рода жидкости. Быстро испаряются летучие жидкости, у которых силы межмолекулярного взаимодействия малы (например, эфир, спирт, бензин). Если капнуть такой жидкостью на руку, мы ощутим холод. Испаряясь с поверхности руки, такая жидкость будет охлаждаться и отбирать у нее некоторое количество теплоты.
Скорость испарения жидкости зависит от площади ее свободной поверхности. Это объясняется тем, что жидкость испаряется с поверхности, и чем больше площадь свободной поверхности жидкости, тем большее количество молекул одновременно вылетает в воздух.
В открытом сосуде масса жидкости вследствие испарения постепенно уменьшается. Это связано с тем, что большинство молекул пара рассеивается в воздухе, не возвращаясь в жидкость (в отличие от того, что происходит в закрытом сосуде). Но небольшая часть их возвращается в жидкость, замедляя тем самым испарение. Поэтому при ветре, который уносит молекулы пара, испарение жидкости происходит быстрее.
Применение испарения в технике.
Испарение играет важную роль в энергетике, холодильной технике, в процессах сушки, испарительного охлаждения. Например, в космической технике быстроиспаряющимися веществами покрывают спускаемые аппараты. При прохождении через атмосферу планеты корпус аппарата в результате трения нагревается, и покрывающее его вещество начинает испаряться. Испаряясь, оно охлаждает космический аппарат, спасая его тем самым от перегрева.
Конденсация.
Конденсация (от лат. condensatio — уплотнение, сгущение) — переход вещества из газообразного состояния (пара) в жидкое или твердое состояние.
Известно, что при наличии ветра жидкость испаряется быстрее. Почему? Дело в том, что одновременно с испарением с поверхности жидкости идет и конденсация. Конденсация происходит из-за того, что часть молекул пара, беспорядочно перемещаясь над жидкостью, снова возвращается в нее. Ветер же выносит вылетевшие из жидкости молекулы и не дает им возвращаться.
Конденсация может происходить и тогда, когда пар не соприкасается с жидкостью. Именно конденсацией объясняется, например, образование облаков: молекулы водяного пара, поднимающиеся над землей, в более холодных слоях атмосферы группируются в мельчайшие капельки воды, скопления которых и представляют собой облака. Следствием конденсации водяного пара в атмосфере являются также дождь и роса.
При испарении жидкость охлаждается и, став более холодной, чем окружающая среда, начинает поглощать ее энергию. При конденсации же, наоборот, происходит выделение некоторого количества теплоты в окружающую среду, и ее температура несколько повышается. Количество теплоты, выделяющееся при конденсации единицы массы, равно теплоте испарения.
Испарение происходит при любой температуре. При испарении молекулы покидают жидкость, энергия жидкости уменьшается, значит, температура жидкости тоже уменьшается .

Пар над кружкой с чаем — испарившаяся вода. Молекулы пара имеют большую кинетическую энергию, чем молекулы жидкости. Это позволяет им преодолеть притяжение соседних молекул жидкости. Испарившиеся молекулы забирают часть энергии жидкости, поэтому чай остывает.
Весной сугробы снега тают не только с помощью перехода в жидкое состояние. Сублимация ускоряет уменьшение снежных и ледяных покровов. На иллюстрации видно, что снег уменьшил свой объём без образования ручейков.

Резкий запах нафталина — это сублимированные молекулы, которые с помощью диффузии доходят до наших органов обоняния.

Кипение — это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности, но и внутри неё.

Известно, что одновременно с испарением происходит переход молекул из пара в жидкость. Это явление называют конденсацией.
Как известно, для процесса испарения необходимо подводить энергию. При конденсации происходит обратный процесс — энергия выделяется.
Всем знакома ситуация, когда летним вечером при заходе солнца становится прохладно. В этот момент водяной пар, находящийся в атмосфере, конденсируется. Мы наблюдаем это явление, как выпадение росы, т.е. на окружающих нас предметах появляются капельки воды.

Роса — не единственный пример конденсации. Все видели как запотевают окна или трубы с холодной водой в ванной комнате. При кипячении жидкости, например, в чайнике, мы говорим, что идет пар. На самом деле это образуется туман (поток испарившихся молекул воды, попадая в воздух значительно меньшей температуры, тут же конденсируется). Образование облаков также связано с явлением конденсации. Как известно, облако состоит из мелких капелек воды.
Испарение — переход молекул вещества из жидкого состояния в газообразное.
Важно! В результате испарения жидкости вылетают самые быстрые молекулы. Поэтому средняя скорость молекул газа уменьшается. Это приводит к уменьшению средней кинетической энергии газа, а следовательно — и температуре.
Скорость испарения зависит от:
Конденсация — процесс, обратный испарению, т.е. молекулы из газообразного состояния переходят в жидкое.
В открытом сосуде всегда преобладает испарение. В герметично закрытом сосуде устанавливается равновесие между этими процессами.
Динамическое равновесие — это состояние, при котором число испарившихся за единицу времени молекул равно числу сконденсированных. пар, который находится в состоянии динамического равновесия, называется насыщенным.
Пример №1. В сосуде под поршнем при температуре 100 o C находится 2 г водяного пара и такое количество воды. Не изменяя температуры, объем сосуда увеличили в 3 раза. Определить массу воды, перешедшей при этом в пар.
Вода и пар под поршнем находятся в динамическом равновесии. Поэтому при увеличении объема изменение (уменьшение) давления вызывает усиление испарения. Вода кипит при 100 о С только при условии, что давление равно 10 5 Па. Следовательно, давление насыщенного пара равно именно 10 5 Па.
Применим уравнение состояния идеального газа для первого и второго случая:
p 1 V 1 = m 1 M . . R T
p 2 V 2 = m 2 M . . R T
m1 — масса пара в состоянии 1, m2 — масса газа в состоянии 2.
Внимание! Несмотря на постоянство температуры, применять закон Бойля — Мариотта нельзя, так как в данном случае не сохраняется постоянство массы (количества молекул) пара.
R T M . . = p 1 V 1 m 1 . .
R T M . . = p 2 V 2 m 2 . .
Приравняем правые части и выразим массу пара в состоянии 2:
p 1 V 1 m 1 . . = p 2 V 2 m 2 . .
p 1 V 1 m 1 . . = p 2 3 V 1 m 2 . .

6 г — это масса пара в состоянии 2. Это значит, что в газообразное состояние должно перейти 6 – 2 = 4 г воды. Но под поршнем было лишь 2 г. Следовательно, испарится вся вода.
Влажность воздуха
Выделяют абсолютную и относительную влажности воздуха.
Абсолютная влажность воздуха — физическая величина, показывающая массу водяных паров, содержащихся в 1 м 3 воздуха.
Абсолютная влажность воздуха обозначается буквой ƒ. Единица измерения — кг/м 3 . Но так как содержание в воздухе водяных паров мало, абсолютную влажность воздуха часто указывают в г/м 3 .Исходя из определения, она определяется формулой:
Так как количество испаренных молекул зависит от температуры среды, при одинаковом объеме сосуда и количестве жидкости испарится больше там влаги, где температура выше. Поэтому абсолютная влажность воздуха не дает представления о том, насколько насыщенным является пар. В связи с этим было введено понятие относительной влажности воздуха.
Относительная влажность воздуха — отношение парциального давления водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара при той же температуре, выраженной в процентах.
Относительная влажность воздуха обозначается буквой ϕ. Это безразмерная физическая величина. Математически ее можно вычислить по формуле:
p — парциальное давление водяного пара, p0 — давление насыщенного пара (при той же температуре).
Парциальное давление водяного пара — давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали.
Относительную влажность воздуха можно также вычислить через плотности:
ρ — плотность водяного пара, ρ0 — плотность насыщенного пара при той же температуре (табличная величина).
Пример №2. Парциальное давление водяного пара в воздухе при 20 о С равно 699 Па, а давление насыщенных паров при этой температуре равно 2330 Па. Определить относительную влажность воздуха.
Читайте также:

