Жедел коронарлы синдром реферат
Обновлено: 07.07.2024
Синдром хронической усталости, головокружения и боль в шее могут быть следствием мальформации (аномалии) Арнольда — Киари. После начала широкого использования МРТ стало понятно, что болезнь встречается у 14–30 % популяции
Мальформация Арнольда — Киари (МАК) — это патология развития ромбовидного мозга: продолговатого и заднего мозга, в последний входит Варолиев мост и мозжечок. При МАК задняя черепная ямка не соответствует мозговым структурам, расположенным в этой области: мозжечок и продолговатый мозг из‑за небольших размеров опускаются ниже большого затылочного отверстия, что приводит к их ущемлению и нарушению ликвородинамики. МАК относят к группе кранио-вертебральных (черепно-позвоночных) мальформаций.
В эпоху до МРТ частота МАК оценивалась от 3,3 до 8,2 наблюдений на 100 000 населения, а у новорожденных — 1 на 4–6 тысяч. Сегодня понятно, что распространенность синдрома Арнольда — Киари значительно больше. Из-за бессимптомного течения и в результате учета разных типов МАК цифры очень разнятся — от 14 до 30 %.
Версии о причинах
Этиология и патогенез синдрома Арнольда — Киари остаются неуточненными. Киари предположил, что смещение мозжечка и продолговатого мозга происходит из‑за внутриэмбриональной гидроцефалии, которая возникает как следствие стеноза сильвиева водопровода — узкого канала длиной 2 см, который соединяет III и IV желудочки мозга.
Гидроцефалия — патологическое состояние, характеризующееся избыточным накоплением спинномозговой жидкости (ликвора) в ликворных пространствах головного мозга.
Типы мальформаций
1 тип — опущение миндалин мозжечка в позвоночный канал ниже уровня большого затылочного отверстия с отсутствием спинномозговой грыжи. У 15–20 % пациентов этот тип сочетается с гидроцефалией, а у 50 % больных — с сирингомиелией — заболеванием, при котором в спинном и продолговатом мозге образуются полости. В 1991 году было предложено подразделить аномалии Арнольда — Киари 1 типа на тип А — с сирингомиелией и тип В — без сирингомиелии.
Сирингомиелии при Арнольде — Киари 1 степени.
Энцефаломенингоцеле — врожденная грыжа головного мозга и его оболочек, содержащая цереброспинальную жидкость.
Спинальная дизрафия — порок развития, заключающийся в отсутствии слияния по средней линии парных закладок кожи, мускулатуры, позвонков, спинного мозга
2 тип — опущение нижних отделов червя мозжечка, продолговатого мозга и IV желудочка. Отличительным признаком данного типа является сочетание со спинномозговой грыжей (spina bifida) в поясничном отделе, отмечается прогрессирующая гидроцефалия, часто — стеноз водопровода мозга. Среди детей с менингомиелоцеле до 90 % случаев сопровождается аномалией Арнольда — Киари 2 степени.
Менингомиелоцеле — грыжа спинномозгового канала, при которой происходит выпячивание тканей и вещества спинного мозга через костный дефект позвоночного столба
0, 1 и 2 степени синдрома Арнольда — Киари наиболее распространены в популяции. III и IV типы обычно несовместимы с жизнью.
Симптоматика
Неврологические симптомы 0 и 1 типов аномалии Арнольда-Киари наиболее часто начинают беспокоить в возрасте 20–40 лет. Степень дислокации миндалин мозжечка может нарастать под влиянием неблагоприятных факторов. Чаще всего жалобами при МАК 0 типа являются головная боль, преимущественно шейно-затылочной локализации, а также боль в шее. Аномалия Арнольда — Киари 1 типа у взрослых чаще проявляется жалобами на нистагм, дизартрию, атаксию, интенционный тремор (тремор при произвольных движениях), головную боль, головокружение, нарушение чувствительности, парезы, нарушение функции тазовых органов, нарушения частоты и ритма пульса, ритма дыхания, лабильность артериального давления, симптомы поражения каудальной группы черепных нервов (IX, X, XI, XII пары) — нарушение чувствительности лица и бульбарные расстройства (расстройства глотания и речи).
Синдром Арнольда-Киари 2 степени впервые проявляется не у взрослых, а у новорожденных или в раннем детском возрасте. МАК 2 типа протекает более тяжело, дети с такой патологией уже рождаются с гидроцефальной формой черепа. Гидроцефалия препятствует нормальному развитию. Кроме того, такие дети страдают нарушениями дыхания, сердцебиения и глотания. Часто заболевание сопровождается судорожными припадками. У детей развивается нистагм, апноэ, стридор, парез голосовых связок, дисфагия с регургитацией, нарушение тонуса в конечностях. Выраженность неврологической симптоматики в первую очередь зависит от выраженности нарушений ликвородинамики, а не от степени эктопии миндалин мозжечка.
Терапия
Лечение аномалий Арнольда — Киари зависит от выраженности неврологической симптоматики. Консервативная терапия включает в себя нестероидные противовоспалительные препараты и миорелаксанты. Если в течение 2–3 месяцев консервативная терапия безрезультатна или у пациента имеется выраженный неврологический дефицит, показано оперативное вмешательство. В процессе операции устраняется сдавление нервных структур и нормализуется ликвороток путем увеличения объема (декомпрессии) задней черепной ямки и установки шунта. Оперативное лечение эффективно, по разным источникам, в 50–85 % случаев, в оставшихся случаях симптоматика регрессирует не полностью. Операцию рекомендуется выполнять до развития тяжелого неврологического дефицита, поскольку восстановление происходит лучше при минимальных изменениях неврологического статуса. Подобное оперативное лечение выполняется почти в каждом федеральном нейрохирургическом центре России и проводится в рамках высокотехнологичной медицинской помощи по системе ОМС.
Пациенты, имеющие мальформацию Арнольда-Киари 0 и 1 типа, могут даже не знать о наличии у себя этого заболевания в течение всей жизни. Вследствие пренатальной диагностики МАК II, III и IV типа дети с данной патологией рождаются всё реже, а современные технологии выхаживания позволяют значительно увеличить продолжительность жизни таких детей.
Коронарный синдром – это комплекс симптомов, которые появляются при сужении коронарных артерий и нарушении кровообращения миокарда. Он проявляется сильной болью в груди, одышкой, головокружением, резким потоотделением и пр. Причиной коронарного синдрома может быть стенокардия, ишемическая болезнь сердца или инфаркт миокарда. Во всех случаях пациенту нужна неотложная медицинская помощь.
Коронарный синдром – это не точный диагноз, а термин, которым обозначают недостаточное кровоснабжение миокарда и сопутствующие этому симптомы. Его используют при поступлении пациента в клинику, когда точная причина болезни не установлена. Таким пациентам сначала оказывают экстренную помощь и стабилизируют их состояние, а после проводят ЭКГ и другие обследования. От их результатов и истории болезни пациента зависит дальнейшее лечение.
Причины развития коронарного синдрома
Коронарный синдром развивается при сужении или закупорке коронарных артерий – это сосуды, через которые кровь попадает в миокард, обеспечивая его кислородом и питательными веществами. Причиной сужения может быть спазм артерий, атеросклеротическая бляшка или тромб. Чаще всего коронарный синдром развивается у людей с атеросклерозом и ишемической болезнью сердца.
Недостаточное кровоснабжение миокарда приводит к нарушению работы сердца и появлению соответствующих симптомов. Если просвет сосудов сужен больше чем на 70%, клетки миокарда постепенно отмирают – развивается инфаркт.
Коронарный синдром может быть проявлением:
нестабильной стенокардии – обострения ишемической болезни сердца, которая развивается при сужении коронарных артерий из-за отложения в них атеросклеротических бляшек, закупорки тромбом или спазма (артерии сужаются на 50-70%);
инфаркта миокарда – острого нарушения кровоснабжения миокарда, гипоксии и, как следствие, отмирания тканей (артерии сужаются более чем на 70%).
Классификация коронарных синдромов
Хронический коронарный синдром развивается при сужении артерий, как правило, из-за атеросклероза (отложения холестериновых бляшек на стенках сосудов). В этом случае ставят диагноз ишемическая болезнь сердца или стенокардия.

В мире распространяется новый штамм коронавируса, который скоро вытеснит дельту. Он получил название – штамм омикрон. Симптомы инфекции, вызванной заражением штаммом омикрон могут отличаться от симптомов предыдущих штаммов. Рассмотрим подробности в этой статье.
Эксперты отмечают, что, люди, подвергшиеся воздействию омикрона, заболевают быстрее и могут иметь симптомы, отличные от симптомов других вариантов.
Симптомы омикрона
Ранние данные свидетельствуют о том, что у большинства людей, по крайней мере, у тех, кто получил последние вакцины против Covid, омикрон вызывает легкое течение заболевания.
По-видимому, омикрон проявляет явные симптомы простуды:
- Кашель
- Усталость или вялость
- Заложенность носа и насморк
Более того, данные могут отражать только определенные слои населения: молодые и в остальном здоровые, а также полностью вакцинированные.
Понятно, что если вы вакцинированы, особенно если прошли ревакцинацию, омикрон, как правило, вызывает более легкие инфекции. Но врачи еще не получили достаточной информации о том, какое течение болезни омикрон вызывает у непривитых людей.
Не в легких, а в бронхах
Появляются доказательства того, что омикрон не проникает глубоко в легкие, как предыдущие варианты.
Исследование, опубликованное в интернете университетом Гонконга и еще не прошедшее экспертную оценку, показало, что, хотя омикрон менее опасен для легких, он может быстрее воспроизводиться выше в дыхательных путях. Этим способом омикрон может проявляться скорее как бронхит, чем пневмония.
Обычно пациенты с острым бронхитом не страдают одышкой. Они имеют тенденцию кашлять и выделять мокроту. Пациенты с пневмонией, как правило, испытывают одышку и чувствуют большую усталость, чем при бронхите.
Тем не менее, люди не могут полагаться на симптомы для самодиагностики болезни. Помимо омикрона, продолжают циркулировать дельта штамм и грипп.
По этим причинам врачи призывают людей, у которых есть какие-либо симптомы простуды или гриппа, пройти тестирование.
Как долго длится инкубационный период омикрона?
Согласно предварительным данным, время инфицирования человека может быть меньше, чем для предыдущих вариантов - от полной недели до трех дней или меньше.
Хотя необходимо гораздо больше исследований, можно предположить, что очень заразный вирус, такой как омикрон, будет иметь более короткий инкубационный период. В конце концов, его цель - как можно быстрее заразить как можно больше людей.
Вот почему распространение происходит намного быстрее. Эксперты добавили, что инкубационный период может быть короче или длиннее в зависимости от ряда переменных, включая возраст, основные проблемы со здоровьем и статус вакцинации.
Когда нужно пройти тестирование на Covid?
Учитывая возможность более короткого инкубационного периода, врачи посоветовали каждому, кто контактировал с инфицированным человеком, пройти тестирование примерно через 72 часа после контакта.

Аномалии коронарных артерий — почти terra incognita для современной кардиологии, в то же время, по разным данным, они обнаруживаются у 0,6 % – 5,64 % кардиологических пациентов, однако есть вероятность, что частота встречаемости намного выше. Недостаточно изучены анатомические варианты коронарных сосудов, их патофизиологическое и клиническое значение, прогноз, вследствие чего нет обоснованных рекомендаций по лечению пациентов, часты ошибки в диагностике и выборе лечения.
Подавляющее большинство аномалий коронарных артерий доброкачественны, но существует группа аномалий, чреватых постоянными или периодическими нарушениями кровоснабжения миокарда и тяжелыми последствиями ишемии без ранней диагностики и лечения. Часто их единственным проявлением становится внезапная сердечная смерть. К этой группе относится синдром Бланда-Уайта-Гарланда.
Аномальное отхождение левой коронарной артерии от легочной артерии (ALCAPA — anomalous origin of the left coronary artery from the pulmonary artery), или синдром Бланда-Уайта-Гарланда (СБУГ), относится к редким врожденным порокам сердца (1 на 300 тысяч новорожденных) и составляет 0,25 % от всех ВПС.
Анатомическое описание порока впервые дал в 1911 году русский патологоанатом А.И. Абрикосов, описавший вскрытие 5-месячного ребенка с аневризмой левого желудочка. Исчерпывающее описание синдрома впервые дали E. Bland, P. White и J. Garland, работавшие в Массачусетской больнице общего профиля, в 1933 году.
Они описали случай 3-месячного ребенка с прогрессирующими проблемами с кормлением, кардиомегалией, выявленной при рентгенографии грудной клетки, и ЭКГ-признаками поражения левого желудочка. На вскрытии было обнаружено, что левая коронарная артерия (ЛКА) отходила от легочной артерии (ЛА). Эффективное лечение этой патологии нашлось только в 1960 году, когда Sabiston et al. показали наличие ретроградного тока крови из ЛКА в ЛА. Лигирование аномальной ЛКА в месте отхождения от ЛА спасло жизнь больному ребенку.
Аномальное отхождение ЛКА от ЛА возникает в эмбриогенезе в результате нарушения разделения конотрункуса перегородкой на аорту и ЛА или сочетания персистирования эндокардиальных подушек в легочной артерии и их дефективной инволюции в аорте. Генетические предпосылки заболевания не изучены. Предполагают, что причиной могут служить мутации в генах CFTR (трансмембранный регулятор муковисцидоза), MEN1 (множественная эндокринная неоплазия типа 1) и PKP2 (плакофилин-2).
Клиническая картина СБУГ
Спектр клинических проявлений СБУГ многообразен. Различают инфантильный и взрослый типы заболевания.

Рисунок 1 | Классификация СБУГ. Источник: Peña E. et al. ALCAPA syndrome: not just a pediatric disease //Radiographics. – 2009
При инфантильном, или летальном, типе СБУГ (85–90 % случаев) симптомы манифестируют обычно на втором месяце жизни. Новорожденные выглядят здоровыми, поскольку относительно высокое сопротивление ЛА пока еще поддерживает антероградный ток крови по аномальной ЛКА, а фетальный гемоглобин обеспечивает миокард кислородом. На 1–2 месяце жизни ребенка сопротивление сосудистого русла легких падает в связи с закрытием артериального протока, что ведет к уменьшению антероградного тока крови и перфузии миокарда.
Классические симптомы (приступы беспокойства, плача, колик, одышки, бледность, цианоз, потливость, срыгивание, сложности с кормлением), описанные Bland et al. в 1933 г., позволяют заподозрить патологию коронарных артерий. Как правило, приступы беспокойства возникают после или во время кормления или плача, когда повышается потребность миокарда в кислороде, и длятся несколько минут. Между приступами ребенок выглядит здоровым. Больные дети отстают в физическом развитии.
При осмотре обнаруживается расширение сердечной тупости, сердечный горб, аускультативно нормальные тоны и отсутствие шумов либо выслуживаются шум митральной регургитации, ритм галопа, изредка, чаще на 2–3 году жизни, мягкий непрерывный шум в верхних отделах по левому краю грудины, напоминающий шум у больных с коронарной фистулой или открытым артериальным протоком, усиление II тона над ЛА при развитии легочной гипертензии, гепатомегалия. Со временем из-за недостаточного развития коллатералей развиваются инфаркты переднебоковой стенки ЛЖ, недостаточность митрального клапана и хроническая сердечная недостаточность.
В ряде случаев регургитация на МК может маскировать проявления основного порока, что может привести к диагностической ошибке и неадекватной хирургической тактике. При отсутствии хирургической коррекции в 90 % случаев смерть наступает в течение первого года жизни.
Если у больного доминирует правый тип кровоснабжения сердца и имеется сеть многочисленных хорошо развитых межсосудистых анастомозов в системе коронарных артерий, симптомы могут отсутствовать или проявляться незначительно, и заболевание переходит во взрослый тип (10–15 % случаев). Некоторые взрослые пациенты с СБУГ не испытывают недомогания, но значительно чаще аномалия проявляет себя одышкой, сердцебиением, обмороками, стенокардией, легочной гипертензией, кардиомиопатией, желудочковыми аритмиями и внезапной сердечной смертью. Симптомы не всегда связаны с физической активностью и могут внезапно возникать в покое, результаты функциональных проб часто ложноотрицательные, что затрудняет диагностику.
Из-за развития большого числа коллатералей происходит шунтирование крови из правой коронарной артерии (ПКА) в ЛКА и ЛА и наблюдается феномен обкрадывания. В отдельных случаях СБУГ не проявляется до более позднего возраста (старше 30 лет), что объясняется адаптацией не только к хронической ишемии участка миокарда, кровоснабжаемого ЛКА, но и к шунтированию крови. Предполагается, что адаптация происходит благодаря:
- обеспечению перфузии ЛЖ из ПКА по коллатералям между ПКА и ЛКА;
- уменьшению территории миокарда, зависящей от ЛКА, в результате доминирования ПКА;
- уменьшения шунтирования крови из артериального в венозное русло из-за появления со временем стеноза устья ЛКА;
- развития коллатералей бронхиальных артерий, обеспечивающих перфузию ишемизированного миокарда.
P. Angelini выделяет несколько механизмов стеноза КА:
• Коронарная гипоплазия
Интрамуральный инвагинированный сегмент проксимальной эктопической артерии меньше в окружности, чем более дистальные экстрамуральные сосуды. Автор предлагает в качестве ценного количественного параметра индекс гипоплазии (отношение длин окружностей интрамурального сегмента и более дистального на внутрисосудистом УЗИ). Врожденный ход артерии в медии аорты скорее приводит к ненормальному росту КА до и после рождения.
• Латеральная компрессия
На поперечном разрезе интрамуральный сегмент имеет овоидную, а не круглую форму. Латеральное сдавливание уменьшает площадь по сравнению с площадью сечения круглого на разрезе сосуда с той же длиной окружности. Латеральное сдавливание характеризуется коэффициентом асимметрии (отношение меньшего диаметра к большему при внутрисосудистом УЗИ). В систолу диаметр еще больше уменьшается.
Таким образом, заподозрить у пациента СБУГ можно при наличии необъяснимой кардиомегалии, митральной недостаточности или стойкого систолического шума над областью сердца.
Инструментальная диагностика СБУГ
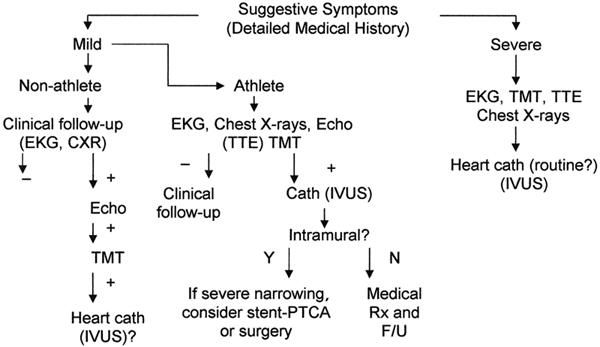
Рисунок 2 | Предлагаемый диагностический протокол для взрослых пациентов с риском развития аномалий коронарных артерий. Источник: Angeline P. Coronary artery anomalies—current clinical issues //Tex Heart Inst J. – 2002
В 80–90 % диагноз СБУГ устанавливается на вскрытии. Наиболее актуальна скрининговая диагностика аномалий коронарных артерий для спортсменов и военнослужащих. Согласно данным Американского Национального регистра внезапной смерти среди спортсменов аномалии КА являются второй по частоте причиной внезапной сердечной смерти (17 %), уступая лишь гипертрофической кардиомиопатии. Сообщается, что функциональные пробы и радионуклидные методы часто не выявляют временную ишемию у спортсменов с аномалиями КА. От 55 % до 93 % пациентов, умерших от внезапной сердечной смерти, вызванной аномалиями КА, не имели ранее кардиологической симптоматики и менее 10 % из них обращались к кардиологу с симптомами, связанными с аномалией.
Прямым указанием на СБУГ служит визуализация ЛКА, отходящей от легочного ствола (чаще всего от его левой нижнелатеральной части сразу за клапаном ЛА). Далее ЛКА следует по межжелудочковой борозде и распадается на левую переднюю нисходящую и огибающую артерии. Косвенными признаками СБУГ являются извитость КА, расширенная ПКА, множественные расширенные коллатерали между ПКА и ЛКА, гипертрофия и дилатация ЛЖ, миксоматозная дегенерация и ишемическая дисфункция папиллярных мышц, гипокинез стенки ЛЖ, расширенные бронхиальные артерии.
Диагностической процедурой выбора для диагностики СБУГ является коронарография с инъекцией в корень аорты, однако из-за анатомических особенностей устья аномальной ЛКА не всегда удается визуализировать ее ход. Аортография используется для лучевой диагностики у детей младше одного года, коронарография – у детей старше 5 лет. Процедура чревата осложнениями, среди которых часто встречаются временные изменения на ЭКГ (11 %), временная брадикардия (2,5 %), сосудистые нарушения (11,6 %) и такие серьезные осложнения, как желудочковая фибрилляция (0,6 %).
Большинство диагнозов СБУГ основаны на данных эхокардиографии с цветовым допплеровским картированием. ЭхоКГ позволяет избежать осложнений коронарографии и оценить дисфункцию МК. Дополнительные исследования проводятся при невозможности установить точный диагноз на ЭхоКГ или для дифференциальной диагностики. Трансторакальная ЭхоКГ используется у детей в связи с наличием хорошего акустического окна (у взрослых более чувствительна чреспищеводная ЭхоКГ).

На трансторакальной ЭхоКГ (А, В) видно нормальное отхождение ПКА (стрелка на А) и ЛКА (стрелка на В). С. Ко-сая КТ сердца визуализирует нормальное отхождение ПКА (наконечник), однако отсутствует соединение (стрелка) ЛКА с левым аортальным синусом. D. Объемная реконструкция КТ четко визуализирует аномальное отхождение ЛКА (черная стрелка) от легочного ствола (белая стрелка). Виден расширенный левый желудочек.
Источник: Goo H. W. Coronary artery imaging in children //Korean journal of radiology. – 2015
МРТ сердца дает дополнительную информацию о направлении тока крови в ЛКА (кино-МРТ с последовательностью SSFP), состоянии клапанов, миокарда, местной сократимости, сопутствующих пороках, которая важна для предоперационной оценки и послеоперационного наблюдения за пациентами. При исследовании пациент не подвергается ионизирующему облучению, что важно в педиатрии. МРТ сердца используется для обнаружения субэндокардиальной ишемии и фиброза миокарда, который может стать субстратом для возникновения летальных аритмий, при этом получают изображения с усилением в отложенную фазу после инъекции гадолиния.
На ЭКГ-синхронизированной МСКТ-ангиографии лучше, чем на МРТ, визуализируется не только аномальная ЛКА, но и расширенная и извитая ПКА, множественные межкоронарные коллатеральные сосуды, расширенные бронхиальные артерии.
Радионуклидные методы визуализации сердца позволяют оценить перфузию миокарда и функциональное значение аномалии КА. К ним относятся нагрузочная сцинтиграфия с таллием, однопротонная эмиссионная компьютерная томография и позитронная эмиссионная томография. Однопротонная эмиссионная КТ (ОПЭКТ)-МРТ и позитронная эмиссионная томография (ПЭТ)-МРТ выявляют ишемию миокарда у асимптоматических пациентов и пациентов с симптомами. При гибридном КТ-коронарография/ОПЭКТ-МРТ исследовании удается обнаружить нарушения кровотока в кровоснабжаемых КА участках даже при отсутствии дефектов перфузии. На решение об оперативном вмешательстве радионуклидные методы в целом не влияют и не используются при обследовании большинства пациентов.
Нередко первым признаком СБУГ являются нарушения ритма, представляющие риск развития внезапной сердечной смерти. Тем не менее, ЭКГ-признаки гипертрофии и перегрузки левых отделов сердца отмечают у всех пациентов с СБУГ. Перспективными в диагностике ишемии миокарда ЛЖ у данной категории больных могут быть поверхностное ЭКГ-картирование и метод 12-канального холтеровского мониторирования, помогающий выявить транзиторные периоды ишемии миокарда, даже при отрицательных результатах других нагрузочных проб.
ЭКГ у младенцев с СБУГ обычно указывает на переднебоковой инфаркт ЛЖ, признаками которого являются аномальные зубцы Q и временные изменения интервала ST в отведениях I, aVL, V5 и V6. У 20–45 % пациентов отсутствуют аномалии зубца Q и на мысль о СБУГ может навести аномальный прирост зубца R в грудных отведениях.
Различают временные, связанные с текущим повреждением, и более длительные, связанные с исчезновением мышечной ткани, изменения на ЭКГ. Первыми признаками повреждения являются заостренные зубцы Т, свидетельствующие о локальной гиперкалиемии, которые исчезают через несколько часов и часто не обнаруживаются. Затем последовательно появляются изменения сегмента ST, элевация точки J с сегментом ST вогнутой формы и дальнейшая элевация точки J с выпучиванием сегмента ST.
Иногда наблюдается реципрокная депрессия сегмента ST в отведениях II, III, aVF и даже V1 и V2. Признаками исчезновения мышечной ткани являются появление зубца Q и уменьшение амплитуды зубца R в затронутых отведениях. В течение последующих двух недель сегмент ST становится изоэлектрическим, зубец Т — инвертированным и симметричным, уменьшается амплитуда зубца R, углубляется зубец Q. Единственными ЭКГ-признаками переднебокового инфаркта после окончания острой фазы являются аномальные зубцы Q и R.
Вышеперечисленные изменения неспецифичны и характерны для острого миокардита и дилатационной кардиомиопатии, однако одновременное наличие следующих четырех ЭКГ-признаков присуще только СБУГ и позволяет провести дифференциальную диагностику:
- зубец Q выше 0.3 мВ (3 мм);
- ширина зубца Q больше 30 мс;
- qR-комплекс по крайней мере в одном из отведений: I, aVL, V5 и V6. Отсутствие зубцов Q во всех нижних отведениях (II, III, aVF).

Рисунок 4 | ЭКГ женщины 72-х лет с ALCAPA. Источник: Fierens C. et al. A 72 year old woman with ALCAPA //Heart. – 2000. – Т. 83. – №. 1. – С. e2-e2

Рисунок 5 | ЭКГ ребенка 3-х месяцев с ALCAPA. Источник: Hoffman J. I. E. Electrocardiogram of anomalous left coronary artery from the pulmonary artery in infants //Pediatric cardiology. – 2013
Данные изменения встречаются в 55–80 % случаев СБУГ. Причины отсутствия аномальных зубцов Q недостаточно ясны, однако у взрослых пациентов оно ассоциировано больше с субэндокардиальным инфарктом, чем с трансмуральным; больше с нижним, чем с передним; больше с мелкоочаговым, чем крупноочаговым. Стоит отметить и новые, но пока не получившие широкого применения, методы диагностики, например внутрисосудистое УЗИ и измерение интракоронарного давления с определением ФРК.
Дифференциальную диагностику СБУГ проводят с миокардитом, болезнью Кавасаки, васкулитами (узелковым полиартериитом или артериитом Такаясу), склеродермией, синдромом Элерса-Данло, наследственной геморрагической телеангиэктазией, дилатационной кардиомиопатией, врожденной недостаточностью МК, стенозом и коарктацией аорты.
Лечение СБУГ
Синдром Бланда-Уайта-Гарланда является абсолютным показанием к хирургическому лечению.
Выживаемость спустя 20 лет после операции, проведенной в младенчестве, составляет 95 %. Скудные данные о хирургическом лечении взрослых пациентов, переживших внезапную сердечную смерть, также выглядят многообещающими, однако до сих пор не проведено рандомизированных контролируемых исследований для оценки долгосрочных результатов разных способов коррекции порока.
В 1960 г. Sabiston et al., сотрудники Johns Hopkins Hospital, описали лечение 2,5-месячного ребенка с СБУГ. У ребенка наблюдались трудности при кормлении, одышка и звуки хрюканья. Рентгенография грудной клетки выявила кардиомегалию, на ЭКГ были признаки свежего повреждения миокарда. Катетеризация сердца выявила дилатацию и дисфункцию ЛЖ, аномальная ЛКА не визуализировалась. После полного обследования было принято решение о хирургическом вмешательстве с целью реваскуляризации ЛЖ. В ходе операции был обнаружен инфаркт миокарда и аномальная ЛКА.
С целью определить направление кровотока по аномальной КА Sabiston et al. измерили систолическое давление в ЛА и ЛКА, которое составило 25 и 30 мм рт.ст. соответственно. При окклюзии аномального сосуда в месте отхождения от ЛА давление в нем возросло до 75 мм рт.ст., обеспечив ретроградный кровоток по коллатералям. Сатурация кислородом в ЛКА составляла 100 %, в ЛА — 76 %, что также свидетельствовало о наличии кровотока по коллатералям. Sabiston et al. рекомендовали наложение лигатуры на аномальную ЛКА как эффективный метод лечения патологии.
Доказанными осложнениями перечисленных методов хирургической коррекции являются реканализация аномальной КА, увеличение риска атеросклероза, тяжелая ишемическая митральная регургитация. Более современные методы не несут за собой такие риски.
Современный способ хирургической коррекции СБУГ основан на предложенной в 1974 г. Neches et al. прямой имплантации ЛКА в аорту. Устье аномальной ЛКА выделяется из ЛА вместе с небольшим лоскутом ЛА и подсоединяется к корню аорты с формированием двухкоронарной системы. Описанный способ является операцией выбора при СБУГ. Послеоперационная летальность составляет 0–16 % в зависимости от степени дооперационного повреждения миокарда. Главным осложнением может стать тяжелая кровопотеря из-за разрыва аномальной артерии при пересадке. У взрослых прямая имплантация ЛКА часто невозможна из-за ригидности ткани и большим расстоянием от устья ЛКА до аорты. В этих случаях предпочтительным является шунтирование аномальной ЛКА с использованием артериального и венозного трансплантата. При этом риск стеноза пересаженного сосуда выше при использовании венозного трансплантата. Трансплантат подкожной вены сохраняет проходимость в среднем на 80 % в течение 5–8 лет.
При наличии противопоказаний к прямой имплантации ЛКА в аорту с 1979 г. применяется операция Takeuchi. Она заключается в создании тоннеля внутри ЛА (аортопульмонарного окна), через который аорта сообщается с устьем аномальной ЛКА. Данный метод ассоциирован с высокой частотой надклапанного стеноза легочной артерии и обструкции тоннеля.
Пациентам с необратимым, несмотря на коррекцию с формированием двухкоронарной системы, повреждением миокарда показана трансплантация сердца. У пациентов с высоким риском возникновения желудочковых фибрилляций (пациенты с ишемической кардиомиопатией и низкой фракцией выброса) возможно использование имплантируемого кардиовертера-дефибриллятора.
Читайте также:

