Строение твердых жидких и газообразных тел реферат
Обновлено: 28.06.2024
Молекулярно – кинетическая теория дает возможность понять, почему вещество может находиться в разных агрегатных состояниях: газообразном, жидком и твердом.
Внешними отличительными чертами этих состояний являются сжимаемость (изменение объема) и текучесть (сохранение формы).
С точки зрения молекулярно-кинетической теории, агрегатные состояния различаются по значению среднего расстояния между молекулами и характеру движения молекул друг относительно друга.
Увеличивая температуру газа при фиксированном давлении, можно получить частично, а затем полностью ионизованную плазму, которую часто считают четвертым состоянием вещества. С увеличением давления вещество может перейти в пятое – нейтронное – состояние, которое реализуется в природе в виде нейтронных звезд.
На основе МКТ рассмотрим различия и сходства теплового движения частиц газов, жидкостей и твердых тел.
Газы – это тела, в которых молекулы почти свободно хаотически двигаются в промежутках между столкновениями, во время которых резко меняется характер их движения. Согласно МКТ молекулы газа находятся друг от друга на расстояниях, превышающих размер самих молекул в несколько раз. В этом случае силы притяжения уже малы, поэтому, участвуя в хаотичном движении, молекулы газа могут удаляться на любое расстояние. Газ занимает объем сосуда любых размеров. Его можно существенно сжать под действием внешних сил.
Например, объем сосуда может в десятки тысяч раз превышать объем находящихся в нем молекул.
Газы легко сжимаются, если уменьшается среднее расстояние между молекулами, но форма молекулы не изменяется. Молекулы, двигаясь в пространстве с огромными скоростями - сотни метров в секунду, сталкиваются, затем отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга.
Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема.
Многочисленные удары молекул о стенки сосуда создают давление газа. Примером этому может служить воздушный шарик. Его невозможно надуть с одной стороны. Газ или воздух в шарике распространяется по всему объему.
Как можно судить о концентрации молекул внутри шарика? Чем больше газа внутри шарика, тем он плотнее накачан, т.е. становится более упругим.
Жидкости – это тела, образованные веществами, находящимися в состоянии, в котором не сохраняется форма тела под действием силы тяжести или небольшой нагрузки. Однако жидкость трудно сжимается даже под действием значительных сил.
Молекулы жидкости не образуют постоянной пространственной структуры; расположены друг от друга на расстояниях, сравнимых с размерами самих молекул, почти вплотную друг к другу, поэтому молекула жидкости ведет себя иначе, чем молекула газа. Характер движения этих молекул представляет собой множество колебаний относительно положения равновесия, в результате столкновения с соседними молекулами, т.е. временное оседлое положение, чередуется со скачками на новое оседлое положение.
В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения равновесия: здесь сила отталкивания равна силе притяжения, т. е. суммарная сила взаимодействия молекулы равна нулю. Время оседлой жизни молекулы воды: время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше 10-12-10-13 с. С повышением температуры время оседлой жизни молекул уменьшается.
Характер молекулярного движения в жидкостях, впервые установил советский физик Яков Ильич Френкель. Результаты его работы позволяют понять основные свойства жидкостей.
Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей.
Жидкости текучи, т. е. не сохраняют своей формы, так как внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы. Вот почему жидкость течет и принимает форму сосуда.
Твердое тело – это агрегатное состояние вещества, характеризующееся стабильностью формы при значительных нагрузках (сравнимых с воздействием сил тяжести) и тепловым движением атомов в виде малых колебаний вокруг положений равновесия (отсюда возникновение деформаций лишь при больших внешних силах). Кроме того, расстояние между молекулами сравнимо с размером самих молекул, и между ними при сжатии возникают силы отталкивания (отсюда несжимаемость твердых тел).
Атомы или молекулы твердых тел, в отличие от атомов и молекул жидкостей, колеблются около определенных положений равновесия. По этой причине твердые тела сохраняют не только объем, но и форму. Потенциальная энергия взаимодействия молекул твердого тела существенно больше их кинетической энергии.
Есть еще одно важное различие между жидкостями и твердыми телами. Жидкость можно сравнить с толпой людей, где отдельные личности беспокойно толкутся на месте, а твердое тело подобно той же толпе людей, которые хотя и не стоят по стойке смирно, но выдерживают между собой в среднем определенные расстояния. Если соединить центры положений равновесия атомов или ионов твердого тела, то получится правильная пространственная решетка, называемая кристаллической.
На рисунках изображены кристаллические решетки поваренной соли и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам.
Различают кристаллические и аморфные твердые тела.
В аморфных телах атомы колеблются вокруг хаотически расположенных точек, упорядоченность которых наблюдается лишь на расстояниях, сравнимых с межатомными.
В кристаллах периодичность в расположении этих точек наблюдается для сколь угодно отдаленных атомов.
С точки зрения МКТ эти свойства объясняются упорядоченным расположением атомов (молекул) в теле. Такое расположение длительное время не меняется.
Кристалл – это твердое тело, обладающее трехмерной периодической атомной или молекулярной структурой. Обычно такое тело имеет форму правильного симметричного многогранника. Крупные одиночные кристаллы называются монокристаллами. В природе встречаются монокристаллы различных размеров: от очень больших кристаллов кварца (до нескольких сотен килограммов) до мелких (россыпи кристаллов алмаза). Отличительной особенностью кристаллических тел является:
1) анизотропия монокристаллов (зависимость свойств от направления); например, если стеклянную банку положить, то её легко можно раздавить, встав на неё. Однако, если поставить банку, то она легко выдержит ваш вес;
2) наличие фиксированной температуры плавления.
Аморфное тело не имеет упорядоченной (кристаллической) структуры молекул, сохраняет форму только благодаря затрудненности перемещения молекул относительно друг друга.
При нагревании аморфное тело размягчается постепенно. Механические, тепловые и другие свойства одинаковы вдоль всех направлений такого тела.
Аморфное состояние характерно для молекул, имеющих большую длину по сравнению с поперечным размером самих молекул (органические полимеры, стекла). При продолжительном воздействии малой силы аморфные тела, как и жидкости, обнаруживают текучесть.

Все вещества в природе, независимо от температуры и давления, состоят из молекул одного и того же состава. Однако строение вещества отличается при различных внешних условиях. Кратко рассмотрим строение газообразных, жидких и твердых тел.
Агрегатные состояния вещества
Внешний вид одного и того же вещества существенно зависит от температуры и давления. Правда, далеко не любое вещество легко наблюдать в разных состояниях (особенно это касается плазмы). Но для подготовки доклада в 10 классе достаточно изучить свойства обычной воды. Любой знает, что обычная вода при низкой температуре превращается в лед, а при высокой — в пар, причем эти изменения обратимы.
Влияние давления проследить сложнее, однако тоже возможно: например, измеряя температуру кипения воды в горах, где атмосферное давление заметно ниже. Так, на Крестовом перевале (Военно-Грузинская дорога) вода кипит уже при 92 ⁰С.
Лед, жидкость и пар — это агрегатные состояния воды, строение которых имеет свои особенности. Рассмотрим их с точки зрения молекулярно-кинетической теории (МКТ).
Строение газа
При достаточно высокой температуре и не слишком большом давлении молекулы вещества обладают большой энергией, и сил их взаимодействия недостаточно, чтобы удерживать их рядом. Сила гравитации также оказывается недостаточной, чтобы заметно влиять на поведение молекул. Поэтому при таких условиях молекулы могут свободно перемещаться в пространстве, заполняя весь предоставленный объем.
Молекулы сталкиваются друг с другом и с другими телами, создавая давление газа, однако путь их свободного полета многократно превышает размеры молекул. Взаимодействия происходят лишь в короткое время столкновения. Связь давления с объемом и температурой описывается газовыми законами.

Рис. 1. Три газовых закона.
Строение жидкого вещества
Если уменьшать температуру газа, то энергия молекул будет всё меньше, свободный пробег — тоже. Наконец, молекулы в среднем станут находиться настолько близко друг к другу, что силы притяжения начнут играть заметную роль в поведении вещества, выражаясь в виде поверхностного натяжения. Сила тяжести будет также вносить свою лепту: в результате вещество займет нижнюю часть предоставленного объема.
В жидком состоянии молекулы находятся очень близко друг к другу. Поэтому сжать их можно лишь за счет изменения формы молекул, для чего требуется гораздо больше энергии по сравнению со сжатием за счет уменьшения расстояний между молекулами. Большую часть времени молекулы жидкости проводят в беспорядочных колебаниях, но появление даже небольшой внешней силы способно двигать молекулы жидкости, что обеспечивает текучесть.

Рис. 2. Молекулы в жидкости.
Строение твердого тела
Если уменьшать температуру жидкости, то наступает момент, когда энергия молекулы становится меньше энергии связи между соседними молекулами. В таком состоянии молекулы выстраиваются в регулярную пространственную структуру с наименьшей потенциальной энергией, называемую кристаллом. Порядок, в котором находятся молекулы внутри кристалла, называется кристаллической решеткой.
В кристалле молекулы не могут менять свое расположение относительно соседей. Уменьшению расстояний мешают силы отталкивания положительных ядер в молекулах, увеличению расстояний — силы притяжения между электронными оболочками и ядрами соседних молекул.
Кристалл сохраняет свою форму даже под действием достаточно больших внешних нагрузок потому, что для ее изменения необходимо разрушить сразу много молекулярных связей.
Сравнительная таблица строения твердых, жидких и газообразных тел представлена ниже:
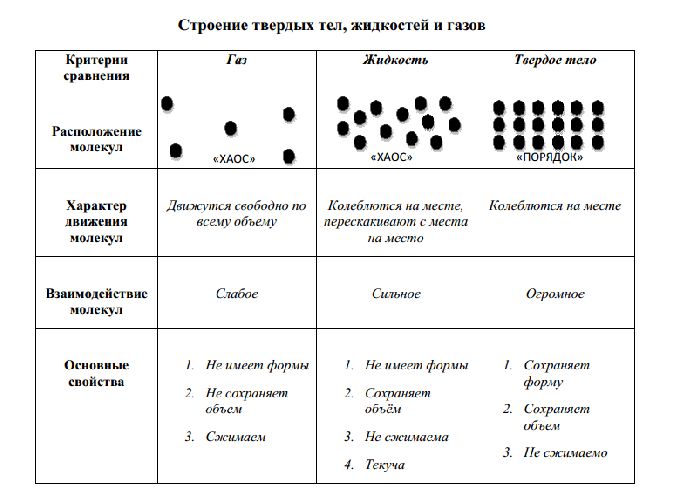
Рис. 3. Таблица строения твердых жидких и газообразных тел.
Что мы узнали?
С точки зрения МКТ, газ представляет собой молекулы вещества, имеющие достаточно большую энергию, чтобы независимо двигаться на относительно больших расстояниях друг от друга. В жидкостях молекулы располагаются рядом и начинают взаимодействовать, но всё еще способны двигаться независимо. В твердых телах молекулы выстраиваются в строгую пространственную структуру и не могут двигаться относительно друг друга.
Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главноеэто зависимость физических свойств от выбранного в кристалле направления. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Многие кристаллы по-разному проводят теплоту… Читать ещё >
- свойства газа
- жидких и твердых тел с точки зрения молекулярно-кинетической теории
Строение газообразных, жидких и твердых тел ( реферат , курсовая , диплом , контрольная )


Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но молекулы не сдавливают друг друга.
Молекулы с огромными скоростями — сотни метров в секундудвижутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Если соединить центр равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристалической.

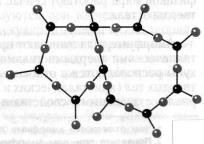
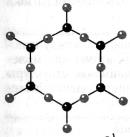
Кристаллы — это твёрдые тела, атомы или молекулы которых занимают определённое, порядочное положение в пространстве. Поэтому кристаллы имеют плоские грани. Например крупинка обычной поваренной соли имеет плоские грани, составляющие друг с другом прямые углы.
Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главноеэто зависимость физических свойств от выбранного в кристалле направления. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл кварца по-разному преломляет свет в зависимости от направления падающих на него лучей. Зависимость физических свойств от направления внутри кристалла называют анизотропией. Все кристаллические тела анизотропны.
Монокристаллы и поликристаллы.

Кристаллическую структуру имеют металлы. Если взять большой кусок металла, то на первый взгляд его кристаллическое строении никак не проявляется ни во внешнем виде куска, ни в его физических свойствах Обычно металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению к друг другу беспорядочно. В результате в объеме, значительно превышающем объем отдельных кристалликов, все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Твердое тело, состоящее из большого числа маленьких кристалликов, называют поликристаллическим. Одиночные кристаллы называют монокристаллами.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема урока. Строение газообразных, жидких и твердых тел.
Цель: обучающая - сформировать представления о механических свойствах твердых тел, жидкостей, газов, объяснить эти свойства на основе знаний о различиях в расположении, движении, притяжении и отталкивании молекул; познакомить с молекулярными силами взаимодействия и их природой, установить характер зависимости сил притяжения и отталкивания от расстояния между молекулами.
развивающая : способствовать формированию логического мышления, развивать умение ставить перед собой вопросы.
воспитательная: продолжить формирование культуры общения, вырабатывать умение слушать и быть услышанным, воспитывать трудолюбие, аккуратность прививать культуру умственного труда; показать значение одного из признаков диалектического познания, подчеркнув обобщение различных систем в единстве внутреннего и внешнего.
Тип урока: комбинированный с компьютерной поддержкой.
Методы обучения: лекция, беседа, демонстрация, работа с раздаточным материалом, работа на компьютерах .
Оборудование: компьютеры, демонстрационный проектор, слайды, интерактивный курс физики для учащихся 7 – 11 классов, раздаточный материал.
2. Проверка домашнего задания.
5. Изучение нового материала.
6. Обобщение и систематизация знаний.
8. Домашнее задание.
Проверка домашнего задания.
Фронтальный опрос по вопросам домашнего задания, поставленного на предыдущем уроке.
3. Вызов.
4. Осмысление.
Самостоятельная работа с учебником и учебной программой на компьютере:
Изучить понятие фазового перехода.
Пронаблюдать на компьютере различные фазовые переходы и сформулировать их особенности и соотношение энергий молекул вещества (результаты записать в тетрадь).
Объяснить внешние свойства вещества в разных агрегатных состояниях на основе знаний основных положений МКТ.
Отметить особенности веществ, близких по строению (алмаза и графита). Рассмотреть структуру алмаза и графита на экране.
Заполнить инструкционный лист с планом обсуждения и обобщения:
Инструкционный лист:
План исследования
Описать структурное соединение, т.е. указать количество атомов, образующих его; представить в пространстве модель вещества, состоящую из молекул, атомов, ионов.
Выделить общее в рассматриваемых структурных соединениях.
Выявить различие внешних свойств алмаза и графита.
Укажите, какие особенности структуры рассматриваемых веществ определяют различие их свойств.
Обратите внимание на порядок атомов при компоновке их в молекулы; укажите различие в порядке компоновки.
Итог работы: план проведенного исследования представляет в упрощенном виде путь поиска ученых к созданию веществ с определенными свойствами. Исследование свойств веществ, приводит к открытию новых явлений.
Изучение нового материала.
Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях.
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул ( рис.8.5 ). Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но форма молекулы не изменяется ( рис.8.6 ).

Молекулы с огромными скоростями - сотни метров в секунду - движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я.И.Френкелем, позволяет понять основные свойства жидкостей.
Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей .
Как известно, жидкости текучи, т. е. не сохраняют своей формы . Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы ( рис.8.8 ). Вот почему жидкость течет и принимает форму сосуда.
Твердые тела. Атомы или молекулы твердых тел, в отличие от атомов и молекул жидкостей, колеблются около определенных положений равновесия. По этой причине твердые тела сохраняют не только объем, но и форму . Потенциальная энергия взаимодействия молекул твердого тела существенно больше их кинетической энергии.
Есть еще одно важное различие между жидкостями и твердыми телами. Жидкость можно сравнить с толпой людей, где отдельные индивидуумы беспокойно толкутся на месте, а твердое тело подобно стройной когорте тех же индивидуумов, которые хотя и не стоят по стойке смирно, но выдерживают между собой в среднем определенные расстояния. Если соединить центры положений равновесия атомов или ионов твердого тела, то получится правильная пространственная решетка, называемая кристаллической .
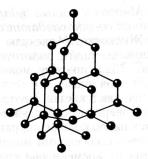
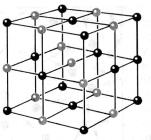
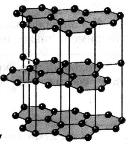
На рисунках 8.9 и 8.10 изображены кристаллические решетки поваренной соли и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам.
Рис. 8.11 Якутские алмазы.
Кристаллические и аморфные тела
В ходе изучения строения твердых тел с помощью современных методов удалось выяснить, что молекулы и атомы большинства веществ в тведом состоянии расположены в строго определенном порядке, физики говорят: образуют кристаллическую решетку. Такие вещества называются кристаллическими. Примерами кристаллических веществ могут быть алмаз, графит (рис. 1), лед, соль, металлы и т. п.
Порядок расположения атомов в кристаллической решетке вещества определяет его физические свойства . Так, например, алмаз и графит состоят из одних и тех же атомов — атомов углерода, однако эти вещества весьма отличаются друг от друга, так как атомы в них расположены по-разному (рис. 1).

Рис. 1. Модели кристаллических решеток: о — алмаза, 6 — графита. Шариками изображены центры атомов; линий, соединяющих атомы, на самом деле не существует, они проведены только для того, чтобы пояснить характер пространственного расположения атомов

Рис. 2. Модели кристаллических решеток: а - льда б - поваренной соли (маленькие шарики - атомы натрия, большие - атомы хлора)
Существует группа твердых веществ (стекло, воск, смола, янтарь и т. п.), молекулы (атомы) которых не образуют кристаллической решетки и в целом расположенные беспорядочно. Такие вещества называют аморфными. При определенных условиях твердые тела плавятся, т. е. переходят в жидкое состояние. Кристаллические вещества плавятся при определенной температуре. Например, лед обычно переходит в жидкое состояние, если температура равна О °С, нафталин — если достигает 80 °С, ртуть — если падает до -39 °С. В отличие от кристаллических, аморфные вещества не имеют oпределенной температуры плавления. В случае увеличения температуры они переходят в жидкое состояние постепенно (таяние восковой свечи).
Взаимодействие частиц вещества
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые вращаются вокруг ядра. Атом, как и молекула, электрически нейтрален. Рассмотрим силу взаимодействия между частицами на примере двух неподвижных молекул.
Между телами в природе существуют гравитационные и электромагнитные силы. Так как массы молекул крайне малы, то силы гравитационного взаимодействия между ними можно не рассматривать. На больших расстояниях электромагнитного взаимодействия между молекулами тоже нет.
При уменьшении расстояния между частицами (рис. 3) они начинают ориентироваться так, что их обращённые друг к другу стороны будут иметь разные по знаку заряды (в целом молекулы остаются при этом нейтральными), и, в итоге, между молекулами возникают силы притяжения (максимальная сила притяжения на расстоянии 2–3 диаметров молекулы). При уменьшении расстояния между молекулами возникают силы отталкивания как результат взаимодействия отрицательно заряженных электронных оболочек атомов молекул. Следовательно, на молекулу действует сумма сил: притяжения и отталкивания (на больших расстояниях преобладает сила притяжения, на малых – сила отталкивания).

Рис. 3. Взаимодействие между молекулами
На рисунке 4 изображён график зависимости силы взаимодействия между молекулами от расстояния между ними. Красной линией показана сила притяжения, синей линией – сила отталкивания, зелёной линией – итоговый график сил. Величина – это такое расстояние между молекулами, на котором силы притяжения становятся равными силам отталкивания (положение устойчивого равновесия).

Рис. 4. График зависимости силы взаимодействия между молекулами в зависимости от расстояния между ними
Находящиеся на расстоянии друг от друга и связанные электромагнитными силами молекулы обладают потенциальной энергией. В положении устойчивого равновесия потенциальная энергия молекул минимальна. В веществе каждая молекула взаимодействует одновременно со многими соседними молекулами, что также влияет на величину их минимальной потенциальной энергии. Кроме того, все молекулы вещества находятся в непрерывном движении, то есть обладают кинетической энергией. Таким образом, структура вещества и его свойства (твёрдых, жидких, газообразных тел) определяется соотношением между минимальной потенциальной энергией взаимодействия молекул и их запасом кинетической энергии теплового движения.
У газа расстояние l между молекулами много больше размеров молекул r 0 : ' l>>r 0 .
У жидкостей и твердых тел l ≈ r 0 . Молекулы жидкости расположены в беспорядке и время от времени перескакивают из одного оседлого положения в другое.
У кристаллических твердых тел молекулы (или атомы) расположены строго упорядоченно.
Обобщение и систематизация знаний
Основная задача, которую решают ученые, - это создание веществ, свойства которых определены заранее. Путь к решению ее длинный и сложный. Прежде чем использовать ту или другую закономерность, необходимо научиться ее выделять и изучать. Здесь можно применить прием обобщения, которым мы и воспользовались при сравнении структур алмаза и графита, а также при рассказе о жидких кристаллах. Познакомить учащихся со структурными элементами приема обобщения:
Выделение большого числа признаков (свойств);
Выделение признаков сходства;
Выделение существенных признаков сходства;
Соотношение выделенных общих признаков;
Объединение их – возникновение нового физического понятия (свойства, явления);
Выделение объектов, попадающих под данное понятие (свойство, явление);
Практическая значимость вновь открытого понятия (свойства, явления).
Рефлексия.
1.Самостоятельное заполнение таблицы:
2. Применение знаний МКТ в науке и технике
1. Какие внешние свойства необычных кристаллов привели к необходимости изучения и систематизации их?
2. Что общего между типичными жидкостями, состоящими из относительно простых молекул, и жидкими кристаллами?
3. Что общего между классическими и жидкими кристаллами?
4. Какие свойства веществ выделили их в особый класс (жидкие кристаллы)?
5. Применение свойств жидких кристаллов в современной промышленности.
3.Незаконченное предложение.
Мне понравилось на уроке то, что…
На уроке меня порадовало…
Я удовлетворён своей работой, потому что…
Мне хотелось бы порекомендовать…
Если бы я был учителем, то …

Домашнее задание .
Ответить на вопросы:
Чем отличаются траектории движения молекул газа, жидкости и твёрдого тела?
При сильном охлаждении воздуха его можно сделать жидким. При этом объем, который занимает воздух, уменьшается почти в 700 раз. Сделайте вывод из этого факта: какую долю объема газа составляет объем самих молекул?
Газ способен к неограниченному расширению. Почему существует атмосфера Земли?
Читайте также:

