Стереохимия диенового синтеза реферат
Обновлено: 05.07.2024
ДИЕНОВЫЙ СИНТЕЗ – реакция органической химии, при которой происходит взаимодействие соединений, содержащих две двойных связи (диен), с олефинами (соединениями, содержащими одну двойную связь). За открытие этой реакции немецкие химики О.Дильс и К.Альдер в 1950 были удостоены Нобелевской премии. В литературе диеновый синтез часто называют реакцией Дильса-Альдера.
Особенности диенового синтеза.
Синтез осуществляют с участием диенов, у которых две двойные связи разделены не более чем одной простой связью (сопряженный диен), например, бутадиен
Второй компонент – олефин Х–СН=СН–Х (соединение с одной двойной связью) обычно содержит дополнительные группы Х (Х – карбонильная, карбоксильная, нитрогруппа и др.), которые активируют двойную связь олефина, в результате он легко вступает в диеновый синтез.
Сущность диенового синтеза состоит в том, что три двойные связи двух соединений, участвующих в реакции, раскрываются с последующим замыканием и образованием новых связей. На рисунке раскрывающиеся связи отмечены красным цветом, а вновь возникшие – зеленым:
Таким образом, в исходной системе было три двойных связи, а в результате образуется циклическое соединение с одной двойной связью. Поскольку в этом процессе происходит только перегруппировка связей, то побочные продукты не образуются.
Наиболее эффектный вариант диенового реализуется в том случае, когда в качестве исходного взято соединение, содержащее два диеновых фрагмента, например, два циклопентадиенильных кольца, связанных гибкой углеводородной перемычкой –(СН2)n–. Второй компонент, как и в предыдущем примере, олефин. Одно из циклопетадиенильных колец, играя роль диенового компонента, реагирует с олефином строго по схеме диенового синтеза (цветовое выделение связей такое же, как на предыдущем рисунке):
Применение.
Диеновый синтез широко используют в органической химии для синтеза циклических и полициклических соединений, а также как метод аналитического определения диенов.
Михаил Левицкий
Реакция органической химии, при которой происходит взаимодействие соединений, содержащих две двойных связи (диен), с диенофилами (соединениями, содержащими одну двойную связь) называется диеновым синтезом. За открытие этой реакции немецкие химики О.Дильс и К.Альдер в 1950 были удостоены Нобелевской премии. В литературе диеновый синтез часто называют реакцией Дильса-Альдера.
Синтез осуществляют с участием диенов, у которых две двойные связи разделены не более чем одной простой связью (сопряженный диен).
Содержание
Введение…………………………………………………………………..2
Литературный обзор
История изучения диенового синтеза…………………….…. 3
Механизм диенового синтеза………………………………….6
Диеновый синтез на примере различных реакций………. 8
Фосфорсодержащие диенофилы в реакциях Дильса-Альдера………………………………………………………. 19
Обсуждения………………………………………. ……………. 22
Экспериментальная часть………………………………………. 33
Вывод………………………………………………………………39
V. Литература…………………………………………………………40
Вложенные файлы: 1 файл
диеновый синтез.docx
- Литературный обзор
- История изучения диенового синтеза…………………….…. 3
- Механизм диенового синтеза………………………………….6
- Диеновый синтез на примере различных реакций………. 8
- Фосфорсодержащие диенофилы в реакциях Дильса-Альдера………………………………………… ……………. 19
- Обсуждения………………………………………. …… ………. 22
- Экспериментальная часть………………………………………. 33
- Вывод……………………………………………………………… 39
- поликетиды в качестве феромонов насекомых;
- изопреноиды в виде витаминов феромонов и гормонов;
- фенилпропаноиды, которые являются структурными компонентами стенок клеток;
- алкалоиды, участвующие в образовании защитных функций растительности от внешних факторов.
- циклические диены;
- гетероциклические диены;
- енины.
- малеиновый ангидрид;
- тетрацианэтилен;
- акриловая кислота;
- метилакрилат;
- акрилонитрил.
Реакция органической химии, при которой происходит взаимодействие соединений, содержащих две двойных связи (диен), с диенофилами (соединениями, содержащими одну двойную связь) называется диеновым синтезом. За открытие этой реакции немецкие химики О.Дильс и К.Альдер в 1950 были удостоены Нобелевской премии. В литературе диеновый синтез часто называют реакцией Дильса-Альдера.
Синтез осуществляют с участием диенов, у которых две двойные связи разделены не более чем одной простой связью (сопряженный диен).
Второй компонент – диенофил Х–СН=СН–Х (соединение с одной двойной связью) обычно содержит дополнительные группы Х (Х – карбонильная, карбоксильная, нитрогруппа и др.), которые активируют двойную связь диенофила, в результате он легко вступает в диеновый синтез 1.
Актуальность: учитывая высокую биологическую активность и широкий спектр практического применения фосфорорганических соединений, исследования реакций диенового синтеза является актуальным. В настоящее время в литературных данных содержится недостаточное количество информации о методах синтеза фосфорорганических соединений, что представляет наибольший интерес для изучения реакций данного вида.
Цель работы: изучение реакций диенового синтеза на примере диена- α-терпинена и фосфорсодержащих диенофилов.
I. Литературный обзор
1. История изучения диенового синтеза
В 40х – 50х годах XX века исключительную роль в промышленности играло целенаправленное изучение широких циклов реакций.
Диеновый синтез был предметом интереса химиков многих стран. Большие заслуги в его развитии принадлежат школе А. Е. Фаворского. Первые примеры диенового синтеза можно найти в работах В. Н. Ипатьева (1897) и С. В. Лебедева (1909) по исследованию димеризации изопрена .
Как общая реакция органической химии диеновый синтез был открыт в 1928 году немецкими химиками-органиками О. Дильсом и К. Альдером. Диеновый синтез широко применяют в синтетической органической химии, в том числе для синтеза стероидов. Исследование диенового синтеза позволило объяснить ряд процессов при полимеризации диеновых углеводородов.
В последующие годы диеновый синтез действительно стал незаменимым средством для химиков-органиков, которые применяли его при синтезе таких веществ, как лекарства, витамины, гормоны, стероиды, синтетические каучуки и пластмассы.
В настоящее время диеновый синтез, называемый реакцией Дильса - Альдера, является одним из важнейших синтетических методов, имеющих весьма широкое и разнообразное применение. В большинстве случаев диеновый синтез непосредственно приводит к ненасыщенным алициклическим и гетероциклическим шестичленным системам, многие из которых, а также продукты их дальнейших превращений оказались физиологически активными веществами, обладающими антиконвульсивным, снотворным, инсектицидным, гербицидным и репелентным действием. Во многих случаях диеновый синтез оказался единственным методом, позволяющим получать мостиковые и другие ди- и полициклические структуры, составляющие основу многих природных соединений и представляющие самостоятельный интерес. Благодаря стереохимической направленности реакции Дильса - Альдера ее используют также в синтезе природных соединений определенной пространственной конфигурации [1].
Биография О. Дильса и К. Альдера
Отто Пауль Герман Дильс (23 января 1876 г. – 7 марта 1954 г.)
Немецкий химик Отто Пауль Герман Дильс родился в Гамбурге. В шесть лет Дильс поступил в Йоахимштальскую гимназию в Берлине. В двадцатилетнем возрасте Дильс поступил в Берлинский университет для изучения химии. В 1900 г. он под руководством Эмиля Фишера блестяще защитил докторскую диссертацию и стал ассистентом Фишера в университетском Химическом институте.
В 1904 г. Дильс становится лектором, а в 1906 г. – профессором органической химии. В 1916 г. Дильс принял назначение на должность профессора химии и директора Химического института Университета Кристиана Альбрехта (позднее Кильского университета). С 1925 г. он ректор этого университета.
В 1928 г. Дильс с одним из своих бывших студентов, Куртом Альдером, опубликовал статью, в которой они впервые объясняли диеновый синтез. Хотя диеновый синтез уже был обнаружен другими химиками, этому явлению не было дано научного объяснения. Сотрудничество Дильса с Альдером продолжалось до 1936 года.
В 1950 г. Дильс и Альдер были награждены Нобелевской премией по химии "за открытие и развитие диенового синтеза". Болезнь не позволила Дильсу присутствовать на церемонии награждения.
Кроме Нобелевской премии, Дильс был награжден медалью Адольфа фон Байера Германского химического общества (1930), получил почетную медицинскую степень в Кильском университете. Он являлся членом академий наук Гёттингена, Галле и Мюнхена.
Курт Альдер (10 июля 1902 г. – 20 июня 1958 г.)
Немецкий химик Курт Альдер родился в Германии, в Кенигсхютте. В 1922 г. Альдер окончил в Берлине среднюю школу и поступил в Берлинский университет, чтобы изучать химию.
Свое обучение Альдер продолжил в Университете Христиана Альбрехта, где работал у Отто Дильса, профессора органической химии и директора университетского Химического института. В 1926 г., завершив диссертацию о реакциях с азодикарбоновым эфиром, Альдер был удостоен докторской степени и стал ассистентом Дильса.
В 1930 г. Альдер был назначен лектором по органической химии в Кильском университете, а в 1934 г. стал экстраординарным профессором. Вернувшись в 1940 г. к академической деятельности, Альдер, которого не привлекли к исследованиям, осуществляемым в военное время Германией, был назначен руководителем работ по экспериментальной химии и химической технологии в Кельнском университете. Одновременно он стал директором Химического института этого университета.
После получения Нобелевской премии (1950) Альдер продолжал заниматься преподавательской деятельностью и научными исследованиями в области дальнейшего потенциального применения диенового синтеза в промышленных целях. В 1955 г. он, присоединившись к 17 другим Нобелевским лауреатам, подписал декларацию, призывающую все страны осудить войну как инструмент внешней политики. В 1957 г. врач, поставив ему диагноз: истощение организма, посоветовал полный отдых. Альдер умер на следующий год, в возрасте 55 лет [3].
2. Механизм диенового синтеза
Диеновый синтез – реакция 1,4-присоединения диеновых углеводородов с сопряжёнными двойными связями к ненасыщенным соединениям с активированной двойной связью (диенофилы) (схема 1).
В реакцию вступают циклические и ациклические 1,3-диены, енины (алкинилалкены -C=C–C≡C-) или их гетероаналоги – соединения с фрагментами -С=С-С=О, -С=С-СN. Наличие донорных заместителей в диене облегчает протекание реакции.
Диенофилами обычно являются алкены и алкины с активированной электроноакцепторными заместителями кратной связью. В роли диенофилов также могут выступать соединения, содержащие двойные связи с гетероатомом, например -С=О, -С=N-, -СN, -N=О, -S=O, -N=N-. Обнаружено, что в некоторых случаях даже вещества с изолированными двойными связями могут присоединять диены, однако такие реакции обычно протекают в более жёстких условиях [2].
В результате диенового синтеза образуются шестичленные циклы, содержащие двойную связь между вторым и третьим атомами углерода исходного диена.
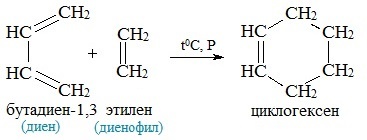
Типичный пример диенового синтеза – Реакция Дильса – Альдера – получение ангидрида тетрагидрофталевой кислоты из бутадиена-1,3 и малеинового ангидрида:
Реакцию Дильса – Альдера осуществляют простым смешением или нагреванием реагентов при 100 – 120°С. При отсутствии активирующей группы в диенофиле для диенового синтеза необходимы жёсткие условия. Обычно эта реакция протекает с высокими выходами, её скорость снижается с увеличением количества и объёма заместителей [4].
Реакция Дильса – Альдера высокостереоспецифична и всегда идёт по схеме цис-присоединения.
Неоднократно наблюдалось, что аддукты реакции диенового синтеза термически неустойчивы. Поэтому в подавляющем числе случаев данная реакция обратима и при нагревании до температур более 200°C снова образуются исходные продукты. Диссоциация происходит с различной лёгкостью в зависимости от характера аддуктов.
Различные типы сопряженных систем, способных вступать в реакцию диенового синтеза, могут быть классифицированы следующим образом:
1. Ациклические сопряжённые системы.
2. Алициклические сопряжённые системы:
3. Ароматические сопряжённые системы:
4. Гетероциклические соединения
Реакция Дильса – Альдера иногда сопровождается полимеризацией диенов – побочная реакция. Применение ингибиторов полимеризации (гидрохинона), низкая температура реакции и выбор подходящих растворителей являются иногда эффективными факторами для подавления полимеризации диена.
Реакция Дильса – Альдера очень важна для синтеза сложных природных полициклических структур [2].
3. Примеры реакций диенового синтеза
Реакции циклоприсоединения – реакции, протекающие с образованием нового цикла из двух реагирующих молекул (без отщепления каких-либо групп или атомов). Такие реакции сопровождаются общим уменьшением кратности связей. Конечным продуктом реакций циклоприсоединения являются циклические субстраты.
Ферментативная реакция Дильса-Альдера — что это такое
Реакцией Дильса-Альдера называют присоединение к ненасыщенному углеводороду или диену, который обладает сопряженными двойными связями соединения и содержит кратные связи (диенофила).
Процесс химической реакции соответствует 1,4–присоединению, в результате чего образуются циклические продукты. Реакция диенового синтеза характерна для диенов и диенофилов, обладающих разным строением. Скорость преобразований и выход возрастают, если диен обладает электронодонорными, а диенофил – электроноакцепторными заместителями.
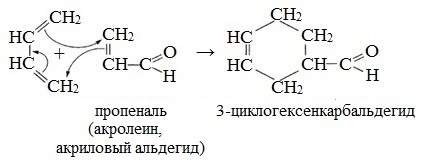
Одна из важнейших реакций органической химии была открыта в 1928 году выдающимися немецкими химиками О. Дильсом и К. Альдером. Открытие диенового синтеза принесло ученым Нобелевскую премию в 1950 году.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Продукты диенового синтеза в большинстве своем характеризуются высокой биологической активностью. Они активно применяются в фармацевтической промышленности и производстве средств для защиты растений. Синтез разнообразных химических соединений, таких как пестициды циклодиенового ряда, осуществляется благодаря реакции Дильса-Альдера с ее высокой стереоселективностью и региоселективностью, а также широким спектром возможных реагентов. Такие процессы можно наблюдать при вторичном метаболизме живых организмов. Ярким примером служит биосинтез следующих веществ:
Существуют примеры внутримолекулярного варианта реакции Дильса-Альдера. В этом качестве развивается синтез растительного гормона абсциссовой кислоты.
Механизм протекания, при каких условиях
Реагенты при отсутствии заместителей взаимодействуют в достаточно жестких условиях. К примеру, для реакции бутадиена-1,3 и этилена необходим температурный режим более 200 градусов и давление свыше 400 атмосфер. Выход химического процесса при этом небольшой. Если реагенты обладают электронодонорными и электроноакцепторными заместителями, реакция протекает в условиях комнатной температуры или при малом нагреве с количественным выходом. Реакция относится к классу [4+2]-циклоприсоединения. В процессе три тт-связи разрываются и образуются две σ-связи и одна тт-связь. Реакция является одностадийной и характеризуется единственным переходным состоянием. Кроме бутадиена-1,3, вступать в реакцию Дальса-Альдера могут:
Диенофилы представлены следующими типами:
Стереохимия реакции Дильса-Альдера
Реакция Дильса-Альдера характеризуется стереоспецифичностью. Данное понятие обозначают стабильность пространственных конфигураций реагентов в процессе химической реакции. Во время исследований специфики протекания реакции Дильса-Альдера применялись различные реагенты. В итоге было доказано важное стереохимическое правило Альдера. Согласно данному утверждению, в процессах, которые контролируются кинетически, преимущественно образуется изомер с эндо-положением заместителя Х в диенофиле. Таким образом, в бициклической системе заместитель Х и метиленовый мостик занимают транс-положение.
Примеры с малеиновым ангидридом
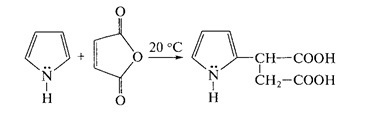
Пиррол достаточно трудно вступает в химическую реакцию 1,4-циклоприсоединения, согласно правилу Дильса-Альдера. Для него характерна реакция заместительного присоединения по второму атому углерода кольца. К примеру, в процессе реакции пиррола и малеинового ангидрида конечным результатом является продукт замещения.
Циклоприсоединение нашло активное применение в области органической химии. С его помощью синтезируют карбоциклические и гетероциклические соединения, которые обладают разнообразным набором и числом атомов в кольце. Этот процесс представляет большой теоретический интерес. В процессе реакции Дильса-Альдера бутадиена-1,3 с малеиновым ангидридом можно получить 1,2,3,6-тетрагидрофталевый ангидрид.
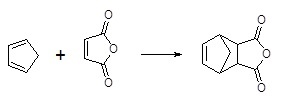
Ангидрид тетрагидрофталевой кислоты представляет собой белое кристаллическое порошкообразное вещество, температура плавления которого составляет от 103 до 104 градусов. Молекулы такого вещества характеризуются циклическим строением.

ГОСТ
1,2 и 1,4-бензохиноны, 1,4-нафтохинон и производные этих хинонов являются активными диенофилами в реакции Дильса-Альдера.
Примеры реакций
Типичным примером такой реакции является взаимодействие 1,4-бензохинона с 1,3-бутадиеном при 25$^\circ$С, в результате которой образуется моноаддукт, который затем медленно енолизуется в соответствующий гидрохинон. Такое превращение, как и следовало ожидать, подвергается кислотному катализу. При последующем окислении оксидом хрома (VI) образуется 1,4-нафтохинон.
При нагревании 1,4-бензохинон присоединяет по двум двойным связям две молекулы 1,3-бутадиена.
В качестве другого примера такой реакции можно привести синтез пентацена из 1,4-бензохинона и 1,2-диметиленциклогексана:
Реакция Дильса-Альдера
Реакция Дильса-Альдера - реакция циклоприсоединения между сопряженным диеном и замещенным алкеном (который также называется диенофилом), которая приводит к образованию замещенных циклогексенов. Реакция проходит также в том случае, когда некоторые атомы в новообразованном цикле не является атомами углерода. В некоторых случаях реакция Дильса-Альдера может протекать в обратном направлении и называется реакцией ретро-Дильса-Альдера. Отто Дильс и Курт Альдер впервые сообщили об этой реакции в 1928 году, за что в 1950 году были награждены Нобелевской премией по химии.
Механизм реакции
Реакция Дильса-Альдера относится к так называемым перицикличным реакциям. Перицикличные реакции, в результате которых образуются циклические соединения, называются реакциями циклоприсоединения. Существует много разновидностей реакций циклоприсоединения, одним из самых распространенных является [4 + 2] - циклоприсоединение, где ключевым этапом является согласованное взаимодействие 4$\pi$-электронов диена и 2$\pi$-электронов диенофила, находящихся на высшей занятой (ВЗМО) и нижней свободной ($HCMO$) молекулярных орбиталях соединений. Эта реакция проходит сравнительно легко, несмотря на то, что переходное состояние содержит шестичленную $\pi$-электронную ароматическую структуру, которая снижает энергию активации.
Готовые работы на аналогичную тему
Диеновый компонент реакции Дильса-Альдера может быть как с открытой цепью, так и циклическим и содержать различные заместители. Однако существует ограничение: диен должен существовать в $s$-цис конформации. Циклические диены, которые постоянно находятся в $s$-цис конформации, являются исключительно активными в данной реакции (например, циклопентадиен), в то время как циклические диены, которые могут находиться только в $s$-транс конформации, в реакцию Дильса-Альдера вообще не вступают. Особенно реакционным является диен Данишефского (1-метокси-3-триметилсилилоксы-1,3-бутадиен) и подобные диены с заместителями при $C$1 и $C$3. Их повышенная реакционная способность обусловлена повышением энергии $HCMO$ диена.
Очень высокореакционными также являются нестабильные диены, которые можно получить только как промежуточные соединения (in situ) и которые стабилизуются при образовании ароматического кольца при циклоприсоединении.
Бензеноидные соединения редко подвергаются реакции Дильса-Альдера и часто требуют очень активных диенофилов. Одним из примеров такой редкой реакции является реакция Вагнера-Яурегга.
Стереохимия циклоприсоединения
Поскольку реакция Дильса - Альдера это согласованный проецесс перераспределения электронной плотности через циклическое переходное состояние, то конфигурация продукта определяется конфигурацией реагентов. Так, из ($Z$) -алкенов образуются цис-продукты, а из ($E$) -алкенов - транс-продукты. Аналогичным образом можно определить и ориентацию заместителей диена в продукте циклоприсоединения.
Стереохимию циклоприсоединения к хинонам можно рассмотреть на примере реакции циклопентадиена с 1,4-бензохиноном, которой свойственна высокая стереоселективность. При четырех возможных стереоизомерных продуктах в реакции образуется только эндо-цис-изомер 1:1. Присоединение второй молекулы циклопентадиена происходит также стереоспецифично.
Наличие электроноакцепторных заместителей в хинонах активирует диенофилы, а электронодонорных заместителей замедляет циклоприсоединение 1,3-диенов.
Читайте также:

