Стадии электродного процесса реферат
Обновлено: 05.07.2024
Отдельные стадии электродного процесса могут быть как химическими ( С), так и электрохимическими ( Е), причем каждая стадия характеризуется своими кинетическими параметрами. Химическая стадия - это процесс превращения вещества, при котором не происходит переноса электрона на электрод или от него. Она может протекать как в глубине раствора, так и непосредственно у поверхности электрода. Скорость химической стадии не зависит от потенциала электрода и подчиняется законам химической кинетики. Однако она может влиять на перенос заряда, происходящий на других стадиях. [1]
Скорость отдельной стадии электродного процесса зависит от поляризации, причем эта зависимость различна для разных стадий. Поэтому при увеличении поляризации скорость ранее лимитирующей стадии может превысить скорость какой-либо другой стадии, которая становится лимитирующей. Таким образом, при изменении поляризации электрода может происходить смена лимитирующей стадии. [2]
Скорость отдельной стадии электродного процесса зависит от поляризации, причем эта зависимость различна для разных стадий. Поэтому при увеличении поляризации скорость ранее лимитирующей стадии может превысить скорость какой-либо другой стадии, которая в таком случае становится лимитирующей. Таким образом, при изменении поляризации электрода может происходить смена лимитирующей стадии. [3]
Скорость отдельной стадии электродного процесса зависит от поляризации, причем эта зависимость различна для разных стадий. Поэтому при увеличении поляризации скорость ранее лимитирующей стадии может превысить скорость какой-либо другой стадии, которая становится лимитирующей. Таким образом, при изменении поляризации электрода может происходить смена лимитирующей стадии. [4]
Выбор амплитуды позволяет проследить отдельные стадии электродного процесса . Направление поляриза - - ции изменяют в зависимости от природы деполяризатора. [5]
Общей причиной поляризации является замедленность отдельных стадий электродного процесса , являющегося сложной гетерогенной реакцией. [6]
Метод наложения переменного тока на постоянный позволяет исследовать скорости отдельных стадий электродного процесса , что невозможно сделать при использовании только одного постоянного тока. [7]
Иногда при адсорбции на электроде поверхностно-активного вещества происходит торможение отдельных стадий многоступенчатого электродного процесса . Так, Холлек и сотрудники в ряде работ ( см., например, [93]) показали, что при восстановлении в щелочной среде ароматических нитросоединений на ртутном капельном электроде введение в раствор поверхностно-активных веществ тормозит лишь вторую электрохимическую стадию процесса, следующую за обратимым переносом первого электрона на нитрогруппу. В результате такого торможения на полярограм-ме возникают две волны: первая - отвечающая одноэлектронному восстановлению нитросоединения до соответствующих радикал-анионов, и вторая - дальнейшему необратимому восстановлению этих радикал-анионов. [8]
Установление природы медленной стадии электродного процесса основывается на различном характере зависимости результирующей скорости отдельных стадий электродного процесса от таких параметров, как потенциал и материал электрода, концентрация реагирующих частиц в растворе, гидродинамические условия, температура. Изменяя соответствующие параметры, устанавливают, как при этом изменяется скорость суммарного электродного процесса, и на основании полученных экспериментальных данных делают заключение о природе медленней стадии. Вместо термина медленная стадия иногда используют понятия лимитирующая стадия, или скорость определяющая стадия. При прохождении поляризующего тока может нарушаться равновесие не одной, а нескольких стадий, тогда электродный процесс может включать несколько медленных стадий. [9]
Метод наложения переменного тока на постоянный позволяет, не прибегая к величинам перенапряжения, исследовать скорости отдельных стадий электродного процесса , которые недоступны при использовании только одного постоянного тока. [10]
Для наиболее простых случаев разработан математический аппарат, позволяющий достаточно успешно рассчитать значения тока и определить константы скорости отдельных стадий электродного процесса . [11]
При некоторых типах электродных процессов форма полярограммы зависит от амплитуды развертки напряжения, поэтому амплитуда должна фиксироваться. Выбор амплитуды позволяет проследить отдельные стадии электродного процесса . Направление поляризации изменяют в зависимости от природы деполяризатора. [12]
Оказывается причина этого - снова неодинаковая скорость отдельных стадий электродного процесса . Так, при использовании свинцового электрода в слабокислом растворе третья стадия процесса идет быстрее первых двух, и промежуточные продукты не успевают вступать в химическое взаимодействие между собой или перегруппировываться; в результате образуется главным образом анилин. На платиновом катоде при избытке кислоты в растворе третья стадия реакции идет настолько медленно, что выход анилина практически равен нулю. Таким образом, и в реакциях электрохимического синтеза главную роль играет кинетика электродных процессов. [13]
В щелочных растворах кинетические закономерности реакции меняются. В случае водорода это обусловлено изменением механизма реакции, л случае кислорода - изменением соотношения скоростей отдельных стадии электродного процесса , а в случае перекиси водорода - уменьшением концентрации реагирующих частиц в реакционной зоне. [14]
Электродный процесс включает ряд стадий; в простейшем случае это подача деполяризатора к электроду, собственно электрохимическая реакция - перенос электронов, отвод продуктов реакции от поверхности электрода. Электродные процессы с участием органических веществ обычно включают также химические стадии - чаще всего протонизацию, а также другие химические реакции, протекающие как до, так и после собственно электрохимической стадии. На отдельные стадии электродного процесса существенное влияние оказывают адсорбционные явления на границе электрод - раствор, а также строение двойного электрического слоя, возникающего на этой границе. В этой главе рассматривается кинетика отдельных стадий электродного процесса, которые оказывают влияние на его общую скорость. Последнее находит свое отражение в высоте, форме и положении по отношению к оси потенциалов полярографической волны. [15]
ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ, физ.-хим. процессы, к-рые протекают на границе раздела проводников электрич. тока 1-го и 2-го рода и сопровождаются переходом через эту границу заряженных частиц - электронов и (или) ионов. При этом в качестве проводников 1-го рода могут выступать разл. металлы и сплавы, хим. соед., обладающие электронной проводимостью (напр., оксиды), а также полупроводниковые материалы; в качестве проводников 2-го рода выступают разл. ионные системы - р-ры и расплавы электролитов, а также твердые электролиты.
Любой электродный процесс всегда протекает в двух направлениях: в катодном, когда к границе раздела со стороны электрода течет отрицат. катодный ток (соответствующую плотность тока обозначают), и в анодном, когда к границе раздела со стороны электрода течет положит. анодный ток (плотность тока). Суммарный электродный процесс является катодным, если , и анодным, если; при этом измеряемая плотность тока . Катодные процессы связаны с переносом электронов е от электрода к молекулам или ионам реагирующих на электроде в-в; последние при этом восстанавливаются. В анодных процессах, наоборот, происходит окисление реагирующих в-в, сопровождающееся переходом электронов на электрод либо растворением материала электрода. Хим. превращения в катодном процессе наз. электровосстановлением (напр., О2 + 4е + 4Н + 2Н2О), в анодном - электроокислением (напр., 2Сl - - 2еС12). В условиях электрохим. равновесия i =i и i = 0.
Обнаружить анодную составляющую катодного электродного процесса можно с помощью радионуклидов. Так, если на амальгаме цинка, содержащей радионуклид Zn, в неактивном р-ре ZnSO4 проводить катодный электродный процесс.

Zn 2+ + 2e(Hg)Zn(Hg), то через нек-рое время р-р также
обнаруживает радиоактивность из-за наличия. Закон сохранения массы в ходе электродных процессов отражают Фарадея законы.
Важной особенностью электродных процессов является их стадийный характер. Рассмотрим стадии электродных процессов на примере р-ции 2Н3О + + 2е(М) Н2 + 2Н2О (М - металл). В стадии массопереноса ионы Н3О + из объема р-ра переходят к пов-сти металла М: (Н3О + )об(Н3О 4 )пов. Затем следует стадия вхождения ионов Н3О + в двойной электрический слой (их адсорбция на электроде): (Н3О + )пов(Н3О + )адс. После этого имеет место собственно электрохим. стадия разряда-ионизации: (Н3О + )адс + е(М)Надс + Н2О. Удаление адсорбированного водорода с пов-сти электрода может осуществляться по трем параллельным путям:
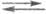
1) 2Надс(Н2)пов

2) Надс + е(М) + (Н3О + )адс(Н2)пов + (Н2О)адс,
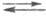
3) Надс + е(М) + (Н2О)адс (Н2)пов + (ОН - )адс
Путь (1) получил назв. рекомбинации, а пути (2) и (3) -электрохим. десорбции с участием соотв. ионов Н3О + и молекул воды. Затем следует стадия массопереноса растворенного Н2 от пов-сти металла в объем р-ра: (Н2)пов (Н2)об. И, наконец, процесс завершается стадией образования новой фазы - пузырьков Н2: (Н2)об(Н2)газ. Если же в р-ре имеется к.-л. орг. основание В (напр., пиридин), возникают дополнит. стадии: хим. взаимодействие - В + Н3О + ВН + + Н2О (в объеме р-ра и на пов-сти электрода), разряд адсорбированных частиц ВН + и удаление продуктов с пов-сти электрода.
Выяснение механизма электродного процесса и определение скоростей как отдельных стадий, так и суммарного электродного процесса составляет предмет электрохимической кинетики. Электродные процессы лежат в основе прикладной электрохимии.
Лит.: Дамаскин Б.Б., Петрий О. А., Введение в электрохимическую кинетику, 2 изд.. М., 1983.
Электродные реакции – это гетерогенные процессы, и их кинетика определяется закономерностями переноса заряда и массопередачи. В некоторых случаях необходимо учитывать также сопряженные химические реакции. Причем сопряженные реакции могут протекать исключительно на поверхности электрода (гетерогенные, или поверхностные, реакции) или же в околоэлектродном пространстве (гомогенные, или объемные, реакции). Они могут предшествовать переносу заряда или следовать за ним; возможны также химические превращения промежуточных продуктов электролиза. Электродная реакция, сопровождающая протекание тока через электрод и обнаруживаемая посредством химического анализа, слагается в общем случае из целого ряда последовательных ступеней. Одну из главных задач при изучении кинетики электродных процессов составляет установление действительного ряда ступеней, из которых слагается аналитически определенная электродная реакция. Следующая задача состоит в определении их скорости, которая, согласно закону Фарадея, пропорциональна плотности тока. Для решения этих двух задач необходимо установить зависимость плотности тока, а значит, и скорости реакции от электродного потенциала, концентрации участвующих веществ и других переменных, например от температуры.
В полной аналогии с кинетическими закономерностями химических процессов скорость электродной реакции задается ее самой медленной стадией. Именно наиболее затрудненные стадии и определяют величину и характер полного перенапряжения.
Процессы электролиза, протекающие в системе твердое тело – электролит, являются гетерогенными и включают в себя следующие стадии, характерные для всех гетерогенных процессов (отдельные стадии не обязательно протекают раздельно и некоторые из них могут отсутствовать):
1. Массоперенос из объема раствора к границе раздела между раствором и электродом для восполнения концентрации компонентов, израсходованных в процессе протекания реакций на электродах. Обычно массоперенос происходит за счет диффузии. Однако, когда реагирующие частицы заряжены, электрическое поле оказывает существенное влияние на массоперенос.
2. Адсорбция ионов или молекул, участвующих в электрохимическом процессе, в области двойного электрического слоя, который непосредственно контактирует с поверхностью электрода.
3. Хемосорбция комплексообразующих ионов или молекул, приводящая к частично обобществленной электронной структуре с ионами, локализованными на поверхности электрода.
4. Удаление ионов из кристаллической решетки, в которой остаются электроны. В случае самопроизвольного растворения или восстановления оставшиеся электроны потребляются при восстановлении или окислении деполяризатора. Эта стадия является “истинной” электрохимической реакцией (электродной реакцией), известной также как стадия переноса заряда.
5. Адсорбция первичных продуктов реакции на поверхности.
6. Десорбция первичных продуктов.
7. Последующие химические превращения первичных продуктов (иногда уже в адсорбированном состоянии).
8. Удаление конечных продуктов реакции с поверхности, что обеспечивает дальнейший перенос заряда. Этот процесс всегда включает диффузию.
Поскольку эти стадии протекают одна за другой, в соответствии с законами кинетики реакций последовательных процессов, скорость суммарного процесса определяется наиболее затрудненной (самой медленной) стадией. При изучении механизма реакции основная задача состоит в выявлении этой стадии. Понятия “медленная” и “быстрая” реакции не означает, что та или иная стадия протекают с различной скоростью. В действительности все стадии электродного процесса протекают с одинаковой скоростью, а используемые понятия характеризуют лишь возможность этих стадий.
Так, при быстрой электрохимической реакции и медленной диффузии устанавливается такое состояние у поверхности электрода, при котором реакция могла бы протекать с большой скоростью, но медленная диффузия этому препятствует. Напротив, в случае медленной электродной реакции и быстрой диффузии скорость последней оказывается сниженной, так как медленный расход реагирующего вещества не создает достаточно большой разности концентраций, необходимой для развития диффузии.
В зависимости от того, какая из стадий является более медленной, различают электрохимическую и диффузионную кинетику электродного процесса.
Скорость электродного процесса принято выражать в виде плотности тока. Эта величина лишь формально отличается от единиц скоростей, принятых в других областях кинетики реакций, а именно: когда скорость реакции v, отнесенная к 1 см 2 поверхности электрода, выражается в моль/(с . см 2 ), а превращение одного моля сопровождается переносом заряда величиной zF, плотность тока равна:

(1.81)
В любой конкретной реакции j и v различаются только константой; следовательно, j действительно соответствует скорости электрохимического процесса.
Читайте также:

