Современные методы местного лечения ран реферат
Обновлено: 02.07.2024
А.Г. ИЗМАЙЛОВ 1 , С.В. ДОБРОКВАШИН 1 , Д.Е. ВОЛКОВ 1 , В.А. ПЫРКОВ 2 , Р.Ф. ЗАКИРОВ 2 , Ш.А. ДАВЛЕТ-КИЛЬДЕЕВ 2
1 Казанский государственный медицинский университет, 420012, г. Казань, ул. Бутлерова, д. 49
2 Госпиталь для ветеранов войн г. Казани, 420039, г. Казань, ул. Исаева, д. 5
Доброквашин Сергей Васильевич — доктор медицинских наук, профессор, заведующий кафедрой общей хирургии, тел. (843) 557-39-46, e-mail: [email protected]
Волков Дмитрий Евгеньевич — кандидат медицинских наук, доцент кафедры общей хирургии, тел. (843) 556-29-26, e-mail: [email protected]
Пырков Вячеслав Андреевич — заведующий хирургическим отделением, тел. (843) 556-29-26, e-mail: [email protected]
Закиров Рустем Фаридович — кандидат медицинских наук, врач хирургического отделения, тел. (843) 556-29-26, e-mail: [email protected]
Давлет-Кильдеев Шамиль Анварович — врач хирургического отделения, тел. (843) 556-29-26, e-mail: [email protected]
В статье представлены результаты лечения 112 больных в возрасте от 26 до 82 лет с различными формами инфицированных ран мягких тканей. Среди них 8 больных (7,2%) с абсцессами мягких тканей, 19 (16,9%) — с инфицированными ранами мягких тканей, 7 (6,3%) — с нагноением послеоперационных ран, 40 (35,7%) — с инфицированными трофическими язвами и с инфицированными пролежнями — 38 (33,9%). В группе сравнения у 74 (66,1%) больных использовались традиционные способы закрытого и открытого метода лечения с активным дренированием инфицированных ран мягких тканей. В основной группе — 38 (33,9%) больных — применялся также закрытый и открытый способ, но с применением разработанного дренажа и композиции на основе препарата ксимедона. Применение новых подходов позволяет расширить показания к раннему наложению ранних вторичных швов на рану при открытом лечении в условиях общехирургического стационара.
Ключевые слова: клеевая композиция, гнойная рана, дренажное устройство, экссудат.
A.G. IZMAILOV 1 , S.V. DOBROKVASHIN 1 , D.E. VOLKOV 1 , V.A. PYRKOV 2 , R.F. ZAKIROV 2 , S.A. DAVLET—KILDEEV 2
¹Kazan State Medical University, 49 Butlerov St., Kazan, Russian Federation, 420012
²Hospital for War Veterans of Kazan, 5 Isayev St., Kazan, Russian Federation, 420039
New approaches in local drug treatment of infected wounds in soft tissues
Dobrokvashin S.V. — D. Med. Sc., Professor, Head of the Department of General Surgery, tel. (843) 557-39-46, e-mail: [email protected]
Volkov D.E. — Cand. Med. Sc., Associate Professor of the Department of General Surgery, tel. (843) 556-29-26, e-mail: [email protected]
Pyrkov V.A. — Honored Doctor of RT, Head of Surgical Department, tel. (843) 556-29-26, e-mail: [email protected]
Zakirov R.F. — Cand. Med. Sc., oncologist, doctor of the Surgical Department, tel. (843) 556-29-26, e-mail: [email protected]
Davlet-Kildeev Sh.A. — doctor of Surgical Department, tel. (843) 556-29-26, e-mail: [email protected]
The article presents the results of treatment of 112 patients with various infected wounds of soft tissue, aged from 26 to 82 years. Among these, 8 patients (7.2%) were with a soft tissue abscess, 19 (16.9%) with infected wounds in soft tissue, 7 (6.3%) with postoperative wound suppuration, 40 (35.7%) with infected trophy wounds and 38 (33.9%). infected with bed sores. In the comparison group, conventional methods of closed and open treatment with active drainage of infected wounds in soft tissues were used in 74 (66.1%) patients. In the main group – 38 (33.9%) patients- the closed and open methods were used, but with the developed drainage and compositions based on xymedone. The new approaches allow to expand the indications for early imposition of early secondary sutures on the wound during open treatment in a general surgical hospital.
Key words: adhesive composition, purulent wound, drainage device.
Раневой процесс классифицируется (по М.И. Кузину) [9]: I — фаза воспаления, подразделяется на период сосудистых изменений и период очищения раны от некротических тканей; II — фаза регенерации, образования и созревания грануляционной ткани; III — фаза реорганизации рубца и эпителизации. Существует альтернативная четырехстадийная классификация раневого процесса BYRP (Black Yellow Red Pink) [10]. В данной системе различные цвета имитируют различные фазы раневого процесса. В классификации BYRP выделены стадии: Black (черный) — некроз, Yellow (желтый) — фибрин в ране, Red (красная) — грануляционная ткань, Pink (розовая) — эпителизация раны. Цвет раны меняется в зависимости от процессов, происходящих в ней. При этом стадии B и Y соответствуют I фазе раневого процесса по М.И. Кузину. Стадии R и P соответствуют II и III фазам [11, 12].
При лечении больных с данной патологией применяем традиционные подходы для местного лечения ран. В 1-й фазе раневого процесса — растворы: диоксидина, 3%-ной перекиси водорода, 10%-ного натрия хлорида; салициловая мазь, левомеколь; 2-я фаза — аргосульфановая мазь, левомеколь и левосин; 3-я фаза — мазь актовегин, солкосерил, метилурациловая. С целью ускорения процессов заживления гнойной раны, нами разработаны способы лечения инфицированных ран мягких тканей (патент на изобретение РФ № 2261699 от 10.10 2005 г., патент на изобретение РФ № 2348396 от 10.03.2009 г.).
Материал и методы исследования
Критерии включения в исследование: возраст пациентов от 18 до 85 лет, наличие первичной гнойной раны мягких тканей, нагноение послеоперационных ран. Критерии исключения из исследования: анаэробная инфекция, тяжелый раневой сепсис, беременность, онкологические заболевания, токсикомания, наркомания [8].
В соответствии с поставленными целями выделена группа сравнения больных — 74 (66,1%), в которой использовались традиционные способы закрытого и открытого метода лечения и активное дренирование инфицированных ран мягких тканей, и основная группа — 38 (33,9%) больных, где применялся также закрытый и открытый способ по показаниям, но с применением разработанного дренажного устройства и композиции на основе препарата ксимедона.
По данным литературы, противопоказаниями к закрытому методу лечения, и мы с этим согласны, считаются: невозможность проведения полноценной хирургической обработки гнойной раны; наличие в полости раны некротических тканей; наличие резких воспалительных изменений кожи и окружающих тканей; невозможность адаптации краев раны без чрезмерного натяжения [9].
Распределение больных основной и контрольной групп по возрасту и полу представлено в табл. 1.
Таблица 1.
Распределение больных по возрасту и полу
В исследование включены пациенты с гнойными процессами различной этиологии. Среди больных было 8 (7,2%) с абсцессами мягких тканей, 19 (16,9%) — с инфицированными ранами мягких тканей, 7 (6,3%) — с нагноением послеоперационных ран, 40 (35,7%) — с инфицированными трофическими язвами и инфицированными пролежнями — 38 (33,9%) представлены в табл. 2.
Таблица 2.
Распределение больных по характеру заболеваний
У 48 (42,8%) больных в клинической картине преобладали явления воспаления, имелись фибринозно-гнойный налет, обильная экссудация, в то же время наблюдались единичные участки грануляций. У 64 (57,2%) больных преобладали 1–2-я стадия раневого процесса. На фоне грануляционной ткани, частично выполняющей язвенную поверхность, отмечали краевую эпитализацию. На отдельных участках имелись налеты фибрина, умеренная экссудация.
Из 112 больных воспалительный процесс у 23 (20,5%) локализовался на животе, у 15 (13,4%) — в ягодичной области, у 38 (33,9%) — на спине, и у 36 (32,2%) — на нижних конечностях. После вскрытия и хирургической обработки гнойного очага инфекции больных распределяли следующим образом. При отсутствии противопоказаний к наложению первичного шва выполнялось лечение раны закрытым способом. Методика закрытого способа лечения заключалась в следующем. Швы накладывались только на кожу, все остальные слои гнойной раны оставались неушитыми. Перед ушиванием кожных краев раны в раневую полость устанавливалась через прокол кожи и подлежащие ткани традиционная двухпросветная трубка. В послеоперационном периоде проводили постоянное промывание антисептиком с активной аспирацией.
Основную группу составили 38 больных, к которым применяли разработанный способ лечения гнойных ран с применением закрытого и открытого способа по показаниям. При закрытом способе использовали дренирование послеоперационной раны разработанным нами дренажным устройством (патент РФ №2261699) [13]. Устройство представляет собой полимерный эластичный гладкогофрированный трубчатый сетчатый дренаж из биологически инертного материала. Устройство выполнено в виде полимерной гладкостенной трубки с наличием на одном конце боковых отверстий. Трубка своим перфорированным концом размещена внутри гофрированного эластичного чехла, контактирующего с раневой поверхностью, выполненного из неактивного синтетического материала, например, из крупноячеистого лавсана, образуя рабочую часть устройства. Устройство представляет собой единую дренажную комбинированную систему, которую промывали 30–50%-ным раствором гидрохлорида ксимедона, а также проводили ультразвуковую кавитацию. Устройство для санации в исходном состоянии после стерилизации рабочей частью дренажной трубки (2) устанавливают в дренируемой полости. Проксимальный отдел отводящей трубки через контраапертуру строго в нижнем полюсе полости выводят наружу до места фиксации и прикрепляют к коже, например, лейкопластырем или с помощью шва (4). Установку трубчатого дренажа проводили в нисходящем направлении в нижней точке дренируемой полости в качестве пассивного коллектора. При таком расположении дренажа обеспечивается пассивный отток экссудата по принципу силы его тяжести и капиллярности. В верхнем полюсе полости между крайними, предварительно наложенными швами (5) и (6) рыхло вводят пропитанный 30–50%-ным водным раствором гидрохлорида ксимедона марлевый тампон (7) с частичным размещением его в просвете в торцевой части чехла (3), что придает дренажу непрерывность. Швы (5, 6) и остальные последовательно завязывают (8), сближая края раны и следя за тем, чтобы не было сдавливания чехла (3) рабочей части устройства и марлевого тампона (рис. 1.).
Рисунок 1.
Дренажное устройство

Послеоперационную рану через отводящий конец устройства промывали 30–50%-ным водным раствором гидрохлорида ксимедона. Затем в просвет трубки рабочей части устройства вводили ультразвуковой излучатель и производили внутриполостное ультразвуковое воздействие в среднем в течение 4-10 минут, далее эвакуировали раствор. Ультразвуковую кавитацию осуществляли с помощью отечественной ультразвуковой установки УРСК — 7Н. Воздействие низкочастотным ультразвуком производили с резонансной частотой 26,5 кГц, экспозиция ультразвуковой кавитации находилась в пределах от 2,5-10 минут. Эту процедуру проводили 2 раза в день в течение всего срока дренирования. Дренажное устройство удаляли при отсутствии отделяемого, на 1-3 суток.
При открытом способе лечения под повязкой применялась композиция для лечения гнойных ран (патент на изобретение №2348396). Композиция содержит: масс.%. Левомицетин — 0,75, полиэтиленоксид 1500 — 19,05 и полиэтиленоксид 400 — 76.2, отличающаяся тем, что содержит ксимедон 4,0 мас.% [14, 15]. Композицией пропитывали стерильные марлевые салфетки, которыми рыхло заполняли рану. Перевязки производили ежедневно до полного очищения раны от гнойно-некротического процесса. Применение композиции оказывало выраженное качественное и количественное влияние на изменение в микробном пейзаже отделяемого ран. Намечалось быстрое уменьшение обсемененности полости раны микрофлорой.
В комплекс лечебных мероприятий у больных всех групп была включена антибактериальная и симптоматическая терапия.
Для статистической обработки полученных данных использовалась компьютерная программа Statistica 6.0 [17]. Для оценки статистической значимости различий при сравнении качественных эффектов в парах распределений применяли точный метод Фишера, при сравнении групп по количественному признаку — критерий Манна — Уитни для независимых выборок. Критическое значение уровня значимости принималось равным (р≤0,05).
Использование разработанных новых подходов лечения гнойных ран позволяет расширить показания к наложению раннего вторичного шва на гнойную рану и тем самым сократить сроки лечения этой группы больных.
Результаты сравнительной оценки эффективности местного лечения гнойных ран при их вторичном заживлении в основной и контрольных группах, представлены в табл. 3.
Таблица 3.
Эффективность местного лечения гнойных ран
Из них: Нагноение раны
При анализе результатов лечения больных представленных двух групп больных выявлено, что исчезновение местных признаков воспаления происходит на 2–4-е сут. во всех двух группах больных. Появление грануляций в группе сравнения в среднем достигалось на 4,1±0,7 сут, параллельно с очищением ран от гнойных и некротических масс и заполнением их грануляционной тканью исчезали местные признаки воспаления. Клинические наблюдения подтверждались микробиологическими и цитологическими исследованиями. При этом различали следующие типы цитограммы: регенеративно-воспалительный, регенераторный, что служило показанием к наложению раннего вторичного шва. Переход раневого процесса во вторую фазу проявлялся снижением количества микробных тел менее чем 10 5 на 1 мл раневого отделяемого. Ввиду отсутствия визуального контроля течения раневого процесса после наложения швов при закрытом способе в основной группе и группе сравнения данных о появлении грануляций нет. Показания к прекращению санаций и наложению ранних вторичных швов явились: отсутствие в ране некротических тканей, отсутствие выраженных воспалительных изменений паравульнарных тканей, уменьшение количества раневого отделяемого, заполнение раневой полости грануляционной тканью и нормализация температуры тела больного.
При решении вопроса о необходимо наложения раннего вторичного шва, служили также клинические признаки и данные ультразвукового исследования полости раны. Интегрирующим показателем лечения гнойной раны является ее полное заживление, т.е. сроки снятие швов. Сроки снятия швов в основной группе составили, соответственно, 12,5±1,5 сут., а в группе сравнения 15,2±1,3 суток.
Заключение
Применение разработанных новых подходов лечения больных с инфицированными ранами мягких тканей с использованием разработанного дренажного устройства и клеевой композиции, позволяет расширить показания к раннему наложению ранних вторичных швов на рану при открытом способе лечения, что привело к сокращению сроков лечения больных в среднем на 2,1±0,8 суток.
Что такое открытая рана? Причины возникновения, диагностику и методы лечения разберем в статье доктора Николенко Виталия Александровича, травматолога со стажем в 12 лет.
Над статьей доктора Николенко Виталия Александровича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Раной называют повреждение кожных покровов или слизистых оболочек, вызванное внешним воздействием механических сил.
Исходя из приведённого определения, причиной раны, как нозологической формы, может являться исключительно травмирующий агент.

Природа раны всегда экзогенная (возникает под воздействием внешних факторов). Даже если речь идёт о травматизации мягких тканей изнутри костями или разрыве кожи от перенапряжения — всё же изначальной причиной поврежения является приложенная извне сила, которая превысила предел прочности тканей и привела к ране косвенным путём. [1]
В большинстве случаев рана — результат прямого нарушения целостности покровной ткани тем или иным ранящим объектом. Характер раны, тактика лечения, вероятные осложнения и её клинический исход напрямую зависят от изначального воздействия и свойств ранящего объекта (преимущественно его геометрии и силе соударения). [2]
Как отдельные варианты ранения рассматриваются размозжение тканей и травматические отслойки тканей в результате тупой травмы тела. Последний вариант отличается обширной зоной деструкции и дополнительными факторами, отягощающими раневой процесс в отсроченном периоде. [3]
Огнестрельные раны также рассматриваются обособленно в силу особого подхода в лечении. Ранящий источник в этом случае, обладая значительной кинетической энергией, образует вокруг раны область контузии тканей. [4]
Тяжесть раневого процесса определяется способом воздействия. В настоящее время достаточно изучен профиль осложнений, характерный для каждого вида раны. Наглядным примером комплексного раневого процесса, приводящего к общему заболеванию, служит глубокая колотая рана, осложнившаяся клостридиальной инфекцией. [5]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы открытой раны
Первым и патогномоничным симптомом, характерным для раны, является нарушение целостности кожных покровов или слизистой оболочки. Другими неотъемлемыми клиническими признаками являются:
- диастаз краёв повреждённых тканей;
- кровотечение из зоны повреждения;
- боль и функциональные расстройства.
Перечисленная тетрада, четко и академично характеризует рану. [6]
Под диастазом понимают расхождение краёв раны, неизменно возникающее при любом ранении в той или иной степени выраженности. Даже резаная рана с гладкими краями имеет диастаз, в том числе при макроскопически адаптированных краях раны.
Кровотечение из раны присутствует всегда, за исключением редких случаев коагулопатии (нарушений свёртываемости крови). [7] Собственно кровотечение может нести раннюю и непосредственную угрозу жизни. Оно явным образом даёт понять, что человек имеет дело именно с раной. Капиллярное, венозное, артериальное или смешанное кровотечение — компонент, присущий любой ране.
Боль — специфичный вариабельный признак раны. Его вариабельность обусловлена не только характером и локализацией раны, но и общим состоянием организма, индивидуальной лабильностью и уровнем болевого порога.
Диагноз можно установить при одновременном сочетании всех перечисленных выше симптомов, однако это не ограничивает спектр всех проявлений раны. Диагностирование раны не представляет особой сложности ввиду внешних очевидных признаков травмы. Кроме того, при осмотре обращает на себя внимание выраженное нарушение функции, которое следует рассматривать как симптомокомплекс. [8]
Нарушение функции проявляет себя неспецифически, то есть может быть присуще не только последствиям ранения, но и сочетанных повреждений.
Функциональные расстройства, связанные с раной, стоит разделить на локальные и системные — это упрощает диагностику и поясняет природу симптоматики раны.
- К локальным нарушениям функции относят последствия острой воспалительной и посттравматической реакций, которые характерны для отёка. [9]
- К системным функциональным расстройствам относят общие реакции организма (например, лихорадку).
Под нарушением функции в симптоматике раны, как правило, понимают не дисфункцию на тканевом уровне с патогенетическими сдвигами, а глобальные проявления анатомического характера: нарушение подвижности в сегменте, вплоть до утери опороспособности и объёма движений. [10]
Патогенез открытой раны
Патогенез ранений детально изучен. На его основе строится лечение ран. Неизменность патогенетических звеньев при ранении позволяет говорить о раневом процессе и его течении как об общем комплексе типичных проявлений, характерных для любой раны, независимо от её морфологии.
Существуют различные класификации терминологий и длительности фаз, однако классификация Росса заслужила признание повсеместно. Согласно ей, выделяют три фазы раневого процесса:
- воспалительная фаза;
- пролиферативная фаза;
- реорганизационная фаза. [11]
Воспалительная фаза
В первой фазе происходит острая сосудистая реакция, характеризующаяся:
- вазоспазмом (сужением артерий и капилляров) с целью локального гемостаза (остановки кровотечения);
- выбросом гуморальных факторов свёртывания, катализаторов местных иммунных реакций.
Задача воспалительной фазы — мобилизовать силы организма с целью локализации процесса и подготовки к успешной репарации (восстановлению) в дальнейшем. [12]
Второй этап этой фазы состоит в элиминации (устранении) организмом поврежденных структур. Длительность перечисленных процессов — от трёх до пяти суток. После чего наступает следующая стадия раневого процесса.
Пролиферативная фаза
Как видно из названия, в этот период начинается восстановление повреждённых и замещение утраченных тканей.
Как правило, эта фаза протекает от нескольких суток до нескольких недель. Существует прямая зависимость от количества утраченной ткани при ранении. В основе пролиферативной фазы лежит преобладание процессов синтеза за счёт клеток-предшественников. [14]
Реорганизационная фаза
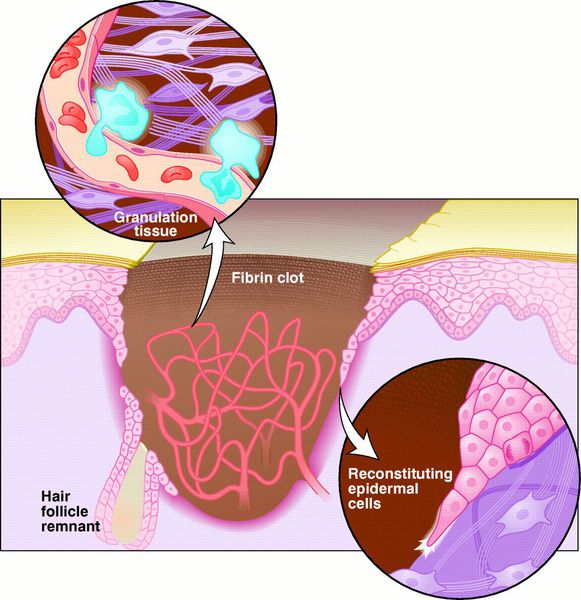
Заживление ран проходит по одному из трёх путей: первичным или вторичным натяжением, или под струпом. [19]
Первичное натяжение — самый благоприятный способ заживления. Для него, однако, требуются изначальные благоприятные условия: рана с минимальной микробной контаминацией, плотно соприкасающиеся края раны, отсутствие некротических тканей.
Вторичное натяжение — вариант заживления раны, противоположный описанного выше натяжения. Этот тип заживления характерен для инфицированных ран. [20]
Заживление под струпом — заживление, характерное для ран с большой площадью, но малой глубиной. При этом, протекает процесс, аналогичный заживлению первичным натяжением, но ориентированный в продольной плоскости. Кроме того, раневая поверхность покрывается струпом — слоем высохшей крови, тканевой жидкости и детрита. [21] Струп выполняет функцию биологической повязки до заживления и эпителизации раны.
Классификация и стадии развития открытой раны
Классификация ран обширна, в основном, за счёт обилия классифицируемых признаков.
В основную класификацию ран, радикально влияющую на способ их ведения, включают инфицированные и неинфицированные повреждения или, как их называют врачи, гнойные и чистые раны.
По способу и обстановке нанесения раны делятся на хирургические, случайные, умышленные и раны военного времени.
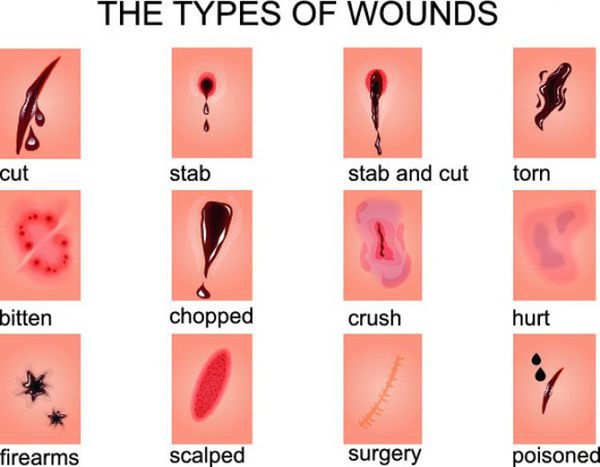
По характеру раневых ворот, что зависит от механизма нанесения раны:
- огнестрельные;
- размозженные;
- укушенные;
- резаные;
- ушибленные;
- колотые;
- рубленные;
- рваные;
- скальпированные;
- раздавленные. [16]
В классификациях по данному признаку встречаются раны смешанного характера (например, укушено-рваные или размозжено-рваные).
По обширности выделяют рану с малой зоной повреждения и обширную рану.
По количеству ран: одиночная и множественные раны. Эта классификация включает дополнительный критерий: множественные раны разделяются на сочетанные и комбинированные. [17]
По характеру раневого канала раны разделяются на слепые, сквозные, касательные, проникающие и непроникающие.
По наличию осложнений раны могут быть осложненными и неосложненными. Осложниться раны могут общими и местными процессами.
Независимо от характера раны, ей присуща клиническая стадийность, которая отражает аналогичную последовательность патогенеза.
Непосредственно после нанесения раны, возникает первичный рефлекторный спазм сосудов микроциркуляторного русла, как нейровегетативный ответ на травму. [18] Это короткий период, с характерным отсутствием кровотечения, несмотря на масштаб повреждения. После чего, развивается кровотечение.
Независимо от характера и интенсивности кровотечения, организм стремится к гемостазу сосудистым и гуморальным звеном. Если гемостаз наступил, и состояние после кровопотери стабилизировано — начинается репаративная фаза.
Осложнения открытой раны
Осложнения ран делятся на местные и общие. И те, и другие могут быть ранними и поздними, в зависимости от сроков развития.
Местные осложнения ран могут носить инфекционный и неинфекционный характер. Инфекционные местные осложнения — присоединение активного микробного заражения раны с клиническим проявлением воспалительной реакции. [22]
Инфицирование раны — бесспорное осложнение, замедляющее заживление раны, снижающее вероятность первичного заживления, приносящее риск генерализованных осложнений и ухудшающее отдалённый прогноз. [23]
Некроз — гибель тканей в зоне раны. Это вторичный процесс, развивающийся уже в отделённом времени после получения раны.
Как отдельный вид местных осложнений, рассматривают вторичное кровотечение, возникшее после изначально выполненного гемостаза раны. В случае выполненного хирургического лечения возможны осложнения раны другого характера — несостоятельность швов.
К неинфекционным местным осложнениям относят повреждение крупных нервов, магистральных сосудов, сухожилий. Это приводит к необходимости расширения объёмов оперативного пособия (и даёт абсолютные показания к нему), резко уменьшая шансы на восстановление функции сегмента. [25]
Общие или генерализованные осложнения раны опасны нарушениями жизненных функций организма. Общие осложнения ран могут стать фатальными для пациента.
Выделяют следующие неинфекционные осложнения общего характера:
- Геморрагический шок — декомпенсация витальных показателей организма, на фоне массивной кровопотери. Это раннее общее осложнение, которое встречается наиболее часто.
- Травматический шок — преобладание болевой импульсации, как ключевого компонента в нарушении гемостаза. Травматический шок включает в себя понятие массивной кровопотери, но связан с отягощением раны другой травмой либо множественными ранами. [26]
Общие осложнения инфекционной причины: сепсис, клостридиальная инфекция.
Осложнения местные и общие тесно связаны. Генерализация осложнений напрямую указывает на вероятную ошибку в подходах к лечению. Любой раневой процесс может генерализоваться даже при правильных тактических решениях врача. [16]
Диагностика открытой раны
Диагностика раны в своем большинстве — визуальна. Результатов осмотра достаточно, чтобы установить предварительный и, в большинстве случаев, полный диагноз. Нарушение целостности тканей, зияние краёв раны, кровотечение — критерии диагноза. [3]
Не стоит пренебрегать сбором жалоб пациента, уточнением деталей об обстоятельствах получения раны с целью моделирования механизма нанесения раны. Общеклинический план опроса пациента позволит дополнить диагноз сопутствующей патологией, важной для лечения раны.
В ряде случаев, определить повреждение подлежащих анатомических структур позволят клинические тесты. Оценка объёмов движений сегмента при ранении в проекции сухожилий, нагрузочные тесты выявляют полные или частичные повреждения, которые могут быть не визуализированы во время ревизии. [10]
Инструментальные методы диагностики раны направлены на исключение сопутствующего повреждения сосудов, нервов, внутренних органов. Рентген-визуализация выявляет рентгеноконтрастные инородные тела, что станет ценной информацией для хирурга перед операцией.
Лабораторный минимум — общий анализ крови, коагулограмма. Они позволят в кратчайшие сроки оценить объём кровопотери и проблемы с гемостазом.
Одним из немногих специфичных для раны лабораторных тестов является посев раневого содержимого на рост бактериальной флоры с определением чувствительности к антибиотикам.
Лечение открытой раны
Лечение ран бывает общим и местным, консервативным и оперативным.
Монотерапия (только общее или местное) раны не применятся, за редким исключением.
Показания к консервативному лечению — поверхностные и осаднённые раны, раны с адаптированными краями, отказ пациента от оперативного лечения, терминальное состояние пациента либо абсолютные противопоказания к выполнению наркоза или анестезии. [28] Условным показанием к консервативному лечению, является первичное инфицирование раны. В этом случае применимы отсроченные швы либо консервативное ведение.
Технически, лечение раны консервативным способом заключается в регулярных перевязках раны до заживления с целью минимизации риска инфекционных осложнений. Вопрос о хирургическом лечении в таком случае, может быть поставлен в ходе динамического наблюдения. [12]
Вакуум-терапия
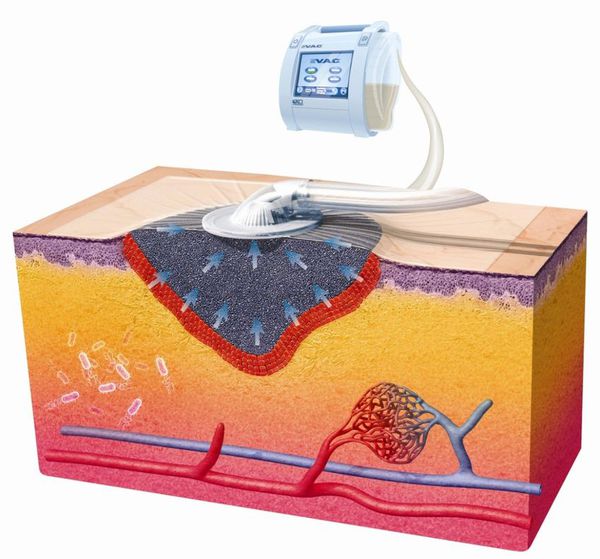
Эффективный и современный способ консервативного лечения ран — вакуум терапия, проводимая с использованием окклюзионных повязок. Отрицательное давление, импульсный и переменный режимы приводят к положительным эффектам: адекватному дренированию раны, щадящей стимуляции репаративных процессов, устранению затёков и отслойки кожи. [29]
Этот способ лечения подходит как для чистых, так и для инфицированных ран, не ограничивая способность пациента к передвижению.
Физиолечение
Как вспомогательный метод местной терапии, применяется физиолечение — ультрафиолетовое облучение раны, гипербарическая оксигенация, воздействие холодным плазменным потоком. [27]
Хирургические способы лечения
Раневой процесс может протекать таким образом, что показания к хирургической активности появляются в отдаленном периоде. [8]
Лечение раны оперативным путём заключается в хирургической обработке: ревизии, гемостазе, иссечении нежизнеспособных тканей, анатомическом (послойном) восстановлении целостности тканей путём ушивания либо сопоставления и удержания скобами.
При ранах с дефектами тканей применима первичная пластика раны с целью реконструкции сегмента и профилактики неминуемых некротических и инфекционных осложнений.
Общая терапия
Общее лечение раны выполняется с соблюдением комплексных принципов: антибиотикотерапия, анальгетики, инфузионно-трансфузионная терапия (при показаниях), введение противостолбнячной, противогангренозной сыворотки, применение анаболических препаратов, поливитаминных комплексов, лечение сопутствующей патологии организма с целью повышения его компенсаторных возможностей. [27]
Отсутствие хирургического, местного лечения раны или его несостоятельность не компенсируется общим лечением и, в том числе, мощной антибиотикотерапией. Санация (лечение) локального очага — приоритетная. Заживление раны без адекватной хирургической обработки затягивается на недели и месяцы.
Прогноз. Профилактика
Прогноз раны определяется её характером — очевидно, что рваная рана заживает длительнее и хуже, чем резаная. [11] Обширность повреждения, сопутствующая и сочетанная патология значительно повлияют на сроки заживления.
Во многом, течение раневого процесса подвластно осложнениям. Осложнения, возникшие в отдалённом периоде, могут замедлить хорошо протекавшее ранее заживление.
Опыт врача хирурга, радикальность обработки раны, способ хирургического пособия и ошибки в его выполнении, техническая и материальная база лечебного учреждения — всё это переменные факторы, объясняющие условность прогноза. [19]
Неблагоприятный прогноз несут раны с дефектами мягких тканей, с нарушением целостности сосудов, нервов, мышц и сухожилий, а также раны, сопровождающиеся переломами.
Отдельного внимания заслуживает прогноз ран инфицированных неспецифичной и специфичной флорой. [11] Первая группа характеризуется вариабельным течением раневого процесса со сроками, превышающими время заживления неинфицированных ран. Вторая группа ран может нести инвалидизирующее влияние: анаэробная агрессивная флора вынуждает хирургов выполнять ампутации и экзартикуляции с целью спасения жизни. [16]
Получение случайных ран не подвержено контролю. Это объясняет трудность их профилактики. Производственный травматизм — единственное звено, подвластное влиянию профилактики. Соблюдение техники безопасности на рабочих местах значительно снижает риск ранений. В остальном, профилактика направлена на раннее и корректное лечение раны с целью минимизации раневых осложнений. [4]
Морозов А.М. 1 Сергеев А.Н. 1 Сергеев Н.А. 1 Дубатолов Г.А. 1 Жуков С.В. 1 Городничев К.И. 1 Муравлянцева М.М. 1 Сухарева Д.Д. 1
Раневые покрытия представляют собой особую лекарственную форму. В данной статье рассматривается использование раневых покрытий, которые способны повысить эффективность лечения ран различной этиологии. В современной клинической практике существует и активно используется множество видов покрытий, оказывающих влияние на определенную стадию раневого процесса. Принцип работы раневых покрытий заключается в создании влажной абактериальной среды, которая является оптимальной для ускоренного заживления раневого дефекта. По структурно-функциональным особенностям выделяют следующие группы покрытий: пленочные раневые покрытия, гидроколлоидные покрытия, гидрофибры, альгинаты, коллагеновые раневые покрытия, гидроцеллюлярные покрытия, гидрогелевые покрытия, атравматичные раневые покрытия и сорбирующие покрытия. Каждая из групп обладает собственными характеристиками, что позволяет рационально подойти к выбору определенного типа покрытий, основываясь на их положительных и отрицательных свойствах. Применение раневых покрытий в медицине является неотъемлемой частью местной терапии ран, так как они оказывают комплекс благоприятных воздействий на раневой процесс и обеспечивают доставку лекарственных средств непосредственно в рану. Однако не существует идеальных раневых покрытий, способных обеспечить благоприятные условия на всех стадиях заживления раневого дефекта. В связи с этим необходимо внедрять новые технологии в производство покрытий, разрабатывать новые комбинации и расширять возможности их применения.

1. Анисенко О.В. Разработка раневых покрытий направленного действия // Сборник материалов международных научно-практических конференций / Под редакцией А.А. Коротких. 2018. С. 479-483.
4. Мохов Е.М., Морозов А.М., Кадыков В.А., Аскеров Э.М., Панова А.В., Пельтихина О.В. О возможности применения С - реактивного белка и прокальцитонина как актуальных и доступных маркеров воспаления в хирургии // Московский хирургический журнал. 2018. №2(60). С. 24-29.
5. Унижаева А.Ю., Мартынчик С.А. Медико-экономическая оценка затрат и качества стационарной помощи при ожоговой травме // Социальные аспекты здоровья населения. 2012. № 6 (28). С. 8.
7. Шаблин Д.В., Павленко С.Г., Евглевский А.А., Бондаренко П.П., Хуранов А.А. Современные раневые покрытия в местном лечении ран различного генеза // Фундаментальные исследования. 2013. № 12-2. С. 361-365.
9. Сошкина В.В., Астамирова Т.С. Пленочные покрытия при лечении детей с ожогами кожи // Российский вестник детской хирургии, анестезиологии и реаниматологии. 2015. № 5(2). С.56-60.
11. Легонькова О.А., Алексеев А.А. Современные раневые покрытия: их свойства и особенности // Вестник Росздравнадзора. 2015. № 6. С. 66-68.
13. Мохов E.М., Любский И.В., Сергеев А.Н., Морозов А.М., Кадыков В.А., Аскеров Э. М., Пельтихина О.В., Хорак К.И. Возможности разработки нового биологически активного шовного материала в хирургии (обзор литературы) // Вестник экспериментальной и клинической хирургии. 2019; 12(3): 193- 198. DOI: 10.18499/2070-478X-2019-12-3-193-198.
14. Clare Williams. Product Focus 3m Tegasorb Thin: A hydrocolloid dressing for chronic wounds. British Journal of Nursing. 2013. vol. 9. no. 11. DOI: 10.12968/bjon.2000.9.11.6263.
15. Парамонова О.А., Савченко Ю.П., Гайворонская Т.В., Бабичев С.А., Гербова Т.В., Уварова А.Г. Применение раневого покрытия "Аквасель Аg+ Повязка Гидрофайбер" в комплексном лечении больных флегмонами лица и шеи // Клиническая стоматология. 2017. № 3(83). С. 44-47.
16. Смирнов А.Н., Голованев М.А. Опыт применения нетканой повязки Аквасель с серебром у детей с раневой инфекцией // Российский вестник детской хирургии, анестезиологии и реаниматологии. 2012. Т. 2. № 3. С. 101-102.
20. Бежин А.И., Липатов В.А., Фрончек Э.В., Григорьян А.Ю., Наимзада М.Д.З. Применение хитозан-коллагенового комплекса с нано-частицами серебра и химотрипсином в лечении гнойно-некротических ран // Вестник новых медицинских технологий. 2019. Т. 26. № 3. С. 23-28. DOI: 10.24411/1609-2163-2019-16419.
21. Стручков А.А., Анфимов П.Е., Кулакова К.В., Бугров С.Н. Применение раневого покрытия "Биотекст" для местного лечения ожогов // Вопросы травматологии и ортопедии. 2012. №2. С.16-17.
22. Жуковский В.А., Жуковская И.И., Шкарупа Д.Д., Коровичева С.Ю., Ахметшина О.З., Карнаухов И.В. Покрытие раневое // Патент РФ № 2010130119/15. Патентообладатель Общество с ограниченной ответственностью "Линтекс" (ООО "Линтекс"). 2011.
23. Храмилин В.Н. Применение перевязочных средств на основе липидо-коллоидной технологии в местном лечении синдрома диабетической стопы // Сахарный диабет. 2010. № 3. С.129–132.
24. Везенцев А.И., Успенская М.В., Попов В.А., Игнатьева Ю.А., Евсеев Р.А., Касанов К.Н., Цыган В.Н., Бадалов В.И. Биоактивное гидрогелевое раневое покрытие // Патент РФ № 2545735. Патентообладатель Касанов Кирилл Николаевич. 2015. Бюл. № 9.
25. Jacky Edwards. Hydrogels and Their Potential Uses in Burn Wound Management // British Journal of Nursing. 2010. 9 (11). S12. P. 14-16. DOI: 10.12968/bjon.2010.19.Sup4.48419.
26. Винник Ю.С., Маркелова Н.М., Шишацкая Е.И., Кузнецов М.Н., Соловьева Н.С., Зуев А.П. К вопросу о выборе раневых покрытий в лечении гнойных ран // Фундаментальные исследования. 2015. №1(5). С. 1061-1064.
27. Muangman P., Nitimonton S., Aramwit P. Comparative Clinical Study of Bactigras and Telfa AMD for Skin Graft Donor-Site Dressing. International Journal of Molecular Sciences. 2011. vol. 12(8). P. 5031–5038. DOI:10.3390/ijms12085031.
В настоящее время в современной медицине одним из центральных вопросов остается местное лечение ран различной этиологии. В качестве решения данной проблемы осуществляются активная разработка и использование раневых покрытий.
Области применения раневых покрытий крайне разнообразны. Они используются для лечения патологии суставов, термических ожогов, лучевых поражений кожи и слизистых оболочек, гнойных ран и трофических язв.
Главными задачами раневых покрытий являются создание благоприятных и оптимальных условий для ускорения раневого процесса на всех его этапах и уменьшение сроков госпитализации пациентов [3].
Раневой процесс представляет собой последовательность нескольких стадий, в конечном счете приводящих к эпителизации и закрытию кожного дефекта. Каждый этап в заживлении ран имеет свои особенности. Фаза воспаления характеризуется образованием большого количества экссудата. В фазе пролиферации необходимы стимуляция регенерации и снижение травматизации раны, чтобы предотвратить разрушение молодой грануляционной ткани. В фазу заживления молодая грануляционная ткань трансформируется в грубую рубцовую, поэтому требуется ускорение миграции клеток и клеточного деления. Для каждой фазы необходимо выбирать определенный тип раневых покрытий, ориентируясь на их наиболее ярко выраженные свойства. Для оценки течения раневого процесса необходимы визуальная оценка раневой поверхности, а также исследование маркеров воспаления, таких как С-реактивный белок и прокальцитонин [4].
Существует ряд требований для всех раневых покрытий [5, 6]. Во-первых, раневые покрытия должны обеспечивать оптимальный микроклимат для заживления ран и способствовать ускоренной эвакуации экссудата. Во-вторых, раневые покрытия должны сдерживать инвазию микроорганизмов в рану. В-третьих, необходимо отсутствие токсического, аллергического, антигенного и раздражающего компонентов [7]. Не последнее место занимают социально-экономические требования: покрытия должны иметь умеренную стоимость, быть простыми в обращении для медицинского персонала и комфортными в ношении для самих пациентов. Важным критерием является отсутствие факта прилипания покрытий к раневым поверхностям, что существенно облегчает перевязку больного [8].
Использование раневых покрытий основано на принципе влажного заживления раны. Процессы регенерации активнее осуществляются в абактериальной влажной среде, так как она способствует большей миграции клеток эпителиальной ткани в очаг воспаления, приводит к активации эндогенных протеаз, что снижает использование аллергенных протеолитических ферментов.
Цель исследования: оценить эффективность применения современных групп раневых покрытий в лечении ран различной этиологии.
Материалы и методы исследования. Для компиляции основных фактов использовался классический метод анализа литературы. Изучался материал из актуальных публикаций, содержащих информацию о видах раневых покрытий, их составе и области применения.
Результаты исследование и их обсуждение. В современной медицине перечень раневых покрытий постоянно растет. На данный момент появилось около 300 наименований, и одним из принципов, по которым можно разделить раневые покрытия на группы, является их структурно-функциональная особенность. Выделяют следующие группы покрытий: пленочные, гидроколлоидные, гидрофибры, альгинаты, коллагеновые, гидроцеллюлярные, гидрогелевые, атравматичные и сорбирующие покрытия.
Пленочные раневые покрытия. Пленочные раневые покрытия – это один из наиболее ранних видов покрытий. Пленка представляет собой прозрачный тонкий листок гидрофобного полимера, обращенный к раневой поверхности, примером которого служит аминосахар хитозан. Покрытия из хитозана являются проницаемыми для кислорода и водяного пара, что препятствует мацерации и слущиванию эпидермиса. Они также предотвращают инвазию микроорганизмов в рану и создают оптимальный микроклимат для заживления. Главным преимуществом использования хитозана является его способность стимулировать процессы пролиферации клеточных элементов как на ранней, так и на поздней стадии развития раневого процесса и препятствовать образованию грубых рубцов.
Главными достоинствами покрытий являются их атравматичность, прозрачность и дешевизна [11]. Недостатками же пленок служат их многослойность и невозможность осуществления полной конгруэнтности с раневой поверхностью, поэтому возникает необходимость многократных перевязок. Наибольшую эффективность пленки показывают при местном лечении ожогов.
Гидроколлоидные покрытия. По своему строению гидроколлоидные покрытия представляют собой полиуретановую губку или пленку, покрытую гидрофильным коллоидом: желатином, целлюлозой или пектином, диспергированными в адгезивной массе. Принцип работы такого вида покрытия заключается в контакте коллоида с раневой поверхностью и его последующей трансформации в гель под действием выделяющегося раневого экссудата. Таким способом с раневым покрытием удаляется избыток экссудата с сохранением влажной среды в ране.
Еще одним примером служит препарат Tegasorb, состоящий из желатиновых, пектиновых и полисахаридных гранул, распределенных в полиизобутиленовой адгезивной массе. Препарат активно используется в лечении пролежней и трофических язв нижних конечностей [14]. Кроме этого, гидроколлоидные покрытия нашли свое применение в терапии диабетических язв и ожогов первой и второй степени.
Гидроколлоиды хорошо фиксируются на коже, полностью моделируя форму конечности. Из-за невысокой сорбирующей способности такие покрытия наиболее эффективны на ранах с умеренно выраженной экссудацией. Недостатком гидроколлоидных покрытий является отсутствие прозрачности, поэтому возникает необходимость постоянного мониторинга раневых поверхностей. Кроме этого, при применении гидроколлоидов высок риск развития мацерации тканей.
Аморфная паста служит одной из форм выпуска гидроколлоидных покрытий и является удобной для заполнения глубоких язв. Она наносится под пленочные или сорбирующие покрытия.
Гидрофибры. Представляют собой гидроколлоидные волокна, которые при контакте с раной поглощают большое количество экссудата, превышающего молекулярную массу вещества в 20 раз, поэтому применяются для ран со средней и сильной степенью экссудации.
Единственным представителем группы является Aquacel. Он имеет структуру мягкой стерильной повязки, состоящей из волокон натриевой соли карбоксиметилцеллюлозы и ионов серебра. Сухие волокна при контакте с раневым отделяемым быстро превращаются в гель, который поддерживает влажную среду в ране и способствует образованию грануляционной ткани [15]. Постоянно поступающие в рану ионы серебра повышают бактерицидные свойства препарата к широкому спектру микроорганизмов, в том числе и по отношению к метициллин-устойчивым штаммам золотистого стафилококка и ванкомицин-устойчивым штаммам энтерококка, снижая риск развития вторичного инфицирования раны [16]. Aquacel применяют при лечении ожогов, трофических язв, пролежней и ран с высоким риском инфицирования.
Альгинатные раневые покрытия. Данная группа относится к биоразлагающимся раневым покрытиям, получаемым из морских водорослей. В качестве основы они содержат кальциевую соль альгиновой кислоты – альгинат кальция. При взаимодействии с ионизированным натрием, который находится в составе раневого экссудата, происходит ионный обмен кальция на натрий. В результате образуется альгинат натрия, который является растворимым соединением и, связывая воду, превращается в гель. Данный гель формирует оптимальную среду для пролиферации и миграции клеток, обусловливающих заживление раневого дефекта.
Альгинатные покрытия обладают дренирующей и адсорбционной функцией, так как способны отводить и впитывать раневой экссудат. Следует отметить гемостатические свойства альгинатов, обусловленные содержащимся в них фактором свертывания крови – ионов кальция, что позволяет использовать их при остановке легких кровотечений. Альгинаты атравматичны, так как образующийся гель легко снимается с поврежденной поверхности, и благодаря осаждению микробов в геле повышаются их бактерицидные свойства.
Одним из современных препаратов является альгинатная повязка Fibroclean Ag, которая содержит в своем составе ионы серебра и целлюлозогликолевую гиалуроновую кислоту, обеспечивающую высокую впитывающую способность [17]. Бактерицидное действие ионов серебра направлено преимущественно на Streptococcus viridans и Candida albicans, а также на все антибиотикорезистентные штаммы [18]. Альгинатные поверхности используются для лечения ран с сильным выделением экссудата, их высокая впитывающая способность позволяет реже производить перевязку пациента, что значительно снижает риск травматизации тканей и имеет экономические преимущества.
Коллагеновые покрытия активно используются при травмах кожных покровов и слизистых оболочек, трофических язвах, длительно незаживающих ранах, пролежнях [22].
Гидроцеллюлярные покрытия. Их основным компонентом является губка из синтетического материала, чаще это силикон или поролон. По строению губка представляет собой систему разветвленных пор, что способствует лучшей адсорбции экссудата. Данный вид покрытий активно применяется для ран со средней или сильной степенью экссудации, также они могут использоваться как вторичные раневые покрытия для альгинатов. Примером может служить препарат Cellosorb, созданный с помощью особой липидно-коллоидной технологии и содержащий ионы серебра, которые обеспечивают пролонгированный антибактериальный эффект [23]. Данные покрытия показаны для лечения ран со средней и сильной экссудацией.
Гидрогелевые покрытия. Главное свойство гидрогелевых покрытий заключается в их высокой степени гидратации, что способствует своевременному введению раны во влажную среду для обеспечения бактерицидного действия и создания оптимального микроклимата для ее заживления [24]. По структуре они представляют собой полимеры с гидрофильными центрами для лучшей адсорбции экссудата. Гидрогелевые покрытия способствуют аутолизу некротических тканей, значительно облегчая процесс их удаления, и защищают образовавшуюся грануляционную ткань. В медицине они используются при лечении огнестрельных ран, длительно незаживающих ран после термического, химического и лучевого поражения. Примерами являются покрытия Hydrosorb и Hydrosorb Comfort, на 60% состоящие из воды. Ввиду способности Hydrosorb оказывать успокаивающее и охлаждающее действие на рану данный препарат активно применяется для местной терапии поверхностных ожогов [25].
Достоинством покрытий является высокая пластичность, благодаря этому они хорошо моделируются на ране со сложным рельефом. Они не обладают адгезией и не приводят к травматизации раневой поверхностей. Однако из-за их низкой адсорбционной способности используются только при слабой экссудации. Также ввиду своей дороговизны гидрогелевые покрытия почти не применяются, так как могут быть заменены более дешевыми и эффективными аналогами.
Атравматичные раневые покрытия представляют собой сетчатые или перфорированные пленки. Сетчатые атравматичные покрытия состоят из хлопковой марли, пропитанной гидрофобными составами (парафином, ланолином, вазелином). Такая структура обеспечивает хорошую проницаемость для воздуха и раневого экссудата. Кроме того, такие повязки могут содержать антибиотики для увеличения бактерицидного эффекта. Атравматичные покрытия имеют главное преимущество – они позволяют обеспечить безболезненную смену повязок, без повреждения грануляций и эпителия, также они могут оставаться на ране до ее полного заживления при отсутствии признаков инфекции.
Сорбирующие раневые покрытия. Их характерной особенностью является способность поглощать выделяющийся из раны экссудат, количество которого может быть значительным. Они состоят из трех слоев: первый – тонкая пленка из неадгезивного материала, второй – сорбирующая поверхность и третий – водонепроницаемое покрытие. Классическим сорбентом в медицине является целлюлоза и ее производные [26]. Примером может служить покрытие Telfa, состоящее из впитывающих хлопковых волокон. Данную повязку активно используют при лечении в трансплантологии [27]. Наиболее важное качество сорбирующих повязок заключается в том, что отсутствует необходимость ежедневных перевязок. После нанесения покрытия диагностику состояния раны можно проводить спустя 5–7 суток.
Также для обеспечения лучшего заживления ран сорбирующие раневые покрытия применяются в сочетании с другими видами, такими как альгинаты, гидрофибры и гидроколлоидные поверхности.
Заключение. На данный момент активно используется многообразие раневых покрытий, которые позволяют осуществлять доставку лекарственных средств непосредственно в зону поражения. Применение раневых покрытий является эффективным в аспекте местной терапии ран, так как они оказывают комплекс благоприятных воздействий: изолируют рану от внешней среды, снижают риск развития инфицирования, способствуют улучшению процессов репаративной регенерации, препятствуют образованию келоидных рубцов и улучшают обменные процессы и трофику тканей.
Однако интерес в сфере лечения не снижается, так как до сих пор не был создан вид покрытий, который отвечал бы всем предъявляемым требованиям. Разработка нового материала для создания раневых покрытий, подробное изучение фаз раневого процесса, использование достижений фармации позволяют добиться наибольших успехов при лечении ран различной этиологии.
Читайте также:

