Синдром гийена барре реферат
Обновлено: 02.07.2024
Приобретенные невропатии по происхождению чаще всего воспалительные, но их также могут вызвать различные токсины и неопределенные процессы.
Воспалительные поражения периферической нервной системы включают две группы диффузных заболеваний: острые полиневропатии, также обозначенные термином полирадикулоневрит, и намного менее частые хронические прогрессирующие полиневропатии. Локальные воспалительные невропатии относительно распространены, хотя их механизмы малоизвестны.
Синдром Гийена-Барре (СГБ, острая воспалительная невропатия, острый полирадикулоневрит) — острое воспалительное заболевание периферических нервов, характеризующееся клинически прогрессирующей слабостью, которая обычно появляется спустя несколько дней после вирусной болезни или иммунизации. Суть взаимосвязей дисфункции нерва и инфекции до конца не понята, но иммунологический механизм играет важную роль. Наиболее частая форма характеризуется патоморфологически острой демиелинизацией, но острая моторная аксональная невропатия (ОМАН) и острая моторная и сенсорная аксональная невропатия (ОМСАН) вследствие острого аксонального дегенеративного процесса стали выявляться все чаще с отчеливым летним пиком заболеваемости, особенно в Китае, Японии, Мексике, Корее и Индии, но также и в других странах (van der Meche et al., 1991; Thomas, 1992; Feasby et al., 1993).
Выявление клинически сходных случаев СГБ одного с первично демиелинизирующими поражениями, и другого с тяжелым и, вероятно, первичным аксональным повреждением (Feasby et al., 1986; McKhann et al., 1993), указывает на вероятность двух различных механизмов ('Ihomas, 1992; Feasby et al., 1993).
Данное проявление связано с наличием иммуноглобулинов и комплемента на наружной поверхности связанной шванновской клетки. В меньшинстве случаев встречается демиелинизация, связанная с макрофагами, несмотря на малочисленность лимфоцитов. Такие случаи обусловлены скорее действием антител, чем Т-лимфоцитарным аутоиммунным процессом (Homavar et al., 1991). Прерыв аксонов с последующей валлеровской дегенерацией присутствует только в самых тяжелых случаях с интенсивным воспалением. Пролиферация шванновских клеток встречается в дальнейшем течении болезни, вероятно как первый шаг в процессе ремиелинизации.
При аксональных формах, ОМАН и ОМСАН, преобладает дегенерация валлеровского типа с небольшими признаками демиелинизации или лимфоцитарной инфильтрации. При ОМАН сенсорные аксоны в значительной степени сохранны. Помимо аксональных дегенеративных изменений, в моторных нейронах виден хроматолиз (Griffin et al., 1995, Visser et al., 1995).
б) Патогенез. Наблюдаемые при острой воспалительной демиелинизирующей форме синдрома Гийена-Барре (СГБ) (ОВДП) патологические изменения сходны с проявлениями острого аллергического неврита, вызываемого у экспериментальных животных иммунизацией гомогенизатами периферических нервов или чужеродным миелином, так же как и пассивным переносом Т-клеток, активированных в отношении белков или пептидов миелина. У людей иммунологические механизмы все еще неясны, и вклад гуморальных и клеточных факторов все еще является предметом дискуссий, однако роль гуморальных факторов представляется безусловно важной. Внутриневральная инъекция сыворотки от пациентов с синдромом Гийена-Барре (СГБ) вызывает демиелинизацию у животных (Feasby et al., 1982).
Антитела к миелину были продемонстрированы у пациентов с СГД за счет связывания компонента комплемента С1 и особенно высоки в начале болезни (Koski et al., 1986). Некоторые антитела были найдены в миелиновых оболочках и на клетках Шванна, но в случаях ОВДП не был идентифицирован ни один свободный антиген.
Активированные компоненты комплемента СЗа и С5а были найдены в ЦСЖ (Hartung et al., 1987). Наиболее привлекательная гипотеза состоит в том, что патогенный механизм способен повредить шванновскую клетку с высвобождением ее антигенов, запускающих каскад событий с последующей сегментарной демиелинизацией, в свою очередь ответственной за множественные блоки проведения (Sumner, 1981), которые являются электрофизиологической основой клинических проявлений СГБ.
Молекулярная мимикрия, вовлекающая антигены, распределенные между липополи- или олигосахаридами клеточной оболочки/капсулы микроорганизмов предшествующих инфекций и похожие мишени на аксонах, является ключевым элементом при аксональных формах СГБ. Campylobacter jejuni чаще всего описывается как причинный фактор ОМАН и ОМСАН. Несколько серотипов С. jejuni связаны с СГБ, особенно тип Пеннера HS/019. Высокие титры антител против ганглиозидов GM1 и GD1b выявляются в значительной доле случаев, особенно связанных с кампилобакпгерной инфекцией (Gregson et al., 1993; Vriesendorp et al., 1993). Анти-GQlb антитела имеются более, чем в 85% случаев синдрома Миллера Фишера с атаксией, арефлексией и офтальмоплегией (см. ниже) (Yuki et al., 1993). Экстраокулярные нервы, перехваты Ранвье соматических нервов и клетки ганглиев дорсальных корешков связывают анти-GQ1b антитела, возможно, объясняя специфичность клинических проявлений. Эти антитела обнаруживаются и при ОВДП с офтальмоплегией.
Было продемонстрировано, что антитела к GQ1b и GM1 блокируют нервно-мышечную передачу in vitro. Анти-GM1 антитела вмешиваются в функционирование ионных каналов перехватов (Takigawa et al., 1995). С помощью этих данных можно объяснить быстрые изменения мышечной силы, иногда заметные на ранней стадии заболевания и в ответ на терапию иммуноглобулином.
в) Эпидемиология. Синдром Гийена-Барре (СГБ) обычно встречается у детей старше 3-4 лет, но описаны случаи раннего и даже неонатального дебюта (А1-Qudah et al., 1988). Общая частота синдрома Гийена-Барре (СГБ) —1,9 случаев на 100000 населения (Larsen et al., 1985). Уровень заболеваемости у австралийских детей в возрасте до 15 лет был приблизительно 0,8 на 100000 в год (Morris et al., 2003). Заболевание обычно развивается через 2-4 недели после инфекции или иммунизации ((ones, 1996). Среди идентифицированных вирусных агентов часто указывались вирусы группы герпеса (цитомегаловирус, CMV; вирус Эпштейна-Барр, EBV) (Dowling и Cook, 1981), и значительное внимание уделено иммунизации против бешенства (Hemachudha et al., 1988) и против гриппа (Poser и Behan, 1982).
Другие вирусные агенты, такие, как возбудитель гепатита С (MacLeod, 1987; De Klippel et al., 1993) и вирус ветряной оспы (Sanders et al., 1987) выявляются менее часто, и четкая связь определена только для CMV и EBV (Jones, 1996). Полиовирусная инфекция не является причиной (Rantala et al., 1994).
Инфекция С. jejuni, часто с диареей, является наиболее распространенной инфекцией, предшествующей СГБ и, даже более того, варианта Миллера Фишера (Vriesendorp et al., 1993, Jones 1996). Из 100 пациентов, изученных Winer et al. (1988), у 38% были симптомы со стороны дыхательной системы и у 17% симптомы со стороны желудочно-кишечного тракта. Серологическое подтверждение С. jejuni (14%) и CMV инфекции (11%) встречалось значительно чаще у больных, чем в контрольных группах.
г) Клинические симптомы. В типичном случае СГБ начинается внезапно со слабости, обычно поражающей нижние конечности. Затем следуют параличи с восходящим течением. Паралич генерализован в половине случаев, преобладает в дистальных отделах конечностей в 30%, и симметричен, хотя незначительные различия весьма распространены, и сообщалось о грубой асимметрии у редких пациентов (Jones, 1996). В 20% случаев преобладает проксимальное поражение. Лицевой нерв поражается в 50% случаев, часто с двух сторон (Hung et al., 1994). Офтальмоплегия встречается в 3% случаев (Dehaene et al., 1986). Неврит зрительного нерва нетипичен (Behan et al., 1976). Отек соска зрительного нерва также может быть связан с повышенным внутричерепным давлением (Morley и Reynolds, 1966), но изменения сознания описываются нередко, и симптомы со стороны ЦНС были найдены у 5 из 24 пациентов Bradshaw и Jones (1992), объективные признаки поражения ЦНС достаточно нетипичны (Willis и Van den Bergh, 1988) и, судя по нашему опыту, явно редки. Сенсорные симптомы присутствуют приблизительно в половине случаев.
Боль часто заметна в начале, в то время как парестезии и гипестезии присутствуют только у немногих детей старшего возраста.
Глубокие сухожильные рефлексы утрачены рано в 83% случаев, даже в непарализованных областях (Winer et al., 1988). Потеря глубокой чувствительности при дальнейшем течении часто обнаруживается при осмотре.
Паралич дыхательных мышц является обычным осложнением СГБ, часто с необходимостью респираторной поддержки (Ropper, 1992). Легкая дыхательная недостаточность развивается еще чаще, приводя к гиперкарбии. В сиднейском исследовании 71 случая детского возраста с 1988 до 2004 гг. признаки респираторного поражения были в 30% случаев (21 пациент), но только в пяти случаях потребовалась вентиляция. Вегетативная патология присутствует у многих пациентов и способна вызывать гипотензию, гипертензию, аритмию сердца и даже остановку сердца (Winer et al., 1988). Распространенные в детском возрасте вегетативные нарушения, по нашему опыту, редко бывают серьезными, а лечение необходимо лишь в отдельных случаях. Задержка или недержание мочи встречаются в 10% случаев. Достаточно нередка атаксия, по всей вероятности, сенсорного происхождения, и может преобладать в клинической картине. Подошвенные реакции обычно флексорные, но может быть замечен рефлекс Бабин-ского (|ones, 1996).
ЦСЖ чаще всего нормальная в течение первых дней болезни. Повышение белка в ЦСЖ появляется между 2 и 15 днями и достигает пика на 4-5 неделе после клинического начала. Концентрация общего белка в ЦСЖ и процентная доля IgG представляется особенно зависимой от степени повреждения гематоэнцефалического барьера, которая в свою очередь коррелирует с клиническим течением. Олигоклональные IgG часто присутствуют в ЦСЖ, но поступают в основном из сыворотки. Связывание олигоклональных IgG при СГБ является преходящим и коррелирует с развитием повреждения гематоэнцефалического барьера, наличием повреждения черепных нервов и тяжестью болезни (Segurado et al., 1986). В казуистических случаях белок ЦСЖ может остаться нормальным (Sullivan и Reeves, 1977). В отличие от белка, содержимое клеток ЦСЖ в пределах нормы с классической белково-клеточной диссоциацией менее чем 10 клеток/мм 3 . Наличие более 50 мононуклеарных лейкоцитов/мм 3 должно вызвать сомнение в диагнозе (Asbury и Cornblath, 1990), но меньшее число клеток приемлемо и не имеет прогностического значения.
д) Электрофизиология. Электрофизиологическое исследование при ОВДП (Cornblath et al, 1988; Ropper et al., 1990) показывает заметное снижение моторных скоростей проведения, наряду с более длительной задержкой реакции в дистальных отделах, совпадающими с демиелинизацией приблизительно у 50% пациентов. Некоторое количество аномальных моторных или сенсорных скоростей проведения присутствуют в 90% случаев, но, из-за очагового распределения поражений вероятность обнаружения расстройств увеличивается с числом исследованных нервов, а степень поражения может меняться в зависимости от исследуемого нерва. В 20% случаев нарушения находят только в одном или двух, но не всех исследованных нервах. Амплитуда сенсорных потенциалов действия и моторного потенциала действия уменьшена. Блок проведения мог быть выявлен, по крайней мере, в одном нерве в 74% случаев, описанных Bradshaw и Jones (1992). С помощью измерения латентности F-волны можно диагностировать патологию проксимальных нервов или корешков, не выявляемую при обычном обследовании.
При ОМАН и ОМСАН моторные скорости проведения нормальны или почти нормальны, но амплитуда суммарного потенциала действия мышцы уменьшается или не выявляется. При обеих формах СГБ амплитуда среднего суммарного потенциала действия мышцы в значительной степени определяет прогноз (Cornblath et al., 1988). Признаки денервации и фибрилляции указывают на значительное поражение аксонов и могут быть плохими прогностическими признаками у взрослых, но менее серьезными у детей (Bradshaw и Jones 1992; Triggs et al., 1992).
Исследования вызванных потенциалов показали аномалии как слуховых вызванных потенциалов ствола, так и соматосенсорных вызванных потенциалов (Ropper и Chiappa 1986).
ж) Диагноз. Синдром Гийена-Барре (СГБ) — основная причина острого вялого паралича. Диагноз СГБ не вызывает проблем в типичных случаях. Диагностические критерии (Asbury и Cornblath, 1990) включают симметричную слабость и арефлексию, наличие легких сенсорных симптомов и знаков, прогрессирование симптомов с продолжительностью не более четырех недель после начала, отсутствие повышения температуры, дисфункции сфинктеров и признаков поражения ЦНС. Последние два критерия, возможно, не относятся ко всем случаям детского возраста. Типичные результаты исследования ЦСЖ и электрофизиологические данные подтверждают клинический диагноз.
У детей распространены состояния, способные имитировать СГБ, но только немногие вызывают серьезные проблемы. В обязательном порядке исключают состояния, требующие неотложного специфического лечения, особенно компрессия спинного мозга. Поперечный миелит дифференцируют при выявлении сегментарного сенсорного поражения и поражения сфинктеров. Редкие случаи нарушения обмена веществ, такие как синдром Ли (Coker, 1993), могут напоминать СГБ. Полиомиелит в настоящее время встречается исключительно редко, но некоторые токсические невропатии могут быть перепутаны с острым полиневритом. У подростков учитывается возможность невропатии вследствие злоупотребления летучими растворителями. Дифтерийная невропатия очень похожа на СГБ, но редка. Ботулизм и дифтерия могут быть исключены при поражении внутренних глазных мышц, которое никогда не присутствует при СГБ. Клещевой паралич может давать сходную клиническую картину, но обнаружение паралича зрачка или наполненного кровью клеща позволяет провести дифференцировку. Результаты клинического нейрофизиологического исследования также неоднородны (Grattan-Smith et al., 1997).
з) Течение синдрома Гийена-Барре (СГБ) у детей. Начальная фаза постепенно нарастающего поражения продолжается 10-30 дней. Продолжительность более четырех недель исключает диагноз СГБ и предполагает диагноз подострого СГБ (Hughes et al., 1992; Rodriguez-Casero et al., 2005) или хронической воспалительной полиневропатии. При некоторых формах (Ropper, 1986а) паралич прогрессирует очень быстро с полной тетраплегией в течение 2-5 дней. У таких пациентов часты тяжелые дыхательные нарушения, и вероятность осложнений выше, чем при среднетяжелой форме.
Далее следует фаза плато, по данным одних исследователей (Billard et al., 1979) длинная, но не подтвержденная в других работах (Billard et al., 1979), она связана с относительно неблагоприятным прогнозом и персистированием двигательных расстройств.
По имеющимся данным смерть наступает в 2-3% педиатрических случаев, хотя в некоторых взрослых выборках (Winer et al., 1988) летальность достигала 15%, главным образом у взрослых пациентов старшего возраста. Смертельные случаи не встречались в 71 случае личных наблюдений (Robert Ouvrier) с 1988 г.
Восстановление обычно полное. Моторные осложнения, часто легкие, встречаются у 5-25% пациентов. Повторы и поздние рецидивы встречаются приблизительно у 3% пациентов (Wijdicks и Ropper, 1990). Поздние рецидивы через несколько лет после первого эпизода, вероятно, имеют отличный механизм от тех, которые наблюдаются после прекращения плазмофереза или кортикостероидной терапии, и обычно только парциальны (Ropper et al., 1988).
Факторы, указывающие на неблагоприятный прогноз, включают быстрое развитие паралича, возможно большую продолжительность фазы плато, выраженный дистальный дефицит, и наличие потенциалов фибрилляции и низкой амплитуды усредненных потенциалов действия двигательных единиц (Ropper, 1986а). Преобладающее представление, что болезнь имеет лучший прогноз у детей, чем у взрослых, было подвергнуто сомнению Kleyweg et al., (1989) и Jansen et al., (1993), которые не нашли различия по тяжести между 18 детьми и 50 взрослыми и поэтому рекомендовали одинаковое лечение в обеих группах. Однако, большое совместное исследование (Korinthenberg и Monting, 1996) подтвердило меньшую тяжесть болезни у детей. Rantala et al. (1995) нашли три главных фактора риска для более тяжелых случаев: начало симптомов в течение восьми дней после предшествующей инфекции, поражение черепных нервов, и уровень белка в ЦСЖ >800 мг/л в течение первой недели болезни.
и) Лечение синдрома Гийена-Барре (СГБ) у ребенка. Симптоматическая терапия — основная часть лечения СГБ. Тщательный мониторинг витальных функций, профилактика аспирационной пневмонии и зондовое питание, а при необходимости респираторная поддержка значительно уменьшили смертность.
Как показано в контролируемых исследованиях, лечение кортикостероидами не дает благоприятных эффектов и даже продлевает госпитализацию (Hughes, 1991; Hughes et al., 2007). Эффективность плазмафереза безусловна у взрослых (French Cooperative Group, 1987; McKhann et al., 1988), если он выполнен в первую неделю болезни и повторен в течение 7-14 дней. Данный метод лечения сократил продолжительность госпитализации, позволил избежать дыхательной недостаточности и ограничил распространение параличей. Очевидно, подобное лечение показано в тяжелых случаях рано проявляющегося быстрого распространения. Однако пока не установлены достоверно точные показания. Плазмаферез трудно использовать у детей массой менее 15 кг, хотя Khatri et al. (1990) и Jansen et al. (1993) сообщили о благоприятных результатах с использованием адаптированного метода. Epstein и Sladky (1990) нашли, что плазмаферез уменьшает заболеваемость СГБ в детстве, сокращая интервал до восстановления самостоятельной ходьбы. О результатах, таких же, как у взрослых пациентов, сообщено Jansen et al. (1993). Новый путь для терапии открыла демонстрация эффективности внутривенного введения высоких доз (2 г/кг) гаммаглобулинов (van der Meche и Schmitz, 1992;, Hartung et al., 1995).
Дозы 0,4 г/кг/день в течение первых пяти дней болезни обеспечивают результаты, подобные таковым при плазмоферезе (van der Meche и Schmitz, 1992). Применение всей дозы в течение двух дней может быть более эффективно, чем обычный дробный прием (Kanra et al., 1997), однако приводит к большему проценту обусловленных лечением рецидивов (Korinthenberg et al., 2005). Этот метод широко распространился как замена плазмофереза у детей. Некоторые публикации посвящены вопросу эффективности иммуноглобулиновой терапии. Castro и Ropper (1993) сообщили об ухудшении у 7 из 15 взрослых, и отмечены рецидивы после первоначально хороших результатов (Irani et al., 1993). Тем не менее, лечение иммуноглобулинами представляется эффективным и безопасным (van der Meche и Schmitz, 1992; Jones, 1996, Korinthenberg и Monting 1996; Shahar et al., 1997). Точные показания пока не определены; случаи с быстрым распространением или угрожающей дыхательной недостаточностью — очевидные кандидаты, но пока неясно, когда показано лечение ранних случаев. По мнению одного из авторов (RO), допустимо лечение пациентов с быстрой динамикой или же с проявлениями, выходящими за рамки амбулаторного лечения.
Rantala et al. (1995) предложили раннее назначение во время диагностики при наличии факторов риска. Недавнее исследование у взрослых, сравнивающее внутривенное введение иммуноглобулина (ВВИГ) в сочетании с внутривенным введением метилпреднизолоном (500 мг/день) с одним ВВИГ, не показало надежного статистического подтверждения преимуществ комбинации; исследовательская группа теперь рутинно использует комбинированную терапию (Van Koningsveld et al., 2004).
Что такое синдром Гийена — Барре? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуйков А. В., невролога со стажем в 21 год.
Над статьей доктора Жуйков А. В. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Синдром Гийена-Барре (ГБС) — острое аутоиммунное заболевание, которое охватывает группу острых нарушений периферической нервной системы. Характеризуется мышечной слабостью, а также болью и ползанием мурашек в начале болезни из-за поражения чувствительных волокон. Каждый вариант нарушений характеризуется особенностями патофизиологии и клинического распределения слабости в конечностях и черепных нервах.
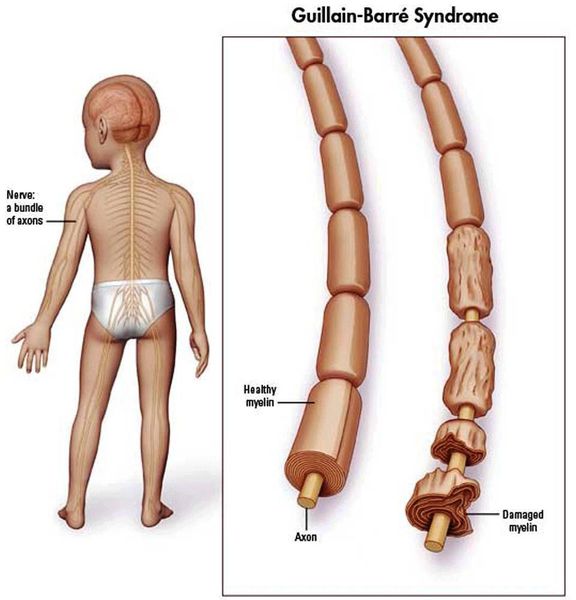
У 70% пациентов с ГБС наблюдалось предшествующее инфекционное заболевание перед появлением неврологических симптомов.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Гийена — Барре
Симптомы ОРВИ или расстройства желудочно-кишечного тракта отмечаются у 2/3 пациентов. Первыми симптомами ГБС являются парестезии пальцев конечностей, за которыми следует прогрессирующая слабость мышц нижних конечностей и нарушения походки. Болезнь прогрессирует в течение нескольких часов или дней, возникает слабость верхних конечностей и развиваются паралич черепных нервов. Параличи обычно симметричны и носят, конечно, периферический характер. У половины пациентов боль может быть первоначальной жалобой, что затрудняет диагноз. Атаксия и боль чаще встречаются у детей, чем у взрослых. Задержка мочи наблюдается у 10%-15% больных. Поражение вегетативных нервов проявляются головокружениями, гипертонией, чрезмерным потоотделением и тахикардией.
При объективном обследовании выявляется восходящая мышечная слабость, а также арефлексия. Сухожильные рефлексы нижних конечностей отсутствуют, но рефлексы верхней конечности могут вызываться. Мышечная слабость может задействовать и респираторные мышцы. Поражение черепных нервов отмечается в 35-50%, вегетативная нестабильность в 26%-50%, атаксия — в 23%, дизестезия — в 20% случаев. [1]
Наиболее распространенными признаками вегетативной дисфункции являются синусовая тахикардия или брадикардия и артериальная гипертония. У пациентов с тяжелой вегетативной дисфункцией наблюдаются изменения периферического вазомоторного тонуса с гипотензией и лабильностью артериального давления.
Нечастые варианты клинического течения болезни включают лихорадку в начале неврологических симптомов, тяжелую сенсорную недостаточность с болью (миалгии и артралгии, менингизм, корешковая боль), дисфункции сфинктеров.
Возможность ГБС должна рассматриваться у любого пациента с быстрым развитием острой нервно-мышечной слабости. На ранней стадии ГБС следует отличать от других заболеваний с прогрессирующей симметричной мышечной слабостью, включая поперечный миелит и миелопатию, острую токсическую или дифтеритическую полиневропатию, порфирию, миастению и нарушения электролитного обмена (например, гипокалиемия).
Патогенез синдрома Гийена — Барре
Нейрофизиологические процессы, лежащие в основе ГБС, подразделяются на несколько подтипов. Наиболее распространенные подтипы включают:
- острую воспалительную демиелинизирующую полирадикулопатию;
- острую двигательную аксональную невропатию;
- острую моторную и сенсорную аксональную нейропатию;
- синдром Миллера-Фишера, как вариант ГБС, характеризуется триадой признаков: офтальмоплегия, атаксия и арефлексия.
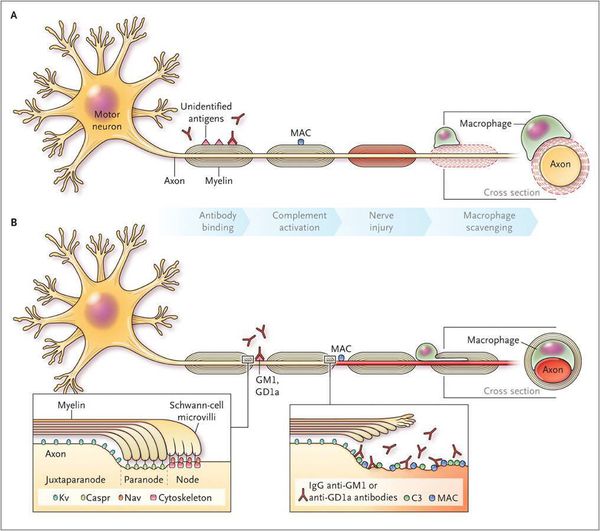
Считается, что ГБС развивается вследствие выработки антител против белка инфекционного агента, которые перекрестно реагируют с ганглиозидами нервных волокон человека. Аутоантитела связываются с миелиновыми антигенами и активируют комплемент, с формированием мембранно-атакующего комплекса на внешней поверхности клеток Шванна. Повреждение оболочек нервных стволов приводит к нарушениям проводимости и мышечной слабости (на поздней стадии может происходить и аксональная дегенерация). Демиелинизирующее поражение наблюдается по всей длине периферического нерва, включая нервные корешки.
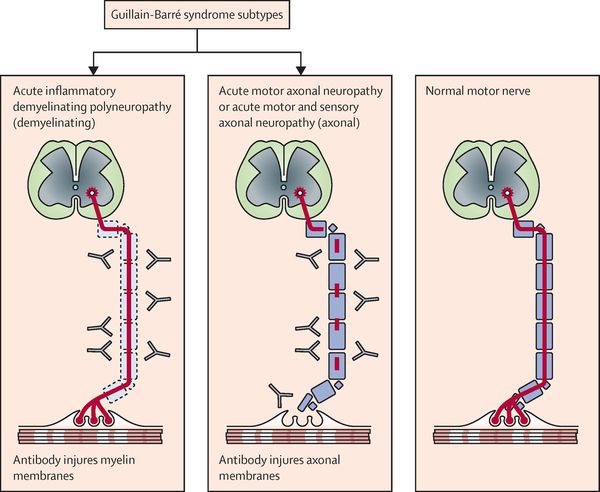
Поражаются все типы нервов, в том числе вегетативные, моторные и сенсорные волокна. Вовлечение двигательных нервов происходит значительно чаще, чем сенсорных.
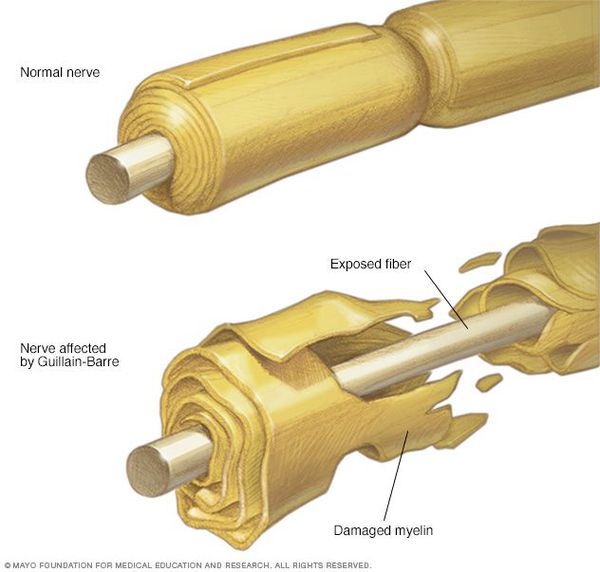
Осложнения синдрома Гийена — Барре
Пациенты с ГБС подвержены риску опасных для жизни респираторных осложнений и вегетативных нарушений.
Показания для перевода в отделение интенсивной терапии включают:
- быстрое прогрессирование моторной слабости с поражением респираторных мышц;
- вентиляционную дыхательную недостаточность;
- пневмонию;
- бульбарные расстройства;
- тяжелую вегетативную недостаточность.
Осложнения проводимого лечения, требующие интенсивной терапии, включают перегрузку жидкостью, анафилаксию на введение внутривенного иммуноглобулина или гемодинамические нарушения при проведении плазмафереза.
У 15%-25% детей с ГБС развивается декомпенсированная дыхательная недостаточность, которая требует механической вентиляции легких. [2] Респираторные нарушения чаще встречается у детей с быстрым прогрессированием заболевания, слабостью верхних конечностей, вегетативной дисфункцией и поражениями черепных нервов. Интубация трахеи может потребоваться у больных для защиты дыхательных путей, проведения механической вентиляции легких. При ГБС быстрое прогрессирование, двусторонний паралич лицевого нерва и вегетативная дисфункция предопределяют повышенную вероятность интубации. Необходимо планирование ранней интубации для минимизации риска осложнений и необходимости проведения экстренной интубации.
Вегетативная дисфункция повышает риск эндотрахеальной интубации. С другой стороны, дисавтономия может увеличить риск гемодинамических реакций на препараты, используемые для индукции анестезии во время интубации.
Признаки, указывающие на необходимость механической вентиляции легких: [4]
- вентиляционная дыхательная недостаточность;
- увеличение потребности в кислороде для поддержания SpO2 выше 92%;
- признаки альвеолярной гиповентиляции (PCO2 выше 50 мм. рт. ст.);
- быстрое снижение жизненной емкости на 50% по сравнению с исходным уровнем;
- невозможность кашля
Вегетативная дисфункция является основным фактором смертности при ГБС. Фатальный сердечно-сосудистый коллапс из-за вегетативной дисфункции наблюдается у 2%-10% тяжелобольных пациентов. [3] Мониторинг частоты сердечных сокращений, артериального давления и электрокардиограммы следует продолжать до тех пор, пока пациенты нуждаются в респираторной поддержке. Чрескожная кардиостимуляция может потребоваться при выраженной брадикардии. Гипотония корректируется восполнением объема циркулирующей крови (ОЦК), и, если пациент невосприимчив к восполнению ОЦК, применяются α-агонисты, такие как норадреналин, мезатон, адреналин.
При нестабильной гемодинамике непрерывная регистрация артериального и центрального венозного давления должна проводиться для контроля объема инфузионной терапии.
Артериальная гипертензия может возникать, но это осложнение не требует специального лечения, если оно не осложняется отеком легких, энцефалопатией или субарахноидальным кровоизлиянием.
Диагностика синдрома Гийена — Барре
Инструментальная диагностика
Люмбальная пункция
При люмбальной пункции результаты СМЖ обычно показывают повышенный уровень белка (> 45 мг/дл), без плеоцитоза ( [3]
Игольчатая электромиография характеризуется наличием признаков текущего денервационно-реиннервационного процесса при полинейропатии. Исследуют дистальные мышцы верхних и нижних конечностей (например, переднюю большеберцовую мышцу, общий разгибатель пальцев), а при необходимости и проксимальные мышцы (например, четырёхглавую мышцу бедра).
ЭНМГ-исследование у больных с ГБС зависит от клинических проявлений:
- при дистальных парезах исследуются длинные нервы на руках и ногах: не менее четырех двигательных и четырех чувствительных (двигательные и чувствительные порции срединного и локтевого нервов; малоберцовый, большеберцовый, поверхностный малоберцовый и икроножный нервы с одной стороны).
Оценка основных ЭНМГ- параметров:
Первые признаки денервационного процесса появляются через две-три недели после начала заболевания, признаки реиннервационного процесса — через месяц.
Лечение синдрома Гийена — Барре
Общее поддерживающее лечение и уход
Пациенты, требующие интенсивной терапии, требуют тщательного общего ухода. Запор наблюдается более чем в 50% случаев пациентов с ГБС в результате динамической непроходимости кишечника.
При боли применяют парацетамол. Катадолон и трамадол применяют при выраженном болевом синдроме. При нейропатической боли эффективны карбамазепин и габапентин.
В лечении ГБС предпринимаются различные виды иммуномодулирующей терапии. [1] [2]
Внутривенный иммуноглобулин назначают в виде ежедневной инфузии (в дозе 0,4 гр/кг/день) в течение 5 дней в первые 2 недели болезни. Второй курс иммуноглобулина может потребоваться 5%-10% пациентов, при отрицательной динамике после первоначального улучшения. Механизм действия внутривенного иммуноглобулина, вероятно, многофакторный и, как полагают, включает модуляцию активации комплемента, нейтрализацию идиотипических антител, подавление воспалительных медиаторов (цитокины, хемокины).
Побочные эффекты иммуноглобулина включают головную боль, миалгию и артралгию, гриппоподобные симптомы, лихорадку. У пациентов с дефицитом IgA может развиться анафилаксия после первого курса внутривенного иммуноглобулина.
Плазмаферез способствует удалению антител, вовлеченных в патогенез ГБС. В течение каждого сеанса 40-50 мл/кг плазмы заменяют смесью 0,9% раствора хлорида натрия и альбумина. Проведение плазмафереза приводит к сокращению времени выздоровления и снижению потребности в искусственной вентиляции. Эти преимущества очевидны, если плазмаферез проводится в течение первых двух недель после начала болезни. Осложнения, связанные с плазмаферезом, включают гематому в области венопункции, пневмоторакс после катетеризации подключичной вены и сепсис. Плазмаферез противопоказан пациентам с тяжелой гемодинамической нестабильностью, кровотечением и сепсисом.
Комбинация плазмафереза и иммуноглобулина не показала клинических преимуществ.
Кортикостероиды не должны использоваться при лечении ГБС, т. к. не ускоряют выздоровление, не уменьшают вероятность ИВЛ и не влияют на долгосрочный результат. [2]
Прогноз. Профилактика
ГБС остается серьезным заболеванием, несмотря на улучшение результатов лечения. По сравнению со взрослыми, у детей чаще отмечается более благоприятное течение заболевания, с полным, а не частичным выздоровлением. Причинами неблагоприятного исхода при ГБС являются дыхательная недостаточность, осложнения искусственной вентиляции легких (пневмония, сепсис, острый респираторный дистресс-синдром и тромбоэмболические осложнения), остановка сердца, вторичная по отношению к дисавтономии.
Восстановление обычно начинается через две-четыре недели после прекращения прогрессирования симптомов. Среднее время от начала заболевания до полного выздоровления составляет 60 дней. Данные относительно долгосрочного исхода ГБС ограничены. 75% - 80% пациентов полностью выздоравливают. Около 20% пациентов не могут ходить через полгода.
Младшая возрастная группа (менее 9 лет), быстрое прогрессирование и максимальная мышечная слабость, потребность в искусственной вентиляции легких являются важными предикторами длительного двигательного дефицита. [4]
(острый идиопатический полиневрит; острая воспалительная демиелинизирующая полирадикулонейропатия)
, MDCM, New York Presbyterian Hospital-Cornell Medical Center
Синдром Гийена – Барре – это острая, обычно быстро прогрессирующая воспалительная полинейропатия, характеризующаяся мышечной слабостью и умеренным выпадением дистальной чувствительности и самоограничивающимся течением. Заболевание имеет аутоиммунную природу. Диагноз ставится на основе клинических данных. Лечение включает в себя плазмаферез, внутривенные иммуноглобулины, искусственную вентиляцию легких при тяжелом течении.
Этиология синдрома Гийена-Барре (СГБ)
Хотя причина не до конца понятна, заболевание расценивают как аутоиммунное.
Примерно у двух третей пациентов синдром Гийена-Барре возникает через 5 дней - 3 недели после банального инфекционного заболевания, операции или вакцинации. Инфекция – триггерный фактор у более 50% пациентов; наиболее частые патогены включают:
Побочные эффекты ингибиторов контрольных точек иммунного ответа включают синдром, который напоминает синдром Гийена-Барре.
Симптомы и признаки СГБ
У большинства пациентов с cиндромом Гийена-Барре доминирует вялый парез; всегда проксимальные мышцы поражаются в большей степени и нарушения чувствительности выражены меньше. Обычно практически симметричная мышечная слабость с парестезиями начинается распространяться с ног и затем поражает руки, но в некоторых случаях парез начинается с мышц рук или головы. В 90% случаев слабость обычно достигает максимума на 3-4 неделе заболевания. Выпадают глубокие сухожильные рефлексы. Функция сфинктеров обычно не нарушается. Слабость остается неизменной в течение различного периода времени, как правило, в течение нескольких недель, а затем разрешается.
При тяжелом течении более чем в половине случаев страдают лицевые и орофарингеальные мышцы. Может развиваться дегидратация и недостаточность питания. В 5–10% случаев в связи с параличом дыхательных мышц требуется интубация трахеи и проведение ИВЛ.
У некоторых пациентов (возможно, при вариантной форме) развивается выраженная, угрожающая жизни вегетативная дисфункция с колебаниями артериального давления, нарушением секреции антидиуретического гормона, аритмиями, закупоркой желудочно-кишечного тракта, задержкой мочи и нарушением реакции зрачков на свет.
При нетипичном варианте (синдроме Фишера или синдроме Миллера-Фишера) могут развиваться офтальмоплегия, атаксия и арефлексия.
Диагностика СГБ
Исследование спинномозговой жидкости (СМЖ)
Диагноз синдром Гийена-Барре ставится, прежде всего, на основании клинической картины.
Дифференциальная диагностика
Аналогичная острая слабость Слабость Мышечная слабость – одна из наиболее частых причин, по которой пациент обращается за медицинской помощью. Мышечная слабость представляет собой снижение мышечной силы, однако многие пациенты. Прочитайте дополнительные сведения может возникать при миастении грависа, ботулизме, полиомиелите (в основном за пределами США), клещевом параличе, инфицировании вирусом Западного Нила, метаболических невропатиях и поперечном миелите, но эти нарушения обычно можно различить по следующим критериям:
Инфекция, вызванная вирусом Западного Нила, сопровождается головной болью, лихорадкой и асимметричным вялым параличом, но без нарушений чувствительности.
Метаболические нейропатии развиваются на фоне хронических метаболических нарушений.
Поперечный миелит сопровождается болью, слабостью, нарушением чувствительности и дисфункцией мочи.
Обследование
Необходимы проведение анализов на наличие инфекционных заболеваний и оценка иммунного статуса, включая тесты на гепатит и ВИЧ, и электрофорез белков сыворотки.
При подозрении на синдром Гийена – Барре показана госпитализация для выполнения нейрофизиологического исследования (анализ скорости распространения возбуждения по нерву и электронейромиография), проведения анализа ликвора и наблюдения с определением форсированной жизненной емкости легких каждые 6–8 часов. При нейрофизиологическом исследовании в двух третях пациентов выявляется замедление скорости распространения возбуждения и признаки сегментарной демиелинизации; тем не менее, нормальные результаты, в особенности в первые 5-7 дней, не позволяет исключить диагноз и не должно становиться причиной откладывания лечения.
При анализе ликвора может выявляться белково-клеточная диссоциация (повышение уровня белка и нормальное количество лейкоцитов), но ее может не быть в течение 1-й недели заболевания, а в 10% случаев она вообще отсутствует.
В отдельных случаях, компрессия шейного отдела спинного мозга могут имитировать синдром Гийена-Барре, особенно когда присутствует сопутствующая полинейропатия (вызывая или способствуя пониженной рефлекторности) и бульбарное поражение отчетливо не выражено; в таких случаях выполняют МРТ-исследование.
Прогноз при СГБ
Синдром Гийена – Барре фатальный в
Лечение СГБ
Интенсивная поддерживающая терапия
Внутривенный иммуноглобулин (ВВИГ) или плазмаферез
Синдром Гийена – Барре – это неотложное состояние, требующее постоянного мониторинга и поддержания жизненно важных функций, обычно в палате интенсивной терапии и реанимации. Необходимо часто измерять форсированную жизненную емкость легких, чтобы при необходимости начать респираторную поддержку. При снижении форсированной жизненной емкости до уровня
При невозможности приема жидкости через рот следует проводить инфузионную терапию с поддержанием диуреза на уровне не менее 1,0–1,5 л/день. В условиях постельного режима конечности следует оберегать от травм и сдавливания.
Тепло облегчает боль, что может использоваться при назначении ранней физиотерапии. Следует избегать иммобилизации, чреватой развитием анкилозов и контрактур. Как можно раньше следует обеспечивать пассивные движения в суставах в полном объеме, а после уменьшения остроты симптомов начинают активные упражнения. Низкомолекулярный гепарин (НМГ) помогает предотвратить тромбоз глубоких вен у пациентов, прикованных к постели. В нескольких рандомизированных исследованиях и мета-анализах сообщалось, что НМГ более эффективны, чем нефракционированный гепарин в низких дозах (обычно назначается в дозе 5000 единиц 2 раза в день), при этом риск кровотечения при их применении одинаковый.
При раннем назначении ВВИГ (IVIG) 2 г/кг в течение 1-2 дней или, более медленно, 400 мг/кг внутривенно 1 раз в день в течение 5 дней подряд является терапией выбора; оно имеет некоторые преимущества в период до 1 месяца от начала заболевания.
Плазмаферез Плазмаферез Аферез – это процесс разделения клеточных и растворимых компонентов крови с помощью прибора. Аферез часто проводится на донорах, цельная кровь которых центрифугируется для получения отдельных. Прочитайте дополнительные сведения помогает при проведении на ранних стадиях заболевания; он применяется также при неэффективности IVIG (внутривенного иммуного глобулина). Плазмаферез он позволяет укоротить длительность заболевания и пребывания в стационаре и снижает риск смерти и частоту развития стойкого паралича. Тем не менее он может вызвать гипотонию из-за большого объема жидкости, а внутривенный доступ может быть затруднен или вызвать осложнения. Плазмаферез удаляет введенные ранее внутривенные иммуноглобулины, нивелируя их эффект, поэтому его не следует проводить во время или вскоре после завершения лечения иммуноглобулинами, рекомендуется соблюдать интервал как минимум 2–3 сут. Рекомендовано подождать, по крайней мере, 2-3 дня после отмены IVIG.
Порохина Ирина Дмитриевна 1 , Кузьмина Светлана Валентиновна 2
1 Первый Санкт-Петербургский Государственный Медицинский университет им. акад. И.П. Павлова, студентка 6 курса
2 Первый Санкт-Петербургский Государственный Медицинский университет им. акад. И.П. Павлова, кандидат медицинских наук, ассистент кафедры неврологии и нейрохирургии с клиникой
Аннотация
Данная статья посвящена обзору основных заболеваний, требующих проведения дифференциальной диагностики с синдромом Гийена-Барре, который в настоящее время является основной причиной возникновения тяжелых острых прогрессирующих периферических параличей и приводит к формированию стойкого неврологического дефицита.
Porokhina Irina Dmitrievna 1 , Kuzmina Svetlana Valentinovna 2
1 Pavlov First Saint Petersburg State Medical University, 6th year student
2 Pavlov First Saint Petersburg State Medical University, Candidate of Medical Science, Assistant professor of the Neurology and Neurosurgery Department
Abstract
This article is concerned with the most common diseases from which Guillain-Barre syndrome must be differentiated by the doctor. Nowadays Guillain-Barre syndrome is the main cause of severe acute progressive flaccid paralyses and it results in persistent neurological deficits.
В последние десятилетия по данным российской и зарубежной литературы роль синдрома Гийена-Барре в возникновении у пациентов тяжелых острых прогрессирующих периферических парезов рассматривается как ведущая, но при этом для данного синдрома характерен однофазный вариант течения с высокой вероятностью полного восстановления вне зависимости от тяжести клинических проявлений развернутой стадии заболевания при своевременной диагностике и адекватной патогенетической терапии [1, с.20].
Средний возраст пациентов на момент начала заболевания составляет 40 лет (диапазон возраста заболевших от 3 недель до 95 лет). Характерно наличие двух возрастных пиков: первый – в 20 – 29 лет, второй – в 50 и более лет. [2, с. 23 – 24]
У 1/3 пациентов развиваются дыхательные нарушения, требующие проведения ИВЛ.
5– 87% – полное выздоровление;
5 – 22% – выздоровление с дефектом;
5 – 33% – летальность [2, c.28].
Заболеваемость синдромом Гийена-Барре в мире составляет 1 – 2 случая на 100 тыс. населения в год. Заболеваемость в отдельных субъектах Российской Федерации по данным исследований от 2010 года составила от 0,34 до 2,5 на 100 тыс. населения [1, с.22].
По современным представлениям синдром Гийена – Барре является приобретенной иммуноопосредованной невропатией, развитие которой происходит вследствие иммунной реакции на предшествующее иммуноактивирующее событие (вирусная инфекция, оперативное вмешательство и др.) [3, c.23].
Установлено, что более чем 60% пациентов переносят респираторную или желудочно-кишечную инфекцию за 1 – 6 недель до появления первых симптомов заболевания. По данным серологических исследований эта инфекция может быть вирусной (CMV, EBV, HSV1, HSV2, VZ, вирус гриппа, вирусы Коксаки и ECHO и др.) или бактериальной (Mycoplasma pneumoniae, Campylobacter jejuni) [4, c.97].
Среди бактериальных триггеров ведущая роль принадлежит С. jejuni. Молекулярная мимикрия между ганглиозидами (эпитопы GM1, GM1b, GD1a, GQ1b, GalNAc-GD1a) и липосахаридами С. jejuni способствует выработке антиганглиозидных антител.
Среди триггеров вирусной природы ведущая роль принадлежит цитомегаловирусу (10 – 22% наблюдений). У пациентов с ЦМВ-ассоциированным синдромом Гийена-Барре выявляются анти-GM2-ганглиозидные антитела, при этом в клинической картине доминирует поражение чувствительных волокон, особенно черепных нервов [3, c.23], [6, c. 187, 188].
Клинические формы синдрома Гийена-Барре
А) Варианты с типичной клинической картиной:
1) Классическая форма – острая воспалительная демиелинизирующая полирадикулоневропатия (ОВДП) – 85 и >%
- Парапаретическая
- Фарингоцервикобрахиальная
2) Острая моторная аксональная полиневропатия (ОМАН) – 3%
3) Острая моторно-сенсорная аксональная полиневропатия (ОМСАН) – Классическая форма (ОВДП) :
1 этап. Представление макрофагами перекрестно-реагирующего антигена наивным Т-лимфоцитам, их активация, циркуляция по кровотоку и фиксация на эндотелии венул периферических нервов.
2 этап. Активация продукции В-лимфоцитами антиганглиозидных антител (в основном, анти-GM1).
3 этап. Преодоление макрофагами, Т-лимфоцитами и антиганглиозидными антителами гематоэнцефалического барьера, проникновение их через эндотелий в периваскулярную зону и миграция к эндоневрию.
4 этап. Вхождение макрофагов Т-лимфоцитов и аутоантител в эндоневрий, идентификация аутоантигенов на леммоцитах, что приводит к комплемент-опосредованному повреждению их мембран [3, c.23 – 24], [5, c.2 – 7].
В настоящее время ведется поиск новых патогенетических механизмов развития синдрома Гийена – Барре. По данным публикации Y.Z. Wang с соавторами от 2012 года обнаружено повышение экспрессии Toll-подобных рецепторов 2,4 и 9 типов (TLR2, TLR4 и TLR9) у пациентов с синдромом Гийена – Барре по сравнению со здоровыми, а также установлена достоверная положительная корреляция между высокими уровнями этих показателей и выраженностью неврологического дефицита [3, c.26].
Аксональные формы (ОМАН, ОМСАН) :
Первоначальное поражение локализовано не в леммоцитах, а в области перехватов Ранвье и вентральных корешков двигательных (ОМАН) или двигательных и чувствительных нервов и дорсальных корешков (ОМСАН).
При взаимодействии анти-GM1-ганглиозидных антител с перехватами Ранвье происходит блокада ионных К/Na каналов и, как следствие, нарушение проведения нервного импульса. Это приводит к аксональной дегенерации с почти полным отсутствием или минимальной выраженностью лимфоцитарной воспалительной реакции и периаксональной макрофагальной инфильтрации [2, c.39 – 41, 138].
Для ОМАН и ОМСАН характерно развитие вторичной демиелинизации нервных волокон. Течение ОМАН, как правило, более благоприятное, что связывают с поражением только синаптических окончаний двигательных волокон. Если же в патологический процесс вовлекаются аксоны на значительном протяжении (как при ОМСАН), скорость их регенерации значительно снижается, а иногда и полностью прекращается вследствие гибели тел нейронов. Клинически ОМАН и ОМСАН практически неотличимы от классической формы синдрома Гийена-Барре [2, c. 138 – 140],[7, c.1323, 1326].
Чаще всего в дебюте заболевания у пациентов появляются двигательные и/или чувствительные расстройства (гипестезии, гиперестезии, парестезии) в нижних и/или верхних конечностях. Реже заболевание дебютирует с изолированного болевого синдрома в мышцах плечевого, тазового пояса и нижних конечностей или с изолированной слабости бульбарных мышц и наружных мышц глаз. Очень редко (при тяжелом течении) – с нарушения функций тазовых органов. [2, c. 87 – 88], [4, c.98 – 99].
Как правило, двигательные и чувствительные нарушения первоначально появляются в нижних конечностях и через несколько часов или дней распространяются на верхние конечности, туловище, шею, краниальную мускулатуру (восходящий паралич Ландри). Примерно у трети пациентов заболевание манифестирует с одновременным поражением верхних и нижних конечностей. [7, c. 1323].
Мышечная слабость появляется сначала в проксимальных отделах конечностей, симметрична, характерно резкое снижение, а затем выпадение сухожильных рефлексов [2, c.87 – 88], [4, c. 99].
Парезы различной степени выраженности / параличи конечностей, чаще симметричные. Вовлечение краниальной мускулатуры и мышц шеи свидетельствует о тяжелом течении заболевания и обычно является предвестником развития слабости межреберных мышц и диафрагмы и, как следствие, дыхательных расстройств (у 25 – 30% больных возникает потребность в ИВЛ).
Характерны резкое угнетение глубоких рефлексов (причем степень угнетения рефлексов не соответствует тяжести паралича), гипотония с последующей атрофией мышц [2, c. 89 – 90, 94], [4, c.99].
Нарушения глубокой чувствительности (вибрационной, тактильной) встречаются у 20 – 50% пациентов, выражены значительно.
Выраженный болевой синдром отмечается у половины пациентов. Боль может быть корешковой (положительный симптом Ласега) либо мышечной (боли в мышцах спины, плечевого и тазового пояса, ноющего характера, усиливающиеся при движении; нередко наблюдаются мышечные спазмы, особенно в ночное время) [2, c. 94 – 96], [4, c. 99 – 100].
Встречаются более чем у 60% пациентов. Характерны нарушения со стороны сердечно-сосудистой системы: резкие колебания артериального давления, ортостатическая гипотензия, нарушения ритма (тахи- и брадиаритмии). Также характерны нарушения потоотделения (усиление или ослабление),ослабление моторики ЖКТ вплоть до развития кишечной непроходимости, нарушения мочеиспускания (задержка либо недержание мочи) [2, c. 96, 99 – 100], [4, c.100 – 101].
1) Прогрессирования (2 – 4 недели);
2) Плато (1 – 4 недели);
3) Восстановления (недели – месяцы).
Если прогрессирование симптомов продолжается в течение 4 – 8 недель, заболевание трактуется как подострая воспалительная демиелинизирующая полирадикулоневропатия. В том случае, если фаза прогрессирования длится более 8 недель, заболевание переходит в статус хронического [2, c.102 – 103], [4, c.101].
Диагностические критерии Ropper A.H.,1992 г.
Облигатные признаки : прогрессирующая слабость в верхних и нижних конечностях, арефлексия.
Признаки, свидетельствующие в пользу диагноза : нарастание симптоматики на протяжении нескольких дней или недель (до 4 недель); относительная симметричность симптомов; легкие нарушения чувствительности; вовлечение черепных нервов (особенно двустороннее поражение лицевых нервов); восстановление, начинающееся через 2 – 4 недели после прекращения прогрессирования; вегетативная дисфункция; отсутствие лихорадки в начале заболевания, высокое содержание белка в ЦСЖ при нормальном или незначительно повышенном цитозе (не более 10 клеток в мкл); типичные данные ЭМГ.
Признаки, исключающие диагноз : признаки ботулизма, миастении, полиомиелита, токсической полиневропатии; нарушение обмена порфиринов; недавно перенесенная дифтерия; изолированное нарушение чувствительности (в отсутствие мышечной слабости) [4, c.102].
- острая полиневропатия, характеризующаяся триадой симптомов: атаксия, арефлексия, офтальмоплегия. Ежегодно в мире регистрируется 1-2 новых случаев заболевания на 100 000 населения. Средний возраст пациентов – 44 года. Пики заболеваемости: 30 – 39 лет и 50 – 59 лет [8, c.312 – 313].
Особенности патогенеза : B-лимфоциты синтезируют антитела к оболочечным антигенам Campylobacter jejuni, которые перекрестно реагируют с ганглиозидом GQ1b, высокое содержание которого выявлено в нейронах мозжечка, III, IV и VI черепных нервах и спинно-мозговых ганглиях. С другой стороны, Campylobacter jejuni может провоцировать продукцию и других антител, связанных с развитием синдрома Гийена-Барре (анти-GM1, анти-GD1a). Таким образом объясняется сочетание вялого тетрапареза с поражением глазодвигательных нервов и мозжечковой атаксией. До сих пор остается открытым вопрос о локализации поражения при СМФ (является ли оно полностью периферическим или происходит с вовлечением ЦНС) [4, c.122 – 123], [8, c.317].
Первые симптомы : двоение в глазах, шаткость походки, реже – светобоязнь, птоз, дизартрия, дисфагия, слабость мимической мускулатуры. Появляются вышеперечисленные симптомы, как правило, через 1 – 3 недели после перенесенной респираторной или кишечной инфекции [4, c. 120].
- Наружная (характерно вовлечение наружных мышц глаза, при этом птоз наблюдается только у 50% пациентов);
- Внутренняя (характерно вовлечение внутренних мышц глаз, связана с парасимпатической денервацией глаза).
Начинается асимметрично, в течение нескольких дней становится симметричной и полной, может приобретать черты надъядерной или межъядерной вследствие того, что рефлекторные движения глаз восстанавливаются раньше произвольных [4, c. 120 – 121].
Характерна неустойчивость при стоянии и при ходьбе (статолокомоторная атаксия), как правило, клинически неотличима от мозжечковой атаксии.
Выпадение глубоких рефлексов с верхних и нижних конечностей.
- Парез мимической мускулатуры, связанный с поражением лицевого нерва; поражение тройничного, слухового нервов;
- Вялый парез конечностей (чаще – тетрапарез), течение легкое;
- Легкие дизестезии, чаще в дистальных отделах конечностей и на лице;
- Преходящее затруднение мочеиспускания [4, c. 120 – 122], [8, c.318].
1) Исследование цереброспинальной жидкости: выявление белково-клеточной диссоциации;
2) Выявление в крови антител к ганглиозиду GQ1b;
3) ЭМГ: снижение амплитуды потенциалов действия сенсорных нервов, отсутствие замедления проведения по моторным и сенсорным нервам [2, c.143 – 144], [4, c.126 ].
1. Полиневропатия при острой перемежающейся порфирии.
Острая перемежающаяся порфирия – заболевание с аутосомно-доминантным типом наследования, при котором активность фермента порфобилиноген-дезаминазы снижается до 50%.
Распространенность в странах Европы составляет 1 – 2 случая на 100 тыс. человек в год. Проявляется у 20% гетерозигот в виде клинических приступов, провоцирующими факторами для которых служат порфириногенные вещества (лекарственные препараты, алкоголь, инфекции, оперативные вмешательства и др.). Первый приступ обычно развивается в возрасте 15 – 35 лет. Большинство пациентов за свою жизнь переносит один или несколько приступов, которые завершаются полным выздоровлением, множественные приступы возникают менее чем у 10%. Течение острое, реже – подострое. Летальность также составляет около 10% [4, c.414 – 415].
В основе патогенеза поражения нервной системы при острой перемежающейся порфирии лежит нейротоксическое действие эпсилон – аминолевулиновой кислоты, порфобилиногена и продуктов их метаболизма на структуры как периферической (в большей степени) так и центральной нервной системы (в меньшей степени вследствие низкой проницаемости ГЭБ).
Характерна аксональная дегенерация с последующим развитием вторичной демиелинизации с вовлечением в патологический процесс толстых и тонких миелинизированных и немиелинизированных нервных волокон. Также характерно развитие дистрофии нейронов вегетативных ганглиев [4, c.415, 419 – 420].
Как правило, классический приступ острой перемежающейся порфирии начинается с вегетативных симптомов, с последующим присоединением психических нарушений и полиневропатии преимущественно моторного характера.
Вегетативные симптомы: боли в животе схваткообразного или ноющего характера разной интенсивности, рвота, запор либо диарея; задержка мочеиспускания. Характерны также синусовая тахикардия, повышение АД (иногда до очень высоких цифр, что приводит к острой гипертонической энцефалопатии), субфебрилитет.
Психические нарушения : депрессия, нарушения сна, тревожное или гипоманиакальное состояние; в тяжелых случаях – делирий, угнетение сознания, генерализованные судорожные припадки [4, c. 420 – 422].
Полиневропатия: нарастающий вялый тетрапарез, характеризующийся вовлечением первыми верхних конечностей от проксимальных отделов к дистальным (бибрахиальный парез). Парезы, как правило, симметричны, но могут быть и асимметричными (гемипарезы), в 50% случаев появляются на фоне миалгий. Возможен дебют с парестезий в конечностях, на туловище, лице и шее. Сухожильные рефлексы сохранены, по мере прогрессирования заболевания могут ослабляться и выпадать.
При тяжелом течении заболевания характерно вовлечение дыхательных мышц, поражение черепных нервов, что приводит к развитию бульбарного синдрома, пареза мимической мускулатуры, нарушений движения глаз.
Нарушение чувствительности наблюдается редко, в основном – поверхностной по типу гиперестезии [4, c.422 – 424].
Табл.1. Дифференциальная диагностика синдрома Гийена-Барре и острой перемежающейся порфирии
Читайте также:

