Реферат препараты растительного происхождения
Обновлено: 05.07.2024
- КЛЮЧЕВЫЕ СЛОВА: тревожные состояния, препараты растительного происхождения, магний
Тревога является обязательной составляющей интегративной реакции организма на стрессовое воздействие. Сложно переоценить роль дистресса (патологическая разновидность стресс-синдрома, отрицательно влияющего на организм, психическую деятельность и поведение человека) в формировании психовегетативных нарушений. Вегетативные изменения, вызванные дистрессом, разнообразны и могут затрагивать практически все органы и системы организма [2]. Повышенная стрессодоступность и избыточные тревожные реакции способствуют формированию психовегетативного синдрома. Он сопровождается психическими и вегетативными симптомами [2], которые характеризуются полисистемностью [1, 3].
К психическим проявлениям тревожных расстройств обычно относят:
Вегетативные (соматические) проявления включают:
- потливость, холодные и влажные ладони;
- сухость во рту;
- ощущение кома в горле;
- ощущение нехватки воздуха;
- напряжение и боль в мышцах;
- тошноту, понос, боли в животе; головокружение;
- предобморочное состояние;
- снижение либидо, импотенцию;
- напряжение и боль в мышцах;
- учащенное сердцебиение;
- приливы жара или холода.
Тревога, чувство внутреннего напряжения, раздражительность – жалобы, которые часто звучат на приеме у врача. В течение жизни примерно у 50% населения отмечаются отдельные симптомы тревоги или синдромально очерченные тревожные расстройства [4]. Нередко субсиндромальные тревожные состояния скрываются за массивной вегетативной дисфункцией, формируя психовегетативный синдром. Причем такие состояния своевременно не диагностируются [5].
В проспективном исследовании КООРДИНАТА убедительно показано, что депрессивные и тревожные расстройства обычно не распознаются врачами общей практики и негативно отражаются на течении сердечно-сосудистых заболеваний, в частности артериальной гипертензии [7].
В основе формирования тревоги лежит нарушение баланса медиаторов, таких как серотонин, норадреналин и гамма-аминомасляная кислота (ГАМК). Именно через эти медиаторные системы обычно реализуется действие противотревожных препаратов.
Обычно при тревожных расстройствах применяют различные психотропные препараты. Для купирования остро возникшей тревоги чаще используют анксиолитики – производные бензодиазепина [8], как правило Феназепам и диазепам. Реже назначают транквилизаторы и антидепрессанты.
Среди ГАМКергических анксиолитиков ведущее место занимают бензодиазепиновые транквилизаторы, которые отличаются быстрым достижением терапевтического эффекта. Однако ряд побочных явлений (вялость, мышечная слабость, нарушение внимания), присущих данным препаратам, снижают повседневную активность пациентов, а следовательно, приверженность терапии. Больные опасаются риска развития лекарственной зависимости и симптомов отмены, а также развития нарушений координации из-за страха падения и появления неустойчивости [8]. Сказанное приобретает особое значение, когда речь идет о пациентах детского [1] и пожилого [9] возраста, страдающих тревожными расстройствами.
Согласно данным Всемирной организации здравоохранения, до 80% населения планеты отдают предпочтение лекарственным средствам растительного происхождения [10]. Но это не означает отказ от антидепрессантов или комбинированной терапии. На фоне усложняющейся клинической картины и хронизации тревоги приоритет остается за ними.
Вопрос об альтернативном лечении пациентов с тревожными расстройствами остается крайне актуальным. В качестве такого лечения рассматриваются препараты растительного происхождения. Официнальные препараты растительного происхождения с минимальным количеством побочных эффектов могут также использоваться для усиления эффективности рецептурных препаратов. Эксперты Всемирной организации здравоохранения рекомендуют: прежде чем назначать препараты бензодиазепинового ряда, следует рассмотреть возможность альтернативной терапии (небензодиазепиновые анксиолитики, препараты растительного происхождения). Одним из наиболее эффективных и безопасных альтернативных способов терапии субсиндромальных тревожных расстройств считается применение растительных успокаивающих средств на основе валерианы, мелиссы, пассифлоры, душицы, вереска либо пустырника [11]. Среди растительных препаратов с анксиолитическим и успокаивающим действием, выраженной седативной активностью можно выделить ряд целебных растений, которые назначаются как в виде травяных сборов, так и в виде таблетированных форм.
Мелисса лекарственная (Melissa officinalis)
Сегодня мелисса лекарственная (Melissa officinalis) применяется в медицине преимущественно как седативно-снотворное средство. Кроме того, она используется при функциональных гастроинтестинальных расстройствах [12]. Ее эффективность при функциональной диспепсии подтверждена результатами метаанализа двойных слепых рандомизированных исследований [13].
В листьях растения содержатся витамин C, витамины группы B, кальций, магний, калий, железо, медь, селен, марганец. Фитохимический анализ экстракта мелиссы лекарственной выявил наличие альдегидов монотерпеноидов, полифенольных соединений, монотерпеновых гликозидов [14, 15]. Кроме того, обнаружено присутствие дубильных веществ, флавоноидов, алкалоидов и кумаринов, но не других вторичных метаболитов, таких как антрахиноны и сапонины.
Мелисса лекарственная оказывает анксиолитическое, ноотропное [10], умеренное спазмолитическое и антимикробное, а также антиоксидантное, антиноцицептивное, противоопухолевое (антимутагенное) действие [16]. Мелисса способна стимулировать пониженный аппетит.
Высказывается предположение, что мелисса угнетающе воздействует на ацетилхолинэстеразу головного мозга и снижает активность никотиновых и мускариновых рецепторов в коре больших полушарий [17, 18].
Частота побочных эффектов при ее использовании не отличается от таковой при применении плацебо [19].
Обзор A. Shakeri и соавт. был посвящен анализу традиционных видов использования, фитохимии, фармакологической активности, фармакокинетики и токсичности мелиссы лекарственной. Для анализа данных использовались материалы (печатные, электронные) статей по традиционной медицине с использованием данного лекарственного растения. Электронные базы данных включали статьи, цитируемые в Web of Science, PubMed, Science Direct, Google Scholar, Scopus и опубликованные с 1956 по 2015 г. в разделе фармакологии и биохимии растений. Традиционное использование мелиссы лекарственной отмечалось в основном в Европе, Средиземноморском регионе и странах Ближнего Востока. В ряде клинических испытаний зафиксировано анксиолитическое, противовирусное и спазмолитическое действие мелиссы, а также ее влияние на настроение, познавательную способность и память. Основные предполагаемые механизмы, реализующие эффекты мелиссы лекарственной, связаны со стимуляцией ацетилхолина и ГАМК-рецепторов, а также с подавлением матриксной металлопротеиназы 2. Полученные данные свидетельствуют о потенциальном применении мелиссы лекарственной в лечении широкого спектра заболеваний, в частности тревожных состояний [20].
Пассифлора инкарнатная (Passiflora incarnata)
Пассифлора инкарнатная (Passiflora incarnata) также широко используется в качестве анксиолитического и седативного средства в силу предполагаемого модулирующего эффекта на ГАМК.
В экспериментальных условиях наряду с нейропротективным влиянием пассифлора воздействовала на нейропатическую боль у мышей [21]. Базовые антиноцицептивные механизмы запускаются в результате воздействия на опиатергические ГАМКергические рецепторы. Седативное влияние реализуется через ГАМКергические механизмы, тем самым обеспечивается дозозависимый эффект [21].
В открытом обсервационном исследовании с участием 639 пациентов (средний возраст – 46,3 ± 17,5 года) с тревожными нарушениями и инсомнией оценивали влияние пассифлоры на состояние тревожности и нарушения сна [22]. Тревога выявлена в 85,4% случаев по шкале Гамильтона и в 93,3% по опроснику Спилбергера. 62,7% пациентов принимали пассифлору, 26,1% – пассифлору в комбинации с психотропным препаратом. Через четыре недели зафиксировано достоверное улучшение показателей. Исследователи пришли к выводу, что пассифлора может стать альтернативой психотропным препаратам на начальном этапе терапии тревожных расстройств.
Боярышник обыкновенный (Crataegus oxyacantha)
Среди лекарственных растений особой популярностью пользуется боярышник обыкновенный (Crataegus oxyacantha). Он применяется в качестве средства, благотворно влияющего на сердечно-сосудистую систему (уменьшает неприятные ощущения в области сердца, нормализует сердечный ритм). Благодаря наличию тритерпеновых соединений и флавоноидов боярышник оказывает спазмолитическое действие.
В двойном слепом рандомизированном плацебоконтролируемом исследовании оценивали эффективность и безопасность фиксированной комбинации, содержащей экстракты растений (боярышника обыкновенного, эшшольции калифорнийской (Eschscholzia californica)) и магния, в терапии тревожных расстройств [23]. В исследовании участвовали 264 пациента (средний возраст – 44,6 года) с симптомами генерализованной тревожности от легкой до умеренной степени выраженности (по шкале Гамильтона). 130 больных получали исследуемый препарат, 134 – плацебо (по две таблетки два раза в день в течение трех месяцев). Эффективность препарата, содержащего экстракты лекарственных растений и магний, превышала таковую плацебо.
Магнийсодержащие препараты
Некоторые авторы подчеркивают способность магния увеличивать устойчивость организма к стрессу [24]. В связи с этим применение содержащих магний препаратов открывает новые перспективы метаболической терапии у пациентов с нарушением адаптационных возможностей в условиях хронического стресса. Все чаще обсуждается роль Mg 2+ в работе гипоталамо-гипофизарно-надпочечниковой оси. На фоне его дефицита увеличивается транскрипция кортикотропин-рилизинг-гормона в паравентрикулярном ядре гипоталамуса, повышается уровень адренокортикотропного гормона плазмы, индуцируется развитие патологической тревоги при стрессе, что клинически проявляется тревожным поведением [25]. Установлено, что при использовании транквилизаторов и антидепрессантов индуцированная дефицитом магния гипервозбудимость гипоталамо-гипофизарно-надпочечниковой оси с клиническими проявлениями патологической тревоги регрессирует [26]. Особое значение приобретает дефицит магния с позиции нарушений работы митохондрий и синтеза РНК и ДНК, концевые участки (теломеры) которых необходимы как для поддержания целостности генома, так и для сдерживания клеточного старения [25]. Активность фермента теломеразы (добавляющей фрагменты ДНК) зависит от уровня магния. Повышение активности гипоталамо-гипофизарно-надпочечниковой оси и катехоламинов чревато избыточной потерей клетками внутриклеточного Mg 2+ . При дефиците магния и высокой катехоламиновой активности в результате дестабилизации ДНК нарушаются ее репликация и транскрипция, что приводит к укорочению теломер, нарушению синтеза белка и функции митохондрий и, как следствие, старению и смерти клетки [27]. Достаточное содержание Mg 2+ в организме является критическим фактором для нормального клеточного гомеостаза [28]. Включение содержащих магний препаратов в базовую терапию любого патологического процесса позволяет модифицировать клеточный метаболизм.
У здоровых взрослых лиц при дефиците водорастворимых витаминов возникают повышенная утомляемость, тревожность, раздражительность, бессонница, нарушения памяти и способности к концентрации внимания. Как известно, витамины группы B характеризуются нейротропным действием. Витамин В6 улучшает всасывание магния в желудочно-кишечном тракте и проникновение его в клетки, необходим для нормального функционирования центральной и периферической нервной системы. Витамин В6:
- участвует в синтезе нейромедиаторов;
- в фосфорилированной форме обеспечивает процессы декарбоксилирования, переаминирования, дезаминирования аминокислот;
- участвует в синтезе белка, ферментов, гемоглобина, простагландинов, обмене серотонина, катехоламинов, глутаминовой кислоты, ГАМК, гистамина;
- улучшает использование ненасыщенных жирных кислот;
- снижает уровень холестерина и липидов в крови;
- улучшает сократимость миокарда;
- способствует превращению фолиевой кислоты в активную форму.
Новарест
Согласно инструкции, показаниями к применению Новареста являются:
- повышенная нервная возбудимость;
- раздражительность;
- тревожные состояния (предменструальный синдром);
- повышенная утомляемость;
- легкие формы нарушения сна;
- функциональные нарушения сердечно-сосудистой деятельности и желудочно-кишечного тракта (в рамках вегетососудистой дистонии).
Новарест применяют по одной таблетке два-три раза в день во время еды в течение одного – трех месяцев. При нарушениях сна – две таблетки за полчаса перед сном. Максимальная суточная доза – три таблетки.
Из побочных эффектов редко наблюдаются аллергические реакции и общая слабость. Противопоказаниями к назначению являются детский возраст и повышенная чувствительность к компонентам комплекса.
Использование растений в качестве лекарственных средств пришло в наш век из глубокой древности и до сих пор играет значительную роль в арсенале лекарственных средств современной медицины.
Это обусловлено некоторыми преимуществами фитотерапии по сравнению с синтетическими лекарственными средствами. Одним из основных преимуществ является малая частота побочных явлений .
Интерес к фитотерапии вызван также изменением возрастной структуры населения: увеличение лиц пожилого и старческого возраста, которые как правило страдают теми или иными заболеваниями при которых требуется длительное применение лекарственных средств и риск развития побочных явлений при этом должен быть минимальным.
Особую роль фитотерапия занимает в педиатрической практике , т.к. Лекарственные растения действуют мягче и реже дают нежелательные осложнения.
Существует мнение, что такой комплекс сформировавшийся в живой клетке, имеет большее сходство с человеческим организмом, чем изолированное, химически чистое действующее вещество, поэтому оно легче ассимилируется и дает меньше побочных эффектов.
Огромное значение лекарственные растительные средства играют в профилактике заболеваний . Т.к. абсолютно здоровых людей в наше время нет, большинство из нас находиться в т.н. третьем состоянии - между здоровьем и болезнью, на грани срыва адаптивных механизмов, т.е. тогда, когда организм нуждается в легко коррегирующем действии, нормализующем слегка измененные функции организма.
Очень велики возможности комплексного применения лекарственных средств, т.к. лекарственные растения в своем большинстве совместимы между собой и другими лекарственные веществами и при сочетании лекарственных растений часто проявляется синергизм их действия.
Необходимо отметить, что лек. растительное сырье является наиболее дешевым и доступным источником получения лекарственных средств.
Детальное изучение химического состава, фармакологических свойств, а также клинических испытаний растений позволяют ежегодно внедрять в практику ЗО новые высокоэффективные лекарственные средства из растений.
Кроме того в настоящее время возникает большой ассортимент различных лекарственных форм из лекарственных растений. Кроме традиционно известных таблеток, капель, сиропов выпускаются такие лекарственные формы, как лечебные ванны, чаи, пастилки, что делает удобным применение ЛРС в педиатрической и гериатрической практике.
Наиболее часто сейчас встречается такая ЛФ, как диетические супы, которые являются прекрасным питанием для больных с различными заболеваниями.
Широко распространенными становятся медицинские вина, которые представляют собой экстракты различных растений в натуральном вине.
В своей работе я попыталась представить наиболее полное описание номенклатуры новых ЛРС, их состав, механизм действия, фармакокинетику и другие сведения способствующие рационализации фармакотерапии.
В общей сложности в работе представлено около 70 наименований новых ЛС растительного происхождения, разделенным по фармакотерапевтическим группам.
Надеюсь, что представленная информация является интересной и окажется полезной для дальнейшей профессиональной деятельности читателей.
Состав и форма выпуска.
Фильм-таблетки: в упаковке 30 штук.
Гиперицин (общий). не менее 0,3 мг в 1 таб.
Фармакологическое действие. Деприм - фитопрепарат для коррекции астенических состояний. Зверобой, в частности его основной ингредиент - гиперицин, оказывает благоприятное действие на функциональное состояние центральной и вегетативной нервной системы. Деприм устраняет подавленность, апатию и такие симптомы, как плохое самочувствие, потеря аппетита, расстройства сна. При применении Деприма улучшается настроение, повышается психическая и физическая трудоспособность.
Показания. Астенические состояния.
Режим дозирования. Взрослым назначают по 1 таблетке 3 раза в сутки.
Детям старше 7 лет назначают по 1 таблетке в сутки; максимальная доза 2 таблетки в сутки.
Длительность лечения - от нескольких недель до нескольких месяцев.
Побочное действие. В редких случаях могут наблюдаться реакции повышенной чувствительности; фотосенсибилизация.
Противопоказания. Фотосенсибилизация в анамнезе.
Особые указания. Во время лечения Депримом следует избегать ультрафиолетового облучения.
Состав и форма выпуска. Активное вещество - кавалактон (содержится в сухом экстракте из корней растения кава-кава).
Таблетки 0,12 г по 30, 60, 100 штук в упаковке.
Фармакологическое действие. Транквилизатор растительного происхождения. Оказывает анксиолитическое и успокаивающее действие, связанное, по-видимому, со снижением возбудимости лимбической системы. Оказывает также противосудорожное действие.
Кавалактон хорошо и быстро всасывается из ЖКТ. Выводиться из организма частично через почки, частично с фекалиями.
Показания. Состояния страха, напряженности, беспокойства.
Режим дозирования. Назначают по 1-2 таблетке ежедневно. Таблетки следует принимать не разжевывая, после еды, запивая достаточным количеством воды. Продолжительность лечения определяется в каждом случае индивидуально. При необходимости применения препарата более 3-х месяцев требуется врачебный контроль.
Противопоказания. Эндогенные депрессии, беременность, лактация.
Особые указания. Пациентом, принимающим антарес 120, следует воздерживаться от потенциально опасных видов деятельности, требующих быстрой двигательной и психической реакции, повышенного внимания. Во время лечения препаратом необходимо избегать приема алкоголя. В случае появления желтушного окрашивания кожных покровов прием препарата следует прекратить. Антарес120 может усилить действие препаратов, угнетающих ЦНС.
Состав и форма выпуска. Активное вещество - 2,5 % смесь эфирных масел мелиссы, перечной мяты, фенхеля, мускатного ореха, гвоздики, чабреца, сосновых игл, аниса, эвкалипта, шалфея, корицы и лаванды в разбавленном этиловом спирте. Раствор для приема внутрь, для местного и наружного применения 50 мл во флаконе.
Фармакологическое действие. Алталекс - комбинированный растительный препарат, применяемый при различных функциональных нарушениях. Обладает седативным, спазмолитическим, болеутоляющим, противовоспалительным и антисептическим действием.
Фармакологическое действие растений, входящих в состав препарата представленно в таблице1.
Поиск новых биологически активных соединений растительного происхождения для лечения и профилактики иммуносупрессии инфекционных заболеваний остается активной частью фармацевтических исследований. Основой противовирусной терапии является воздействие на вирус или его составляющие компоненты на той или иной стадии репродукции. Практическая медицина обладает достаточно внушительным арсеналом противовирусных средств, способных подавлять репродукцию вируса на любой из трех стадий репродукции вируса. Однако противовирусная химиотерапия начинает сталкиваться с серьезной проблемой появления вариантов вируса, устойчивых к тем или иным препаратам. Описаны препараты растительного происхождения с различной химической структурой, способные проявлять антивирусную активность на различных стадиях репродукции вируса. Большое разнообразие биологически активных соединений, находящихся в растениях, позволяет рассчитывать на возможность получения новых высокоактивных препаратов, обладающих способностью блокировать различные вирусы, в том числе резистентные к существующим коммерческим химиопрепаратам.

1. Этиотропная лекарственная терапия вирусных инфекций / Г.А. Галегов, В.Л. Андронова, Н.А. Леонтьева и др. // Вопр. вирусол. – 2004. – № 3. – С. 35–40.
2. Покpовский В.И., Онищенко Г.Г., Чеpкасский Б.Л. Совpеменные пpедставления об инфекционной патологии и основные напpавления совеpшенствования стpатегии ее пpофилактики // Вестник РАМН. – 2000. – № 1. – C. 3–6.
4. Balunas, M.J.; Kinghorn, A.D. Drug discovery from medicinal plants // Life Sci. – 2005. – 78. – P. 431–441
5. Bantia S., Parker C.D., Ananth S.L. et al. Comparison of the anti-influenza virus activity of RWJ-270201 with those of oseltamivir and zanamivir // Antimicrob. Agents and Chemother. – 2001. – Vol. 45, № 4. – Р. 1162–1167.
6. Boltz D.A., Aldrige J.R., Webster R.G., et al. Drugs in development for influenza // Drugs. – 2010. – Vol. 70. – P. 1349–1362.
7. Calland, N.; Albecka, A.; Belouzard, S.; Wychowski, C.; Duverlie, G.; Descamps, V.; Hober, D.; Dubuisson, J.; Rouillé, Y.; Séron, K. (−)-Epigallocatechin-3-gallate is a new inhibitor of hepatitis C virus entry // Hepatology – 2012. – Vol. 55. – P. 720–729.
8. Calland N., Dubuisson J., Rouillé Y., Séron K. Hepatitis C Virus and Natural Compounds: A New Antiviral Approach? // Viruses. – 2012. – № 4. – P. 2197–2217.
9. Ciesek, S.; von Hahn, T.; Colpitts, C.C.; Schang, L.M.; Friesland, M.; Steinmann, J.; Manns, M.P.; Ott, M.; Wedemeyer, H.; Meuleman, P.; et al. The green tea polyphenol, epigallocatechin-3-gallate, inhibits hepatitis C virus entry// Hepatology. – 2011. – Vol. 54. – P. 1947–1955.
10. Deyrup M., Sidwell R., Little R. et al. Improved delivery through biological membranes. Synthesis and antiviral activity of a series of ribavirin chemical delivery systems: 2’ and 3’ derivatives // Antiviral Chem. and Chemother. – 1991. – Vol. 2. – P. 337–356.
11. Fabricant D.S., Farnsworth N.R. The value of plants used in traditional Medicine for drug discovery // Environmental Health Perspectives. – 2001. – Vol. 109. – P. 69–75.
12. Krug R.M., Aramini J.M. Emerging antiviral targets for influenza A virus // Trends. Pharmacol. Sci. – 2009. – Vol. 30. – P. 269–277.
13. Li Y., Jiang R., Ooi L.S. et al. Antiviral triterpenoids from the medicinal plant Schefflera heptaphylla // Phytother. Res. – 2007. – Vol. 21. – P. 466–470.
14. Patick A.K., Potts K.E. Protease inhibitors as antiviral agents // Clinic. Microbiol. Rev. –1998. – Vol. 11, № 4. – P. 614–627.
15. Preziosi P. Influenza pharmacotherapy: present situation, strategies and hopes // Expert Opin. Pharmacotherapy. – 2011. – P. 23–30.
16. Ryu Y. B., Curtis-Long M.J., Kim J.H., Jeong S.H., Yang M.S., Lee K.W., Lee W.S., Park K.H. Pterocarpans and flavanones from Sophora flavescens displaying potent neuraminidase inhibition // Bioorganic & Medicinal Chemistry Letters. – 2008. – Vol. 18. – P. 6046–6049.
17. Safrin S. Antiviral agents. Basic and clinical pharmacology. In: Katzung B.G., editor, McGrow-Hill. – New York, 2007. – P. 815.
18. Sidwell R. Ribavirin: A review of antiviral efficacy // Abstr. Recent. Res. Devel. in Antimicrob. Agents and Chemother. (G. Pandalai, ed.) Research Signpost. – India, 1995. – Vol. 1. – Р. 219–256.
20. Wagoner, J.; Morishima, C.; Graf, T.N.; Oberlies, N.H.; Teissier, E.; Pécheur, E.I.; Tavis, J.E.; Polyak, S.J. Differential in vitro effects of intravenous versus oral formulations of silibinin on the HCV life cycle and inflammation // PLoS One. – 2011. – P. e164–174.
21. Wagoner, J.; Negash, A.; Kane, O.J.; Martinez, L.E.; Nahmias, Y.; Bourne, N.; Owen, D.M.; Grove, J.; Brimacombe, C.; McKeating, J.A.; et al. Multiple effects of silymarin on the hepatitis C virus lifecycle // Hepatology. – 2010. – Vol. 51. – P. 1912–1921.
На протяжении всей своей истории человечество соприкасалось с царством растений, используя последние для удовлетворения своих хозяйственных, пищевых и лекарственных целей. Поэтому неудивительно, что даже современные лекарственные препараты разработаны на основе природных соединений. Среди них наиболее известны витамин С, аспирин, хинин, морфин и кодеин. В последние десятилетия большое внимание уделяется изучению свойств таксола, арглабина, винбластина и некоторых других соединений, полученных на основе растительных препаратов.
Поиск новых биологически активных соединений растительного происхождения для лечения и профилактики иммуносупрессии, инфекционных заболеваний, онкологии и метаболических заболеваний остается активной частью фармацевтических исследований [15]. В последние годы на рынке появилось более 40 новых препаратов природного происхождения, прошедших полный путь от исследования до клинических испытаний [2]. Такое внимание исследователей к природным соединениям обусловлено в первую очередь меньшей токсичностью растительных препаратов и более широким спектром действия. Некоторые лекарственные соединения растительного происхождения обнаружили способность эффективно блокировать развитие различных вирусов, включая вирус простого герпеса, гриппа, вирус иммунодефицита человека, вирусы гепатита С и В и многие другие [4, 8, 17, 19,].
Основой противовирусной терапии является воздействие на вирус или его составляющие компоненты на той или иной стадии репродукции. Весь процесс репродукции вирусов может быть условно разделен на три фазы [15]. Первая фаза охватывает события, которые ведут к адсорбции и проникновению вируса в клетку, освобождению его внутренних структурных компонентов и модификации его таким образом, что он способен вызвать инфекцию. Вторая фаза репродукции связана со сложными процессами, в течение которых происходит экспрессия вирусного генома. Заключительной стадией репродукции является выход вирусного потомства из клетки путем почкования или за счет лизиса, причем в последнем случае клетка погибает [12]. Имеющийся на сегодняшний день арсенал противовирусных средств способен оказывать воздействие на любой из этапов репродукции вируса.
Адсорбция и проникновение вируса в клетку
Рис. 1. Соединения, блокирующие стадию адсорбции вируса [4, 8, 13]
Освобождение внутреннего компонента вируса
После проникновения вириона в клетку происходит целый комплекс превращений вируса, смысл которых заключается в удалении вирусных защитных оболочек, препятствующих экспрессии вирусного генома. Этот процесс сопровождается рядом характерных особенностей: исчезает инфекционность вируса, появляется чувствительность к нуклеазам, возникает устойчивость к нейтрализующему действию антител. Основной группой растительных соединений, способных подавлять репродукцию вирусов на этой стадии, являются аналоги силимарина, лютеолина и кверцетина (рис. 2) [4, 20, 21].
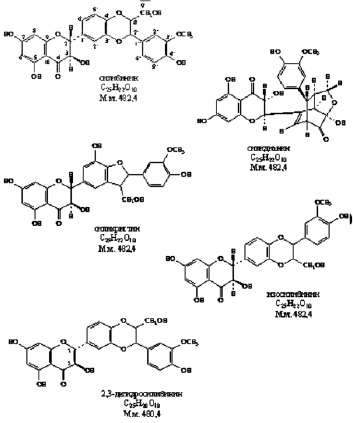
Рис. 2. Соединения, блокирующие освобождение внутреннего компонента вируса
Экспрессия вирусного генома и сборка вирусных частиц
Экспрессия вирусного генома и сборка вирионов являются самыми сложными этапами, включающими транскрипцию нуклеиновых кислот, трансляцию белков, посттрансляционные модификации вирусных белков, репликацию нуклеиновых кислот, сборку вирусных частиц. Этот этап репродукции вирусов успешно блокируется 2 основными группами растительных соединений: ингибиторами РНК полимераз и ингибиторами посттрансляционных модификаций белков. К таким препаратам относятся алпизарин, госсипол, эпиген и др (рис. 3).
Механизм действия подобных препаратов связан с образованием ацил-ферментных производных и основан на блокировании одной из трех основных областей, критичных для активности аспарагиновой протеазы вируса: каталитическое ядро фермента, содержащее пару Asp-Thr/Ser-Gly триад, мобильная flap-область и домен димеризации на N- и С-концах протеазы [1, 10, 14].
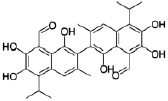
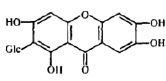
Рис. 3. Соединения, блокирующие экспрессию вирусного генома
Выход вирусного потомства
Завершающим этапом репродукции вируса является выход вирионов из инфицированной клетки. Этот процесс может протекать с помощью почкования вируса и лизиса клетки. Лизис клетки, как правило, сопровождается гибелью клетки. Блокировать такой механизм выхода вируса практически невозможно.
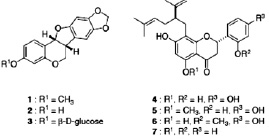
Рис. 4. Структура ингибиторов нейраминидазы [7, 9, 16]
На сегодняшний день практическая медицина обладает достаточно внушительным арсеналом противовирусных средств, способных подавлять репродукцию вируса на любой стадии процесса. Однако, несмотря на определенные успехи, достигнутые в вирусной химиотерапии, клиническая практика сталкивается с серьезной проблемой появления вариантов вируса, устойчивых к тем или иным препаратам.
Изучение растительных препаратов, обладающих антивирусными свойствами (алпизарин, эпиген, протефлазид, госсипол), показало, что за счет разных механизмов действия препаратов (противовирусное и иммуностимулирующее) появление вирусов, устойчивых к данным препаратам, не наблюдается. Большое разнообразие биологически активных соединений, находящихся в растениях, позволяет рассчитывать на возможность получения новых высокоактивных препаратов, обладающих способностью блокировать различные вирусы, в том числе, резистентные к существующим коммерческим химиопрепаратам. Подобные препараты, сочетающие в себе свойства иммуностимулирующих и противовирусных соединений, можно рекомендовать для лечения и профилактики инфекционных заболеваний, ассоциированных с иммунодефицитным состоянием, в том числе таких, как грипп, ВИЧ, гепатит С и др. [11, 17].
Рецензенты:
Профилактика и лечение невротических расстройств – одна из актуальнейших проблем современной фармакологии. Это особенно важно для России, где имеется огромное количество провоцирующих факторов для развития такого рода заболеваний.
Современная фармакология располагает большим количеством лекарственных средств, влияющих на центральную нервную систему. Присутствующие на фармацевтическом рынке синтетические транквилизаторы, безусловно, эффективны, но имеют длинный перечень побочных эффектов. Седативный (анксиолитический) препарат должен снижать ощущение тревоги, обладать успокаивающими свойствами, оказывая при этом незначительное действие на двигательные и мыслительные функции. Степень подавления ЦНС, вызванная седативным средством, должна быть минимальной.
Фитотерапия невротических расстройств традиционно привлекает мягким действием, высоким уровнем безопасности и, как следствие, возможностью их длительного применения при сохранении достаточно высокой эффективности. Актуальна проблема лечения алкоголизма и особенно абстинентного синдрома с использованием эффективных фитотранквилизаторов, к которым не развивается зависимость, что часто наблюдается для транквилизаторов бензодиазепинового ряда.
В таблице 1 представлены растения, которые наиболее часто используются как седативные. Эти растения активно используются в практической медицине в виде монокомпозиций, однако при этом существенным недостатком является ограниченный диапазон их лечебного воздействия на патогенез и различные симптомы невротических расстройств. Современная фитотерапия неврозов и неврозоподобных состояний включает в себя, прежде всего, использование комплексных (комбинированных) лекарственных средств растительного происхождения. Их основное достоинство - положительное влияние на различные патологические звенья невротических расстройств. Композиция комплексных фитопрепаратов формируется таким образом, чтобы оказывать лечебное воздействие на функции нервной, сердечно-сосудистой, иммунной и др. систем и органов человеческого организма, так или иначе вовлеченных в развитие патологического процесса.
Таблица 1. Растения, наиболее часто применяемые как седативные
| Сырье | Основные действующие вещества |
| Пустырник (Leonurus L.), трава | Эфирные масла, иридоиды, дитерпеноид леокардин, сапонины, алкалоид стахидрин, аскорбиновая кислота, дубильные вещества, фенолкарбоновые кислоты и их производные и др. |
| Валериана лекарственная (Valeriana officinalis L.s.l.), корневища с корнями | Эфирные масла, изовалериановая к-та, валепатриаты, алкалоиды, гликозидные соединения и др. |
| Мята перечная (Mentha piperita L.), листья | Эфирные масла (ментол и его эфиры изовалериановой и уксусной кислот), каротин, органические к-ты, флавоноиды и др. |
| Мелисса лекарственная (Melissa officinalis L.), трава | Эфирные масла (цитраль, цитронеллаль, мирцен, гераниол), слизь, смолы, горечи, аскорбиновая кислота, дубильные вещества, органические кислоты и др. |
| Хмель обыкновенный (Humulus lupulus L.), шишки | Горькое вещество лупулин, эфирные масла, алкалоид хумулин, гормоны, хлорогеновая, валериановая кислота, флавоновые гликозиды и др. |
| Пион уклоняющийся (Paeonia anomala L.), корневища и корни | Гликоиридоиды (бензоилпионифлорин, альбифлорин, пионифлорин, оксипинифлорин) сахара, танины, алкалоиды, эфирное масло, гликозид салицин, салициловая и бензойная к-та и др. |
| Пассифлора мясокрасная (Passiflora incarnatа L.), трава | Сапонины, витамины, алкалоиды (гарман, гармин, гармол), белковые и пектиновые вещества, свободные сахара, аминокислоты (тирозин, пролин, фенилаланин, валин, глютамин и др.), оксикумарины, флавоноиды и др. |
| Душица обыкновенная (Origanum vulgare L.), трава | Эфирные масла, фенолы, тимол , аскорбиновая к-та, дубильные вещества, жирные масла и др. |
| Зверобой продырявленный (Hypericum perforatum L.), трава | Флавоноиды (гиперозид, рутин, кверцетин, изокверцетин и др.), эфирные масла, витамины, сапонины и др. |
| Синюха голубая (Polemonium caeruleum L.), корневища с корнями | Тритерпеновые гликозиды (сапонины), флавоноиды, эфирное масло, смолистые вещества, органические кислоты, кумарины и др. |
Читайте также:

