Реферат на тему растворы электролитов
Обновлено: 05.07.2024
Электролиты чрезвычайно важны в науке и технике. Все жидкие системы в живых организмах содержат электролит. Важный класс электролитов - полиэлектролиты.
Электролиты являются средой для проведения многих химических синтезов и процессов электрохимических производств. При этом всё большую роль играют неводные растворы электролитов. Благодаря им возможно создания новых химических источников тока и совершенствования технологических процессов разделения веществ - экстракции из растворов и ионного обмена.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения электронов.
Сила электролита в значительной степени зависит от природы растворителя. Мерой воздействия растворителя является диэлектрическая проницаемость, значение которой для воды весьма высока и при 20 градусах равно 81. Именно для воды свойство ослаблять химические связи между ионами особенно сильно.
Деление электролитов на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих электролитов, а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др.
Цель данного реферата дать определение понятию электролиты, выявить их свойства и различия, а также подробно рассмотреть диссоциации кислот, оснований и солей.
Электролитическая диссоциация.
Одним из важнейших факторов растворимости являются силы межмолекулярного взаимодействия возникающие между частицами растворенного вещества и молекулами растворителя. В ряде случаев действие этих сил приводит к тому, что дробление веществ на мельчайшие частицы в растворе идет дальше и растворение сопровождается диссоциацией молекул на ионы. Например:
Представьте, что газообразный хлористый водород попадает в воду и начинает взаимодействовать с молекулами растворителя. При этом молекулы HCl связываются с молекулами воды силами межмолекулярного взаимодействия. Обобщенно такой процесс называется гидратацией, а связанные с HCl молекулы воды – гидратной оболочкой.
В случае с раствором хлороводорода (соляная кислота) дальнейшая гидратация молекул HCl приводит к разрыву связи H–Cl и образованию в растворе гидратированных подвижных ионов H + (водн) и Cl – (водн). Ионы несут электрический заряд – положительный и отрицательный. Раствор, в котором теперь присутствуют подвижные ионы, становится электропроводным. Поэтому процесс распада вещества в растворе на ионы называется электролитической диссоциацией.
Электролитическая диссоциация – это полный или частичный распад растворенного вещества на ионы.
Теорию электролитической диссоциации в 80-х годах XIX века предложил выдающийся шведский химик Сванте Аррениус (1859-1927). Сегодня нам кажется вполне естественным, что растворенные вещества могут распадаться на ионы. Мы знаем, почему устойчивы именно такие, а не другие ионы – это знание опирается на современные представления о строении атомов. Например, элемент Na (электронная оболочка 1s 2 2s 2 2p 6 3s 1 ) может существовать в виде устойчивого катиона Na + , имеющего уже электронную оболочку чрезвычайно стабильной частицы – атома инертного газа неона (1s 2 2s 2 2p 6 ). В отличие от нейтрального атома неона, заряженная частица Na + хорошо взаимодействует с молекулами полярного растворителя – воды. Анион Cl – имеет электронную оболочку инертного газа аргона (…3s 2 3p 6 ). Таким образом, на процесс диссоциации влияет не только взаимодействие ионов с растворителем, но и фактор устойчивости самих ионов.
По признаку электрической проводимости все растворы можно разделить на две большие группы: растворы электролитов (проводят электрический ток) и растворы неэлектролитов (ток не проводят). Например, чистая вода, а также водные растворы сахара, глюкозы, спирта и ряда других веществ ток практически не проводят (в растворах отсутствуют ионы), поэтому эти вещества – неэлектролиты.
Напротив, раствор хлороводорода (соляная кислота) – это не просто электролит, а сильный электролит: более 99% молекул HCl в растворе распадаются на ионы H + и Cl – . Поэтому обратную стрелку в уравнении диссоциации HCl изображают короткой или вообще не пишут. Такие же свойства у растворов HBr (бромоводородная кислота) и HI (иодоводородная кислота).
Однако вполне похожее соединение – фтороводород HF – не проявляет свойств сильного электролита и в растворе ток проводит плохо. Здесь, наоборот, в уравнении диссоциации нужна более длинная обратная стрелка:
Константа и степень диссоциации.
В месте с процессом диссоциации на ионы, в растворах происходит и обратный процесс – ассоциация ионов в нейтральные молекулы. Таким образом, электролитическая диссоциация – это обратимая химическая реакция или динамическое равновесие, к которому применимы те же закономерности, что и к любому другому химическому равновесию. Например, для описания процесса диссоциации можно использовать константу равновесия Кр, которая в данном случае будет называться константой диссоциации Кд:
Итак, константа диссоциации Кд – это частный случай константы равновесия. Значения Кд для сильных электролитов часто бывают настолько велики, что их не удается измерить непосредственно. Эти значения получают косвенно, из термодинамических данных, и в разных справочниках они могут отличаться, хотя и остаются очень большими. Для нас здесь важно то обстоятельство, что ионов H + и Cl – в растворе очень много (их концентрация – в числителе дроби), а недиссоциированных молекул [HCl] чрезвычайно мало.
Напротив, Кд фтороводорода намного меньше единицы (ее значение уже можно определить более точно – см. следующий параграф). Следовательно, в растворе много недиссоциированных молекул HF и мало ионов H + и F – .
Оба раствора (HCl и HF) являются растворами электролитов, но HCl – сильный электролит, а HF – слабый. На примере этих двух веществ мы видим, что хорошую (или плохую) диссоциацию в растворе, как и хорошую (или плохую) растворимость трудно предсказать только по формуле вещества.
Помимо константы диссоциации, мерой силы электролита может служить степень диссоциации α. Это отношение числа распавшихся на ионы молекул (n1) к общему числу молекул (n0), изначально попавших в раствор:
сильные электролиты – α близка к 1 (или 100%);
слабые электролиты – α около 0,01 (1% и менее).
Поскольку вода – полноправный участник процесса диссоциации, ее иногда включают в химическое уравнение. Например, для уксусной кислоты процесс ее диссоциации в воде можно записать так:
Такие уравнения как бы подчеркивают, что ионы в водном растворе не изолированы, а связаны с молекулами растворителя. Для иона Н + это взаимодействие очень характерно: благодаря его связыванию с не поделенной электронной парой атома кислорода молекулы Н2О образуется достаточно прочный комплекс Н2О---Н + или, как его условно называют, ион гидроксония Н3О + . Конечно, молекулы воды взаимодействуют и с анионом CH3COO – (и любыми другими анионами), но это обстоятельство в уравнениях диссоциации обычно не отражают просто по традиции (и чтобы не загромождать уравнения).
Поскольку к процессу диссоциации применим принцип Ле Шателье, последнее уравнение указывает нам на еще одну важную закономерность: если разбавлять раствор уксусной кислоты, т.е. добавлять в него воду, то по принципу Ле Шателье должен активизироваться процесс, связанный с расходованием воды, т.е. прямая реакция (распад на ионы). В этом случае в растворе должен активизироваться процесс образования ионов из молекул. Иными словами, при разбавлении растворов слабых электролитов степень диссоциации возрастает.
Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
Полезность закона разбавления не исчерпывается определением констант диссоциации. Приведем простой пример его практического использования – вычислим более точно степень диссоциации в 0,1 М растворе уксусной кислоты, если ее константа диссоциации Кд = 1,8·10 –5 . Поскольку электролит слабый (это видно из константы диссоциации), можно воспользоваться законом разбавления для слабых электролитов: Кд = α 2 С. Отсюда:
Подставляя в эту формулу численные значения, получим:
Эта же формула поможет нам количественно определить, как изменитя степень диссоциации в таком растворе, если его разбавить в 10 раз. После разбавления концентрация уксусной кислоты составит 0,01 М. Отсюда:
Мы видим, что при разбавлении степень диссоциации уксусной кислоты заметно возросла.
Диссоциация кислот, оснований, солей.
При диссоциации кислот роль катионов играют ионы водорода (H + ), других катионов при диссоциации кислот не образуется:
Именно ионы водорода придают кислотам их характерные свойства: кислый вкус, окрашивание индикатора в красный цвет и проч.
Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляет кислотный остаток.
одноосновные кислоты: HCl, HF, HNO3;
двухосновные кислоты: H2SO4, H2CO3;
трехосновные кислоты: H3PO4.
Ступенчатая диссоциация двухосновной кислоты:
Ступенчатая диссоциация трехосновной кислоты:
При диссоциации многоосновных кислот самая высокая степень диссоциации приходится на первую ступень. Например, при диссоциации фосфорной кислоты степень диссоциации первой ступени равняется 27%; второй - 0,15%; третьей - 0,005%.
При диссоциации оснований роль анионов играют гидроксид-ионы (ОH - ), других анионов при диссоциации оснований не образуется:
однокислотные основания - KOH, NaOH;
двухкислотные основания - Ca(OH)2;
трехкислотные основания - Al(OH)3.
ZnOH + ↔ Zn 2+ + OH -
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот (диссоциировать с отщеплением катионов водорода), так и в роли оснований (диссоциировать с отщеплением гидроксид-ионов). Такие вещества называются амфотерными.
Диссоциация Zn(OH)2, как основания:
ZnOH + ↔ Zn 2+ + OH -
Диссоциация Zn(OH)2, как кислоты:
Соли диссоциируют в воде на анионы кислотных остатков и катионы металлов (или других соединений).
Нормальные (средние) соли получаются полным одновременным замещением всех атомов водорода в кислоте на атомы металла - это сильные электролиты, полностью диссоциируют в воде с образованием катоинов металла и однокислотного остатка: NaNO3, Fe2(SO4)3, K3PO4.
Кислые соли содержат в своем составе кроме атомов металла и кислотного остатка, еще один (несколько) атомов водорода - диссоциируют ступенчато с образованием катионов металла, анионов кислотного остатка и катиона водорода: NaHCO3, KH2PO4, NaH2PO4.
Основные соли содержат в своем составе кроме атомов металла и кислотного остатка, еще одну (несколько) гидроксильных групп - диссоциируют с образованием катионов металла, анионов кислотного остатка и гидроксид-иона: (CuOH)2CO3, Mg(OH)Cl.
Mg(OH)Cl ↔ Mg(OH) + + Cl -
Двойные соли получаются одновременным замещением атомов водорода в кислоте на атомы различных металлов: KAl(SO4)2.
Смешанные соли диссоциируют на катионы металла и анионы нескольких кислотных остатков: CaClBr.
CaClBr ↔ Ca 2+ + Cl - + Br -
Заключение.
Итак, подведем итоги: Электролитами называют вещества, растворы и сплавы которых с другими веществами электролитически проводят гальванический ток.
Признаком электролитической проводимости в отличии от металлической должно считать возможность наблюдать химическое разложение данного вещества при более или менее продолжительном прохождении тока. В химически чистом состоянии электролиты обыкновенно обладают ничтожно малой электропроводностью.
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например электролит золочения)
Электролиты являются важной частью химических источников тока: гальванических элементов и аккумуляторов. Электролит участвует в химических реакциях окисления и восстановления с электродами, благодаря чему возникает ЭДС. В источниках тока электролит может находиться в жидком состоянии (обычно это водный раствор) или загущённым до состояния геля.
В электролитических конденсаторах в качестве одной из обкладок используется электролит. В качестве второй обкладки — металлическая фольга (алюминий) или пористый, спечённый из металлических порошков блок (тантал, ниобий). Диэлектриком в таких конденсаторах служит слой оксида самого металла, формируемый химическими методами на поверхности металлической обкладки.
Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электрический ток.
Теорию электролитической диссоциации разработал Сванте Аррениус. Предложенная им теория объяснила поведение и многие свойства электролитов.
Согласно этой теории молекулы электролита в воде или другой среде, характеризующейся большой диэлектрической проницаемостью* , распадаются на ионы – положительные (катионы) и отрицательные (анионы).
Процесс распада вещества на ионы получил название электролитической диссоциации. Для слабых электролитов она протекает обратимо и выражается следующим примерным уравнением
К электролитам относятся вещества, в молекулах которых атомы связаны сильно полярной или ионной химической связью.
По современным представлениям электролитическая диссоциация в растворе происходит в результате сложного физико–химического взаимодействия молекул электролита с полярными молекулами растворителя.
Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов - гидратацией) ионов. Сольватация приводит к образованию в растворе ассоциаций между ионами (катионами и анионами) и молекулами растворителя. Процесс растворения вещества К+А- в воде, являющегося соединением с типичной ионной связью, может быть записан следующим образом:
твердое жидкий раствор
Электролитическая диссоциация полярных молекул (КА) в растворе происходит вследствие ослабления связи, вызванного действием полярных молекул растворителя:
КА + хН2О К+(Н2О)к + А-(Н2О)а.
Ассоциации К+(Н2О)к и А-(Н2О)а представляют собой гидратированные катионы и анионы.
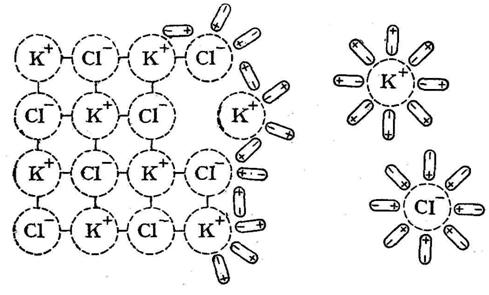
Немаловажное значение имеет величина диэлектрической проницаемости растворителя: чем больше последняя, тем больше ослабляются связи между ионами электролита. Это вытекает из формулы закона Кулона , где F – сила взаимодействия между зарядами l1 и l2, r расстояние между центрами ионов, ε – диэлектрическая проницаемость растворителя. Для воды при 20° ε = 80, то есть сила притяжения ионов в водном растворе ослабляется в 80 раз.
Если в растворе дополнительно могут возникнуть еще и водородные связи между молекулами растворителя и атомом водорода растворенного вещества, то процесс диссоциации протекает еще более эффективно.
С точки зрения теории электролитической диссоциации кислотой называется соединение, диссоциирующее в водном растворе с образованием гидратированных водородных ионов (гидроксоний-ионов) и кислотного остатка:
где Н3О+ - ион гидроксония.
Все общие свойства кислот (кислый вкус, способность изменять окраску индикаторов и т.д.) принадлежат иону гидроксония.
Основанием называется соединение, диссоциирующее в водном растворе с образованием отрицательных гидроксид–ионов ОН-:
МеОН + хН2О Ме+(Н2О)к + ОН- + (х-к)Н2О,
где Ме+ - одновалентный катион.
Все общие свойства растворимых оснований (щелочно–мыльный вкус, способность определенным образом изменять окраску индикаторов и т.д.) принадлежат гидроксид–иону.
С точки зрения электролитической диссоциации соли можно рассматривать как продукт взаимодействия кислоты и основания:
х(кислота) + у(основание) → соль + вода,
где х и у – переменное количество эквивалентов взаимодействующих между собой кислот и оснований.
В зависимости от соотношения х и у различают следующие виды солей, диссоциирующих в водных растворах по схеме:
при х > у – кислые соли
2H2SO4 + Mg(OH)2 ® Mg(HSO4)2 + 2H2O;
Mg(HSO4)2 Mg2+ + 2HSO4- ;
при х = у – средние (нормальные) соли
H2SO4 + Mg(OH)2 ® MgSO4 + 2H2O;
MgSO4 Mg2+ + SO42-;
при х 2MgOH+ + SO42-;
Как правило, все соли относятся к сильным электролитам.
Сильные электролиты в водных растворах полностью диссоциированы на ионы.
В воде, являющейся растворителем, статистически равномерно распределяются полностью гидратированные катионы и анионы сильного электролита. Электростатическое взаимодействие между ионами ослабляется до минимума большими расстояниями между ними и гидратными оболочками, выполняющими экранирующую роль.
В отличие от сильных электролитов диссоциация слабых электролитов протекает обратимо и устанавливается равновесие.
Количественно процесс диссоциации может быть охарактеризован рядом величин: степенью электролитической диссоциации a, константой электролитической диссоциации К и др.
Степень электролитической диссоциации a – это отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
a может измеряться в долях единицы или в процентах. a = 0, если диссоциация отсутствует; a = 1 или a = 100 % при полной диссоциации электролита.
К процессу электролитической диссоциации, как к обратимому процессу, можно применять принцип Ле Шателье и выявить влияние внешних факторов на состояние равновесия, приводящее к изменению значения a.
Для смещения равновесия
К+А- + хН2О К+(Н2О)к + А-(Н2О)а
слева направо, то есть в сторону диссоциации, необходимо увеличить массу растворителя. Это означает, что:
диссоциация слабых электролитов проходит эффективнее в разбавленных растворах, чем в концентрированных. Иными словами, a возрастает с уменьшением концентрации электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе.
так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры.
Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита:
где [К+], [A-] и [KA] - концентрации в растворе ионов и (в г-ион/л) и недиссоциированного соединения КА (в моль/л).
Чем больше К, тем электролит лучше распадается на ионы. Для данного электролита значение К постоянно при определенной температуре и в отличие от a не зависит от концентрации.
Связь между константой К и степенью диссоциации a может быть найдена следующим образом. Концентрация ионов К+ и А- в растворе равна
где С – исходная молярная концентрация; a – степень электролитической диссоциации электролита. Концентрация недиссоциировавших молекул КА в растворе равна
Данное уравнение выражает закон разбавления Оствальда.
Если a мала, то 1- a ≈ 1 и тогда
Видно, что с уменьшением концентрации электролита в растворе степень электролитической диссоциации возрастает.
Диссоциация слабого электролита, молекула которого может диссоциировать не на два, а на большее количество ионов (электролиты с разновалентными ионами), протекает по стадиям (ступенчатая диссоциация). Например, при диссоциации слабой угольной кислоты Н2СО3 в водном растворе имеют место следующие равновесия:
I стадия: Н2СО3 Н+ + НСО3-
II стадия: НСО3- Н+ + СО32-
Как видно из этих данных, процесс диссоциации слабого электролита с разновалентными ионами определяется главным образом первой ступенью.
Для примера приведем константы электролитической диссоциации некоторых слабых кислот и оснований (25 °С):
Для количественной оценки электролитической диссоциации используется понятие степени электролитической диссоциации () — отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Степень диссоциации определяется опытным путем и выражается в долях или процентах. Степень электролитической диссоциации зависит от природы растворителя и растворяемого вещества, температуры… Читать ещё >
Лекция по теме: «Электролитическая диссоация. Растворы электролитов ( реферат , курсовая , диплом , контрольная )
Все вещества по способности в растворе или в расплавленном состоянии проводить электрический ток можно подразделить на две группы: электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся кислоты, основания и соли.
Неэлектролитами называются вещества, растворы или расплавы которых электрический ток не проводят. Например, многие органические вещества.
Способность электролитов (проводников II рода) проводить электрический ток принципиально отличается от электропроводности металлов (проводников I рода): электропроводность металлов обусловлена движением электронов, а электропроводность электролитов связана с движением ионов.
Было обнаружено, что в растворах кислот, оснований и солей экспериментально найденные значения p, tкрист., tкип., pосм, больше теоретически рассчитанных для того же раствора по его молярной концентрации в i раз (i — изотонический коэффициент). Причем число частиц в растворе NaCl увеличилось почти в 2 раза, а в растворе СаCl2 — в 3 раза.
Для объяснения особенностей поведения электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория, получившая название теории электролитической диссоциации. Сущность теории состоит в следующем:
- 1. Электролиты при растворении в воде распадаются (диссоциируют) на заряженные частицы (ионы) — положительно заряженные катионы (Na + , K + , Ca 2+ , H + ) и отрицательно заряженные анионы (Cl-, SO4 2- , CO3 2- , OH-). Свойства ионов совершенно иные, чем у образовавших их атомов. Распад нейтрального вещества на ионы в результате химического взаимодействия с растворителем называютэлектролитической диссоциацией.
- 2. Под действием электрического тока ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду).
- 3. Диссоциация — процесс обратимый и равновесный. Это означает, что параллельно с распадом молекул на ионы (диссоциация), идет процесс соединения ионов в молекулы (ассоциация): КА К + + А-.
- 4. В растворе ионы находятся в гидратированном состоянии.
Для количественной оценки электролитической диссоциации используется понятие степени электролитической диссоциации () — отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Степень диссоциации определяется опытным путем и выражается в долях или процентах. Степень электролитической диссоциации зависит от природы растворителя и растворяемого вещества, температуры и концентрации раствора:
- 1. Чем более полярен растворитель, тем выше степень диссоциации в нем электролита.
- 2. Диссоциации подвергаются вещества с ионной и ковалентной полярной связью.
- 3. Повышение температуры, увеличивает диссоциацию слабых электролитов.
- 4. При уменьшении концентрации электролита (при разбавлении) степень диссоциации увеличивается.
В зависимости от величины степени диссоциация условно электролиты (при концентрации их растворов 0,1 М) делят на:
Средние (0,03 + и кислотного остатка (Cl- - хлорид, NO3— - нитрат, SO4 2- — сульфат, HCO3 гидрокарбонат, CO3 2 карбонат). Например: НСl Н + +Сl-, H2SO4 2Н + +SO4 2- .
Наличие в растворах кислот иона водорода, точнее, гидратированного иона Н3O + , обусловливает общие свойства кислот (кислый вкус, действие на индикаторы, взаимодействие со щелочами, взаимодействие с металлами с выделением водорода и пр.).
В многоосновных кислотах диссоциация происходит ступенчато, причем каждая ступень характеризуется своей величиной степени диссоциации. Так, ортофосфорная кислота диссоциирует по трем ступеням:
Причем 3 т. е. распад электролита на ионы протекает, в основном, по первой ступени и в растворе ортофосфорной кислоты будут находиться преимущественно ионы Н + и H2РO4-. Причины этого в том, что ионы водорода значительно сильнее притягиваются к трехзарядному иону РO4 3- и двухзарядному иону HРO4 2- , чем к однозарядному H2РO4-. Кроме того, на 2-ой и 3-ей ступенях имеет место смещение равновесия в сторону исходной формы по принципу Ле-Шателье за счет накапливающихся ионов водорода.
Основания — электролиты, диссоциирующие с образованием в качестве анионов только гидроксид-ионы (OH-). После отрыва OHостаются катионы: Na + , Cа 2+ , NH4 + . Например: NaOH Na + + ОН-, Са (ОН)2 Са 2+ + 2 OН-.
Общие свойства оснований (мыльность на ощупь, действие на индикатор, взаимодействие с кислотами и пр.) определяются наличием в растворах оснований гидроксо-группы ОН-.
Для многокислотных оснований характерна ступенчатая диссоциация:
Ва (ОН) + Ва 2+ + OН;
Диссоциация амфотерных гидроксидов протекает как по типу основания, так и по типу кислоты. Так, диссоциация гидроксида цинка может протекать по следующим направлениям (при этом равновесие сдвигается в зависимости от среды по принципу Ле-Шателье):
ZnО2 2- + 2Н + Zn (ОН)2 Zn 2+ + 2 ОН;
в щелочной среде.
Соли — это электролиты, диссоциирующие на катионы металла (или заменяющих его групп) и анионы кислотного остатка.
Средние соли диссоциируют полностью: CuSO4 Cu 2+ + SO4 2- . В отличие от средних солей, кислые и основные соли диссоциируют ступенчато:
Сu (ОН)Cl Сu (ОН) + + Cl;
Сu (ОН) + Сu 2+ + OН-,.
причем степень диссоциации солей по второй ступени очень мала.
Реакции обмена в растворах электролитов — это реакции между ионами. Необходимым условием протекания реакций обмена в растворах электролитов является образование слабодиссоциирующих соединений или соединений, выделяющихся из раствора в виде осадка или газа [18, "https://referat.bookap.info"].
При написании уравнений реакций в ионно-молекулярном виде слабодиссоциирующие, газообразные и труднорастворимые соединения записывают в виде молекул, а растворимые сильные электролиты — в виде ионов. При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде (Приложение А).
Рассмотрим методику написания ионных уравнений на примерах.
Пример 1. Напишите в ионно-молекулярной форме уравнение реакции:
Решение: Соли являются сильными электролитами и практически полностью диссоциируют на ионы. Так как ВаSО4 — практически нерастворимое соединение (см. таблицу приложения А), основная часть сульфата бария будет находиться в недиссоциированном виде, поэтому это вещество запишем в виде молекул, а остальные соли, являющиеся растворимыми, в виде ионов:
Ва 2+ + 2Сl- + 2K + + SО4 2- = ВаSО4 + 2K + + 2Сl;
Как видно из полученного полного ионно-молекулярного уравнения, ионы K + и Сlне взаимодействуют, поэтому, исключив их, получим краткое ионно-молекулярное уравнение:
Стрелка показывает, что образующееся вещество выпадает в осадок.
Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Причем суть любой химической реакции отображает именно краткое ионно-молекулярное уравнение. На основании ионно-молекулярного уравнения можно легко написать молекулярное.
Пример 2. Подберите молекулярное уравнение к следующему ионно-молекулярному уравнению:
Решение: Ионы водорода образуются при диссоциации любой сильной кислоты, например НСl. К ионам водорода в кратком ионном уравнении необходимо добавить два иона хлора. К сульфид-ионам следует добавить катионы (например, 2K + ), образующие растворимый, хорошо диссоциирующий электролит. Затем такие же ионы нужно написать в правой части. Тогда полное ионно-молекулярное и молекулярное уравнения будут иметь вид:
- 2Н + + 2Сl- + 2K + + S 2- = Н2S + 2K + + 2Сl-
- 2 НСl + K2S = Н2S + 2 KСl-
Сильные электролиты В водных растворах сильные электролиты полностью диссоциированы, поэтому даже при малых концентрациях растворов энергия электростатического взаимодействия между ионами довольно велика, и пренебречь этим нельзя. Взаимодействие противоположно и одноименно заряженных ионов (притяжение и отталкивание) приводит к тому, что вблизи каждого иона находятся ионы с противоположным зарядом, образующие его ионную атмосферу. Радиус ионной атмосферы сравнительно велик, поэтому ионные атмосферы соседних ионов пересекаются и образуются ионные пары; кроме того, каждый ион окружен дипольными молекулами растворителя — сольватной оболочкой (гидратной, если растворитель — вода). Этот процесс называется ассоциацией:
гидратированные ионы ионная пара
Чем выше концентрация раствора сильного электролита, тем больше вероятность образования ионных пар. Так в растворе возникает подобие пространственной структуры, что ограничивает свободу перемещения ионов и приводит к изменению свойств раствора. Поэтому опытно определяемые коллигативные свойства (p, tкрист., tкип., pосм), зависящие от общего числа частиц в растворе, оказываются меньше рассчитанных в предположении полной диссоциации. Так, для раствора К2SO4 экспериментально получено значение б=71%, а не 100%. Поэтому, определяя степень диссоциации раствора сильного электролита, получают кажущуюся степень диссоциации — величину б с поправкой на межионное взаимодействие. Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита.
Для оценки состояния ионов в растворе и возможности пользоваться соотношениями, выведенными для идеальных растворов, введено понятие активности электролита (а), равной произведению коэффициента активности (f) на концентрацию (С): а = f•С. Коэффициент активности f характеризует степень отклонения свойств данного раствора от идеального.
Слабые электролиты При растворении в воде слабого электролита устанавливается динамическое равновесие между недиссоциированными молекулами и продуктами их диссоциации — ионами. Количественной характеристикой данного равновесия является константа диссоциации (Кд). Так, например, для некоторого электролита АaВb, в растворе которого установилось равновесие:
константа диссоциации выражается следующим соотношением:
Кд =.
[АaВb].
Чем больше Кд, тем сильнее электролит. Если диссоциация протекает ступенчато, то каждой ступени отвечает своя Кд, как и своя степень диссоциации.
Константа и степень диссоциации связаны между собой. Рассмотрим это на примере электролита, распадающегося на два иона по уравнению: АВ А + +В - . Константа диссоциации такого равновесия будет иметь вид:
Кд =.
Пусть C молярная концентрация раствора, — степень диссоциации, тогда концентрация продиссоциировавших частиц (А + и В - ) будет равна C, а непродиссоциировавших (АВ) (1-)C. Тогда.
Кд =.
Так как для разбавленных растворов малая величина («1), то можно считать, что 1-?1. Тогда получаем соотношение (закон разбавления Оствальда):
Kд? C 2 или =.

Значения Kд для слабых электролитов невелики. Например, для диссоциации уксусной кислоты Kд = 1,810 -5 , что свидетельствует о том, что равновесие значительно смещено в сторону молекулярной формы.
По принципу Ле-Шателье эндотермический процесс диссоциации протекает более глубоко при увеличении температуры и связывании продуктов реакции.
2) MgCl 2 , CaBr 2
ТЕОРИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ.
СТЕПЕНЬ И КОНСТАНТА ДИССОЦИАЦИИ
Первая количественная теория растворов электролитов (теория электролитической диссоциации) была высказана Аррениусом. По этой теории молекулы электролитов при растворении распадаются на противоположно заряженные ионы. Процесс диссоциации слабого электролита обратим, т.е. наряду с диссоциацией молекул происходит образование молекул из ионов и, таким образом, в растворе наряду с ионами существуют и молекулы.
Доля молекул, распадающихся на ионы, оценивается степенью электролитической диссоциации , которую обычно обозначают . Степень диссоциации это отношение числа молекул, распавшихся на ионы, к числу молекул растворенного вещества.
Степень диссоциации является характеристикой электролита:
Для неэлектролитов (сахароза) = 0;
Для сильных электролитов ≥ 1;
Для слабых электролитов 0
Рассмотрим диссоциацию уксусной кислоты: СН 3 СООНН + + СН 3 СОО -
Так как процесс диссоциации слабого электролита обратим, то он характеризуется константой равновесия. Константа равновесия для процесса диссоциации есть константа диссоциации. Т.е. все закономерности, характерные для константы равновесия, справедливы и для константы диссоциации.
Константа диссоциации зависит от природы растворителя и температуры (=f(Т)), но не зависит от концентрации электролита в растворе ( f(С)).
Зависимость константы диссоциации от температуры описывается уравнением изобары Вант-Гоффа: .
Пусть концентрация растворенной уксусной кислоты будет С, а степень диссоциации равна . Тогда , ; ; .
Подставим эти значения в выражение константы диссоциации:
; - аналитическое выражение закона разбавления Оствальда, где С общая концентрация электролита [моль/дм 3 ].
Рассмотрим очень слабый электролит, степень диссоциации которого намного меньше единицы (
Как видно, степень диссоциации обратно пропорциональна корню квадратному из концентрации электролита. Чем больше концентрации, тем меньше степень диссоциации. В связи с этим вводится понятие бесконечно разбавленного раствора, в котором даже слабые электролиты полностью диссоциируют на ионы и отсутствуют силы электростатического взаимодействия.
ПРИЧИНЫ И МЕХАНИЗМ ИОНИЗАЦИИ
В ВОДНЫХ РАСТВОРАХ
1 . Ионизация в ионных соединениях.
К ионным соединениям относятся в основном соли с ионной кристаллической решеткой. Такие соединения состоят из ионов не только в растворе, но и в кристаллическом и парообразном состоянии:
NaCl Na + Cl Na + Cl -
Молекула воды полярна из-за разности электроотрицательности кислорода и водорода. Молекула воды имеет угловое строение. Кислород оттягивает на себя электронную плотность, так как его электроотрицательность выше, чем у водорода. На атоме кислорода возникает двойной частично отрицательный заряд, а на каждом из двух атомов водорода частично положительный заряд. Поэтому молекула воды поляризована и её можно представить в виде диполя.

Диполи воды подходят к ионам электролита в кристаллической решетке, ориентируются в его электростатическом поле и ослабляют взаимодействие между ионами в кристалле.

Происходит отрыв иона, его гидратация, то есть электролит растворяется в воде.
2 . Диссоциация полярных соединений. Кроме гидратации (сольватации) важным фактором, приводящим к диссоциации электролита, является способность молекул растворителя образовывать разного типа связи с частицами электролита.

Например, молекулы воды обладают способностью образовывать водородные связи не только между собой, но и с другими молекулами, содержащими атомы сильно отрицательных элементов, таких как фтор, кислород, азот, хлор и другие. Например, при растворении в воде хлороводорода происходит ориентация диполей воды вокруг растворенных молекул, вызывающая ещё большую поляризацию молекул хлороводорода.

Полярная связь между атомами водорода и хлора переходит в ионную. При этом общая электронная пара целиком сдвигается к атому хлора, и в результате происходит гетеролитический разрыв молекулы. Атом хлора превращается в гидратированный хлорид-ион, а протон с молекулой воды образует сложную положительно заряженную частицу H 3 O + , называемую гидроксонием.
HCl + xH 2 O = H 3 O + + Cl - (x-1)H 2 O
Так как гидратированная частица H 3 O + и гидратированный хлорид-ион в уравнении электролитической диссоциации могут быть заменены знаками иона водорода и хлора, то уравнение можно записать так:
ТЕОРИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ АРРЕНИУСА
- Электролиты это вещества, которые в соответствующих условиях диссоциируют на ионы.
- Процесс диссоциации характеризуется степенью диссоциации, которая возрастает с уменьшением концентрации.
- Между ионами в растворе нет взаимодействия.
Пользуясь теорией Аррениуса, нельзя было объяснить, почему разные методы определения константы диссоциации для некоторых электролитов дают разные значения, почему для ряда электролитов константа диссоциации зависит от концентрации раствора. А также тот экспериментальный факт, что для некоторых электролитов при высоких концентрациях раствора степень диссоциации получалась больше единицы. Теория не указывает причин, вызывающих диссоциацию молекул на ионы, и не объясняет, за счет каких сил она происходит. Поэтому существует ещё одна теория теория сильных электролитов Кольрауша.
ТЕОРИЯ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ КОЛЬРАУША
ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Растворы электролитов это проводники 2 рода, обладающие ионной проводимостью. Количественной характеристикой способности растворов переносить электрический ток является электропроводность.
Электропроводность это величина, обратная сопротивлению.
где R сопротивление [Ом]; - удельное сопротивление [Ом·м]; l длина проводника [м]; S площадь поперечного сечения [м 2 ].
Различают два вида электропроводности:
- Удельная электропроводность то величина, обратная удельному сопротивлению.
æ=, [Ом -1 ·м -1 ] = [См/м], где См [Сименс=].
Удельная электрическая проводимость раствора электролита это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м 2 и расположенными на расстоянии 1 м друг от друга.
Величина удельной электропроводности прямо пропорционально зависит от концентрации ионов в единице объема, скорости их движения и переносимого каждым ионом заряда.
Молярная электрическая проводимость раствора мера электрической проводимости всех ионов, образующихся при диссоциации 1 моль электролита при данной концентрации. Молярная электропроводность это электрическая проводимость объема раствора V (м 3 ), заключенного между двумя параллельными электродами, с межэлектродным расстоянием 1 м, причем каждый электрод имеет такую площадь, чтобы в этом объеме содержался 1 моль растворенного вещества.
Между молярной и удельной электрическими проводимостями имеется соотношение
- молярная электрическая проводимость, См·м 2 /моль; æ удельная электрическая проводимость, См/м; V разведение раствора, м 3 /моль; С концентрация, моль/м 3 . Если концентрация раствора выражена в моль/дм 3 , а æ в См/см, то это уравнение записывается в виде
Электропроводность зависит от:
- концентрации;
- температуры;
- вязкости раствора;
- диэлектрической проницаемости среды.
1. Зависимость от концентрации.
а) удельная электрическая проводимость æ= f (С).

В растворах сильных и слабых электролитов рост æ обусловлен увеличением числа ионов в объеме раствора. В области концентрированных растворов сильных электролитов понижение æ связано с увеличением вязкости растворов. У слабых электролитов снижается степень диссоциации, а, следовательно, и число ионов, переносящих электричество.
б) молярная электрическая проводимость = f (С).

С уменьшением концентрации увеличивается. Это объясняется тем, что 1) для сильных электролитов с уменьшением концентрации увеличивается расстояние между ионами и уменьшается межионное взаимодействие;
2) для слабых электролитов с уменьшением концентрации увеличивается степень диссоциации , т.е. увеличивается число ионов.
Зависимость молярной электропроводности от концентрации это тест на силу электролита.
Кольрауш экспериментально установил, что для сильных электролитов существует зависимость

где - молярная электропроводность; - молярная электропроводность бесконечно разбавленного раствора; А константа, зависящая от диэлектрической проницаемости , вязкости растворителя и температуры А=82,4/( Т) 1/2 . Если выразить зависисмость от графически, то получим для сильного электролита прямую, а для слабого электролита кривую. Для сильных электролитов молярная электропроводность при бесконечном разбавлении обычно находится графической экстраполяцией прямой = f () к С=0. Для слабых электролитов находится по закону независимого движения ионов Кольрауша: , где - предельная подвижность катиона, - предельная подвижность аниона. Эти значения можно найти в таблицах справочников.
В концентрированных растворах электролитов существует два вида торможения ионов: релаксационное и электрофоретическое.
1. Релаксационное торможение.
Согласно электростатической теории растворов сильных электролитов ионная атмосфера обладает центральной симметрией. При движении иона симметрия нарушается, а затем вновь формируется в другом положении. Этот процесс протекает с конечной скоростью, называемой временем релаксации . Вследствие этого ионная атмосфера теряет центральную симметрию, а позади движущегося иона всегда будет некоторый избыток заряда противоположного знака. Возникающие при этом силы электростатического притяжения будут тормозить движение иона.
2. Электрофоретическое торможение.
В водной среде ионы гидратированы. Центральный ион и его ионная атмосфера имеют разные по знаку заряды и двигаются в противоположных направлениях. Поэтому движение центрального иона происходит в среде, перемещающейся ему навстречу, что снижает скорость его движения.
Молярная электропроводность данной концентрации всегда меньше молярной концентрации предельно разбавленного раствора из-за сил межмолекулярного взаимодействия:
где и - уменьшение электрической проводимости за счет электрофоретического и релаксационного торможений.
Зависимость молярной электрической проводимости от концентрации для 1,1-валентного электролита выражается уравнением Онзагера:
и - константы, полученные с учетом сил электрофоретического и релаксационного эффекта торможения.
2. Зависимость электропроводности от температуры.
Экспериментально установлено, что с увеличением температуры на 1 удельная электропроводность возрастает примерно на 2-2,5%.
3. Зависимость от вязкости растворителя.
Правило ВальденаПисаржевского выражает закономерность зависимости молярной электропроводности при бесконечном разведении от вязкости растворителя : , если характер сольватации не меняется при переходе от растворителя к растворителю. В противном случае приходится учитывать диэлектрическую проницаемость среды (А.М. Шкодин): .
ПОДВИЖНОСТЬ ИОНА И ЧИСЛА ПЕРЕНОСА
Электропроводность электролитов связана со скоростями движения ионов в растворе. Скорость движения w i [м с -1 ] иона в растворе про-порциональна напряженности приложенного электрического поля Е [В м -1 ]:
Коэффициент пропорциональности u [м 2 с -1 В -1 ] называется абсолютной подвижностью иона.
Произведение u i F ( F - постоянная Фарадея) называется подвижностью иона i [Ом -1 м 2 моль -1 ]:
Подвижность иона при бесконечном разбавлении называется предельной подвижностью иона и обозначается .
Согласно закону Кольрауша о независимой миграции ионов, молярная электропроводность раствора при бесконечном разведении равна сумме предельных подвижностей катионов и анионов:
Доля тока, переносимая данным ионом, называется числом переноса t i иона: , причем по определению =1.
Свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность . Активность иона а i выражается в виде произведения концентрации иона m i , на его коэффициент активности i :
Экспериментально определить активности катиона а + и аниона а невозможно, поэтому вводится понятие средней ионной активности а . Для электролита, образующего катионов и анионов,
Аналогично определяют средний ионный коэффициент активности
и среднюю ионную моляльность m
где m = m + / + = m - / - - моляльность электролита.
Активность электролита определяется как
а = (а ) = ( m ) = m ( + + ).
Согласно закону ионной силы , коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от ионной силы I раствора:
где z i - заряд иона (в единицах заряда протона), m i - его моляльная концентрация.
Согласно первому приближению теории Дебая-Хюккеля , можно рассчитать коэффициент активности i отдельного иона
и средний ионный коэффициент активности :
где z + и z - заряды катиона и аниона, I - ионная сила раствора, А - константа, зависящая от диэлектрической проницаемости растворителя и температуры. Для водного раствора при 25 С А=0,509.
ПРАКТИЧЕСКОЕ ПРИЛОЖЕНИЕ КОНДУКТОМЕТРИЧЕСКИХ ИЗМЕРЕНИЙ
Определение электропроводности называют кондуктометрическими измерениями.
1. Экспериментальное определение констант диссоциации слабых электролитов.
, где - табличная величина. В свою очередь молярную электрическую проводимость можно вычислить по формуле: =1000·æ/С [См·см 2 /моль]. При этом удельная электропроводность æ измеряется опытным путем.
2. Определение концентрации труднорастворимых веществ и их растворимости.
Определение растворимости основано на том, что насыщенный раствор малорастворимых электролитов можно считать бесконечно разбавленным. Измеряя удельную электропроводность такого раствора и рассчитывая для него молярную электропроводность, определяют его концентрацию, т.е. растворимость электролита.
=1000·æ/С С=1000·æ/ ; (табличные значения).
3. Кондуктометрическое титрование.
Этот способ является особенно ценным в случае мутных или окрашенных растворов, которые титровать с применением обычных индикаторов часто невозможно.
Этот метод основан на замене ионов титруемого вещества ионами добавляемого реагента в процессе титрования. Так как в общем случае подвижности указанных ионов разные, то в точке эквивалентности всегда наблюдается резкое изменение электропроводности. Например, титруем сильную кислоту HCl сильным основанием NaCl ^
H + + Cl - + Na + + OH - = H 2 O + Na + + Cl - .
В ходе титрования более подвижные ионы водорода заменяются менее подвижными ионами натрия, поэтому электропроводность падает. После т.э. появляются дополнительные ионы натрия и гидроксида, и электропро-водность растет. Преимущества метода: не нужно титровать по каплям.

Можно титровать сильную кислоту
сильным основанием, слабую кислоту сильным основанием или смесь сильной и слабой кислот.
Читайте также:

