Реферат на тему одноатомные спирты
Обновлено: 05.07.2024
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с углеводородным радикалом.
Они могут рассматриваться поэтому как производные углеводородов, в молекулах которых один или несколько атомов водорода заменены на гидроксильные группы.
В зависимости от числа гидроксильных групп спирты подразделяются на одно-, двух-, трехатомные и т. д.
1. История открытия спиртов
Этиловый спирт, вернее, хмельной растительный напиток, его содержащий, был известен человечеству с глубокой древности.
Впервые спирт из вина получили в VI—VII веках арабские химики, а первую бутылку крепкого алкоголя (прообраза современной водки) изготовил персидский алхимик Ар-Рази в 860 году. В Европе этиловый спирт был получен из продуктов брожения в XI—XII веке, в Италии.
В 1660 году английский химик и богослов Роберт Бойль впервые получил обезвоженный этиловый спирт, а также открыл его некоторые физические и химические свойства, в частности обнаружив способность этанола выступать в качестве высокотемпературного горючего для горелок. Абсолютированный спирт был получен в 1796 году русским химиком Т. Е. Ловицем.
В 1842 году немецкий химик Я. Г. Шиль открыл, что спирты образуют гомологический ряд, отличаясь на некоторую постоянную величину. Правда, он ошибся, описав её как C2H2. Спустя два года, другой химик Шарль Жерар установил верное гомологическое соотношение CH2 и предсказал формулу и свойства неизвестного в те годы пропилового спирта. В 1850 году английский химик Александр Вильямсон, исследуя реакцию алкоголятов с иодистым этилом, установил, что этиловый спирт является производным от воды с одним замещенным водородом, экспериментально подтвердив формулу C2H5OH. Впервые синтез этанола действием серной кислоты на этилен осуществил в 1854 году французский химик Марселен Бертло.
Впервые третичный спирт (2-метил-пропан-2-ол) синтезировал в 1863 году известный русский ученый А. М. Бутлеров, положив начало целой серии экспериментов в этом направлении.
Двухатомный спирт — этиленгликоль — впервые был синтезирован французским химиком А.Вюрцем в 1856 году. Трехатомный спирт — глицерин — был обнаружен в природных жирах ещё в 1783 году шведским химиком Карлом Шееле, однако его состав был открыт только в 1836 году, а синтез осуществлен из ацетона в 1873 году Шарлем Фриделем.
2. Нахождение в природе
Спирты имеют самое широкое распространение в природе, особенно в виде сложных эфиров, однако и в свободном состоянии их можно встретить достаточно часто.
Метиловый спирт в небольшом количестве содержится в некоторых растениях, например: борщевике (Heracleum).
Этиловый спирт — естественный продукт спиртового брожения органических продуктов, содержащих углеводы, часто образующийся в прокисших ягодах и фруктах без всякого участия человека. Кроме того, этанол является естественным метаболитом и содержится в тканях и крови животных и человека.
Фенилэтиловый спирт — душистый компонент розового эфирного масла.
Очень широко представлены в растительном мире терпеновые спирты, многие из которых являются душистыми веществами
3. Физические свойства
Этиловый спирт (этанол) С2Н5ОН — бесцветней жидкость, легко испаряющаяся (температура кипения 64, 7 ºС, температура плавления - 97, 8 ºС, оптическая плотность 0, 7930) . Спирт, содержащий 4—5 % воды, называют ректификатом, а содержащий только доли процента воды — абсолютным спиртом. Такой спирт получают химической обработкой в присутствии водоотнимающих средств (например, свежепрокаленного СаО).
4. Химические свойства
Как у всех кислородосодержащих соединений, химические свойства этилового спирта определяются, в первую очередь, функциональными группами и, в известной степени, строением радикала.
Характерной особенностью гидроксильной группы этилового спирта является подвижность атома водорода, что объясняется электронным строением гидроксильной группы. Отсюда способность этилового спирта к некоторым реакциям замещения, например, щелочными металлами. С другой стороны, имеет значение и характер связи углерода с кислородом. Вследствие большой электроотрицательности кислорода по сравнению с углеродом, связь углерод-кислород также в некоторой степени поляризована с частичным положительным зарядом у атома углерода и отрицательным – у кислорода. Однако, эта поляризация не приводит к диссоциации на ионы, спирты не являются электролитами, а представляют собой нейтральные соединения, не изменяющие окраску индикаторов, но они имеют определенный электрический момент диполя.
Спирты являются амфотерными соединениями, то есть могут проявлять как свойства кислот, так и свойства оснований.
Физико-химические свойства спиртов определяются в основном строением углеводородной цепи и функциональной группы −OH, а также их взаимным влиянием:
1) Чем больше заместитель, тем сильнее он влияет на функциональную группу, снижая полярность связи O—Н. Реакции, основанные на разрыве этой связи, протекают более медленно.
2) Гидроксильная группа −ОН уменьшает электронную плотность вдоль прилегающих связей углеродной цепи (отрицательный индуктивный эффект).
Все химические реакции спиртов можно разделить на три условных группы, связанных с определёнными реакционными центрами и химическими связями:
Разрыв связи O−H;
Разрыв или присоединение по связи С−OH;
Разрыв связи −СOH.
5. Получение и производство
До начала 30-х годов 20 века его получали исключительно сбраживанием пищи углеводсодержащего сырья, и при обработки зерна (рожь, ячмень, кукуруза, овёс, просо) . В 30-е по 50-е годы было разработано несколько способов синтеза из химического сырья
Реакция начинается с атаки ионом водорода того углеродного атома, который связан с большим числом водородных атомов и является поэтому более электроотрицательным, чем соседний углерод. После этого к соседнему углероду присоединяется вода с выбросом Н+. Этим методом в промышленном масштабе готовят этиловый, втор-пропиловый и трет-бутиловый спирты.
Для получения этилового спирта издавна пользуются различными сахаристыми веществами, например, виноградным сахаром, или глюкозой, которая путем "брожения", вызываемого действием ферментов (энзимов), вырабатываемых дрожжевыми грибками, превращается в этиловый спирт.
Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, алкилгалогениды, амины, карбонильные соединения, эпоксиды. Существует множество методов получения спиртов, среди которых выделим наиболее общие:
реакции окисления — основаны на окислении углеводородов содержащих кратные или активированные C−H связи;
реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
реакции гидратации — кислотно-катализируемое присоединение воды к алкенам (гидратация);
реакции замещения (гидролиза) — реакции нуклеофильного замещения, при которых имеющиеся функциональные группы замещаются на гидроксильную группу;
синтезы с использованием металлорганических соединений;
6. Применение
Этиловый спирт широко используют в различных областях промышленности и прежде всего в химической. Из него получают синтетический каучук, уксусную кислоту, красители, эссенции, фотопленку, порох, пластмассы. Спирт является хорошим растворителем и антисептиком. Поэтому он находит применение в медицине.
Основным спиртом, используемых в медицинских целях, является этанол. Его используют в качестве наружного антисептического и раздражающего средства для приготовления компрессов и обтираний. Ещё более широко применяется этиловый спирт для приготовления различных настоек, разведений, экстрактов и прочих лекарственных форм.
Спирты довольно широко используются в качестве душистых веществ для составления композиций в парфюмерно-косметической промышленности.
В пищевой промышленности широкое применение спиртов общеизвестно: основой всех алкогольных напитков является этанол, который получается при сбраживании пищевого сырья — винограда, картофеля, пшеницы и прочих крахмало- или сахаросодержащих продуктов. Кроме того, этиловый спирт используется в качестве компонента (растворителя) некоторых пищевых и ароматических эссенций (ароматизаторов), широко используемых в кулинарии, при выпечке кондитерских изделий, производстве шоколада, конфет, напитков, мороженного, варений, желе, джемов, конфитюров и пр.
Однако, этиловым, список спиртов, используемых в индустрии продуктов питания, не ограничивается. Спирты можно встретить среди самых разных пищевых добавок
Этиловый спирт — сильный наркотик. Попадая в организм, он быстро всасывается в кровь и приводит организм в возбужденное состояние, при котором человеку трудно контролировать свое поведение. Употребление спирта часто является основной причиной тяжелых дорожно-транспортных аварий, несчастных случаев на производстве и бытовых преступлений. Спирт вызывает тяжелые заболевания нервной и сердечно-сосудистой систем, а также желудочно-кишечного тракта.
Спирт опасен в любой концентрации (водка, настойки, вино, пиво и т.д.). Этиловый спирт, применяемый для технических целей, специально загрязняют дурно пахнущими веществами. Такой спирт называют денатуратом (для этого спирт подкрашивают, чтобы отличить его от чистого спирта).
Спирты могут оказывать негативное воздействие на организм. Особенно ядовит метиловый спирт 5-10 мл спирта вызывают слепоту и сильное отравление организма, а 30 мл могут привести к смертельному исходу.
Этиловый спирт наркотик. При приеме внутрь он вследствие высокой растворимости быстро всасывается в кровь и возбуждающе действует на организм. Под влиянием спиртного у человека ослабевает внимание, затормаживается реакция, нарушается координация, появляется развязность, грубость в поведении и т. д. Все это делает его неприятным и неприемлемым для общества. Но следствия употребления алкоголя могут быть и более глубокими. При частом потреблении появляется привыкание, пагубное пристрастие к нему и в конце концов тяжелое заболевание алкоголизм. Спиртом поражаются слизистые оболочки желудочно-кишечного тракта, что может вести к возникновению гастрита, язвенной болезни желудка, двенадцатиперстной кишки. Печень, где должно происходить разрушение спирта, не справляясь с нагрузкой, начинает перерождаться, в результате возникает цирроз. Проникая в головной мозг, спирт отравляюще действует на нервные клетки, что проявляется в нарушении сознания, речи, умственных способностей, в появлении психических расстройств и ведет к деградации личности.
Особенно опасен алкоголь для молодых людей, так как в растущем организме интенсивно протекают процессы обмена веществ, а они особенно чувствительны к токсическому воздействию. Поэтому у молодежи быстрее, чем у взрослых, может появиться алкоголизм.
Описание спиртов как соединений, содержащих одну или несколько гидроксильных групп, строение метилового спирта. Способы упорядочения названий спиртов в нескольких номенклатурных системах. Описание получения одноатомных спиртов различными способами.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 09.12.2010 |
| Размер файла | 287,0 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
OДНОАТОМНЫЕ СПИРТЫ
Спиртами называются соединения, содержащие одну или несколько гидроксильных групп. По их числу спирты подразделяются на одноатомные, двухатомные, трехатомные и т.д. Длины связей и валентные углы в метиловом спирте приведены ниже.
Строение метилового спирта
Валентные углы в 109 о и 110 о указывают на sp 3 -гибридизацию атома углерода, две неподеленные пары электронов кислорода расположены на sp 3 -гибридных орбиталях.
НОМЕНКЛАТУРА
Для спиртов существует несколько способов их названия. В современной номенклатуре ИЮПАК для названия спирта к названию углеводорода добавляют окончание "ол". Самую длинную цепь, содержащую функциональную ОН-группу, нумеруют с того конца, к которому ближе всего находится гидроксильная группа, а заместители обозначаются в префиксе, например:
одноатомный спирт соединение
В некоторых спиртах группу СH2OH удобнее называть гидроксиметил, например:
Иногда спирты называют, пользуясь названием алкильной группы:
В этой номенклатуре положение заместителя в алкильной группе обозначается буквами греческого алфавита.
В другой номенклатуре, называемой карбинольной, простейший спирт CH3OH называется карбинол, остальные - как его производные.
Эта номенклатура удобна для самых простых спиртов, т.к. в ней легко различаются первичные, вторичные и третичные спирты.
ПОЛУЧЕНИЕ ОДНОАТОМНЫХ СПИРТОВ
1.Гидратация алкенов
При взаимодействии алкенов с разбавленными водными растворами кислот основным продуктом оказывается спирт.
Этот метод в лабораторных условиях нашел ограниченную область применения для получения третичных спиртов.
Для получения других спиртов он применим ограниченно, поскольку гидратация алкенов часто сопровождается изомеризацией за счет перегруппировок промежуточно образующихся карбокатионов.
Поэтому в лабораторной практике его вытеснил другой способ, основанный на реакции гидроксимеркурирования-демеркурирования алкенов.
2. Гидроксимеркурирование-демеркурирование алкенов
Эта реакция не сопровождается перегруппировками и приводит к образованию индивидуальных спиртов. Направление реакции соответствует правилу Марковникова, реакция проводится в мягких условиях с выходами, близкими к количественным.
3. Гидроборирование алкенов с последующим окислением
Гидроборирование алкенов и последующее окисление боранов раствором пероксида водорода в щелочной среде приводит, в конечном итоге, к антимарковниковскому продукту присоединения воды к двойной связи.
4. Восстановление альдегидов и кетонов алюмогидридом лития или боргидридом натрия
LiAlH4 и NaBH4 восстанавливают альдегиды до первичных спиртов, а кетоны до вторичных, причем боргидрид натрия предпочтителен вследствие большей безопасности в обращении: его можно использовать даже в водном и спиртовом растворах. Алюмогидрид лития реагирует с водой и со спиртом со взрывом и разлагается со взрывом при нагревании выше 120 о в сухом состоянии.
Алюмогидрид лития при 0-10 о восстанавливает ненасыщенные альдегиды и кетоны до аллиловых спиртов, сохраняя двойную углерод-углеродную связь и восстанавливая карбонильную группу.
Та же самая реакция циклогексен-2-она с NaBH4 приводит к смеси циклогексен-2-ола и циклогексанола в соотношении 1,5:1 в результате присоединения гидрид-иона как к карбонильному углероду, так и к углероду при двойной углерод-углеродной связи.
Лучшим реагентом для избирательного восстановления карбонильной группы в a,b-ненасыщенных альдегидах и кетонах, не затрагивающим двойную углерод-углеродную связь, является диизобутилалюминийгидрид (ДИБАЛ-Н).
5. Восстановление сложных эфиров и карбоновых кислот до первичных спиртов
Первичные спирты образуются при восстановлении сложных эфиров и карбоновых кислот алюмогидридом лития в эфире или ТГФ. Особенно удобен в препаративном отношении метод восстановления сложных эфиров алюмогидридом лития. Следует отметить, что боргидрид натрия не восстанавливает сложноэфирную и карбоксильную группы. Это позволяет проводить селективное восстановление карбонильной группы с помощью NaBH4 в присутствии сложноэфирной и карбоксильной групп. Выходы продуктов восстановления редко бывают ниже 80%. Боргидрид лития в отличие от NaBH4 восстанавливает сложные эфиры до ипервичных спиртов.
6. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
Эти реакции подробно рассмотрены в методической разработке, посвященной металлоорганическим соединениям. Здесь будут приведены только отдельные примеры.
7. Восстановление эпоксидов (оксиранов) с помощью алюмогидрида лития
Эпоксиды под действием LiAlH4 в эфире или ТГФ превращаются в спирты. Реакция состоит в нуклеофильной атаке гидрид-иона по наименее замещенному или пространственно незатрудненному атому углерода с образованием вторичного или третичного спирта.
Раскрытие эпоксидного кольца в циклогексанах происходит в результате аксиальной атаки гидрид-иона и поэтому в образующемся циклогексаноле атом водорода и ОН-группа находятся в аксиальном положении.
Эпоксидное кольцо раскрывается также под действием диалкилкупратов лития. В качестве примера приведем образование транс-2-метилциклогексанола при взаимодействии циклогексаноксида с диметилкупратом лития.
8. Взаимодействие алкилгалогенидов и алкилтозилатов с супероксидом калия
В качестве побочных продуктов всегда получаются алкены, выход которых возрастает при синтезе вторичных спиртов. Для примера приведем получение октанола-1 и октанола-2 из 1-иодоктана и 2-иодоктана, соответственно.
Замещение галогена или тозилоксигруппы на гидроксил сопровождается полным обращением конфигурации у асимметрического атома углерода; так из тозилата (S)-октанола-2 был получен R-октанол-2 с оптической чистотой 97-99%.
Метанол в промышленности получают из оксида углерода (II) и водорода (синтез-газ) над сложным катализатором, состоящим из оксидов меди и цинка, нанесенных на Al2O3 в жестких условиях.
Подобные документы
Класс органических соединений - спиртов, их распространение в природе, промышленное значение и исключительные химические свойства. Одноатомные и многоатомные спирты. Свойства изомерных спиртов. Получение этилового спирта. Особенности реакций спиртов.
доклад [349,8 K], добавлен 21.06.2012
Соединения енолов и фенолов. Происхождение слова алкоголь. Классификация спиртов по числу гидроксильных групп, характеру углеводородного радикала. Их изомерия, химические свойства, способы получения. Примеры применения этилового и метилового спиртов.
презентация [803,3 K], добавлен 27.12.2015
Классификация спиртов по числу гидроксильных групп (атомности) и характеру углеводородного радикала. Получение безводного этанола - "абсолютного спирта", его применение в медицине, пищевой промышленности и парфюмерии. Распространение спиртов в природе.
презентация [11,7 M], добавлен 30.05.2016
Виды спиртов, их применение, физические свойства (кипение и растворимость в воде). Ассоциаты спиртов и их строение. Способы получения спиртов: гидрогенизация окиси углерода, ферментация, брожение, гидратация алкенов, оксимеркурирование-демеркурирование.
реферат [116,8 K], добавлен 04.02.2009
Основные способы получения спиртов. Гидрогенизация окиси углерода. Ферментация. Синтез спиртов из алкенов. Синтез спиртов из галогеноуглеводородов, из металлоорганических соединений. Восстановление альдегидов, кетонов и эфиров карбоновых кислот.
реферат [150,9 K], добавлен 04.02.2009
Реакционные центры в молекуле спиртов. Разновидности механизма превращения спиртов в алкилхлориды взаимодействием их с тионилхлоридом. Превращение спиртов в алкилсульфонаты и их дальнейшие реакции. Механизм дегидратации спиртов по правилам Е1 и Е2.
реферат [173,0 K], добавлен 04.02.2009
Физические и химические свойства спиртов, их взаимодействие с щелочными металлами. Замещение гидроксильной группы спирта галогеном, дегидратация, образование сложных эфиров. Производство этилового, метилового и других видов спиртов, области их применения.
Одноатомные спирты (алкоголи) – это производные алканов, молекула которых имеет одну функциональную гидроксильную группу. Она связана с насыщенным атомом углерода.
В учебниках химии можно встретить определение спиртов – это обширный класс химических соединений, выполняющих важнейшие функции в живых организмах. Рассматриваемые вещества широко применяются в промышленном производстве и повседневной жизни.
Описание и общая формула одноатомных спиртов
В таких спиртах атом водорода замещается гидроксильной группой ОН. Они имеют формулу CnH2n+1OH.
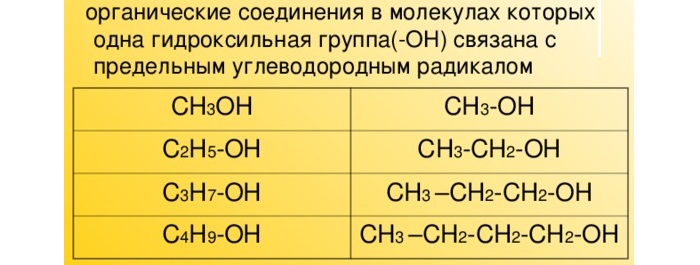
В современной номенклатуре их названия связаны с гомологическим рядом предельных алканов с суффиксом –ол (этанол, пропанол, бутанол, пропанол, гексанол и проч).
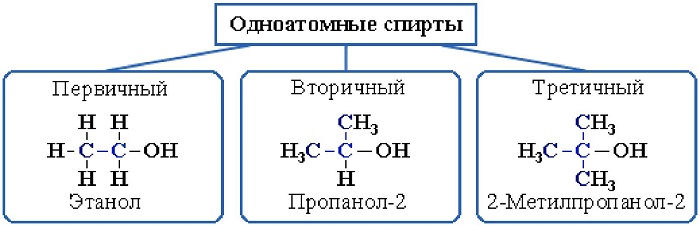
В зависимости от размещения группы ОН, существует классификация алкоголей:
первичные –группа ОН присоединена к первому атому С;
вторичные – гидроксильная группа присоединена ко второму атому этого элемента;
третичные – группа ОН присоединена к третьему атому углерода.
Изомерия одноатомных спиртов
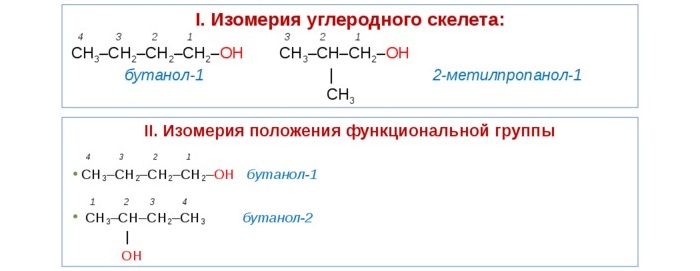
Для этих веществ характерны разные виды изомерии:
Структурная – изменение расположения ОН начиная с соединений, содержащих 3 атома углерода. Так, существует пропанол 1 (н-пропиловый) и пропанол-2 (изопропиловый).
Изомерия углеродного звена – изменение положения гидроксильной группы, начиная с веществ, молекула которых содержит 4 углеродных атома. Так, бутанолу соответствует четыре разных изомера.
Межклассовая изомерия (с эфирами). Этиловому алкоголю с формулой СН3CH2–OH соответствует диметиловый эфир CH3–O–CH3.
Пространственная, или зеркальная изомерия.
Физические свойства
Вещества с количеством атомов углерода до 15 являются летучими жидкостями с резким запахом. Соединения с числом атомов углерода свыше 15 являются твердыми веществами.

Начальный член гомологического ряда (метанол) чрезвычайно токсичен для человека.
Чем выше спирт, тем и выше его температура кипения. Различия между каждым членом гомологического ряда составляет примерно 20 градусов. По мере увеличения размера молекулы и ее массы снижается и их воспламеняемость. Следовательно, легче всех воспламеняется метанол.
Соединения, имеющие в составе молекулы 9 атомов углерода, растворяются в воде (метанол и этанол – в каком угодно соотношении). Хорошо растворяются в растворителях.
Химические свойства
Рассматриваемые вещества ведут себя и как основания, и как кислоты.
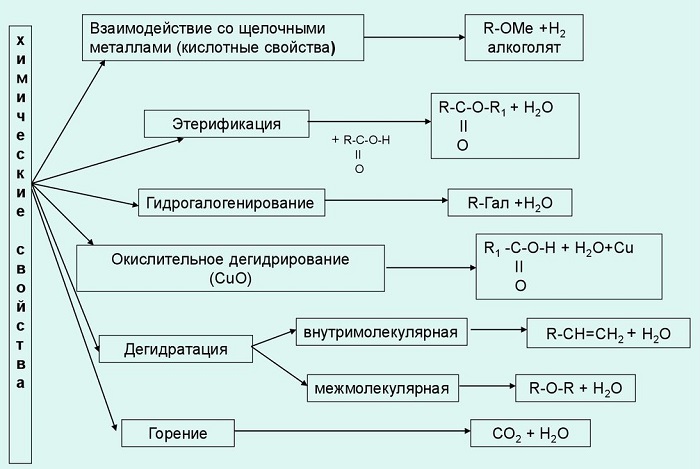
Основные химические свойства одноатомных спиртов:
Взаимодействие с щелочными металлами. При этом образуются алкоголяты или алкоксиды. В воде эти вещества подвергаются гидролизу, образуя спирт и основание.
Взаимодействие с кислотами (органическими и неорганическими). По-другому они называются реакциями этерификации, поскольку конечный их продукт - сложный эфир.
Реакция с хлористым тионилом дает в итоге галогеналкан.
В результате внутримолекулярного обезвоживания получают алкены.
При межмолекулярной дегидратации образуются простые эфиры.
Химическая реакция одноатомного алкоголя с перманганатом калия дает альдегид. Дальнейшим окислением альдегида можно получить одноатомную карбоновую кислоту.
Получение

Известно несколько методов получения простых спиртов:
1. Гидратация алкенов (с присоединением молекулы воды):
2. Гидролиз алкилгалогенидов (с добавлением водных растворов щелочей):
3. Восстановление кетонов:
4. Этанол получают путем разложения глюкозы:
5. Восстановление карбоновых кислот и сложных эфиров.
6. Присоединение металлорганических химических соединений к кетонам и альдегидам.
Применение одноатомных спиртов
Одноатомные спирты широко применяются как исходный реагент для получения альдегидов, кетонов, карбоновых кислот и эфиров. Все эти вещества широко применяются в производстве и быту.
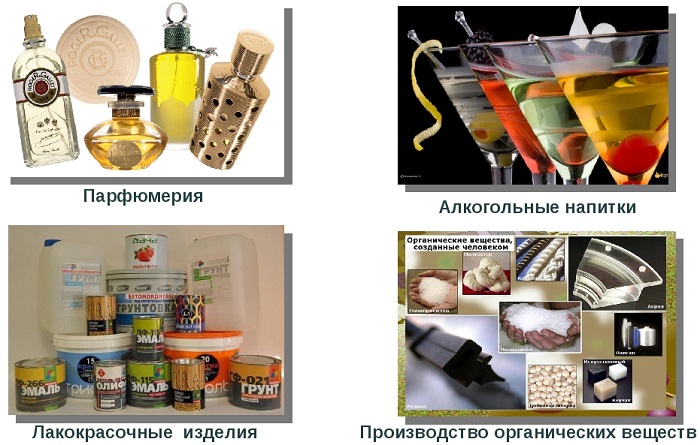
Вот примеры использования наиболее распространенных спиртов:
Метанол является прекрасным органическим растворителем. Его применяют в производстве лаков и красок, органических смол.
Этанол широко используется в медицине как антисептик и растворитель. В пищевой промышленности его используют для получения алкогольных напитков. Он является основой для получения сложных эфиров, уксуса.
Бутанол применяется как растворитель и основа для получения веществ с приятным ароматом.
Бензиловый спирт является основой для получения душистых веществ.
Рассмотренные в статье вещества имеют широкое применение в промышленности. Без них невозможно получение многих веществ, использующихся в быту.
Одноатомные спирты (алкоголи) – это производные алканов, молекула которых имеет одну функциональную гидроксильную группу. Она связана с насыщенным атомом углерода.
В учебниках химии можно встретить определение спиртов – это обширный класс химических соединений, выполняющих важнейшие функции в живых организмах. Рассматриваемые вещества широко применяются в промышленном производстве и повседневной жизни.
Описание и общая формула одноатомных спиртов
В таких спиртах атом водорода замещается гидроксильной группой ОН. Они имеют формулу CnH2n+1OH.

В современной номенклатуре их названия связаны с гомологическим рядом предельных алканов с суффиксом –ол (этанол, пропанол, бутанол, пропанол, гексанол и проч).

В зависимости от размещения группы ОН, существует классификация алкоголей:
первичные –группа ОН присоединена к первому атому С;
вторичные – гидроксильная группа присоединена ко второму атому этого элемента;
третичные – группа ОН присоединена к третьему атому углерода.
Изомерия одноатомных спиртов

Для этих веществ характерны разные виды изомерии:
Структурная – изменение расположения ОН начиная с соединений, содержащих 3 атома углерода. Так, существует пропанол 1 (н-пропиловый) и пропанол-2 (изопропиловый).
Изомерия углеродного звена – изменение положения гидроксильной группы, начиная с веществ, молекула которых содержит 4 углеродных атома. Так, бутанолу соответствует четыре разных изомера.
Межклассовая изомерия (с эфирами). Этиловому алкоголю с формулой СН3CH2–OH соответствует диметиловый эфир CH3–O–CH3.
Пространственная, или зеркальная изомерия.
Физические свойства
Вещества с количеством атомов углерода до 15 являются летучими жидкостями с резким запахом. Соединения с числом атомов углерода свыше 15 являются твердыми веществами.

Начальный член гомологического ряда (метанол) чрезвычайно токсичен для человека.
Чем выше спирт, тем и выше его температура кипения. Различия между каждым членом гомологического ряда составляет примерно 20 градусов. По мере увеличения размера молекулы и ее массы снижается и их воспламеняемость. Следовательно, легче всех воспламеняется метанол.
Соединения, имеющие в составе молекулы 9 атомов углерода, растворяются в воде (метанол и этанол – в каком угодно соотношении). Хорошо растворяются в растворителях.
Химические свойства
Рассматриваемые вещества ведут себя и как основания, и как кислоты.

Основные химические свойства одноатомных спиртов:
Взаимодействие с щелочными металлами. При этом образуются алкоголяты или алкоксиды. В воде эти вещества подвергаются гидролизу, образуя спирт и основание.
Взаимодействие с кислотами (органическими и неорганическими). По-другому они называются реакциями этерификации, поскольку конечный их продукт — сложный эфир.
Реакция с хлористым тионилом дает в итоге галогеналкан.
В результате внутримолекулярного обезвоживания получают алкены.
При межмолекулярной дегидратации образуются простые эфиры.
Химическая реакция одноатомного алкоголя с перманганатом калия дает альдегид. Дальнейшим окислением альдегида можно получить одноатомную карбоновую кислоту.
Получение

Известно несколько методов получения простых спиртов:
1. Гидратация алкенов (с присоединением молекулы воды):
CH2 = CH2 + H2O → CH3CH2OH.
2. Гидролиз алкилгалогенидов (с добавлением водных растворов щелочей):
CH3CH2Сl + NaOH → CH3CH2OH + NaCl.
3. Восстановление кетонов:
CH3-C(O)-CH3 + Н2
→ CH3-CH(CH)-CH3.
4. Этанол получают путем разложения глюкозы:
C6H12O6 → 2C2H5OH + 2CO2.
5. Восстановление карбоновых кислот и сложных эфиров.
6. Присоединение металлорганических химических соединений к кетонам и альдегидам.
Применение одноатомных спиртов
Одноатомные спирты широко применяются как исходный реагент для получения альдегидов, кетонов, карбоновых кислот и эфиров. Все эти вещества широко применяются в производстве и быту.

Вот примеры использования наиболее распространенных спиртов:
Метанол является прекрасным органическим растворителем. Его применяют в производстве лаков и красок, органических смол.
Этанол широко используется в медицине как антисептик и растворитель. В пищевой промышленности его используют для получения алкогольных напитков. Он является основой для получения сложных эфиров, уксуса.
Бутанол применяется как растворитель и основа для получения веществ с приятным ароматом.
Бензиловый спирт является основой для получения душистых веществ.
Рассмотренные в статье вещества имеют широкое применение в промышленности. Без них невозможно получение многих веществ, использующихся в быту.

Атомы водорода в углеводородах могут быть замещены на группы атомов, которые определяют не только принадлежность вещества тому или иному классу соединений, но и его физические и химические свойства. Такие группы называют функциональными.
Одной из важнейших функциональных групп в органической химии является группа
–ОН, которую называют гидроксильной (или гидроксилом).
Производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу – ОН, называют спиртами.
В зависимости от типа углеводородного радикала спирты подразделяют на предельные и непредельные.
В зависимости от числа гидроксильных групп в молекуле спирты делят на одноатомные (одна гидроксильная группа), двухатомные (две гидроксильные группы), трехатомные и другие многоатомные.
Предельными одноатомными спиртами (алканолами) называют органические соединения, содержащие гидроксильную группу – ОН, связанную с алкильным радикалом: CnH2n+1-ОН

Э лектронное и пространственное строение гидроксильной группы. Атом кислорода в невозбужденном состоянии имеет конфигурацию внешнего электронного уровня 2s 2 2p 4 ; из шести электронов два являются неспаренными:

С читают что атом кислорода в спиртах находится в состоянии sр 3 - гибридизации. За счет двух неспаренных электронов на sp 3 -орбиталях атом кислорода образует две ковалентные полярные связи с атомами водорода и углерода. На двух других орбиталях кислород содержит две пары электронов. Гидроксильная группа имеет угловую форму:
Атом кислорода за счет высокой электроотрицательности несет частичный отрицательный заряд. Атомы углерода и водорода обеднены электронной плотностью и имеют частичный положительный заряд. Таким образом, спирты представляют собой полярные соединения.
Гомологический ряд предельных одноатомных спиртов. Изомерия. Первым представителем гомологического ряда предельных одноатомных спиртов (табл. 7.1) является метиловый спирт
Структурные формулы и названия некоторых предельных одноатомных спиртов

СН3ОН (метанол). За ним следует второй гомолог - этиловый спирт C2H5OH (этанол) (рис. 7.1).

Рис. 7.1. Модели молекул метилового (а) и этилового (6) спирта
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы, а с четвертого – изомерия углеродного скелета.
Номенклатура. Если гидроксильная группа находится у первичного углеродного атома, спирт называют первичным, если у вторичного – вторичным, у третичного – третичным. Общая формула гомологического ряда алканолов СnН2n+ 1ОН.
Физические свойства. В гомологическом ряду предельных одноатомных спиртов нет газообразных веществ. Это связано с тем, что молекулы спиртов в значительной степени ассоциированы, т. е. связаны друг с другом водородными связями:

Этим объясняются более высокие по сравнению с соответствующими алканами температуры кипения и плавления. Спирты до C12 – жидкости, высшие спирты – твердые вещества.
Жидкие спирты бесцветные; обладают характерным запахом. Метанол и этанол смешиваются с водой в любых соотношениях. С увеличением молекулярной массы растворимость спиртов падает. Твердые спирты в воде практически не растворимы и лишены запаха. Метанол очень ядовит. Небольшие его количества вызывают слепоту и смерть.
Получение и химические свойства предельных одноатомных спиртов
Способы получения алканолов. Все способы получения предельных одноатомных спиртов можно разделить на общие и специфические. К общим свойствам относят гидролиз галогеналканов, гидратацию алкенов, восстановление альдегидов; к специфическим - отдельные способы получения метанола и этанола.
1. Гидролиз галогеналканов. При взаимодействии галогенпроизводных предельных углеводородов с водными растворами щелочей атом галогена замещается на гидроксильную группу:

Этим способом можно получать спирты любого строения: первичные, вторичные, третичные.

2 . Гидратация алкенов. В присутствии кислот молекула воды присоединяется по двойной углерод-углеродной связи этиленовых углеводородов с образованием спирта. Присоединение протекает по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному атому углерода двойной связи:
3. Восстановление карбонильных соединений. При пропускании смеси паров альдегида (этот класс органических соединении рассмотрен в гл. 8) с водородом над никелевым катализатором происходит присоединение водорода по двойной связи углерод – кислород с образованием спирта:

4. Получение метанола. В промышленности метиловый спирт получают из водяного газа – смеси оксида углерода(II) и водорода:

Реакцию ведут при температуре 250 – 300 0 С в присутствии катализатора оксида цинка или оксида xpoмa(III).
5. Получение этанола. Специфическим способом получения этилового спирта является брожение растворов, содержащих сахаристые вещества, например сахарозу или глюкозу. Так, глюкоза в водном растворе под действием ферментов (органических катализаторов белковой природы) претерпевает спиртовое брожение, превращаясь в этиловый спирт:

Химические свойства спиртов. Спирты могут реагировать с разрывом связей О – Н или О – С в первом случае они проявляют очень слабые кислотные свойства. Водные растворы спиртов не действуют на индикаторы.
1. Реакции замещения атома водорода. Подобно слабым кислотам спирты взаимодействуют со щелочными металлами с образованием солей – алкоголятов – и выделением водорода. Например, металлический натрий реагирует с этиловым спиртом, образуя этилат натрия:

Алкогoляты щелочных металлов легко реагируют с водой, в результате чего образуется исходный спирт и щелочь:
2. Реакция этерификации. Важнейшим свойством спиртов является образование сложных эфиров с карбоновыми кислотами:

Реакции этерификации протекают в присутствии сильных кислот в качестве катализатора и являются обратимыми. (Подробнее о реакциях этерификации и сложных эфирах см. в гл. 9.)
3. Горение спиртов. Спирты горят на воздухе бледно-голубым пламенем с выделением большого количества теплоты:
Этиловый спирт рассматривают как альтернативное бензину автомобильное топливо.
4. Дегидратация спиртов. При нагревании спиртов с водоотнимающими веществами происходит отщепление молекул воды. Дегидратация может протекать как внутри одной молекулы, так и межмолекулярно.
В н у т р и м о л е к у л я р н а я дегидратация протекает при нагревании спиртов с концентрированной серной кислотой до температуры более 180 0 С:

Из этилового спирта таким способом можно получить этилен. Метанол в подобную реакцию не вступает.
М е ж м о л е к у л я р н а я дегидратация спиртов происходит при более низких температурах (менее 140 0 С). В этом случае одна молекула воды отщепляется от двух молекул спирта и образуются соединения, относящиеся к классу простых эфиров. Они являются межклассовыми изомерами спиртов:

5. Взаимодействие с галогеноводородными кислотами. Спирты взаимодействуют с хлоро- и бромоводородной кислотой. При этом гидроксильная группа замещается на атом галогена:
Применение спиртов. Многие спирты используют для получения сложных эфиров. Их применяют в пищевой промышленности в качестве ароматизаторов, отдушек и растворителей, в парфюмерии. Метанол используют для производства формальдегида, некоторых лекарственных веществ. Его применяют также в качестве растворителя лаков и красок. Метанол очень ядовит. Он является нервно-сосудистым ядом. При попадании в организм от 5 до 10мл этого вещества наступает паралич зрения вследствие поражения сетчатки глаз; доза 30мл и более вызывает смерть. Наиболее широкое применение имеет этиловый спирт. В больших количествах его используют при производстве синтетического каучука. Этиловый спирт является растворителем и исходным материалом для производства лаков, медикаментов, душистых веществ, из него получают диэтиловый эфир, сложные эфиры, красители. В медицине этанол применяют как дезинфицирующее средство и растворитель для многих лекарственных форм. В ряде стран этанол используют в качестве альтернативного топлива для двигателей внутреннего сгорания.
Большое количество этилового спирта потребляет пищевая промышленность.
Что такое функциональная группа? Какую группу атомов называют гидроксильной?
Какие органические вещества называют спиртами? Как их классифицируют? Какие спирты называют предельными одноатомными?
Охарактеризуйте электронное строение гидроксильной группы. Как особенности химического строения предельных одноатомных спиртов отражаются на их физических свойствах?
Приведите названия и формулы первых пяти представителей гомологического ряда предельных одноатомных спиртов. Назовите вещества. Какова общая формула алканолов?
Напишите структурные формулы следующих соединений: а) 2-метилпропанола-2; б) 2,3-диметилпентанола-3; в) 3-метилбутанола-2.
При сгорании органического вещества массой 6,9г образовалось 13,2г оксида углерода(IV) и 8,1г воды. Плотность паров этого вещества по воздуху 1,59. Определите молекулярную формулу вещества и напишите возможные изомеры.
Приведите не менее трех способов получения этилового спирта. Какие из этих способов можно использовать для получения гомологов этанола?
Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с
Читайте также:

