Реферат на тему никель по химии
Обновлено: 02.07.2024
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Министерство Образования Республики Беларусь
Белорусский Национальный Технический Университет
Кафедра Химии Реферат на тему:
Химия никеля.Исполнитель: Адамчик Ю.В. гр. 104312
_______________________
Руководитель: Медведев Д.И.
_______________________
Распространение в природе
Физические и химические свойства
Применение никеля в технике
Применение чистого никеля
Применение никелевых сплавов
Основой современной техники являются металлы и металлические сплавы. Разнообразные требования к металлическимматериаламвозрастают по мере развития новых отраслей техники.
В наше время успешно и все более широко используется атомная энергия в мирных целях, предъявляя высокие требования к новым материалам с особыми свойствами; реактивная техника, теоретические основы которой были разработаны нашими учеными многие десятки лет назад, могла стать на службу советского народа только после того, как были созданы и внедрены специальные жаропрочные сплавы.Прогрессивно развивающиеся отрасли промышленности — химическая, нефтяная, машиностроение, транспорт и другие — основываются на широком применении высокопрочных железных, никелевых и других сплавов. Среди главнейших в современной технике металлов никелю принадлежит одно из первых мест. Хотя по распространенности в природе никель занимает среди металлов только тринадцатое место, однако по степени его значения в технике он стоит наравне с железом, алюминием, хромом и другими важнейшими металлами.
Никель обладает ценными химическими и высокими механическими свойствами. Благодаря хорошей пластичности из никеля можно получать разнообразные изделия методом деформации в горячем и холодном состоянии. Основным объектом применения никеля являются металлические сплавы. В этих сплавах никель является или основой, или одним из важных легирующих элементов, придающих сплавам те или иные необходимые свойства. Не случайно, что в течение многих лет в общем потреблении никеля расход его качестве сплавов или легирующего элемента составляет более 80%. Остальная часть никеля применяется в чистом виде (8%) и для никелевых защитных покрытий (около 10%).
В качестве сплавов никель нашел широкое применение в виде жаропрочных, кислотостойких, магнитных материалов, сплавов с особыми физическими свойствами. Особенно большое значение имеет применение никеля в качестве легирующего элемента в специальных сталях и сплавах. О большом разнообразии составов никелевых сплавов свидетельствует то, что по сведениям, опубликованным в последние годы, имеется более 3000 описанных в литературе составов никелевых сплавов, содержащих различные элементы в разных пропорциях и предназначенных для
Похожие работы
2014-2022 © "РефератКо"
электронная библиотека студента.
Банк рефератов, все рефераты скачать бесплатно и без регистрации.
"РефератКо" - электронная библиотека учебных, творческих и аналитических работ, банк рефератов. Огромная база из более 766 000 рефератов. Кроме рефератов есть ещё много дипломов, курсовых работ, лекций, методичек, резюме, сочинений, учебников и много других учебных и научных работ. На сайте не нужна регистрация или плата за доступ. Всё содержимое библиотеки полностью доступно для скачивания анонимному пользователю

Никель — простое вещество, пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен. Относится к тяжелым цветным металлам, в чистом виде на земле не встречается – обычно входит в состав различных руд, высокой твердостью, хорошо полируется, является ферромагнетиком – притягивается магнитом, в периодической системе Менделеева обозначается символом Ni и имеет 28 порядковый номер.
Смотрите так же:
СТРУКТУРА
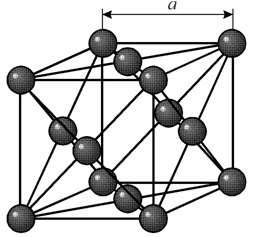
Имеет гранецентрированную кубическую решетку с периодом a = 0,35238 å нм, пространственная группа Fm3m. Эта кристаллическая структура устойчива к давлению, по меньшей мере 70 ГПа. При обычных условиях никель существует в виде b-модификации, имеющей гранецентрированную кубическую решётку ( a = 3,5236 å). Но никель, подвергнутый катодному распылению в атмосфере h 2 , образует a-модификацию, имеющую гексагональную решётку плотнейшей упаковки ( а = 2,65 å, с = 4,32 å), которая при нагревании выше 200 °С переходит в кубическую. Компактный кубический никель имеет плотность 8,9 г/см 3 (20 °С), атомный радиус 1,24 å
СВОЙСТВА

Никель — ковкий и тягучий металл, из него можно изготовлять тончайшие листы и трубки. Предел прочности при растяжении 400—500 Мн/м 2 , предел упругости 80 Мн/м 2 , предел текучести 120 Мн/м 2 ; относительное удлинение 40%; модуль нормальной упругости 205 Гн/м 2 ; твёрдость по Бринеллю 600—800 Мн/м 2 . В температурном интервале от 0 до 631К (верхняя граница соответствует Кюри точке ). Ферромагнетизм никеля обусловлен особенностями строения внешних электронных оболочек его атомов. Никель входит в состав важнейших магнитных материалов и сплавов с минимальным значением коэффициента теплового расширения (пермаллой, монель-металл, инвар и др.).
ЗАПАСЫ И ДОБЫЧА

Никель довольно распространён в природе — его содержание в земной коре составляет около 0,01%(масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (до 8%). Содержание его в ультраосновных породах примерно в 200 раз выше, чем в кислых (1,2кг/т и 8г/т). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13 — 0,41% Ni.
В растениях в среднем 5·10 −5 весовых процентов никеля, в морских животных — 1,6·10 −4 , в наземных — 1·10 −6 , в человеческом организме — 1…2·10 −6 .
Основную массу никеля получают из гарниерита и магнитного колчедана.
Силикатную руду восстанавливают угольной пылью во вращающихся трубчатых печах до железо-никелевых окатышей (5—8% Ni), которые затем очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
Карбонильный способ (метод Монда): Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель [Ni(CO)4], термическим разложением которого выделяют особо чистый металл.
Алюминотермический способ восстановления никеля из оксидной руды: 3NiO + 2Al = 3Ni +Al2O3
ПРОИСХОЖДЕНИЕ

Месторождения сульфидных медно-никелевых руд связаны с лополитоподобными или плитообразными массивами расслоенных габброидов, приуроченных к зонам глубинных разломов на древних щитах и платформах. Характерной особенностью медно-никелевых месторождений всего мира является выдержанный минеральный состав руд: пирротин, пентландит, халькопирит, магнетит; кроме них в рудах встречаются пирит, кубанит, полидимит, никелин, миллерит, виоларит, минералы группы платины, изредка хромит, арсениды никеля и кобальта, галенит, сфалерит, борнит, макинавит, валлерит, графит, самородное золото.
Экзогенные месторождения силикатных никелевых руд повсеместно связаны с тем или иным типом коры выветривания серпентенитов. при выветривании происходит стадийное разложение минералов, а также перенос подвижных элементов, с помощью воды из верхних частей коры в нижние. Там эти элементы выпадают в осадок в виде вторичных минералов.
В месторождениях этого типа заключены запасы никеля в 3 раза превышающие его запасы в сульфидных рудах, а запасы некоторых месторождений достигают 1 млн т. и более никеля. Крупные запасы силикатных руд сосредоточены на Новой Каледонии, Филиппинах, Индонезии, Австралии и др. странах. Среднее содержание в них никеля равно 1.1-2%. Кроме того в рудах часто содержится кобальт.
ПРИМЕНЕНИЕ
Подавляющая часть никеля используется для получения сплавов с другими металлами (fe, cr, cu и др.), отличающихся высокими механическими, антикоррозионными, магнитными или электрическими и термоэлектрическими свойствами. В связи с развитием реактивной техники и созданием газотурбинных установок особенно важны жаропрочные и жаростойкие хромоникелевые сплавы. Сплавы никеля используются в конструкциях атомных реакторов.
Значительное количество никеля расходуется для производства щелочных аккумуляторов и антикоррозионных покрытий. Ковкий никель в чистом виде применяют для изготовления листов, труб и т.д. Он используется также в химической промышленности для изготовления специальной химической аппаратуры и как катализатор многих химических процессов. Никель — весьма дефицитный металл и по возможности должен заменяться другими, более дешёвыми и распространёнными материалами.
Никель (лат. Niccolum), Ni, химический элемент первой триады VIII группы периодической системы Менделеева, атомный номер 28, атомная масса 58,70; серебристо-белый металл, ковкий и пластичный.
Металл в нечистом виде впервые получил в 1751 шведский химик А. Кронстедт, предложивший и название элемента. Значительно более чистый металл получил в 1804 немецкий химик И. Рихтер.
Содержание работы
1. Название элемента.
2. Положение в периодической системе.
3. Физические свойства.
4. Химические свойства.
5. Нахождение элемента и его соединений в пищевом сырье и продуктах питания.
6. Биологическая роль.
7. Методы качественного и количественного определения элемента.
8. Список литературы.
Файлы: 1 файл
Никель.docx
- Название элемента.
- Положение в периодической системе.
- Физические свойства.
- Химические свойства.
- Нахождение элемента и его соединений в пищевом сырье и продуктах питания.
- Биологическая роль.
- Методы качественного и количественного определения элемента.
- Список литературы.
Никель (лат. Niccolum), Ni, химический элемент первой триады VIII группы периодической системы Менделеева, атомный номер 28, атомная масса 58,70; серебристо-белый металл, ковкий и пластичный.
Распространение в природе.Н. — элемент земных глубин (в ультраосновных породах мантии его 0,2% по массе). Существует гипотеза, что земное ядро состоит из никелистого железа; в соответствии с этим среднее содержание Н. в земле в целом по оценке около 3%. В земной коре, где Н. 5,8×10-3%, он также тяготеет к более глубокой, так называемой базальтовой оболочке. Ni в земной коре — спутник Fe и Mg, что объясняется сходством их валентности (II) и ионных радиусов; в минералы двухвалентных железа и магния Н. входит в виде изоморфной примеси. Собственных минералов Н. известно 53; большинство из них образовалось при высоких температурах и давлениях, при застывании магмы или из горячих водных растворов. Месторождения Н. связаны с процессами в магме и коре выветривания. Промышленные месторождения Н. (сульфидные руды) обычно сложены минералами Н. и меди (см. Никелевые руды). На земной поверхности, в биосфере Н. — сравнительно слабый мигрант. Его относительно мало в поверхностных водах, в живом веществе. В районах, где преобладают ультраосновные породы, почва и растения обогащены никелем.
При обычных условиях Н. существует в виде b-модификации, имеющей гранецентрированную кубическую решётку (a = 3,5236 ). Но Н., подвергнутый катодному распылению в атмосфере H2, образует a-модификацию, имеющую гексагональную решётку плотнейшей упаковки (а = 2,65 , с = 4,32 ), которая при нагревании выше 200 °С переходит в кубическую. Компактный кубический Н. имеет плотность 8,9 г/см3 (20 °С), атомный радиус 1,24 , ионные радиусы: Ni2+ 0,79 , Ni3+ 0,72 ; tпл 1453 °С; tkип около 3000 °С; удельная теплоёмкость при 20 °С 0,440 кдж/(кг·К) [0,105 кал/(г°С)]; температурный коэффициент линейного расширения 13,310-6 (0—100 °С); теплопроводность при 25 °С 90,1 вмl (м·K) [0,215 кал/(см·сек·оС)]; то же при 500 °С 60,01 вм/(м·К) [0,148 кал/см (сек·оС)]. Удельное электросопротивление при 20 °С 68,4 ном·м, т. е. 6,84 мком·см; температурный коэффициент электросопротивления 6,8×10-3 (0—100 °С).
Н. — ковкий и тягучий металл, из него можно изготовлять тончайшие листы и трубки. Предел прочности при растяжении 400—500 Мн/м2 (т. е. 40—50 кгс/мм2), предел упругости 80 Мн/м2, предел текучести 120 Мн/м2; относительное удлинение 40%; модуль нормальной упругости 205 Гн/м2; твёрдость по Бринеллю 600—800 Мн/м2. В температурном интервале от 0 до 631 К (верхняя граница соответствует Кюри точке) Н. ферромагнитен. Ферромагнетизм Н. обусловлен особенностями строения внешних электронных оболочек (3d84s2) его атомов. Н. вместе с Fe (3d64s2) и Со (3d74s2), также ферромагнетиками, относится к элементам с недостроенной 3d-электронной оболочкой (к переходным 3d-металлам). Электроны недостроенной оболочки создают нескомпенсированный спиновый магнитный момент, эффективное значение которого для атомов Н. составляет 6 mБ, где mБ — Бора магнетон. Положительное значение обменного взаимодействия в кристаллах Н. приводит к параллельной ориентации атомных магнитных моментов, т. е. к ферромагнетизму. По той же причине сплавы и ряд соединений Н. (окислы, галогениды и др.) магнитоупорядочены (обладают ферро-, реже ферримагнитной структурой, см. Магнитная структура). Н. входит в состав важнейших магнитных материалов и сплавов с минимальным значением коэффициента теплового расширения (пермаллой, монель-металл, инвар и др.).
.Ni сходен с Fe и Со, но также и с Cu и благородными металлами. В соединениях проявляет переменную валентность (чаще всего 2-валентен). Н. — металл средней активности, Поглощает (особенно в мелкораздробленном состоянии) большие количества газов (H2, CO и др.); насыщение Н. газами ухудшает его механические свойства. Взаимодействие с кислородом начинается при 500 °С; в мелкодисперсном состоянии Н. пирофорен — на воздухе самовоспламеняется. Из окислов наиболее важна закись NiO — зеленоватые кристаллы, практически нерастворимые в воде (минерал бунзенит). Гидроокись выпадает из растворов никелевых солей при прибавлении щелочей в виде объёмистого осадка яблочно-зелёного цвета. При нагревании Н. соединяется с галогенами, образуя NiX2. Сгорая в парах серы, даёт сульфид, близкий по составу к Ni3S2. Моносульфид NiS может быть получен нагреванием NiO с серой.
С азотом Н. не реагирует даже при высоких температурах (до 1400 °С). Растворимость азота в твёрдом Н. приблизительно 0,07% по массе (при 445 °С). Нитрид Ni3N может быть получен пропусканием NH3 над NiF2, NiBr2 или порошком металла при 445 °С. Под действием паров фосфора при высокой температуре образуется фосфид Ni3P2 в виде серой массы. В системе Ni — As установлено существование трёх арсенидов: Ni5As2, Ni3As (минерал маухерит) и NiAs. Структурой никель-арсенидного типа (в которой атомы As образуют плотнейшую гексагональную упаковку, все октаэдрические пустоты которой заняты атомами Ni) обладают многие металлиды. Неустойчивый карбид Ni3C может быть получен медленным (сотни часов) науглероживанием (цементацией) порошка Н. в атмосфере CO при 300 °С. В жидком состоянии Н. растворяет заметное количество С, выпадающего при охлаждении в виде графита. При выделении графита Н. теряет ковкость и способность обрабатываться давлением.
В ряду напряжений Ni стоит правее Fe (их нормальные потенциалы соответственно —0, 44 в и —0,24 в) и поэтому медленнее, чем Fe, растворяется в разбавленных кислотах. По отношению к воде Н. устойчив. Органические кислоты действуют на Н. лишь после длительного соприкосновения с ним. Серная и соляная кислоты медленно растворяют Н.; разбавленная азотная — очень легко; концентрированная HNO3 пассивирует Н., однако в меньшей степени, чем железо.
При взаимодействии с кислотами образуются соли 2-валентного Ni. Почти все соли Ni (II) и сильных кислот хорошо растворимы в воде, растворы их вследствие гидролиза имеют кислую реакцию. Труднорастворимы соли таких сравнительно слабых кислот, как угольная и фосфорная. Большинство солей Н. разлагается при прокаливании (600—800 °С). Одна из наиболее употребительных солей — сульфат NiSO4 кристаллизуется из растворов в виде изумруднозелёных кристаллов NiSO4×7H2O — никелевого купороса. Сильные щёлочи на Н. не действуют, но он растворяется в аммиачных растворах в присутствии (NH4)2CO3 с образованием растворимых аммиакатов, окрашенных в интенсивно-синий цвет; для большинства из них характерно наличие комплексов [Ni (NH3)6]2+ и [Ni (OH)2(NH3)4]. На избирательном образовании аммиакатов основываются гидрометаллургические методы извлечения Н. из руд. NaOCI и NaOBr осаждают из растворов солей Ni (II), гидроокись Ni (OH)3 чёрного цвета. В комплексных соединениях Ni, в отличие от Со, обычно 2-валентен. Комплексное соединение Ni с диметилглиоксимом (C4H7O2N)2Ni служит для аналитического определения Ni.
При повышенных температурах Н. взаимодействует с окислами азота, SO2 и NH3. При действии CO на его тонкоизмельчённый порошок при нагревании образуется карбонил Ni (CO)4 (см. Карбонилы металлов). Термической диссоциацией карбонила получают наиболее чистый Н.
Никель и его соединения в продуктах питания.
Никель, содержащийся в натуральных пищевых продуктах, не несет в себе никакой опасности, чего нельзя сказать о продуктах, выращенных в зоне загрязненной промышленными соединениями этого микроэлемента. Такие продукты могут вызвать отравление, так как в них кумулируется большое количество никеля, и длительное их употребление способно вызвать онкологические заболевания.Наиболее богат никелем шоколад, какао порошок, соя и бобы. Меньше его в белом шоколаде, нуте, маргарине, рисе, мясе. Частично никель (около четверти) поступает в организм с водой. Вообще данный микроэлемент в большем количестве содержится в растительной пище, нежели в пище животного происхождения. В связи с этим у вегетарианцев никогда не развиваются состояния, связанные с дефицитом никеля нахождение элемента в пищевом сырье и продуктах питания.
Если по какой-то причине наступает дефицит никеля, то выражается такое состояние замедлением роста, анемией и повышением уровня глюкозы в крови. Достаточно скорректировать питание, увеличив долю продуктов с высоким содержанием этого микроэлемента. Специально принимать препараты, содержащие никель без подтвержденного факта дефицита нельзя, так как он обладает токсическим, мутагенным и тератогенным эффектом.
Взаимодействие с другими веществами
Аскорбиновая кислота снижает усвоение никеля организмом, таким же образом действуют чай, молоко, кофе, апельсиновый сок. При дефиците железа, магния и кальция напротив, увеличивается его абсорбция. У беременных женщин и в период лактации также повышена всасываемость данного микроэлемента.
У взрослого человека составляет от 35 до 60 мкг. В сутки человек с пищей получает с пищей около 100 мкг, то есть полностью покрывается необходимость в данном микроэлементе. В связи с чем дефицит никеля развивается очень редко.
Никель в организме является необходимым микроэлементом.
Среднее содержание его в растениях 5,0·10-5% на сырое вещество, в организме наземных животных 1,0×10-5%, в морских — 1,6×10-5%. В животном организме Н. обнаружен в печени, коже и эндокринных железах; накапливается в ороговевших тканях (особенно в перьях). Физиологическая роль Н. изучена недостаточно. Установлено, что Н. активирует фермент аргиназу, влияет на окислительные процессы; у растений принимает участие в ряде ферментативных реакций (карбоксилирование, гидролиз пептидных связей и др.). На обогащенных Н. почвах содержание его в растениях может повыситься в 30 раз и более, что приводит к эндемическим заболеваниям (у растений — уродливые формы, у животных — заболевания глаз, связанные с повышенным накоплением Н. в роговице: кератиты, кератоконъюнктивиты).
Никель относится к числу микроэлементов, необходимых для нормального развития живых организмов. Однако о его роли в живых организмах известно немного. Известно, что никель принимает участие в ферментативных реакциях у животных и растений. В организме животных он накапливается в ороговевших тканях, например, в перьях.
Повышенное содержание никеля в почвах приводят к эндемическим заболеваниям — у растений появляются уродливые формы, у животных — заболевания глаз, связанные с накоплением никеля в роговице.
Цельный металлический никель не опасен. Пыль, пары никеля и его соединений токсичны. Как было сказано выше, никель способен накапливаться в роговице, поэтому отравление им может привести к значительному ухудшению зрения. Никель — канцерогенное вещество. Токсическая доза никеля (для крыс) — 50 мг. Особенно вредны летучие соединения никеля, в частности, его тетракарбонил Ni(CO)4. ПДК никеля в воздухе составляет от 0,0002 до 0,001 мг/м3 (для различных соединений).
Методы качественного и количественного определения элемента
Использование: в аналитической химии, в системе контроля за содержанием металлов- загрязнителей в пищевых продуктах, почве,воде и растительной продукции. Сущность изобретения: для одновременного качественного и количественного определения группы металлов в растительном сырье, продуктах переработки плодов и ягод и атмосферных осадках анализируемую пробу (золу, полученную сухим озолением из растительных образцов, соков, заготовок для вин или упаренную на водяной бане пробу атмосферных осадков), в которой устанавливают рН 4 - 6, обрабатывают комплексоном, полученную суспензию комплексов пропускают через стеклянный фильтр, концентрат растворяют в ацетонитриле и разделяют полученные хелаты металлов в хроматографической колонке, заполненной обращенно-фазным сорбентом, с последующим детектированием в УФ-области (двухволновая детекция). Используют подвижную фазу (элюент) определенного состава ( ацетонитрил-буферный раствор ( рН 5,4) - NaDЭДТК - хлороформ).

Реферат на тему "Производство, свойства и применение никеля", 2003 г., Минск, Белорусский Национальный Технический Университет, кафедра Химии, Адамчик Юрий Вячеславович, 25 стр.
Введение
Распространение в природе
Получение
Физические и химические свойства
Никелевые сплавы
Применение никеля в технике
Применение чистого никеля
Применение никелевых сплавов
Заключение
Литература
Ароматические амины. Производство и свойства
- формат doc
- размер 237 КБ
- добавлен 11 февраля 2011 г.
В реферате рассмотрены методы получения ароматических аминов (первичных, вторичных и третичных), их физические и химические свойства. Также описаны свойства отдельных представителей ароматических аминов и их применение в промышленности.
Предельные спирты
- формат doc
- размер 368 КБ
- добавлен 10 июня 2011 г.
Реферат - Предназначен для студентов ВУЗов Одноатомные спирты (способы получения, свойства, применение) Галогензамещенные спирты (галогенгидрины) Двухатомные спирты, или гликоли (способы получения, свойства, применение) Трехатомные спирты (способы получения, свойства, применение) Четырехатомные, пятиатомные и шестиатомные спирты. Вопросы для самоконтроля Тесты Приложение
Производство серной кислоты обжигом железного колчедана
- формат doc
- размер 1.53 МБ
- добавлен 26 мая 2009 г.
(Предмет: Потенциально опасные промышленные объекты. ). Серная кислота: применение, свойства, получение. Применение серной кислоты и олеума. Физические свойства серной кислоты. Химические свойства концентрированной серной кислоты. Химические свойства разбавленной серной кислоты. Получение серной кислоты. Сырье. Этапы. Методы. Производство серной кислоты из серы, железного колчедана, сероводорода. Разработка принципиальной технологической схемы пр.
Производство, свойства и применение палладия
- формат doc
- размер 89.5 КБ
- добавлен 17 октября 2011 г.
2011 г., 13 стр. Содержание: Введение Производство палладия Свойства палладия Физические свойства Химические свойство Применение палладия Список литературы
Производство, свойства и применение цинка
- формат doc
- размер 73.5 КБ
- добавлен 16 октября 2011 г.
Реферат на тему "Производство, свойства и применение цинка", 1998 г., 10 стр. Немного истории Металлический цинк Цинк и сталь Сплавы Коротко о соединениях цинка Биологическая роль цинка Это интересно! (Бурундучная руда, цинковые "папоротники".)
Свойства и способы получения амино-альдегидных смол
- формат doc
- размер 177.72 КБ
- добавлен 26 октября 2009 г.
Синтез бихромата аммония
- формат docx
- размер 496.21 КБ
- добавлен 13 октября 2011 г.
Курсовая работа. Содержание ВВЕДЕНИЕ Историческая справка Распространение в природе Свойства хрома Общие сведения Получение хрома Физические свойства Химические свойства Применение Экологические проблемы ХАРАКТЕРИСТИКА БИХРОМАТА АММОНИЯ Бихромат аммония Применение Токсичность Характеристика исходных веществ Хромный ангедрид Дихромат калия Серная кислота Аммиак Гидросульфат калия ПРАКТИЧЕСКАЯ ЧАСТЬ Методики синтеза Получение хромового ангидрида СИ.
Углеродные материалы
- формат doc
- размер 299.5 КБ
- добавлен 26 марта 2011 г.
Химия элемента германия
- формат doc
- размер 128 КБ
- добавлен 06 октября 2010 г.
Оглавление Введение История открытия элемента Распространенность в природе. Основные минералы Свойства элемента Физико-химические свойства Способы получения Применение германия Биологическое значение Соединения германия в различных степенях окисления. Их получение. Применение соединений германия Комплексные соединения Специфические реакции с германием и его соединениями Заключение Список литературы Приложение Реферат сдавался Коченковой В. Е. в 2.
- формат ppt
- размер 167.5 КБ
- добавлен 06 марта 2009 г.
Физические, химические свойства, биологическая роль, распространение в природе, получение хлора в России производство хлора, особенности работы и меры предосторожности, применение
Читайте также:

