Реферат на тему энергия активации
Обновлено: 30.06.2024
Химическая кинетика — это учение о химическом процессе, его механизме и закономерностях протекания во времени. При исследовании химических реакций, в частности, используемых в химической технологии, применяют как методы химической термодинамики, так и методы химической кинетики. Химическая термодинамика позволяет вычислить тепловой эффект данной реакции, а также предсказать, осуществима ли данная реакция и ее состояние равновесия, т. е. предел, до которого она может протекать. Для этого необ ходимо иметь данные о термодинамических параметрах всех компонентов только в начальном и конечном состояниях системы. Но для практики нужно знать не только возможность осуществления данной реакции, но и скорость ее протекания. Ответ на этот вопрос дает химическая кинетика. Для получения закономерностей должны быть известны не только начальное и конечное состояния системы, но и путь, по которому протекает реакция, а он обычно заранее неизвестен. Поэтому получить кинетические закономерности сложнее, чем термодинамические. Зная эти закономерности (математическую модель) изучаемой химической реакции и ее кинетические параметры, можно рассчитать ее скорость и оптимальные условия проведения в промышленном реакторе. С середины XX в. начала развиваться сначала так называемая линейная, а потом нелинейная термодинамика неравновесных процессов, в которую время входит как параметр. Химические реакции, как правило, являются сложными, т. е. протекают через ряд элементарных стадий. Элементарной стадией химической реакции называется сумма актов химического превращения при одновременном сближении (столкновении) нескольких (обычно двух) частиц; при этом энергия связей перераспределяется между атомами с образованием активированного комплекса с его последующим распадом и получением новых частиц.
В основе современной химической кинетики лежат две теории: теория активных столкновений (ТАС) и теория активированного (переходного) комплекса (ТАК).
1. Теория активных столкновений
(теория бинарных соударений) ТАС
Основные предпосылки:
1. Молекулы представляют в виде шариков.
2. Для того, чтобы произошло взаимодействие, необходимо столкновение.
3. Процесс протекает только в том случае, если энергия столкновения больше или равна определенному значению энергии, которая называется энергией активации.
В основу этой теории положено два учения: молекулярно-кинетическая теория и теория Больцмана.
Вывод уравнения ТАС.
z – общее число столкновений в единицу времени.
Д – эффективный диаметр молекул;
n – число молекул в единице объема;
M – молекулярная масса.
С помощью закона Больцмана определяем количество активных столкновений z, т.е. таких, в которых энергия превышает энергию активации:
Тогда доля активных столкновений составит:
Рассмотрим бимолекулярную газовую реакцию типа: 2А, где Р – продукты реакции. Например, это может быть разложение йодистого водорода:
Теперь заметим, что в результате каждого активного столкновения расходуется две молекулы исходного вещества. Поэтому количество прореагировавших молекул в единице объема будет равна удвоенному количеству активных столкновений в то же время и в том же объеме:
Отсюда видно, что скорость реакции зависит от квадрата концентрации.
Сравнение этих уравнений позволяет установить физический смысл предэкспоненциального множителя k, который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени.
В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде:
k=z уравнение Аррениуса
Константа, рассчитанная по этому уравнению, не дает совпадения с экспериментальными данными. Для корректировки в это уравнение вводят стерический фактор р.
Тогда уравнение Аррениуса с точки зрения ТАС запишется следующим образом:
Считается, что стерический фактор отличается от единицы потому, что для осуществления реакции необходима определенная ориентация реагирующих молекул.
В этом уравнении Е – энергия активации, рассчитанная по ТАС, абсолютная (истинная) энергия активации, а экспериментальная – эффективная энергия активации.
Факты, которые не объясняет ТАС:
1. Не дает метода теоретического расчета энергии активации.
2. Не объясняет протекания в растворах.
3. Не объясняет природы стерического фактора.
Мономолеклярные реакции с точки зрения ТАС. Теория Линдемана
В элементарном акте мономолекулярной реакции участвует всего одна молекула. В соответствии с теорией активных столкновений реакция начинается со встречи двух активных молекул. Количество столкновений пропорционально квадрату концентраций. Поэтому, казалось бы, что мономолекулярные реакции, как и бимолекулярные, должны иметь порядок, равный двум. Но многие мономолекулярные реакции описываются уравнением первого порядка, причем порядок реакции может изменяться при изменении концентрации (давления) и быть дробным.
Объяснение механизмов газовых мономолекулярных реакций дано Линдеманом. Он предположил, что после столкновения активные молекулы могут не только распадаться на продукты реакции, но и дезактивироваться. Механизм реакции представляется двухстадийным:
A– активная молекула.
На первом этапе происходит перераспределение энергии, в результате чего одна молекула становится активной, а другая дезактивируется.
На второй стадии оставшиеся активные молекулы мономолекулярно превращаются в продукты реакции.
Рассмотрим стационарный процесс:
Выразим концентрацию активной частицы А * : . Подставим это выражение в выражение скорость определяющей стадии (вторая стадия):
уравнение Линдемана
Анализ уравнения Линдемана:
1. СА – очень маленькая. В этом случае промежутки между столкновениями молекул настолько велики, что дезактивация происходит редко. Распад активных молекул на продукты происходит без затруднений; лимитирующей стадией является стадия активации. В связи с этим в уравнении Линдемана пренебрегаем в знаменателе относительно k3 ( >k3).
; n=1 (реакция первого порядка)
3. СА – средняя. В этом случае мономолекулярные реакции могут иметь дробный порядок (1 2. Теория активированного комплекса (ТАК)
или теория переходного состояния (ТПС)
Более совершенной является теория переходного состояния, в которой в качестве условия возможности протекания реакции рассматривается не столкновение двух молекул, а образование ими непрочного промежуточного комплекса, что позволяет сразу учесть необходимость определенной ориентации реагирующих молекул. Энергия системы зависит от взаимного расположения (конфигурации) атомов и сил взаимодействия между ними. Сама химическая реакция рассматривается как переход от начальной конфигурации атомов (исходные вещества) к конечной (продукты реакции) при непрерывном изменении соответствующих координат (межатомных расстояний, валентных углов). В ходе этого процесса непрерывно изменяется энергия всей системы, при этом всегда образуется некоторая промежуточная конфигурация атомов, соответствующая максимуму потенциальной энергии системы, - эту конфигурацию и называют активным ( промежуточным ) комплексом. Активный комплекс не является, в отличие от обычной молекулы, устойчивой частицей, так как соответствует максимуму, а не минимуму потенциальной энергии.
Основные положения теории:
1. В ходе процесса молекулы постепенно приближаются друг к другу, в результате чего меняются межъядерные расстояния.
2. В ходе реакции образуется активированный комплекс, когда один из атомов становится как бы обобществленным, и межъядерное расстояние становится одинаковым.
3. Активированный комплекс превращается в продукты реакции.
Например, реакцию разложения йодоводорода можно представить следующим образом:

Сначала две молекулы HJ расположены достаточно далеко друг от друга. При этом существует взаимодействие лишь между атомами в молекуле. После сближения на достаточно короткое расстояние начинают возникать связи между атомами, входящими в состав разных молекул, и связи H – J становятся более слабыми. В дальнейшем они ещё более ослабевают и полностью разрываются, а новые связи H – H и J – J, наоборот, упрочняются. В результате происходит перегруппировка атомов и вместо исходных молекул НJ образуются молекулы Н2 и J2. В процессе сближения и перегруппировки атомов молекулы образуют некоторый малоустойчивый активированный комплекс из двух молекул водорода и двух молекул йода; комплекс существует очень недолго и в дальнейшем распадается на молекулы продуктов. На его образование необходима затрата энергии, равная энергии активации.
Представление об активированном комплексе и об энергии активации подтверждается с помощью энергетических диаграмм, построение которых используется в ТАК.
Активированный комплекс всегда имеет избыток энергии по сравнению с энергией реагирующих частиц.
А–В+D → A+B–D

переходное состояние
Е1 – энергия связи BD без А.
Е2 – энергия связи АB без D.
Е3 – энергия связи переходного состояния.
Е4 – энергия свободных атомов.
Е3 – Е2 = Е активации прямой реакции.
Е2 – Е1 = ∆Н тепловой эффект реакции.
Е4 – Е2 – энергия разрыва связи АВ.
Е4 – Е1 – энергия разрыва связи ВD.
Так как энергия разрыва связей Е4 >> Е активации, то реакция протекает с образованием активированного комплекса без предварительного разрыва связей.
Вывод основного уравнения ТАК.
Скорость процесса определяется скоростью прохождения активированным комплексом расстояния .

– время жизни активированного комплекса.
– концентрация активированного комплекса.
, где – средняя скорость прохождения АК через барьер.
– масса комплекса; Т – температура, К.
Тогда время жизни комплекса равно:
Скорость процесса: . Подставим в это выражение значение времени жизни комплекса :
– скорость реакции.
В уравнение вводится трансмиссионный коэффициент , показывающий, какая доля активированных комплексов переходит в продукты реакции.
Рассмотрим бимолекулярную реакцию с позиции ТАК:
Скорость процесса описывается кинетическим уравнением второго порядка: .
Выразим константу скорости:
– выражение константы равновесия.
Константу равновесия процесса образования продуктов реакции и исходных веществ можно представить следующим образом:
к* – константа равновесия процесса образования активированного комплекса;
h – постоянная Планка.
Подставим это выражение в выражение константы скорости бимолекулярной реакции:
уравнение Эйринга
Это уравнение позволяет связать кинетические параметры с термодинамическими.
1. Вводится понятие теплоты и энтропии активации.
2. С помощью этого уравнения можно рассчитать абсолютные скорости химического процесса.
Физический смысл энтропии активации.
Энтропия активации S* – это изменение энтропии при образовании активированного комплекса.
∆S* не связана с ∆S реакции.
Константа скорости реакции может быть выражена через термодинамические параметры:
– подставим это выражение в уравнение Эйринга
основное уравнение ТАК
Физический смысл энтальпии активации.
Прологарифмируем уравнение Эйринга:
Возьмем дифференциал по температуре Т:
– связь между экспериментальной Еакт. и энтальпией активации.
Сопоставляя эти уравнения, можно заметить, что энтальпия активации есть ни что иное, как энергия активации; – энтропия активации численно равна предэкспоненциальному множителю и произведению pz.
д. б. k1 k2 здесь играет роль энтропийный фактор
Ингибитор влияет на энтропийный фактор.
1. Химическая реакция всегда протекает с несоизмеримо меньшей скоростью, чем это соответствует расчету с предположением резуль тативности каждого соударения.
2. Для сходных реакций при одинаковых температурах и концентрациях число соударений приблизительно одинаково, а скорость может отличаться в десятки тысяч раз.
3. Число соударений с изменением температуры на 10 град изме няется на 2-3%, однако скорость реакции изменяется в 2-4 раза.
Недостатки: не может быть объяснена резкая температурная зависимость скорости реакции. Не позволяет рассчитывать значение энергии активации исходя из параметров молекул реагирующих веществ.
Теория активного комплекса применима к реакциям, протекающим в растворах, тогда как теория столкновений хорошо описывает только реакции, протекающие в газовой фазе. Дело в том, что молекулы реагентов в жидкости находятся на более близком расстоянии, когда силы взаимодействия между ними нельзя считать малыми или даже отсутствующими, что часто допустимо в газах.
Химическая кинетика-наука о скоростях, механизмах химических превращений, о явлениях, сопровождающих эти превращения, о факторах, влияющих на них. Скорость, константа скорости, порядок и молекулярность химической реакции. Закон химической кинетики.
Подобные документы
Основные понятия химической кинетики. Сущность закона действующих масс. Зависимость скорости химической реакции от концентрации веществ и температуры. Энергия активации, теория активных (эффективных) столкновений. Приближенное правило Вант-Гоффа.
контрольная работа, добавлен 13.02.2015
Предмет термохимии, изучение тепловых эффектов химических реакций. Типы процессов химической кинетики и катализа. Энтальпия (тепловой эффект) реакции. Скорость реакции, закон действующих масс. Константа химического равновесия, влияние катализатора.
презентация, добавлен 19.10.2014
Химическая кинетика изучает закономерности химических превращений веществ во времени в процессе перехода реагирующей системы к термодинамическому равновесию. Кинетические уравнения простых реакций. Основной закон химической кинетики Гульдберга-Вааге.
реферат, добавлен 29.01.2009
Основные понятия и законы химической кинетики. Кинетическая классификация простых гомогенных химических реакций. Способы определения порядка реакции. Влияние температуры на скорость химических реакций. Сущность процесса катализа, сферы его использования.
реферат, добавлен 16.11.2009
Скорость химической реакции. Понятие про энергию активации. Факторы, влияющие на скорость химической реакции. Законы Бойля-Мариотта, Гей-Люссака, Шарля. Влияние температуры, давления и объема, природы реагирующих веществ на скорость химической реакции.
курсовая работа, добавлен 29.10.2014
Химическая кинетика как раздел химии, изучающий скорость химической реакции. Факторов влияющие на скорость химической реакции: природа реагирующих веществ, температура, концентрация реагирующих веществ, катализатор, площадь соприкосновения веществ.
презентация, добавлен 23.02.2015
Вычисление скорости омыления эфира при заданной константе для химической реакции. Определение активации реакции и построение графиков зависимости удельной и эквивалентной электрической проводимости растворов. Гальванический элемент и изменение энергии.
курсовая работа, добавлен 13.12.2010
Ознакомление с понятием и предметом химической кинетики. Рассмотрение условий химической реакции. Определение скорости реакции как изменения концентрации реагирующих веществ в единицу времени. Изучение общего влияния природы веществ и температуры.
презентация, добавлен 25.10.2014
Задачи химической кинетики, стадии химического процесса. Открытые и замкнутые системы, закон сохранения массы и энергии. Закон Гесса и его следствие, скорость реакций. Явление катализа, гомогенные, гетерогенные, окислительно-восстановительные реакции.
курсовая работа, добавлен 10.10.2010
Понижение температуры замерзания раствора электролита. Нахождение изотонического коэффициента для раствора кислоты с определенной моляльной концентрацией. Определение энергии активации и времени, необходимого для химической реакции между двумя веществами.
Химическая кинетика - это наука о скоростях и механизмах химических превращений, о явлениях, сопровождающих эти превращения, и о факторах, влияющих на них.
Механизм реакции - это последовательность стадий, предлагаемая на основании экспериментально установленных данных о скорости реакции и на экспериментально обнаруженных интер-медиатах реакции (промежуточных продуктах).
Кинетика по способу описания химических реакции делится на два раздела. В формальной или феноменологической кинетике сформулированы закономерности, позволяющие описывать химическую реакцию макроскопически на основе экспериментальных данных. Молекулярная кинетика изучает превращение на основе молекулярных данных о свойствах частиц.
Теоретическую основу химической кинетики составляют теории столкновений и переходного состояния.
Теория столкновений позволяет объяснить влияние концентрации и температуры на скорости реакций.
Теория переходного состояния рассматривает изменение в геометрическом расположении атомов реагирующих молекул как единой системы.
Переходным состоянием или активированным комплексом называется критическая конфигурация, которой соответствует максимум потенциальной энергии вдоль координаты реакции.
Реагирующие молекулы, которые достигают этой критической конфигурации, образуют молекулы продуктов.
Кинетические исследования позволяют определить порядок и константу скорости реакции, число и характер промежуточных продуктов, энергию активации реакции, выяснить влияние природы растворителя, установить характер и число связей, разрываемых в ходе реакции и т.п.
Рассмотрим основные понятия химической кинетики.
1.1 Скорость, константа скорости, порядок и молекулярность химической реакции
С течением времени в процессе химической реакции происходит изменение количеств исходных веществ и продуктов реакции. Эти изменения могут быть различными из-за разных стехиометрических коэффициентов у веществ, принимающих участие в химической реакции. Поэтому, при рассмотрении скорости реакции введены два понятия: скорость реакции по данному веществу и скорость реакции в целом (просто скорость реакции).
Скоростью реакции называется изменение количества i-того вещества (в молях) в единицу времени в единице реакционного пространства R:

(1)
где ni - число молей i-го вещества, израсходованное или полученное в ходе реакции.
Это определение скорости является наиболее общим. Оно справедливо для любых условий, в том числе и для неизотермических.

Если реакция гетерогенная и протекает на границе раздела фаз, то реакционным пространством является поверхность (R = S), и изменение количества вещества относится к единице поверхности. Если реакция гомогенная и протекает в объеме, то реакционным пространством является объем (R = V). Изменение количества вещества рассматривается в единице объема. При условии V = const выражение (1) принимает вид (2)
Если учесть, что ni /V = Сi, тогда вместо (2) получим

(3)
где vi - стехиометрический коэффициент перед i-тым веществом в уравнении химической реакции;
Сi - концентрация i-того вещества, моль/л;
τ - время реакции, с.
В данном случае скорость химической реакции численно равна изменению концентрации одного из реагирующих веществ в единицу времени.
Из уравнения (3) следует, что скорость реакции всегда положительна. Производная d Сi /d τ характеризует скорость реакции по данному веществу. Она имеет отрицательное значение для исходных веществ веществ, так как их концентрация в ходе реакции уменьшается, и положительное для продуктов реакции. Их количество в течение времени возрастает.
Основным законом химической кинетики является закон действующих масс, выражающий зависимость скорости химической реакции от концентрации реагирующих (исходных) веществ, который записывают в виде

(3)
где К - коэффициент пропорциональности или константа скорости химической реакции, численно равная скорости данной реакции при равенстве единице концентраций всех исходных веществ;
n1, n2, . nm - показатели степени - порядки реакции по индивидуальным веществам;
C1 , С2. Сm - концентрации веществ, принимающих участие в данной реакции;
Константа скорости химической реакции зависит от природы реагирующих веществ, температуры и факторов, влияющих на протекание реакции.

называют порядком химической реакции, т.е. порядок химической реакции равен сумме показателей степени концентраций реагентов в кинетическом уравнении реакции и является экспериментальной величиной.
Порядок по данному веществу (частный порядок) определяется как показатель степени концентрации этого вещества в уравнении для скорости реакции.
Мoлекулярность химической реакции равна числу исходных молекул (или других частиц), принимающих участие в элементарном акте этой реакции. При этом число молекул продуктов реакции не имеет значения. В зависимости от числа исходных молекул различают мономолекулярные, бимолекулярные и тримолекулярные реакции. Молекулярность реакции - понятие теоретическое.
Порядок и молекулярностъ реакции совпадают только для простых реакций, протекающих в полном соответствии с их стехиометрическим равнением и законом действующих масс.
Химическая кинетика — это учение о химическом процессе, его механизме и закономерностях протекания во времени. При исследовании химических реакций, в частности, используемых в химической технологии, применяют как методы химической термодинамики, так и методы химической кинетики. Химическая термодинамика позволяет вычислить тепловой эффект данной реакции, а также предсказать, осуществима ли данная реакция и ее состояние равновесия, т. е. предел, до которого она может протекать. Для этого необ ходимо иметь данные о термодинамических параметрах всех компонентов только в начальном и конечном состояниях системы. Но для практики нужно знать не только возможность осуществления данной реакции, но и скорость ее протекания. Ответ на этот вопрос дает химическая кинетика. Для получения закономерностей должны быть известны не только начальное и конечное состояния системы, но и путь, по которому протекает реакция, а он обычно заранее неизвестен. Поэтому получить кинетические закономерности сложнее, чем термодинамические. Зная эти закономерности (математическую модель) изучаемой химической реакции и ее кинетические параметры, можно рассчитать ее скорость и оптимальные условия проведения в промышленном реакторе. С середины XX в. начала развиваться сначала так называемая линейная, а потом нелинейная термодинамика неравновесных процессов, в которую время входит как параметр. Химические реакции, как правило, являются сложными, т. е. протекают через ряд элементарных стадий. Элементарной стадией химической реакции называется сумма актов химического превращения при одновременном сближении (столкновении) нескольких (обычно двух) частиц; при этом энергия связей перераспределяется между атомами с образованием активированного комплекса с его последующим распадом и получением новых частиц.
В основе современной химической кинетики лежат две теории: теория активных столкновений (ТАС) и теория активированного (переходного) комплекса (ТАК).
1. Теория активных столкновений
(теория бинарных соударений) ТАС
Основные предпосылки:
1. Молекулы представляют в виде шариков.
2. Для того, чтобы произошло взаимодействие, необходимо столкновение.
3. Процесс протекает только в том случае, если энергия столкновения больше или равна определенному значению энергии, которая называется энергией активации.
В основу этой теории положено два учения: молекулярно-кинетическая теория и теория Больцмана.
Вывод уравнения ТАС.
z – общее число столкновений в единицу времени.
Д – эффективный диаметр молекул;
n – число молекул в единице объема;
M – молекулярная масса.
С помощью закона Больцмана определяем количество активных столкновений z, т.е. таких, в которых энергия превышает энергию активации:
Тогда доля активных столкновений составит:
Рассмотрим бимолекулярную газовую реакцию типа: 2А, где Р – продукты реакции. Например, это может быть разложение йодистого водорода:
Теперь заметим, что в результате каждого активного столкновения расходуется две молекулы исходного вещества. Поэтому количество прореагировавших молекул в единице объема будет равна удвоенному количеству активных столкновений в то же время и в том же объеме:
Отсюда видно, что скорость реакции зависит от квадрата концентрации.
Сравнение этих уравнений позволяет установить физический смысл предэкспоненциального множителя k, который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени.
В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде:
k=z уравнение Аррениуса
Константа, рассчитанная по этому уравнению, не дает совпадения с экспериментальными данными. Для корректировки в это уравнение вводят стерический фактор р.
Тогда уравнение Аррениуса с точки зрения ТАС запишется следующим образом:
Считается, что стерический фактор отличается от единицы потому, что для осуществления реакции необходима определенная ориентация реагирующих молекул.
В этом уравнении Е – энергия активации, рассчитанная по ТАС, абсолютная (истинная) энергия активации, а экспериментальная – эффективная энергия активации.
Факты, которые не объясняет ТАС:
1. Не дает метода теоретического расчета энергии активации.
2. Не объясняет протекания в растворах.
3. Не объясняет природы стерического фактора.
Мономолеклярные реакции с точки зрения ТАС. Теория Линдемана
В элементарном акте мономолекулярной реакции участвует всего одна молекула. В соответствии с теорией активных столкновений реакция начинается со встречи двух активных молекул. Количество столкновений пропорционально квадрату концентраций. Поэтому, казалось бы, что мономолекулярные реакции, как и бимолекулярные, должны иметь порядок, равный двум. Но многие мономолекулярные реакции описываются уравнением первого порядка, причем порядок реакции может изменяться при изменении концентрации (давления) и быть дробным.
Объяснение механизмов газовых мономолекулярных реакций дано Линдеманом. Он предположил, что после столкновения активные молекулы могут не только распадаться на продукты реакции, но и дезактивироваться. Механизм реакции представляется двухстадийным:
A– активная молекула.
На первом этапе происходит перераспределение энергии, в результате чего одна молекула становится активной, а другая дезактивируется.
На второй стадии оставшиеся активные молекулы мономолекулярно превращаются в продукты реакции.
Рассмотрим стационарный процесс:
Выразим концентрацию активной частицы А * : . Подставим это выражение в выражение скорость определяющей стадии (вторая стадия):
уравнение Линдемана
Анализ уравнения Линдемана:
1. СА – очень маленькая. В этом случае промежутки между столкновениями молекул настолько велики, что дезактивация происходит редко. Распад активных молекул на продукты происходит без затруднений; лимитирующей стадией является стадия активации. В связи с этим в уравнении Линдемана пренебрегаем в знаменателе относительно k3 ( >k3).
; n=1 (реакция первого порядка)
3. СА – средняя. В этом случае мономолекулярные реакции могут иметь дробный порядок (1 2. Теория активированного комплекса (ТАК)
или теория переходного состояния (ТПС)
Более совершенной является теория переходного состояния, в которой в качестве условия возможности протекания реакции рассматривается не столкновение двух молекул, а образование ими непрочного промежуточного комплекса, что позволяет сразу учесть необходимость определенной ориентации реагирующих молекул. Энергия системы зависит от взаимного расположения (конфигурации) атомов и сил взаимодействия между ними. Сама химическая реакция рассматривается как переход от начальной конфигурации атомов (исходные вещества) к конечной (продукты реакции) при непрерывном изменении соответствующих координат (межатомных расстояний, валентных углов). В ходе этого процесса непрерывно изменяется энергия всей системы, при этом всегда образуется некоторая промежуточная конфигурация атомов, соответствующая максимуму потенциальной энергии системы, - эту конфигурацию и называют активным ( промежуточным ) комплексом. Активный комплекс не является, в отличие от обычной молекулы, устойчивой частицей, так как соответствует максимуму, а не минимуму потенциальной энергии.
Основные положения теории:
1. В ходе процесса молекулы постепенно приближаются друг к другу, в результате чего меняются межъядерные расстояния.
2. В ходе реакции образуется активированный комплекс, когда один из атомов становится как бы обобществленным, и межъядерное расстояние становится одинаковым.
3. Активированный комплекс превращается в продукты реакции.
Например, реакцию разложения йодоводорода можно представить следующим образом:

Сначала две молекулы HJ расположены достаточно далеко друг от друга. При этом существует взаимодействие лишь между атомами в молекуле. После сближения на достаточно короткое расстояние начинают возникать связи между атомами, входящими в состав разных молекул, и связи H – J становятся более слабыми. В дальнейшем они ещё более ослабевают и полностью разрываются, а новые связи H – H и J – J, наоборот, упрочняются. В результате происходит перегруппировка атомов и вместо исходных молекул НJ образуются молекулы Н2 и J2. В процессе сближения и перегруппировки атомов молекулы образуют некоторый малоустойчивый активированный комплекс из двух молекул водорода и двух молекул йода; комплекс существует очень недолго и в дальнейшем распадается на молекулы продуктов. На его образование необходима затрата энергии, равная энергии активации.
Представление об активированном комплексе и об энергии активации подтверждается с помощью энергетических диаграмм, построение которых используется в ТАК.
Активированный комплекс всегда имеет избыток энергии по сравнению с энергией реагирующих частиц.
А–В+D → A+B–D

переходное состояние
Е1 – энергия связи BD без А.
Е2 – энергия связи АB без D.
Е3 – энергия связи переходного состояния.
Е4 – энергия свободных атомов.
Е3 – Е2 = Е активации прямой реакции.
Е2 – Е1 = ∆Н тепловой эффект реакции.
Е4 – Е2 – энергия разрыва связи АВ.
Е4 – Е1 – энергия разрыва связи ВD.
Так как энергия разрыва связей Е4 >> Е активации, то реакция протекает с образованием активированного комплекса без предварительного разрыва связей.
Вывод основного уравнения ТАК.
Скорость процесса определяется скоростью прохождения активированным комплексом расстояния .

– время жизни активированного комплекса.
– концентрация активированного комплекса.
, где – средняя скорость прохождения АК через барьер.
– масса комплекса; Т – температура, К.
Тогда время жизни комплекса равно:
Скорость процесса: . Подставим в это выражение значение времени жизни комплекса :
– скорость реакции.
В уравнение вводится трансмиссионный коэффициент , показывающий, какая доля активированных комплексов переходит в продукты реакции.
Рассмотрим бимолекулярную реакцию с позиции ТАК:
Скорость процесса описывается кинетическим уравнением второго порядка: .
Выразим константу скорости:
– выражение константы равновесия.
Константу равновесия процесса образования продуктов реакции и исходных веществ можно представить следующим образом:
к* – константа равновесия процесса образования активированного комплекса;
h – постоянная Планка.
Подставим это выражение в выражение константы скорости бимолекулярной реакции:
уравнение Эйринга
Это уравнение позволяет связать кинетические параметры с термодинамическими.
1. Вводится понятие теплоты и энтропии активации.
2. С помощью этого уравнения можно рассчитать абсолютные скорости химического процесса.
Физический смысл энтропии активации.
Энтропия активации S* – это изменение энтропии при образовании активированного комплекса.
∆S* не связана с ∆S реакции.
Константа скорости реакции может быть выражена через термодинамические параметры:
– подставим это выражение в уравнение Эйринга
основное уравнение ТАК
Физический смысл энтальпии активации.
Прологарифмируем уравнение Эйринга:
Возьмем дифференциал по температуре Т:
– связь между экспериментальной Еакт. и энтальпией активации.
Сопоставляя эти уравнения, можно заметить, что энтальпия активации есть ни что иное, как энергия активации; – энтропия активации численно равна предэкспоненциальному множителю и произведению pz.
д. б. k1 k2 здесь играет роль энтропийный фактор
Ингибитор влияет на энтропийный фактор.
1. Химическая реакция всегда протекает с несоизмеримо меньшей скоростью, чем это соответствует расчету с предположением резуль тативности каждого соударения.
2. Для сходных реакций при одинаковых температурах и концентрациях число соударений приблизительно одинаково, а скорость может отличаться в десятки тысяч раз.
3. Число соударений с изменением температуры на 10 град изме няется на 2-3%, однако скорость реакции изменяется в 2-4 раза.
Недостатки: не может быть объяснена резкая температурная зависимость скорости реакции. Не позволяет рассчитывать значение энергии активации исходя из параметров молекул реагирующих веществ.
Теория активного комплекса применима к реакциям, протекающим в растворах, тогда как теория столкновений хорошо описывает только реакции, протекающие в газовой фазе. Дело в том, что молекулы реагентов в жидкости находятся на более близком расстоянии, когда силы взаимодействия между ними нельзя считать малыми или даже отсутствующими, что часто допустимо в газах.
Представим себе смесь бензина и кислорода. Реакция между этими двумя веществами с термодинамической точки зрения возможна, но она не пойдет без затраты некоторого количества энергии, поступившей, например, в форме простой искры. Так же обстоит дело и со спичкой. Содержащиеся в спичечной головке вещества могут вступить в реакцию, суммарным итогом которой будет выделение энергии, но чтобы запустить реакцию, придется сначала затратить небольшое количество энергии (достаточно тепловой энергии, выделяющейся, когда мы чиркаем спичкой о коробок). Энергия, необходимая для того, чтобы заставить вещества вступить в реакцию, называется энергией активации.Ферменты, действуя как катализаторы, снижают энергию активации (рис.). Они повышают общую скорость реакции, не изменяя в сколько-нибудь значительной степени температуру, при которой эта реакция протекает.
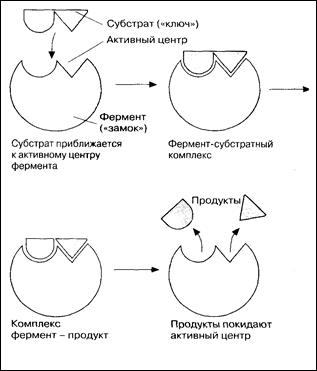
Механизм действия ферментов
Образовавшиеся продукты по форме уже не соответствуют активному центру фермента. Они отделяются от него (поступают в окружающую среду), после чего освободившийся активный центрможет принимать новые молекулы субстрата.
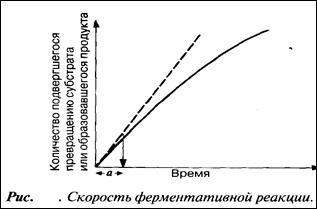
Скорость ферментативных реакций
Мерой скорости ферментативных реакций служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта.
Скорость определяют по углу наклона касательной к кривой на начальной стадии (а на рис.) реакции. Чем круче наклон, тем больше скорость. Со временем скорость реакции обычно снижается, по большей части в результате снижения концентрации субстрата (см. след. разд.).
При высокой концентрации субстрата и при постоянстве других факторов, таких, например, как температура и рН, скорость ферментативной реакции пропорциональна концентрации фермента Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.
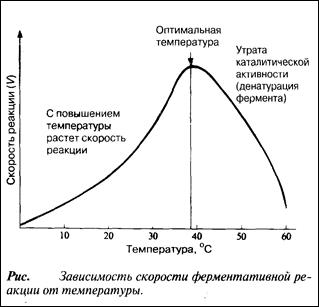
С повышением температуры ускоряется движение молекул, вследствие чего у молекул субстрата и фермента оказывается больше шансов столкнуться друг с другом. В результате увеличивается и вероятность того, что реакция произойдет. Температура, обеспечивающая максимальную активность, называется оптимальной температурой. Если температура поднимается выше этого уровня, скорость ферментативной реакции снижается, несмотря на увеличение частоты столкновений. Происходит это вследствие разрушения вторичной и третичной структур фермента, иными словами, вследствие того, что фермент претерпевает денатурацию (рис.). Молекула фермента развертывается и его активный центр постепенно утрачивает присущую ему форму. Наиболее чувствительны к воздействию высокой температуры водородные связи и гидрофобные взаимодействия.
Температурный оптимум для большинства ферментов млекопитающих лежит в пределах 37—40 °С. Существуют, однако, ферменты с более высоким температурным оптимумом; у бактерий, живущих в горячих источниках, он может, например, превышать 70 о С. Именно такие ферменты используются в качестве добавок к стиральным порошкам для стирки в горячей воде. Когда температура приближается к точке замерзания или оказывается ниже ее, ферменты инактивируются,но денатурации при этом не происходит. С повышением температуры их каталитическая активность вновь восстанавливается.
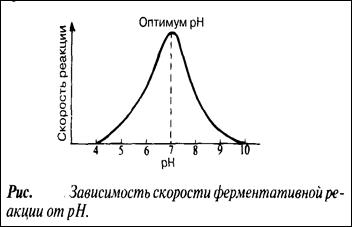
рН
При постоянной температуре любой фермент, как правило, работает наиболее эффективно в узких пределах рН. Оптимальным считается то значение рН, при котором реакция протекает с максимальной скоростью. При более высоких и более низких рН активность фермента снижается. Сдвиг рН меняет заряд ионизированных кислотных и основных групп, что ведет к разрушению ионных связей, участвующих в поддержании специфичной формы молекул фермента. В результате изменяется форма молекул фермента - и в первую очередь форма его активного центра. При слишком резких сдвигах рН фермент денатурирует.
Читайте также:

