Реферат на тему болезнь меньера
Обновлено: 06.07.2024
Болезнь Меньера – это поражение внутреннего уха, при котором возникает головокружение, сенсонервальная тугоухость, тиннитус. В настоящее время не существует патогномоничного симптома для данного заболевания. Для купирования приступов головокружения и рвоты применяют антихолинергические препараты, при острой атаке рекомендованы бензодиазепины. Диуретики и безсолевая диета – основной метод лечения, позволяющий снизить частоту и тяжесть симптомов. При тяжелых и неподдающихся стандартному лечению случаях возможно применение гентамицина или хирургическое вмешательство.
При болезни Меньера изменяется давление эндолимфы лабиринта, влияя на работу внутреннего уха. Причины гиперпродукции эндолимфы неизвестны. К факторам риска относят отягощенный по данному заболеванию семейный анамнез, аутоиммунные заболевания, аллергию, травму головы или уха и, значительно реже, сифилис. Этому заболеванию больше подвержены люди в возрасте от 20 до 50 лет.
Симптомы и признаки болезни Меньера
У пациентов с болезнью Меньера наблюдаются внезапные приступы головокружения Головокружение и пространственная дезориентация Головокружение является неточным термином, который используют пациенты для описания различных похожих ощущений, включая Предобморочное состояние (на грани потери сознания) Головокружение Ощущение. Прочитайте дополнительные сведения , которые обычно длятся от 1 до 6 часов, однако (реже) могут сохранятся до 24 часов, и обычно сопровождаются тошнотой и рвотой. Также может быть повышенное потоотделение, диарея, неустойчивость походки.
Тиннитус Шум в ушах Тиннитус – это шум в ушах. Данное состояние встречается у 10–15% пациентов. Субъективный тиннитус является восприятием звука в отсутствие акустического стимула и слышен только пациенту. В большинстве. Прочитайте дополнительные сведения может быть постоянным или интермиттирующим, по типу свиста или жужжания, не зависит от положения больного или движения. Может присутствовать снижение слуха на низких частотах. Во время приступа или до его начала многие пациенты ощущают чувство заложенности и давления в ухе. В большинстве случаев поражается только одно ухо.
На ранних стадиях заболевания межприступный период может длиться > больше 1 года. По мере прогрессирования заболевания увеличивается степень тугоухости, в то время как выраженность тиннитуса остается без изменений.
Диагностика болезни Меньера
С целью исключения возможных причин головокружения показано МРТ с контрастом
Болезнь Меньера диагностируют клинически. Характерно одновременное сочетание флуктуирующей нейросенсорной тугоухости на низких частотах, эпизодического головокружения, ипсилатеральной флуктуирующей заложенности уха и шума в ушах. Схожие симптомы могут быть при вестибулярной мигрени, вирусном лабиринтите или нейроните, опухоли мостомозжечкового угла (например, акустической нейроме), кровоизлиянии в ствол головного мозга. Для болезни Меньера более характерно одностороннее поражение, поэтому двусторонний характер течения говорит в пользу какого-то другого, схожего по симптоматике заболевания (мигрень). Вестибулярная мигрень (также известная как мигренозное головокружение) характеризуется эпизодами головокружения у пациентов, страдающих мигренью или с другими признаками мигрени, такими как головная боль, фотофобия и фонофобия, или зрительная аура; без потери слуха.
Во время приступа у пациента возникает нистагм, направленный в сторону поражения. В межприступном периоде при клиническом обследовании у пациента может быть диагностирована абсолютная норма. Однако при длительно текущем заболевании и в случаях, что не поддаются лечению, или при наличии гипофункции лабиринта во время проведения теста Фукуды (пациента просят маршировать стоя на месте с закрытыми глазами, этот тест ранее известен под названием тест Унтербергера), пациент поворачивается в сторону пораженного уха, что соответствует одностороннему поражению лабиринта.
Для подтверждения одностороннего поражения лабиринта проводят пробу Хальмаги или тест импульсивного движения головы. Пациента просят сфокусировать свой взгляд в какой-то точке (часто – на носу врача). После этого врач быстро поворачивает голову пациента на 15–30° в одну сторону, наблюдая за глазами больного. При отсутствии поражения на стороне, в которую вращают голову, глаза пациента остаются зафиксированными. Если вестибулярная функция снижена с той стороны, в которую поворачивают голову, вестибулоокулярный рефлекс отсутствует, и глаза пациента быстро следуют за поворотом головы, затем быстро свободно возвращаются в исходное положение.
Пациентам с предполагаемой болезнью Меньера рекомендовано аудиологическое исследование, МРТ (с гадолинием) головного мозга с детальным описанием внутреннего слухового прохода для исключения других нарушений. Как правило, аудиограмма свидетельствует об односторонней сенсоневральной тугоухости на низких частотах. Для подтверждения сенсоневральной потери слуха можно провести тест Ренне Объективное обследование Во всем мире около полумиллиарда человек (почти 8% мирового населения) страдают от потери слуха (1). У более 10% жителей США отмечается тугоухость определенной степени, которая создает им проблемы. Прочитайте дополнительные сведения и тест Вебера Объективное обследование Во всем мире около полумиллиарда человек (почти 8% мирового населения) страдают от потери слуха (1). У более 10% жителей США отмечается тугоухость определенной степени, которая создает им проблемы. Прочитайте дополнительные сведения .
Лечение болезни Меньера
Симптоматически назначают противорвотные, антигисистаминные, бензодиазепины

Актуальность: Болезнь Меньера – это идиопатическое негнойное заболевание внутреннего уха, в основе которого лежат эндолимфатический гидропс и внутрилабиринтная гипертензия, клинически проявляющееся остро возникающими приступами системного головокружения, шумом в ушах и прогрессирующей, чаще односторонней, акузией. Актуальность темы заключается в том, что болезнь Меньера – преимущественно патология лиц трудоспособного возраста (25-50 лет), и в силу выраженности и непредсказуемости приступов приводит к ограничению профессиональной деятельности и инвалидизации молодого контингента населения, что требует искать наиболее современные методы диагностики, позволяющие своевременно поставить диагноз и назначить адекватную терапию [4], которая улучшит качество жизни и значительно продлит трудоспособность больного.
Цель: проанализировать современные методы диагностики болезни Меньера.
Результаты: диагностика классической формы болезни Меньера основывается на клинической картине и данных аудиометрии. Трудности в постановке диагноза могут быть связаны с тем, что многие пациенты, у которых болезнь начинается с приступов головокружения, не могут четко описать свои жалобы. Но, помимо болезни Меньера, существует ряд заболеваний и состояний, которые сопровождаются вестибулярными расстройствами, такие как: доброкачественное пароксизмальное позиционное головокружение, сифилитическое поражение височной кости, шваннома вестибулярного нерва, вестибулярный нейронит, инфекционный лабиринтит, отосклероз, поражения мостомозжечкового угла, такие как менингиома, расширение базилярной артерии, рассеянный склероз, перилимфатическая фистула, транзиторные нарушения кровообращения в вертебро-базилярном бассейне, опухоли черепных нервов, черепно-мозговая травма и ее последствия, базилярная и вестибулярная мигрень. [5, 6]
Тем не менее, традиционные пробы по-прежнему сохраняют актуальность в общеврачебной практике, поскольку зарекомендовали себя как весьма надежные методы диагностики. Классическое обследование больных с болезнью Меньера должно включать ряд обязательных тестов, к которым относятся:
проба Ромберга - проба выполняется следующим образом: пациента просят встать, носки и пятки поставить вместе, закрыть глаза и вытянуть руки вперед [2].
проба Унтербергера (тест Фукуды) - тест проводится следующим образом: пациент должен закрыть глаза, потом он вытягивает руки кпереди, после чего начинает шагать на месте, поднимая при этом колени достаточно высоко. Таким образом делается 50-60 шагов. Тест Фукуды оценивается по степени отклонения от первоначальной позиции. В норме угол отклонения не превышает 30-45 градусов. При этом одностороннее периферическое поражение вестибулярной системы приводит к повороту пациента во время теста в сторону пораженного лабиринта. Центральное же поражение приведет к наличию выраженной атаксии при марше, а отклонение может быть в любую сторону, также могут отмечаться падения или повороты в сторону наличия патологического процесса при вовлечении мозжечка.
проба Бабинского–Вейля ( звёздная проба Бабинского) – основана на том, что при ходьбе с закрытыми глазами, больной отклоняется от намеченного направления в сторону поражения; при многократном повторении этой пробы, если в конце каждой попытки поворачивать больного на 180 0 , траектория его движений образует фигуру звезды [2].
указательная проба Барани – метод заключается в том, что обследуемому предлагают попасть указательным пальцем кисти, разогнутой во всех суставах, в дистальную фалангу указательного пальца врача. Во время пробы обследуемый сидит в удобной позе, врач сидит или стоит, держа свой указательный палец перед ним на определённом уровне [2]. Пробу проделывают несколько раз, при открытых и закрытых глазах обследуемого. Мимопопадание как при закрытых, так и при открытых глазах предполагает поражение мозжечка или вестибулярного аппарата со стороны мимопопадания. В таких случаях отклонение пальца исследуемого происходит в сторону медленного компонента сопутствующего нистагма.
Поскольку изменения при болезни Меньера локализованы во внутреннем ухе, в диагностике этого заболевания наибольшее значение имеет оценка состояния органа слуха и равновесия [1].
При отоскопии определяют неизмененные барабанные перепонки. При камертональном исследовании в тесте Вебера выявляется латерализация звука, направленная в сторону лучше слышащего уха. В тестах Ринне и Федеричи также выявляют типичные для перцептивной тугоухости изменения: оба теста положительны на стороне как лучше слышащего, так и хуже слышащего уха. Для исследования слуховой функции проводят тональную пороговую аудиометрию. В начальной стадии болезни выявляют типичную аудиометрическую кривую - восходящего или горизонтального типа с наибольшим поражением в области низких частот и наличием костно-воздушного интервала в 5-15 дБ на частотах 125-1000 Гц. Снижение слуха не превышает I степени. В дальнейшем наблюдается прогрессивное повышение тональных порогов слышимости по сенсорному типу, вплоть до IV степени в III стадии заболевания [1]. При надпороговой аудиометрии у всех больных, как правило, выявляется положительный феномен ускоренного нарастания громкости.
Для верификации диагноза болезни Меньера необходимо установить наличие эндолимфатического гидропса [1]. В настоящее время наибольшее применение нашли следующие инструментальные методы диагностики гидропса внутреннего уха - дегидратационые пробы, электрокохлеография, функциональная компьютерная стабилометрия.При выполнении дегидратации используют глицерол в дозе 1,5-2,0 г/кг массы больного с равным объемом лимонного сока для потенцирования действия. Исследование слуха проводят непосредственно перед приемом препарата и затем через 1, 2, 3, 24 и 48 ч. Необходимость исследования через 48 ч определяется у каждого больного индивидуально, в зависимости от скорости регидратации [1].Оценку результатов дегидратации проводят по нескольким критериям. Пробу считают положительной, если через 2-3 ч после приема препарата пороги тонального слуха снижаются не менее чем на 5 дБ во всем диапазоне исследуемых частот или на 10 дБ на трех частотах и разборчивость речи улучшается не менее чем на 12%. Пробу считают отрицательной, если пороги тонального слуха через 2-3 ч повышаются и разборчивость речи ухудшается относительно исходного уровня. Промежуточные варианты расценивают как сомнительные.
Весьма информативным считают отоакустическую эмиссию (ОАЭ) - как объективный неинвазивный метод, позволяющий оценить состояние сенсорных структур внутреннего уха при проведении дегидратации, что повышает чувствительность методики до 74% [3]. При положительной дегидратационной пробе амплитуда отоакустического ответа повышается не менее чем на 3 дБ. Наиболее информативна ОАЭ на частоте продукта искажения.
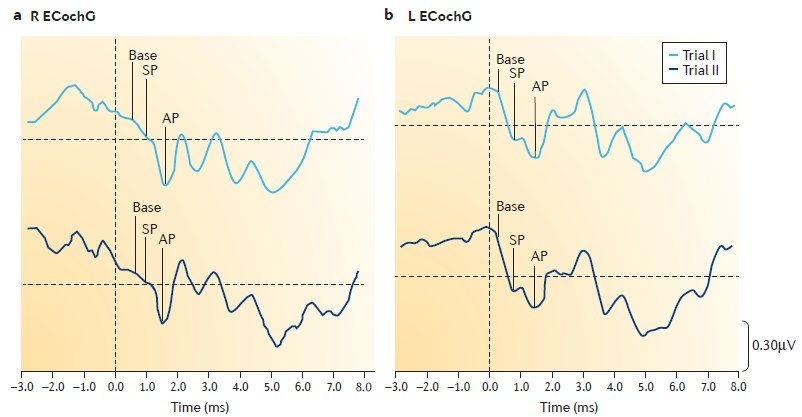
Методика электрокохлеографии, также применяемая для выявления гидропса лабиринта, позволяет регистрировать электрическую активность улитки и слухового нерва, возникающую в интервале 1-10 мс после предъявляемого стимула. При наличии гидропса во внутреннем ухе выявляют следующие признаки [7]:• негативную волну суммационного потенциала, предшествующую потенциалу действия. Амплитуда суммационного потенциала возрастает по мере увеличения интенсивности; соответственно, соотношение амплитуд суммационного потенциала и потенциала действия становится более 0,4;• сдвиг латентного периода потенциала действия при стимуляции щелчками альтернирующей полярности более чем на 0,2 мс;• изменение амплитуды суммационного потенциала при исследовании тональными посылами.
Следует отметить, что на современном этапе для диагностики болезни Меньера широко используется функциональная компьютерная стабилометрия (ФКС), основанная на регистрации и анализе колебаний центра давления(ЦД) тела человека. При обследовании пациентов с этой патологией M. Havia et al. не обнаружили зависимости показателей скорости движения центра давления (ЦД) от давности заболевания [7]. Однако при сопоставлении аудиологических и стабилометрических показателей при снижении слуха на 40–70 дБ было выявлено резкое возрастание скорости движения ЦД в пробе не только с депривацией зрения, но и с открытыми глазами, чего не наблюдалось у пациентов с потерей слуха до 25 дБ. И.А. Горбушева отметила, что функциональное состояние системы равновесия у пациентов с болезнью Меньера при наличии периферического кохлеовестибулярного синдрома характеризовалось снижением постурального контроля в 84% случаев, а при наличии смешанного вестибулярного синдрома – в 100% случаев [3]. Снижение постурального контроля наблюдалось как в состоянии относительного покоя, так и при функциональной нагрузке. Автор указывает, что использование ФКС в сочетании с дегидратационными тестами является более информативным методом в диагностике гидропса лабиринта, чем аудиологический дегидратационный тест.
Вывод: 1. Болезнь Меньера относится к редким заболеваниям, составляя, согласно данным разных авторов, от 20 до 200 случаев на 100000 населения.
2. Трудности в постановке диагноза связаны с тем, что многие пациенты, у которых болезнь начинается с приступов головокружения, не могут четко описать свои жалобы и, кроме того, существует ряд заболеваний и состояний, сопровождающихся вестибулярными расстройствами.
3. По данным литературы, самыми эффективными методами верификации болезни Меньера являются дегидратационые пробы, электрокохлеография, функциональная компьютерная стабилометрия (ФКС), из которых на современном этапе диагностики болезни широко используется ФКС.
Литература:
Алексеева Н. С., Азнабаева Л.Ф., Антонив В.Ф. и др. / Под ред. В.Т. Пальчуна - Оториноларингология: нац. рук., - ГЭОТАР-Медиа, 2009 – с. 954
Большой медицинский энциклопедический словарь// Изд-во: Рипол-классик, 2007 – 907с
Горбушева И.А. Влияние внутрилабиринтной гипертензии на функциональное состояние системы равновесия : автореф. дис. . канд.мед. наук. М., 2005. С. 1–24.
Нурмухаметова Е. Диагностика и лечение болезни Меньера // Русский медицинский журнал. 1998. № 20. С. 1346–1347.
Парфенов В.А., Замергард М.В. Головокружение в неврологической практике // Неврол. журн. 2005. № 1. С. 4–11.
Havia M., Kentava E., Pyykko I. Postural instability in Meniere’s disease // Vestib. Res. 2004. V. 14. № 1. P. 37–46.

Головокружение, являясь крайне распространенной жалобой при первичном осмотре, нередко не рассматривается врачами как важный симптом. Однако за ним может скрываться очень грозная патология, такая как болезнь Меньера (idiopathic endolymphatic hydrops, или идиопатическая эндолимфатическая водянка, лабиринтная водянка).
Что же включает в себя данная патология?
По определению, болезнь Меньера является идиопатической. Другими словами, если причина известна, патологический процесс уже не может быть назван болезнью Меньера. Тем не менее, если корень проблемы заключается в повышении эндолимфатического давления, стоит рассмотреть и другие причины гидропса. Болезнь Меньера в таких случаях следует отличать от этих причин.
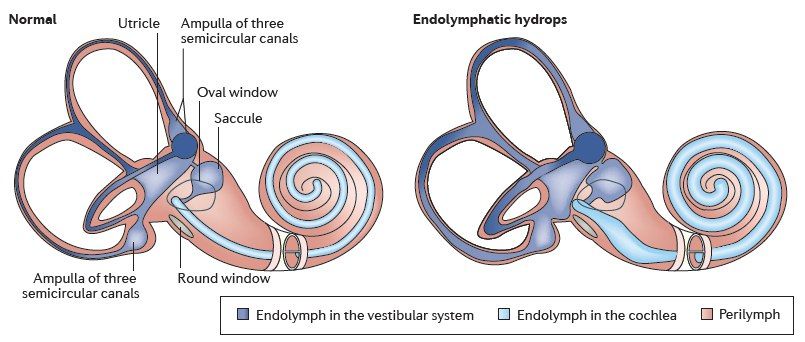
Существует несколько теорий, пытающихся объяснить причину возникновения данной патологии:
Аутоиммунные заболевания, такие как волчанка и ревматоидный артрит, могут вызывать воспалительную реакцию в пределах лабиринта. Аутоиммунная этиология была подтверждена после того, как было установлено, что у пациентов с БМ определяются аутоантитела к щитовидной железе, а также иммунные комплексы в эндолимфатическом мешке (иммунологическая теория).
Заболевания, которые могут привести к повышению эндолимфатического давления, включают метаболические нарушения, гормональный дисбаланс, травмы, а также различные инфекции (например, сифилитический отит и синдром Когана — интерстициальный кератит). Отдельно следует остановиться на метаболических нарушениях. Имеется предположение, что повышение уровня калия в эндолимфатическом пространстве вызывает повреждение волосковых клеток и вестибулярного эпителия, что приводит к развитию симптомов головокружения и тугоухости (метаболическая теория).
Кроме того, замечено, что при болезни Меньера частота аллергических реакций выше, чем среди населения в целом (у 50 % установлено наличие аллергии к веществам, передающимся по воздуху). Пищевые триггеры также являются важными факторами при возникновении БМ (у 45 % больных с аллергией на пищевые продукты) — аллергическая теория.
Также выделяют сосудистую теорию (в связи с частым сочетанием БМ и мигрени у больных), генетическую (аутосомно-доминантный тип наследования, участок DFNA9 гена СОСН) и анатомическую (патология височной кости, в результате чего малый по размеру эндолимфатический мешок расположен позади лабиринта).
В двух из трех случаев обращения с жалобами на головокружение или потерю слуха процесс чаще всего является односторонним.
Первыми проявлениями при БМ, как описано выше, могут стать как вестибулярные нарушения (вертиго), так и слуховые (снижение остроты слуха, наличие шума в ушах).
Выделяют 3 формы БМ:
- Классическая (слуховые + вестибулярные нарушения);
- Кохлеарная (слуховые нарушения с постепенным присоединением вестибулярных);
- Вестибулярная (картина манифестации нарушений обратна кохлеарной форме);
При классическом течении БМ выделяют 3 стадии заболевания:
Достоверная (очевидная) БМ по рекомендациям AAO-HNS (Американская академия отоларингологии и хирургии головы и шеи), JSER (Японское общество по изучению равновесия) и EAONO (Европейская академия отологии и нейро-отологии) представляет собой:
- два или более самопроизвольно возникающих приступа головокружения продолжительностью 20 мин и более;
- потеря слуха, подтвержденная данными аудиологических исследований по меньшей мере в одном случае;
- шум в ушах или ощущение заложенности в пораженном ухе.
При исключении других причин, в результате которых может развиться вышеописанная симптоматика.
- проба Ромберга;
- тест Фукуды/маршевая проба;
- указательная проба Барани;
- проба Бабинского-Вейля;
- проба Ринне/Вебера.
В дополнение к этому проводят калорические пробы, вращательный тест Барани и др.
Инструментальная диагностика включает в себя:
- экстра - и транстимпанальную электрокохлеографию (ЭКоГ);
- аудиометрию (тональная пороговая, надпороговая, речевая).
При ЭКоГ измеряется соотношение суммарного потенциала (СП) и потенциала действия (ПД). При БМ — СП/ПД> 0,3.
Для верификации диагноза рекомендуется применение дегидратационного теста, при котором после проведения тоновой пороговой аудиометрии больному вводят осмотический диуретик из расчёта 1–1,5 мг на кг массы тела пополам с фруктовым соком и повторяют аудиометрию через 1, 2, 3, 24 и 48 часов.
Основной целью лечения болезни Меньера является оказание помощи при острых приступах головокружения, предотвращение повторных атак и устранение прогрессирующего ухудшения слуха и вестибулярной функции в пораженном ухе (или ушах). Несмотря на прогресс в достижении первых двух целей, устранение прогрессирующего во времени ущерба слуху и вестибулярной функции оказалось недостижимым на данный момент времени. Здесь необходимо напомнить, что БМ часто ассоциируется с такими патологиями, как мигрень, СОАС, аутоиммунными заболеваниями, коагулопатиями/васкулопатиями, поэтому было высказано предположение, что цереброваскулярная ишемия способствует увеличению частоты возникновения атак. Необходимо провести тщательный поиск факторов риска сосудистых заболеваний и по возможности их коррекцию. У людей младше 50 лет мигрень является наиболее распространенным кофактором БМ. С коррекцией приступов мигрени, а также их профилактикой в межприступный период вы можете ознакомиться в нашем обзоре. У людей старше 50 лет, для которых характерна полиморбидность, сопутствующие БМ нозологии также требуют своевременной коррекции ввиду возможного влияния на прогрессирование БМ.
Диуретики, использующиеся в качестве терапии первой линии ввиду их возможности уменьшения объема эндолимфы, в результате которого предотвращается формирование гидропса, также весьма неоднозначны в их назначении в ситуации с БМ. Существуют 2 противоположные группы исследований, одна из которых говорит, что их назначение оправдано, особенно у женщин в период менопаузы. Другие же заявляют, что эффект, полученный от их применения, сравним с плацебо. Но не стоит забывать, что комплекс проводимой терапии должен подбираться индивидуально. В случае БМ наиболее часто назначают комбинацию гидрохлортиазида с триамтереном или диакарб. Касаемо ацетазоламида, его назначение оправдано в ситуациях, когда БМ сочетается с мигренью с аурой, или в качестве терапии второй линии, когда препараты, используемые в качестве профилактики мигрени в межприступный период, не оказывают должного эффекта.
Также необходимо помнить о таком препарате, как бетагистина дигидрохлорид — синтетический аналог гистамина (Н3 подгруппа), который по некоторым данным должен составлять основу терапии острых приступов головокружений. Однако здесь стоит сказать, что существует достаточно большая подборка исследований, свидетельствующая о неоднозначности его применения. Так, в январе 2016 года British Medical Journal (BMJ) на основе данных нескольких Кокрановских обзоров пришел к выводу, что бетагистин вряд ли можно считать эффективным в отношении БМ. Они связали его широкое применение, возможно, с высокой толерантностью в отношении дозирования препарата, низкими рисками развития нежелательных реакций, а также банальным отсутствием альтернативы. В поддержку вышесказанному, в том же 2016 году было проведено многоцентровое исследование BEMED (1450 обследованных пациентов), по результатам которого показано, что назначение как низких (48 мг/сут), так и высоких доз (144 мг/сут) этого препарата не показало значительного влияния на снижение частоты острых приступов головокружений, а также на восстановление слуха и вестибулярных функций по сравнению с контрольной группой. Это еще раз подтверждает неоднозначность назначения данного препарата.
Поэтому в качестве альтернативы бетагистину можно предложить Н1-блокаторы, которые способны проникать через ГЭБ. К ним относят дименгидринат, дифенгидрамин, меклозин.
В ряде случаев оправдано использование седативных средств, например, лоразепама/диазепама при остром приступе головокружения. Симптоматический эффект седативных средств при остром головокружении связан с их общим действием, в условиях которого снижается способность вестибулярных ядер анализировать и интерпретировать импульсы, поступающие из лабиринта.
Хирургическое лечение, согласно критериям AAO-HNS, рекомендуется при неэффективности консервативной терапии в течение 6 месяцев.
Болезнь Меньера - негнойное заболевание внутреннего уха, характеризующееся увеличением объема лабиринтной жидкости и повышением внутрилабиринтного давления, в результате чего возникают приступы прогрессирующей глухоты, шума в ушах, головокружения и нарушения равновесия, а также вегетативные расстройства (тошнота, рвота)
Обычно болезнь Меньера - процесс односторонний, в 10-15% случаев - двусторонний.
Заболевание развивается без предшествующего гнойного процесса в среднем ухе и органических заболеваний головного мозга и его оболочек. Тяжесть и частота приступов могут уменьшаться со временем, однако нарушение слуха прогрессирует.
Преобладающий возраст развития болезни Меньера - 30-50 лет.

Содержание
Классификация
- Классическая форма болезни Меньера - одновременное нарушение слуховой и вестибулярной функций (приблизительно 30% случаев)
- Кохлеарная форма - заболевание начинается со слуховых расстройств (50% случаев)
- Вестибулярная форма - заболевание начинается с вестибулярных расстройств (15-20% случаев).
Стадии заболевания
I стадия (начальная) характеризуется периодически возникающим и усиливающимся ушным шумом (напоминающий шум моря), ощущением заложенности и/или давления в ухе, то нарастающей, то ослабевающей сенсоневральной тугоухостью. Периодически возникают приступы системного головокружения продолжительностью от 20 минут до 12 часов. В межприступный период жалоб нет. Приступы возникают несколько раз в год, длятся до 3 часов.

II стадия (стадия разгара) характеризуется ушным шумом и сенсоневральной тугоухостью, прогрессирующей с каждым последующим приступом головокружения, а также тошнотой и рвотой. По данным аудиограммы фиксируется флюктуирующая сенсоневральная тугоухость II-III степени, сохраняющаяся в межприступный период. Приступы головокружения длятся от 20 минут до 12 часов. Приступы возникают до нескольких раз в неделю, сопровождаются вегетативными нарушениями. Слух снижается с каждой новой атакой.
III стадия (стадия затихания процесса) - типичные системные головокружения становятся более редкими. Наряду с типичными приступами системного головокружения появляются шаткость и неустойчивость походки. Субъективный шум в ушах присутствует постоянно, редко усиливаясь в момент приступа. При исследовании слуха по данным аудиометрии отмечается стойкая сенсоневральная тугоухость. Тугоухость приобретает двусторонний характер.
Причины
Существует несколько теорий, связывающих возникновение этого заболевания с реакцией внутреннего уха на различные повреждения:
- Нарушения водно-солевого обмена
- Аллергические заболевания
- Аутоиммунные состояния
- Эндокринные заболевания
- Сосудистые заболевания
- Вирусные заболевания
- Сифилис
- Нарушение функции эндолимфатического протока и эндолимфатического мешка
- Деформация клапана Баста
- Закупорка водопровода преддверия
- Снижение воздушности височной кости
- Травмы головы и височной кости
- Воспалительные процессы инфекционного или аутоиммунного характера внутреннего уха
- Повышение внутричерепного давления
- Нарушения функции нервных волокон внутреннего уха
Симптомы болезни меньера:

- приступообразное течение (в межприступный период признаки заболевания обычно отсутствуют, за исключением снижения слуха);
- постепенное снижение слуха, преимущественно низкочастотное на ранних стадиях заболевания; периодические ухудшения и внезапные улучшения слуха;
- головокружение - спонтанные приступы продолжительностью от 20 минут до нескольких часов;
- шум в ушах;
- нарушение чувства равновесия;
- тошноту или рвоту во время приступов;
- спонтанный нистагм – непроизвольные движения зрачков во время приступов;
- повышенное выделение пота;
- скачки артериального давления – как правило, понижение, но у некоторых больных давление может повышаться;
- рассогласованные сокращения мышц;
- снижение температуры тела.
Диагностика
Чаще всего заподозрить и установить диагноз может ЛОР-врач. Если есть возможность обратиться к отоларингологу, который занимается патологией вестибулярного аппарата (вестибулолог), то стоит посетить и его.
Обязательным для установления диагноза болезнь Меньера является проведение ряда функциональных исследований:
- вестибулометрия (исследование функции вестибулярного аппарата);
- тональная пороговая аудиометрия (исследование слуховой функции);
- дегидратационный тест (проведение аудиометрии, возможно и отоакустической эмиссии, до и после приема диуретика);
- электрокохлеография (регистрация электрических потенциалов, которые генерируются во внутреннем ухе и слуховом нерве в ответ на звуковую стимуляцию);
- видеонистагмография или электронистагмография (исследование вестибулярной функции путем исследования нистагма);
- МРТ-контрастное исследование головного мозга с прицельным исследованием внутреннего слухового прохода.

Также в процессе диагностического поиска могут проводиться дополнительные методы исследования для исключения других причин возникновения симптомов, характерных для болезни Меньера:
- Специфические серологические тесты для диагностики сифилиса;
- Исследование функций щитовидной железы;
- Исследование показателей жирового и углеводного обмена;
- Исследование показателей водно-солевого обмена;
- Консультация невропатолога для исключения патологии ЦНС;
- Консультация кардиолога для исключения патологии сердечно-сосудистой системы;
- Исследование показателей витаминов и микроэлементов в организме пациента.
Лечение болезни меньера
После тщательного обследования пациента и определения стадии заболевания и тяжести течения процесса, медикаментозная коррекция приступов может включать в себя следующие группы препаратов:
- нейролептики;
- агонисты Н1-рецепторов;
- сосудорасширяющие препараты;
- антигистаминные препараты;
- диуретические средства;
- спазмолитики;
- седативные препараты.
В случае тяжелого приступного периода и, например, многократной рвоты, показана госпитализация с целью восполнения дефицита электролитов и коррекции потери жидкости посредством инфузионной терапии.
Долгосрочное лечение подразумевает комплексный подход, включающий в себя не только медикаментозную поддержку пациента, но и коррекцию его образа жизни и привычек.
Медикаментозное лечение включает в себя назначение препаратов для улучшения микроциркуляции, сосудорасширяющих, венотонизирующих, диуретических средств, нейропротекторов.
Комплексное лечение также проводится на фоне адекватного для данного состояния режима питания пациента . Так, из меню должны быть исключены продукты с содержанием избыточного количества соли (соления, колбасные продукты, копчености и пр.), 1-2 раза в неделю рекомендуется проводить разгрузочные дни на бессолевой диете. Кроме того, следует отказаться от потребления алкоголя, кофе и кофеинсодержащих напитков и продуктов, так как они производят негативный эффект на нервную систему и могут в определенной мере провоцировать приступы головокружения.
Особенность пациентов с болезнью Меньера - выраженная эмоциональная лабильность , поэтому фактору психологической поддержки пациента также необходимо уделять достаточное внимание.
Рекомендовано ограничение физической активности во время приступов. Однако, в межприступный период пациентам показаны умеренные физические нагрузки для улучшения координации движений, упражнения для тренировки вестибулярного аппарата.
Консервативные способы лечения не останавливают развитие тугоухости.
Стоит отметить, что для пациентов с болезнью Меньера существуют некоторые ограничения в выборе рода деятельности - такие пациенты не могут работать в экстремальных условиях (подземные, подводные и высотные работы), в зоне повышенной опасности (у движущихся механизмов), при обслуживании любых видов транспортных средств.
Хирургическое лечение
Показанием для хирургического вмешательства является неэффективность консервативного лечения (результаты оценивают через 6 месяцев), стремительное снижение слуха и ухудшение качества жизни пациента.
Целью операции является стабилизация работы вестибулярного аппарата, устранение вегетативных симптомов болезни Меньера и тугоухости. Метод хирургического лечения определяют в индивидуальном порядке в соответствии с результатами комплексного обследования.
Для лечения заболевания могут проводиться следующие операции :
Реабилитация
После операции пациент находится 2-3 дня на стационарном наблюдении. После выписки в течение 10 дней необходимо соблюдать домашний режим. Во время реабилитации (3 месяца) запрещаются авиаперелеты, значительные физические нагрузки, посещение бани. В дальнейшем необходимо исключить прослушивание музыки в наушниках, длительную работу за компьютером.
Прогноз
Еще одной особенностью болезни Меньера является тот факт, что однозначных прогнозов по течению этого заболевания дать невозможно. Прогрессирование этой болезни во многом подчиняется индивидуальным особенностям организма, возрасту больного, условиям его жизни, наличию других заболеваний.
В истории отоларингологии известны случаи, когда болезнь Меньера после длительного течения проявлялась все менее тяжелыми симптомами, пока ситуация не разрешалась благоприятно для пациента — системные головокружения прекращались, и качество жизни восстанавливалось.
Но чаще, все же, данное заболевание активно прогрессирует, вызывая необратимые нарушения слуха.
Профилактика болезни меньера
Профилактика болезни Меньера — понятие условное, так как причины развития этой болезни и провоцирующие факторы до конца не изучены.
Но для снижения вероятности развития этого заболевания следует использовать золотые стандарты здоровья :
Современные проблемы болезни Меньера
Журнал: Вестник оториноларингологии. 2016;81(5): 89-93





С тех пор, как Проспер Меньер впервые описал симптомы заболевания, называемого сейчас болезнью Меньера, прошло более 150 лет, тем не менее его этиология по-прежнему остается неизвестной. В течение многих десятилетий считалось, что причиной данного заболевания является избыток жидкости (гидропс) в эндолимфатическом пространстве внутреннего уха, который приводит к разрывам перепончатых мембран и, как следствие, к слуховым и вестибулярным расстройствам. Недавние гистопатологические исследования показали, что эндолимфатический гидропс не всегда ассоциирован с клиническими проявлениями болезни Меньера. В последние десятилетия предпринимаются попытки обосновать новые теории этиологии, патогенеза и механизма возникновения головокружения при болезни Меньера. Это теория генетической предрасположенности, вирусная теория, аутоиммунная теория, теория нарушения лонгитудинального тока эндолимфы, однако, ни одна из этих теорий не получила достаточных доказательств. Продолжающиеся экспериментальные и морфологические исследования показали, что определенная роль в формировании гидропса принадлежит аквапориновым водным каналам. Механизмы возникновения приступов головокружения также не до конца понятны. В свете современных достижений физиологии и патофизиологии уха теория разрывов, предложенная Schuknecht, кажется все менее вероятной и на смену ей приходят новые гипотезы, объясняющие возможные механизмы контаминации перилимфы ионами калия. Изучение патофизиологических механизмов приступов головокружения может дать ключ и к пониманию этиологии болезни Меньера.
Вместе с тем болезнь Меньера (БМ) — заболевание, известное дольше других и, казалось бы, наиболее подробно изученное в разных ракурсах, по-прежнему остается во многом малопонятным и нередко трудным для диагностики [9, 10]. Несмотря на обилие предложенных способов диагностики с использованием дорогостоящих технических средств, ни один из них не выявил патогномоничных признаков БМ [11, 12], и диагностика этого заболевания проводится в основном клинически с использованием общепринятых критериев, предложенных Американской академией оториноларингологии [13] (см. таблицу).

Таблица.
Несмотря на пробелы в знаниях по этиопатогенезу БМ, современная отохирургия достигла существенных успехов в улучшении качества жизни данной группы больных, причем множество приоритетных разработок принадлежит отечественным ученым [14—18].
В данной статье мы попытались проанализировать, что мы знаем и чего не знаем о БМ.
В 1938 г. C. Hallpike, H. Cairns в Лондоне и K. Yamakawa в Японии почти одновременно опубликовали результаты гистологических исследований височных костей людей, прижизненно страдавших БМ, и показали наличие у них эндолимфатического гидропса (ЭГ) (цит. по [14]). Термин Э.Г. обозначал увеличение объема эндолимфы в пределах перепончатого лабиринта. Авторы впервые высказали предположение, что приступы головокружения провоцируются увеличением давления эндолимфы.
На сегодняшний день развитие БМ связывают с идиопатическим эндолимфатическим гидропсом. Однако вопрос о механизмах формирования гидропса остается открытым. Классические представления о нарушении соотношения продукции и резорбции эндолимфы не могут объяснить некоторые особенности этого патологического состояния, например, неравномерность развития гидропса в улитке и в преддверии [19], или его моносимптомное проявление — только шум в ухе без снижения слуха и головокружения [20], или только острая кондуктивная тугоухость без головокружения [21].
Продолжающиеся экспериментальные и морфологические исследования показали, что определенная роль в формировании гидропса принадлежит аквапориновым водным каналам [22]. Аквапорины — интегральные мембранные белки, формирующие поры в мембранах клеток. Семейство аквапоринов входит в более крупное семейство основных внутренних белков (major intrinsic proteins — MIP), наиболее типичный представитель которых — основной внутренний белок волокон хрусталика. Участие аквапоринов в поддержании гомеостаза жидкостей лабиринта подтверждается экспрессией белков mRNAs of AQP1, AQP2, AQP3, AQP4, AQP5, AQP6, AQP7 и AQP9 во внутреннем ухе, причем они сосредоточены в области сосудистой полоски и эндолимфатического мешка, т. е. в основных зонах секреции и абсорбции эндолимфы. В этих же зонах отмечается экспрессия рецепторов вазопрессина 2-го типа. Водный гомеостаз внутреннего уха регулируется аргинин-вазопрессин-AQP2-системой по аналогии с почкой. Роль нарушений этих механизмов регуляции в формировании ЭГ требует дальнейшего изучения.
ЭГ может быть врожденным или приобретенным. Врожденные нарушения редки, примером такой патологии может служить дисплазия Мондини (недоразвитие улитки). Приобретенный эндолимфатический гидропс объясняют сосудистыми, инфекционными, аутоиммунными, травматическими и метаболическими причинами, однако ни одна из них не получила достаточных доказательств.
В последние десятилетия предпринимаются попытки обосновать новые теории этиологии, патогенеза и механизма возникновения головокружения при Б.М. Это теория генетической предрасположенности, вирусная теория, аутоиммунная теория, теория нарушения лонгитудинального тока эндолимфы и др.
Генетические исследования дают возможность предположить, что БМ наследуется по типу аутосомного доминирования. Среди наиболее вероятных генов, кодирующих предрасположенность к развитию БМ, называют AQP2, KCNE1, KCNE3, HCFC1, COCH и ADD1 [23, 24].
В литературе имеются данные о том, что в некоторых случаях БМ стартует в результате инфицирования вирусами группы герпеса (вируса простого герпеса, вируса Эпштейна—Барр и цитомегаловируса). Согласно вирусной теории БМ является одним из проявлений полиганглионита, вызванного хронической персистирующей нейротропной вирусной инфекцией, а приступы головокружения совпадают во времени с периодами реактивации вируса в пределах внутреннего слухового прохода. По данным R. Gacek [25], посмертно проведенная трансмиссионная электронная микроскопия 11 височных костей больных, страдающих БМ, выявила не только значительное уменьшение числа клеток в спиральном ганглии, но и наличие в них вирусных частиц, включенных в транспортные везикулы. Эти данные поддерживаются клиническими исследованиями автора, отметившего ослабление или исчезновение головокружения при применении противовирусных препаратов у 32 из 35 больных БМ (в 91% случаев). Однако исследования M. Gartner и соавт. [26] выявили дополнительные сведения, не позволяющие принять выводы цитируемой выше публикации. Авторы определяли присутствие генетических последовательностей вирусов herpes simplex 1-го и 2-го типов и Virus Varicella Zoster методом ПЦР в биоптатах вестибулярного узла 34 больных, подвергнутых нейрэктомии по поводу не поддающихся лечению форм БМ. В 34% случаев в клетках вестибулярного ганглия были обнаружены генетические последовательности одного из исследуемых вирусов, однако они были обнаружены и в 91% биоптатов (32 из 34) узла лицевого нерва этой группы больных без клинических проявлений поражения лицевого нерва.
Некоторые ученые предполагают, что вирусная инфекция может спровоцировать аутоиммунную реакцию, вызывающую развитие Э.Г. Сторонники аутоиммунной теории указывают на выявленную принадлежность ряда больных БМ к определенному HLA-гаплотипу [27] и на обнаружение у них антител против антигенов внутреннего уха [28].
Косвенным подтверждением участия аутоиммунных механизмов в патогенезе БМ может быть повышенная частота системных аутоиммунных заболеваний среди больных БМ [29].
Следует, однако, заметить, что ряд ученых [30, 31] считают, что в настоящее время вирусная и аутоиммунная теории не имеют убедительных доказательств.
ЭГ на протяжении многих лет считался морфологическим субстратом БМ и ее отличительным признаком, в связи с чем диагностические тесты для подтверждения данного диагноза были направлены именно на выявление гидропических изменений во внутреннем ухе. Однако секционные исследования височных костей обнаружили, что не во всех случаях гистопатологически подтвержденный гидропс лабиринта проявлялся симптомами вестибулярной дисфункции при жизни [32]. Недавние исследования показали, что гидропс может быть конечным результатом действия множества факторов, включая сосудистые и аутоиммунные, что легло в основу полиэтиологической теории БМ, предполагающей обязательное наличие неких разрешающих факторов, которые переводят бессимптомный ЭГ в клинически манифестированную БМ [34, 34]. В настоящий момент некоторые исследователи задаются вопросом: ЭГ — это причина, следствие или сопутствующий признак БМ [35, 36]?
Столь же загадочными, как и причины БМ, остаются механизмы формирования головокружения [37]. Понимание патофизиологических механизмов приступов головокружения может дать ключ к разгадке этиологии БМ.
В 1964 г. H. Schuknecht [38] при исследовании секционного материала обнаружил рубцы на вестибулярной мембране у больных, при жизни страдающих БМ, на основании чего выдвинул теорию разрывов перепончатого лабиринта при критическом увеличении объема эндолимфы. По мнению H. Schuknecht, критическое повышение давления энлолимфы вызывает разрыв вестибулярной мембраны, разделяющей пери- и эндолимфатическое пространства, что приводит к смешиванию богатой калием эндолимфы с перилимфой и клинически проявляется приступами головокружения и нистагмом в сторону пораженного уха. Разрыв чаще происходит в области геликотремы, базального завитка улитки и маточки, а также в части эндолимфатического мешка, расположенной напротив ампул полукружных каналов. Выход ионов калия в перилимфу вызывает паралич афферентных вестибулярных нервов, сохраняющийся вплоть до заживления разрыва и восстановления исходного уровня электролитов вследствие работы ионных насосов.
Теория разрывов перепончатого лабиринта на протяжении нескольких десятилетий оставалась ведущей и легла в основу представлений о патогенетической роли блокады эндолимфатического протока в формировании гидропса. В рамках этих представлений началось развитие хирургических вмешательств на эндолимфатическом мешке, целью которых было устранение избыточного давления эндолимфы.
В свете современных достижений физиологии и патофизиологии уха теория разрывов кажется все менее вероятной, и на смену ей приходят новые гипотезы, объясняющие возможные механизмы контаминации перилимфы ионами калия. Так, H. Zenner [39] предполагает, что возможен выход ионов калия в межклеточное пространство под влиянием изменений уровня кальция, контролирующего прочность межклеточных связей вестибулярных волосковых клеток.
Среди новых теорий, объясняющих патофизиологические аспекты приступов БМ, наибольшей популярностью пользуется теория нарушения движения эндолимфы. Известно, что инородные частицы, введенные в улитковый проток, через некоторое время оказываются в эндолимфатическом мешке, что доказывает наличие лонгитудинального тока эндолимфы.
Особенности движения эндолимфы были изучены в экспериментах на животных. Так, A. Salt [40] было показано, что состав эндолимфы регулируется сосудистой полоской, которая контролирует приток воды и содержание ионов. Небольшой избыток эндолимфы реабсорбируется сосудистой полоской, при этом формируется радиальный ток эндолимфы. Лонгитудинальный ток в сторону эндолимфатического мешка эндолимфы возникает только при значительном избытке эндолимфы.
В норме баланс эндолимфы поддерживается ее радиальным током, и лишь изредка возникает потребность в формировании лонгитудинального движения. Объемная скорость лонгитудинального тока ограничивается перешейком эндолимфатического протока по принципу песочных часов. Предполагается, что в случаях, когда эндолимфа недостаточно активно перемещается в эндолимфатический мешок, роль резервуара для избытка эндолимфы берет на себя эндолимфатический синус.
Сведения об особенностях анатомии, физиологии и патофизиологии внутреннего уха были обобщены в дренажной теории происхождения гидропса, предложенной в 1991 г. W. Gibson и I. Arenberg [41]. Согласно дренажной теории, избыточный объем эндолимфы накапливается в апикальном отделе улитки, где мембраны лабиринта наиболее тонки и растяжимы. В норме небольшой избыток эндолимфы удаляется радиальным током, но при накоплении более значительного объема требуется лонгитудинальный дренаж. В процессе перемещения эндолимфы в сторону эндолимфатического протока последняя может накапливаться в эндолимфатическом синусе. Обычно этот избыток жидкости продвигается далее без каких-либо симптомов раздражения вестибулярного аппарата, поскольку клапан Баста в этот момент препятствует поступлению эндолимфы в преддверие. При наличии сужения костного эндолимфатического протока или инородных частиц, частично блокирующих эндолимфатический проток (например, свободно мигрирующих отолитов [42]), происходит дальнейшее накопление эндолимфы в синусе, что приводит к открытию клапана Баста. В этот момент эндолимфа поступает в преддверие, вызывая смещение купулы ампулярных рецепторов и появление головокружения и нистагма. Когда избыток эндолимфы удаляется из преддверия, купула возвращается в исходное положение, что приводит к изменению направления нистагма, наблюдаемому во второй фазе приступа БМ.
По мере прогрессирования заболевания функциональные возможности эндолимфатического мешка уменьшаются и приступы головокружения становятся все менее тяжелыми. Остаточный объем эндолимфы в улитковом протоке после каждого эпизода головокружения все увеличивается, что приводит к прогрессированию тугоухости. Постепенно гидропс охватывает весь перепончатый лабиринт подобно тому, как формируется стойкий гидропс у экспериментальных животных после облитерации эндолимфатического мешка, и приступы головокружения прекращаются. На поздних стадиях БМ клапан Баста остается открытым, что приводит к дроп-атаке при случайном возникновении лонгитудинального тока в перепончатом лабиринте.
С точки зрения дренажной теории хирургические вмешательства на эндолимфатическом мешке являются способом, временно или постоянно прекращающим лонгитудинальный ток эндолимфы. При хирургическом сокращении функциональных возможностей эндолимфатического мешка происходит прекращение деструктивных процессов, что приводит к уменьшению тяжести или к полному прекращению приступов головокружения. Метод рассечения эндолимфатического протока во II стадии заболевания, когда после приема внутрь дегидратирующего препарата слух улучшается, приводит практически всегда к прекращению приступов головокружения, что подтверждается в длительных наблюдениях (10—15 лет) [15]. Преимущество таких вмешательств заключается в ускорении естественного развития заболевания при сохранении вестибулярной функции.
Таким образом, полуторовековая история фундаментальных и клинических исследований не привела к раскрытию этиологии и патогенеза болезни Меньера. Недостаток сведений об этих процессах не позволяет в настоящее время предложить эффективные на всех стадиях способы лечения заболевания и профилактики развития вестибулярного и слухового дефицита.
Читайте также:

