Реферат на тему алканы и циклоалканы
Обновлено: 02.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Предмет: химия Учитель МБОУ Гвардейская школа Хасанова Ф.Д.
Цель: изучить и обобщить знания учащихся о алканах и циклоалканах, раскрыть их роль и область применения.
Оборудование : мультимедийный проектор, компьютер, интерактивная доска, презентация, видеоролик.
Личностные УУД: смыслообразование (каков смысл изучения данной темы); нравственно-этическое оценивание усваиваемого содержания
Регулятивные УУД (организация учащимися своей учебной деятельности): целеполагание, планирование, прогнозирование, контроль, коррекция, оценка, волевая саморегуляция в ситуации затруднения.
Познавательные УУД : поиск и выделение необходимой информации, структурирование знаний, смысловое чтение, умение осознанно строить речевое высказывание, логические действия (анализ, синтез, сравнение, обобщение).
Коммуникативные УУД : учебное сотрудничество с учителем и учениками, постановка вопросов, оценка и коррекция действий партнера
Планируемые результаты:
– Учащиеся должны знать: св-ва и применение алканов
– Учащиеся должны уметь: определять их состав по составу углеводородной цепи.
– Учащиеся должны владеть: работа с парой, учебным материалом.
Тип урока : изучение нового материала.
Проверка готовности к уроку.
Изучение нового материала.
Ознакомление с целью и задачами сегодняшнего занятия. Постановка цели урока.
Температуры плавления и кипения в целом увеличиваются с увеличением числа атомов С в молекуле. Первые представители ряда алканов – газы при н.у., алканы, содержащие от 5 до 15 атомов С – обычно жидкости, свыше 15 атомов С – твердые вещества.
Неразветвленные изомеры имеют более высокую температуру кипения, чем разветвленные (причина – разные силы межмолекулярного взаимодействия). Температуры плавления зависят, кроме того, от плотности упаковки молекул в кристалле. Табл. 1.
Табл. 1. Физические свойства алканов.
СН3 С-СН3
Все алканы бесцветны, легче воды и нерастворимы в ней. Алканы хорошо растворяются в органических растворителях, жидкие алканы (пентан, гексан) сами широко используются как растворители.
Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование.
Все связи в алканах малополярные, по этому для них характерны радикальные реакции. Отсутствие пи-связей делает невозможными реакции присоединения.
Для алканов характерны реакции замещения, отщепления, горения.
1. Реакции замещения
А) с галогенами (с хлором Cl 2 –на свету , Br 2 - при нагревании ) реакция подчиняется правилу Марковника (Правила Марковникова ) — в первую очередь галоген замещает водород у наименее гидрированного атома углерода. Реакция проходит поэтапно — за один этап замещается не более одного атома водорода.
Труднее всего реагирует Йод, и притом реакция не идет до конца, так как, например, при взаимодействии метана с йодом образуется йодистый водород, реагирующий с йодистым метилом с образованием метана и йода(обратимая реакция):
CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан)
CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан)
Б) Нитрование (Реакция Коновалова)
Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N 2 O 4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова. Один из атомов водорода заменяется на остаток NO 2 (нитрогруппа) и выделяется вода

2. Реакции отщепления
А) дегидрирование –отщепление водорода. Условия реакции катализатор –платина и температура.
Б) крекинг процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью. При температуре 450–700 o С алканы распадаются за счет разрыва связей С–С (более прочные связи С–Нпри такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов
C 6 H 14 C 2 H 6 + C 4 H 8
В) полное термическое разложение
СН 4 C + 2H 2
3. Реакции окисления
А) реакция горения. При поджигании (t = 600 o С) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды.
Б) Каталитическое окисление - при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–Спримерно в середине молекулы и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
![]()
Например, при неполном окислении бутана (разрыв связи С 2 –С 3 ) получают уксусную кислоту
4. Реакции изомеризации х арактерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов.
С 4 Н 10 C 4 H 10
5 . Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации , но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена).

Применение
Алканы выделяют из полезных ископаемых – нефти, газа, каменного угля. На разных этапах переработки получают бензин, керосин, мазут. Алканы используются в медицине, косметологии, строительстве.
В таблице описаны основные области применения предельных углеводородов .
Бензин, керосин, мазут
В качестве ракетного, моторного топлива
В качестве бытового газа для приготовления пищи
Петролейный эфир (смесь изопентанов и изогексанов),
Изготовление растворителей, смазочных масел, пропитки
Изготовление вазелинового масла (смесь жидких алканов), вазелина (смесь жидких и твёрдых алканов), свечей, моющих средств, лаков, эмалей, мыла. В качестве пропитки спичек. Использование при производстве органических кислот
Изготовление спиртов, альдегидов, кислот
Вазелин, вазелиновое масло
В качестве пропеллентов для изготовления аэрозолей
Изготовление увлажняющих косметических средств
Гудрон (дёготь) – конечный продукт переработки нефти, содержащий смесь алканов, циклоалканов, аренов, металлов, неметаллов
Для изготовления асфальтовых дорог
В качестве пропитки упаковочной бумаги
Производство жевательных резинок
Алканы используются при изготовлении каучука, синтетических тканей, пластмасс, поверхностно-активных веществ. В качестве заправки баллонов для тушения пожаров используются пропан и бутан в сжиженном виде.
Циклоалканы – это циклические углеводороды, не содержащие в молекуле кратных связей и соответствующие общей формуле: CnH2 n .
Физические свойства . При обычных условиях первые два члена ряда (С 3 — С 4 ) — газы, (С 5 — С 16 ) — жидкости, начиная с С 17 — твёрдые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов Циклоалканы в воде практически не растворяются, зато растворяются в химических растворителях. При увеличении числа атомов углерода возрастает молярная масса, следовательно, увеличивается температура плавления.
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду: циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения
Закрепление нового материала. Работа с учебником.
Подведение итога урока
Номенклатура:
Циклоалканы – это циклические углеводороды, не содержащие в молекуле кратных связей и соответствующие общей формуле: CnH2 n .
Циклопропан: Циклогексан:

Прочность связей в циклических соединениях зависит от числа атомов, участвующих в образовании цикла. Она определяется степенью его напряженности, обусловленной изменением валентных углов атомов цикла и отклонением этих атомов от нормального направления.
Для циклопропана межъядерные углы составляют 60º, как в равностороннем треугольнике, для циклобутана – 90º, как в квадрате, а в циклопентане – 108º, как в правильном пятиугольнике. Нормальный валентный угол для атома углерода – 109,5º. Поэтому при расположении в названных соединениях всех атомов углерода в одной плоскости уменьшение валентных углов составляет в циклопропане – 49,5º, в циклобутане – 19,5º, в циклопентане – 1,5º.
Чем больше отклонение валентного угла от нормального, тем более напряжены и, следовательно, непрочны циклы. Однако в отличие от циклопропана циклобутан и циклопентан имеют неплоские циклы. Один из атомов углерода непрерывно выходит из плоскости. Циклобутан существует в виде неплоских "сложенных" конформаций. Циклопентан характеризуется конформацией "конверт".
Для циклогексана, как правильного шестиугольника, межъядерные углы составляют 120º. Если бы молекула циклогексана имела плоское строение, то отклонение от нормального валентного угла атома углерода составляло:109,5º–120º = 10,5º.
Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой молекуле циклогексана сохраняются обычные валентные углы при условии его существования в двух конформациях "кресла" и "ванны". Конформация "кресла" менее напряжена, поэтому циклогексан существует преимущественно в виде конформеров I и III, причем цикл претерпевает непрерывную инверсию с промежуточным образованием конформера II:
ось симметрии II III
I
Двенадцать связей С-Н, которые имеются у циклогексана в конформации "кресла", делятся на два типа. Шесть связей направлены радиально от кольца к периферии молекулы и называются экваториальными связями (e- связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a- связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз)
Физические свойства:
При обычных условиях первые два члена ряда (С 3 — С 4 ) — газы, (С 5 — С 16 ) — жидкости, начиная с С 17 — твёрдые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов Циклоалканы в воде практически не растворяются, зато растворяются в химических растворителях. При увеличении числа атомов углерода возрастает молярная масса, следовательно, увеличивается температура плавления.
Циклоалканы относят к карбоциклическим углеводородам – вещества, молекулы которых содержат замкнутую цепь атомов углерода (цикл).
Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле производят таким образом, чтобы заместители получили наименьшие номера.
Циклоалканы – это циклические углеводороды, не содержащие в молекуле кратных связей и соответствующие общей формуле:

Точно такой же формулой описывается гомологический ряд алкенов. Из чего следует, что каждому циклоалкану изомерен соответствующий алкен. Это пример так называемой межклассовой изомерией.
Атомы углерода в циклоалканах, как и в алканах, находятся в sp3–гибридизованном состоянии и все их валентности полностью насыщены, и образует четыре связи С-С и С-Н. Углы между связями зависят от размера цикла. В простейших циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность. Свободное вращение вокруг связей С-С, образующих цикл, невозможно. Простейший циклоалкан – циклопpопан С3Н6 – представляет собой плоский трехчленный карбоцикл

Остальные циклы имеют неплоское строение вследствие стремления атомов углерода к образованию тетраэдрических валентных углов.

По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки "цикло" (циклопропан, циклобутан, циклопентан, циклогексан и т.д.). При наличии в цикле заместителей нумерацию атомов углерода в кольце проводят так, чтобы ответвления получили возможно меньшие номера. Так, соединение

Следует назвать 1,2-диметилциклобутан, а не 2,3-диметилциклобутан, или 3,4-диметилциклобутан.
Молекулы циклоалканов содержат на два атома водорода меньше, чем соответствующие алканы. Напpимеp, бутан имеет фоpмулу С4Н10, а циклобутан – С4Н8. Поэтому общая формула циклоалканов СnH2n. Структурные формулы циклоалканов обычно изображаются сокращенно в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле.

Для циклоалканов как и для всех классов органических соединений, характерна изомерия углеродного скелета (1. Структурная изомерия). Для циклоалканов характерно структурная изомерия связанная с размером цикла,

со взаимным расположением заместителей в кольце,

со строением заместителя

Структурная изомерия для циклоалканов, во-первых, обусловлена размером цикла. Так, существует два циклоалкана формулы С4Н8: циклобутан и метилциклопропан. Во-вторых, такая изомерия обусловливается положением заместителей в цикле (например, 1,1 и 1,2-диметилбутан).
Изомерия положения заместителей в кольце

3. Межклассовая изомерия с алкенами:

Отсутствие свободного вращения вокруг связей С-С в цикле создает предпосылки для существования пространственных изомеров у некоторых замещенных циклоалканов. Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цисизомер) или по разные стороны (трансизомер):

По размеру цикла циклоалканы делятся на ряд групп, из которых мы рассмотрим малые (С3, С4) и обычные (С5-С7) циклы.
2. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цисизомерах заместители находятся по одну сторону от плоскости кольца, в трансизомерах – по разные:

3. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение.

4. Поворотная изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по у-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые. Например, в циклогексане наиболее устойчивой является конформация "кресла".

В этой пространственной форме отсутствует угловое напряжение, т.к. все валентные углы имеют нормальные для sp3-гибридизованных атомов значения 109°28’. Кроме того, каждая пара соседних атомов углерода (фрагмент этана) находится в заторможенной конформации.

Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур.
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.

Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду: циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
Малые циклы (С3 – С4) довольно легко вступают в реакции гидрирования:

Циклопропан и его производные присоединяют галогены и галогеноводороды:

В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.



Эти соединения, подобно алканам, вступают также в реакции дегидрирования, окисления в присутствии катализатора и др.


Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла. Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.
1. При переработке нефти выделяют главным образом циклоалканы С5 - С7.
2. Действие активных металлов на дигалогензамещенные алканы (реакция Вюрца) приводит к образованию различных циклоалканов:

(вместо металлического натрия используется также порошкообразный цинк).
Строение образующегося циклоалкана определяется структурой исходного дигалогеналкана. Этим путем можно получать циклоалканы заданного строения. Например, для синтеза 1,3-диметилциклопентана следует использовать 1,5-дигалоген-2,4-диметилпентан:

Существуют и другие методы получения циклоалканов. Так, например, циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.

Дегалогенирование дигалогенопроизводных. Трех- и четырехчленные циклы получают децствием цинка на соответствующие дигалогенопроизводные:

Либо можно получить пиролизом солей дикарбоновых кислот. Циклопентан и циклогексан образуются при пиролизе (нагревании без доступа воздуха) кальциевых солей соответственно гександикарбоновой и гептандикарбоновой кислот и воставлении образующихся кетонов.
Мне на самом деле понравилось писать реферат про циклоалканы, используя интернет и книги, я находил много нового, и не только про циклоалканы, но и много других интересных фактов. Сделав реферат про циклоалканы, я хотел бы подвести итоги:
Циклоалканы – это циклические углеводороды, не содержащие в молекуле кратных связей и соответствующие общей формуле:

Атомы углерода в циклоалканах, как и в алканах, находятся в sp3–гибридизованном состоянии и все их валентности полностью насыщены, и образует четыре связи С-С и С-Н. Углы между связями зависят от размера цикла. В простейших циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°. Для циклоалканов, содержащих два и более заместителя, возможна пространственная изомерия.
Для циклоалканов характерна структурная изомерия и изомерия углеродного скелета, изомерия положения заместителей в кольце, межклассовая изомерия, Цис-транс-изомерия, поворотная изомерия
Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества.
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость.
Получит циклоалканы можно путем гидрирования бензола или дегалогенированием дегалогенопроизводных, а так же пиролизом солей декарбоновых кислот.
Так же циклоалканы распространены в природе и широко используются людьми. Они важны и их мир не меньше интересен, чем наш.
1. Учебник химии за 10 класс; О.С.Габриелян, Ф.Н.Маскаев, С.Ю.Пономарев, В.И.Теренин.

Традиционно курс органической химии начинают с изучения алканов - соединений, содержащий только атомы углерода и водорода (они называются углеводородами - не путать с углеводами!) и не содержащих двойных связей. Пользуясь правилом, что углерод четырёхвалентен, а водород образует только одну связь, мы можем нарисовать следующие молекулы в порядке возрастания количества атомов в них:
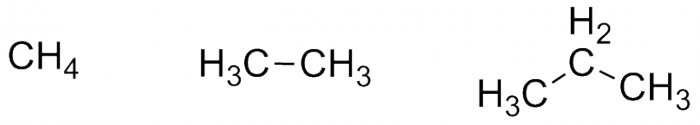
Дальше дело становится интереснее. Следующее соединение должно иметь в себе четыре атома углерода, но выстроить их можно двумя способами:

Два этих соединения являются изомерами, поскольку брутто-формула у них одна и та же: C4H10. Но можно предположить, что свойства их будут различаться. Так и есть: изобутан имеет температуру кипения ниже нуля, а бутан - выше, поэтому сжижается немного легче, чем изобутан (при нормальных условиях оба вещества находятся в форме газа). Если рассматривать соединение с пятью атомами углерода, то таких изомеров будет уже три (попробуйте нарисовать их!). Общая формула у всех будет C5H12.
Собственно, как нетрудно проверить, у всех алканов формула выглядит как CnH2n+2. Первые восемь - это метан, этан, пропан, бутан, пентан, гексан, гептан и октан. Для того, чтобы выделить те изомеры, которые имеют линейное строение, их называют "нормальными", но для простоты пишут, например: н-гексан, н-гептан.
Теперь о свойствах. Как правило, чем "тяжелее" соединение, тем выше его температуры плавления и кипения. И это наблюдается в ряду алканов: метан - самый лёгкий из алканов -это газ, сжижающийся только при очень низкой температуре (Крит. температура - -83°C). Поэтому его хранят в баллонах под большим давлением, такие баллоны можно увидеть на некоторых автобусах, ездящих на природном газе, то есть - метане. В качестве примеси в природном газе (порядка 1%) присутствует этан, следующий алкан, также трудно сжижающийся.
Пропан уже более удобен в использовании: при нормальных условиях это газ, но под давлением в 25атм он сжижается, превращаясь в лёгкую прозрачную подвижную жидкость (занимающую гораздо меньший объём, чем газ при тех же условиях). В таком виде он находится в красных пропановых баллонах.
Бутан требует ещё меньшего давления - около 4атм, и это он плещется в небольших туристических баллонах с газом. При достаточно низкой температуре (-10°C, например) он может вообще отказаться вытекать из баллона, поэтому т.н. "зимнюю смесь" получают, добавляя небольшое количество пропана и изобутана.
Следующие члены ряда алканов ещё больше похожи друг на друга - это прозрачные жидкости разной степени летучести (н-пентан кипит при 30°C, а н-октан - при 125°). Но различные изомеры имеют довольно сильно отличающиеся физические характеристики, поэтому говорить, например, об октане, не уточняя, какой из 18 его изомеров имеется в виду, чаще всего бессмысленно.
Собственно, чистые алканы встречаются довольно редко. Например, бензин - это смесь алканов, получающаяся при перегонке нефти. Её сложно и бесмысленно разделять на отдельные вещества. Более тяжёлые фракции (с числом атомов углерода от 12 до 20) составляют основу дизельного топлива. Самые тяжёлые алканы называются парафинами. Хотя по правде говоря, полиэтилен - это тоже алкан (причём линейный!), но содержащий в себе тысячи и десятки тысяч атомов углерода. Его физические свойства вы, надеюсь, неплохо себе представляете.
Все алканы горят на воздухе, окисляясь до диоксида углерода и водяного пара. Метан можно каталитически окислить в метанол, формальдегид или муравьиную кислоту. Хлор с метаном реагируют, давая смесь метилхлорида, дихлорметана и хлороформа (трихлорметана).
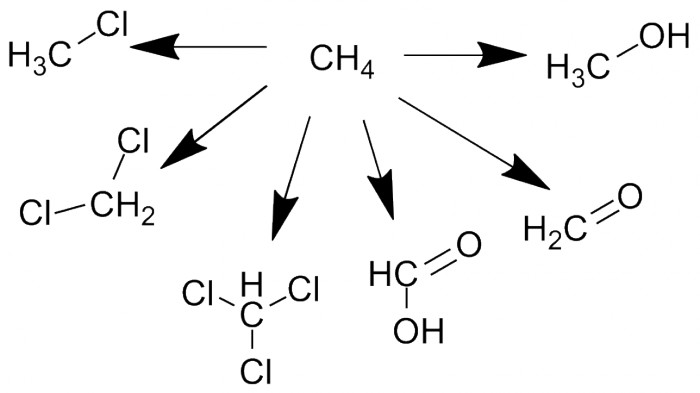
Аналогично реагируют и все другие алканы, давая обычно сложную смесь продуктов. Реакции с бромом и иодом встречаются редко, а фтор обычно разрывает все связи, давая в итоге тетрафторметан и фтороводород. В целом химия алканов довольно бедна, но это и есть одна из причин, почему начинают обычно именно с них.
В отдельную категорию выделяются циклоалканы - алканы, имеющие циклическую структуру. Начиная с циклопропана, их ряд также бесконечен, и разнообразия в них видится больше. Существуют моноциклические, бициклические, трициклические циклоалканы, а также химические извращения развлечения вроде кубана, призмана и адамантана. Последний, кстати, содержится в нефти, своим строением напоминает кристаллическую решётку алмаза (отсюда и название) и встречается в молекулах некоторых лекарств (например, римантадина). Гораздо чаще, правда, в природных соединениях встречается циклопентановый и циклогексановые фрагменты.
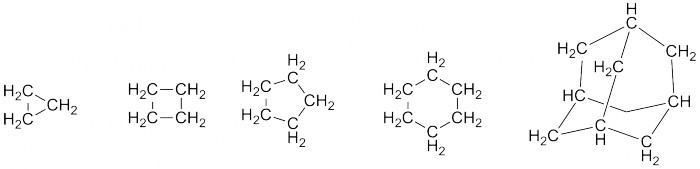
Простейшие циклоалканы. Правая формула - адамантан.
По химическим и физическим свойствам циклоалканы мало отличаются от линейных алканов. Исключение составляет циклопропан и, в меньшей степени, циклобутан, из-за эффекта, известного, как "напряжение цикла". Поскольку в обычных условиях угол между C-C связями составляет около 120 град., то для того, чтобы "зажать" связи в циклопропан или циклобутан, требуется затратить дополнительную энергию (аналогично пружине или автомобильной рессоре). Поэтому в некоторых реакциях цикл может раскрываться. А поскольку запасённая энергия при этом высвобождается, то производные циклопропана исследовались как высокоэнергетичное ракетное топливо взамен керосина. Ещё одна особенность циклопропана - он удостоился чести использоваться как препарат для ингаляционного наркоза, однако был впоследствии заменён негорючими и менее токсичными аналогами.
Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
Общая формула циклоалканов CnH2n, где n≥3.
Атомы углерода в молекулах циклоалканов находятся в состоянии sp 3 -гибридизации и образует четыре σ-связи С–С и С–Н. В зависимости от размеров цикла меняются валентные углы.
| В малых циклах (циклопропан и циклобутан) валентные углы между связями С–С сильно отличаются от валентных углов между связями С–С в алканах (109 о 35′). Поэтому в малых циклах возникает напряжение, которое приводит к высокой реакционной способности таких циклоалканов. |
Самый простой циклоалкан — циклопропан, представляет, по сути, плоский треугольник.

Поэтому циклопропан очень легко вступает в реакции присоединения с разрывом углеродного цикла.
Остальные циклоалканы имеют неплоское строение. Молекула циклобутана имеет перегиб по линии, соединяющей первый и третий атомы углерода в кольце:

Циклобутан также вступает в реакции присоединения, но угловое напряжение в циклобутане меньше, чем в циклопропане, поэтому реакции присоединения к циклобутану протекают сложнее.
Большие циклы имеют более сложное, неплоское строение, вследствие чего угловое напряжение в молекулах больших циклоалканов почти отсутствует.
Циклоалканы с большим циклом не вступают в реакции присоединения. Для них характерны реакции замещения.


Структурная изомерия
Для циклоалканов характерна структурная изомерия, связанная с разным числом углеродных атомов в кольце, разным числом углеродных атомов в заместителях и с положением заместителей в цикле.
- Изомеры с разным числом атомов углерода в заместителях отличаются строением заместителей у одинакового углеродного цикла.
Геометрическая (цис-транс-) изомерия
У циклоалканов с двумя заместителями, расположенными у соседних атомов углерода в цикле цис-транс-изомерия обусловлена различным взаимным расположением в пространстве заместителей относительно плоскости цикла.
| В цис-изомерах заместители находятся по одну сторону от плоскости цикла, в транс-изомерах – заместители расположены по разные стороны. |
Для 1,1-диметилциклопропана цис-транс-изомерия не характерна.
В названиях циклоалканов используется префикс -ЦИКЛО.
| Название циклоалкана | Структурная формула |
| Циклопропан |  |
| Циклобутан |  |
| Циклопентан |  |
| Циклогексан |  |
Название циклоалканов строится по следующим правилам:
1. Цикл принимают за г лавную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями.
2. Нумеруют атомы углерода в цикле так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 1,1-диметилциклопропан или 1,1,3-триметилциклопентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
5. Называют углеродный цикл.
Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения.
1. Реакции присоединения к циклоалканам
| Чем меньше цикл и чем больше угловое напряжение в цикле, тем легче протекают реакции присоединения. Способность вступать в реакции присоединения уменьшается в ряду: циклопропан > циклобутан > циклопентан. |
1.1. Гидрирование циклоалканов
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана.
Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:


Циклопентан присоединяет водород в жестких условиях:

Бромирование протекает более медленно и избирательно.
Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют.
1.2. Галогенирование циклоалканов
Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
| Например. Циклопропан присоединяет бром с образованием 1,3-дибромпропана: |

1.3. Гидрогалогенирование
Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
| Например, циклопропан присоединяет йодоводород. |

| Присоединение галогеноводородов к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и др.) происходит по правилу Марковникова. |
| Например, при присоединении бромоводорода к метилциклопропану преимущественно образуется 2-бромбутан |

2. Реакции замещения
2.1. Галогенирование
Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
| Например, при хлорировании циклопентана на свету или при нагревании образуется хлорциклопентан |

При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:

2.2. Нитрование циклоалканов
При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
| Например, нитрование циклопентана. |

2.3. Дегидрирование
При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода.
Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
| Например, бензол образуется при дегидрировании циклогексана. |

| Например, при отщеплении водорода от метилциклогексана образуется толуол. |

3. Окисление циклоалканов
3.1. Горение
Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
| Например, горение циклопентана. |
3.2. Окисление
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:

1. Дегидрирование алканов
Алканы с длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при нагревании в присутствии металлических катализаторов образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

Дегидроциклизация алканов — важный промышленный способ получения циклоалканов.
2. Гидрирование бензола и его гомологов
При гидрировании бензола при нагревании и в присутствии катализатора образуется циклогексан:

При гидрировании толуола образуется метилциклогексан:

Этим способом можно получить только циклогексан и его гомологи с шестичленным кольцом.
3. Дегалогенирование дигалогеналканов
При действии активных металлов на дигалогеналканы, в которых между атомами галогенов находится три и более атомов углерода.
| Например, 1,4-дибромбутан реагирует с цинком с образованием циклобутана |

Таким образом можно синтезировать циклоалканы заданного строения, в том числе циклоалканы с малыми циклами (С3 и С4).
Читайте также:
- Реферат учет денежных средств бюджетных организаций
- Биоэнергетика живых систем превращение энергии живыми организмами реферат
- Сторителлинг как базовый элемент спичрайтинга эффективное рассказывание историй реферат
- Легионеллез инфекционные болезни реферат
- Перспективы развития солнечной энергетики в россии реферат

