Реферат егэ по химии
Обновлено: 30.06.2024
Собранные в банке бесплатные рефераты по химии – это работы об органических и неорганических веществах, растворах, элементах, металлах и их сплавах, нефти и способах ее переработки.
Рефераты по химии помогут подготовиться к семинарам, экзаменам и докладам. Информация дополнена уравнениями, графическими и структурными формулами.
Каталог готовых рефератов
Выберите предмет
- Четко определите цель работы в рамках заданной темы.
- Исходя из цели, определите в общих чертах содержание будущего реферата, составив предварительный план.
- Составьте список литературы или других источников, соответствующих теме реферата.
- Изучая литературу (другие источники), отмечайте все, что войдет в работу.
- Составьте окончательный подробный план, указывая для каждого пункта источник, из которого будет взят материал.
- Во вступлении реферата раскройте значимость его темы, укажите цель реферата.
- Раскройте все пункты плана, используя конкретные факты, примеры, цитаты из первоисточников.
- Сделайте промежуточные выводы по каждой смысловой части работы.
- Выразите собственное аргументированное мнение по теме реферата (факультативный пункт).
- В подстрочных сносках укажите источники цитат, фактов.
- Сделайте обобщающий вывод.
- Перечитайте реферат, проверьте логичность деления текста на абзацы; если нужно, удалите повторы информации; убедитесь в том, что тема раскрыта, а цель работы достигнута.
- Обзорный реферат (или сводный) – это обобщающая характеристика нескольких первоисточников, касающихся определенной темы.
- Реферат-экстракт – составляется из наиболее важных в смысловом отношении фраз, взятых из анализируемого текста. Отобранные и в случае необходимости отредактированные предложения должны точно передавать общее содержание первоисточника. Чаще всего используется в информационных службах и библиотеках при составлении каталогов.
Любое использование материалов сайта допускается исключительно с согласия редакции при установке активной ссылки на первоисточник. Информация, представленная на сайте, получена из открытых и общедоступных материалов. Ее достоверность подлежит проверке у первоисточника. Редакция не несет ответственности за какие-либо действия, либо за возможный ущерб (как материальный, так и моральный), полученный в результате прочтения материалов. Пользователь сайта принимает решения самостоятельно и несет за них полную ответственность.

Как получить высокий балл ЕГЭ по химии? Заранее начать подготовку к экзамену, работать с репетитором и внимательно изучить результаты прошлых лет. В том числе уделить внимание типичным ошибкам ЕГЭ по химии.
С последним пунктом мы готовы помочь. В этой статье проведём подробный разбор и анализ ошибок ЕГЭ по химии за 2022 год, чтобы вы не допустили их на экзамене.
Хотите получать полезные материалы из мира образования первыми? Подписывайтесь на наш информационный канал в Telegram. И не забывайте следить за акциями и скидками — с ними учиться гораздо выгоднее.
Структура ЕГЭ по химии
Единый государственный экзамен по химии традиционно вызывает много трудностей среди выпускников старших школ. Однако высокие баллы дают возможность поступать на химические факультеты престижных вузов.
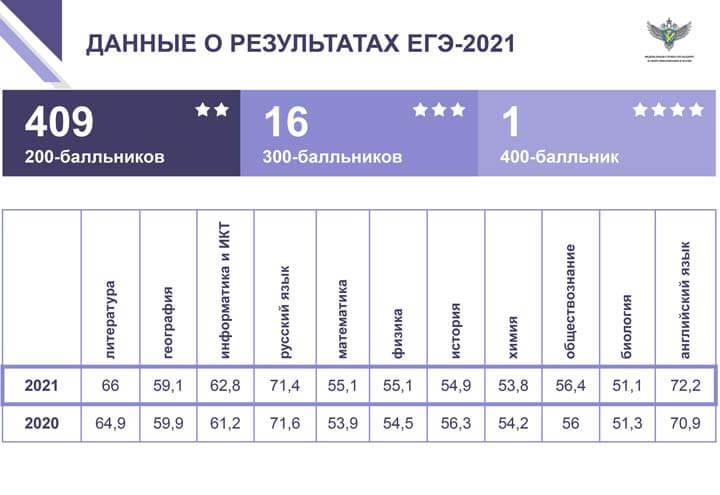
В 2022 году в едином государственном экзамене по химии приняли участие 95 474 человека, а средний балл составил 53,8. Более низкие показатели лишь у ЕГЭ по биологии.
Кстати! Для наших читателей сейчас действует скидка 10% на любой вид работы.
Среди всех участников были и те, кто набрал 100 баллов за ЕГЭ по химии. Таких оказалось 8 121 человек.
Сам экзамен по предмету состоял из 35 заданий, распределённым по трём разным уровням сложности:
- базовому;
- повышенному;
- высокому.
Первая часть ЕГЭ по химии включала в себя варианты заданий базового и повышенного уровня, которые соответствовали одному из четырёх блоков:
- Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Закономерности изменения свойств химических элементов по периодам и группам. Строение вещества. Химическая связь.
- Неорганические вещества: классификация и номенклатура, химические свойства и генетическая связь веществ различных классов.
- Органические вещества: классификация и номенклатура, химические свойства и генетическая связь веществ различных классов.
- Химическая реакция; Методы познания в химии; Химия и жизнь; Расчёты по химическим формулам и уравнениям реакций.
Подробнее познакомиться с результатами ЕГЭ по химии и другим предметам можно на сайте ФИПИ. Там же можно найти аналитические материалы и рекомендации по подготовке, которые будут полезны не только учителям, но и учащимся.
Типичные ошибки ЕГЭ: химия
Давайте подробнее рассмотрим, какие типичные ошибки допускали выпускники, решая задачи каждого блока в этом году.
Здания первого блока проверяли, насколько хорошо выпускники ориентируются в основных химических терминах, знают ли строение атомов и веществ и умеют ли пользоваться Периодической таблицей Д.И. Менделеева.
Наибольшие трудности в выполнении данного блока задач вызвали вопросы, связанные со следующими умениями:
- составлять и записывать электронные модели атомов химических элементов;
- верно определять степень окисления химических элементов, ориентируясь на его положение в Периодической таблице Менделеева.
Неорганические вещества: классификация и номенклатура, химические свойства и генетическая связь веществ различных классов
Данный блок содержит задания, посвящённые неорганическим веществам, их свойствам и связям, которые возникают в процессе взаимодействия.
С заданиями по неорганической химии ученики справляются лучше, чем со следующим блоком, посвящённым органическим соединениям. Но и здесь участники допускают в решении типичные ошибки:
- путаются в свойствах конкретных веществ, которые относятся к разным классам;
- плохо устанавливают соответствия между химическими веществами и реагентами.
Органические вещества: классификация и номенклатура, химические свойства и генетическая связь веществ различных классов
Блок по органической химии требовал от учащихся чётких знаний классификационной принадлежности химических веществ и их строению. К сожалению, результаты были ниже, чем по неорганическим соединениям и основные вопросы возникали в следующих задачах:
- проанализировать строение химических веществ;
- прогнозировать свойства, исходя из химической структуры;
- комплексно применять знания, учитывая все свойства представленных химических веществ.
Химическая реакция; Методы познания в химии; Химия и жизнь; Расчёты по химическим формулам и уравнениям реакций
Последний блок проверял не только теоретические основы, но и практические навыки выпускников. Здесь учащиеся должны были показать, умеют ли они использовать полученные знания на конкретных примерах, могут ли планировать эксперименты и решать химические задачи.
Самые низкие баллы участники набрали, выполняя задания следующих типов:
- определить скорость химической реакции в образовании конкретного вещества, учитывая факторы, от которых она зависит;
- классифицировать реакции, которые относятся к неорганической и органической химии;
- найти обратимые и необратимые реакции;
- определить факторы, которые влияют на химическое равновесие и его смещение;
- решить задачи на качественные реакции неорганических и органических соединений;
- верно использовать знание о массовых долях веществ в растворе, учитывая их соотношение в реакциях.
Вторая часть ЕГЭ по химии с открытыми вопросами
С заданиями самого высокого уровня сложности справилось совсем небольшое количество участников. Пять баллов (максимальное количество) смогли получить лишь 15,8%.
- отлично ориентироваться в свойствах химических веществ и их реакциях;
- разбираться в тонкостях различных химических реакций: окисления, восстановления, ионного обмена;
- легко решать химические задачи и выводить уравнения разных реакций.

Чтобы написать ЕГЭ по химии на отлично, готовьтесь к экзамену заранее
Что делать, чтобы избежать ошибок в ЕГЭ по химии
В ЕГЭ по химии, как и по другим предметам, важно не только хорошо разбираться в самом учебном материале, но и помнить об организационных моментах. Чтобы ничего не забыть, воспользуйтесь нашими советами:
Мы разобрали, какие типичные ошибки в ЕГЭ по химии допустили участники в 2022 году. У вас есть возможность учесть их опыт и уделить особое внимание сложным местам при подготовке. А если будет нужна помощь в написании рефератов, самостоятельных или контрольных по химии и другим предметам, смело обращайтесь в наш студенческий сервис.
Системы контрольных измерительных материалов. Описание экзаменационной модели по химии 2009 и 2010 годов. Анализ основных результатов единого государственного экзамена по предмету. Рекомендации по совершенствованию преподавания химии с их учетом.
| Рубрика | Педагогика |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 17.02.2011 |
| Размер файла | 27,8 K |
Подобные документы
Сущность государственной итоговой аттестации учащихся по химии. Содержание контрольных измерительных материалов. Формы и средства подготовки к ГИА. Система оценивания экзаменационной работы. Выявление уровня знаний учеников сельской школы по предмету.
дипломная работа [2,8 M], добавлен 07.11.2014
Назначение демонстрационного варианта контрольных материалов по обществознанию. Критерии оценки выполнения заданий единого государственного экзамена с развёрнутыми ответами. Задания с выбором ответа и с развёрнутым ответом, раскрытие смысла высказывания.
методичка [293,3 K], добавлен 17.11.2011
Процесс преподавания химии в вечерней школе. Строение и классификация органических реакций. Химические реакции в органической химии. Строение атома. Периодическая система химических элементов Д. И. Менделеева. Строение вещества. Химические реакции.
дипломная работа [53,9 K], добавлен 16.01.2009
Исследование и анализ главных причин потребности интегрированных уроков. Выявление преимуществ и проблем интеграции. Анализ результатов интегрированного обучения и его значение. Разработка плана-конспекта интегрированного урока по химии и физике.
курсовая работа [35,2 K], добавлен 17.07.2013
Цели, значение и содержание контроля результатов обучения химии. Методы устного контроля результатов обучения. Фронтальная контролирующая беседа. Экзамен как метод заключительной проверки. Письменная проверка результатов обучения, контрольная работа.
курсовая работа [24,6 K], добавлен 04.01.2010
Компьютерные технологии на уроках химии, использование компьютерных программ "Органическая химия", "Решение задач по химии", применение различных вычислительных методов и операций. Методы развития творческих подходов к овладению знаниями по предмету.
реферат [144,1 K], добавлен 17.10.2010
Продолжение учебно-воспитательного процесса, начатого на уроке. Поддержание устойчивого интереса к изучению химии. Постанова и организация индивидуальной внеклассной работы по химии. Методика организации и проведения внеклассной работы по химии.

Запланирован на 27 мая 2022 года. Полный перечень тем, которые необходимо знать, что бы получить максимальный балл представлены ниже:
Строение атомов и ионов:
Закономерности изменения свойств в периодах и группах ПС:
- Металлические и неметаллические свойства.
- Окислительные и восстановительные свойства.
- Электроотрицательность.
- Атомный радиус.
- Кислотные и основные свойства оксидов, гидроксидов, водородных соединений.
Валентность и степень окисления:
- Низшие и высшие степени окисления.
- Низшая и высшая валентность.
- Элементы-исключения (высшая валентность или высшая степень окисления не соответствует номеру группы).
- Элементы с постоянной валентностью.
- Элементы с постоянной степенью окисления в соединениях.
- Возможные промежуточные степени окисления.
Химические связи и кристаллические решетки
- Ковалентная неполярная связь.
- Ковалентная полярная связь.
- Донорно-акцепторный механизм образования ковалентных связей.
- Ионная связь.
- Металлическая связь.
- Водородная связь.
- Длина связи.
- Энергия связи.
- Аморфные вещества.
- Молекулярная решетка.
- Атомная решетка.
- Ионная решетка.
- Металлическая решетка.
- Вещества молекулярного и немолекулярного строения.
- Зависимость физических свойств от типа решетки.
Классификация веществ в неорганической химии:
- Оксиды (кислотные, основные, амфотерные, несолеобразующие).
- Гидроксиды (кислотные, основные, амфотерные)
- Кислоты (одноосновные, двухосновные, многоосновные, кислородсодержащие и бескислородные, сильные и слабые).
- Основания (растворимые и нерастворимые).
- Соли (нормальные, кислые, основные).
Подготовка к ЕГЭ по химии
Задания 6, 7, 8, 9, 31
Химические свойства неорганических веществ:
- Химические свойства простых веществ-металлов (реакции с неметаллами, кислотами, солями, оксидами). Особые свойства алюминия, цинка, бериллия.
- Химические свойства простых веществ-неметаллов (реакции с металлами и другими неметаллами, щелочами, концентрированными кислотами, водой, замещение одними неметаллами других).
- Характерные химические свойства основных оксидов (взаимодействие с водой, кислотами, кислотными оксидами, восстановителями). Получение основных оксидов.
- Характерные химические свойства кислотных оксидов (взаимодействие с основаниями и основными оксидами, водой). Получение кислотных оксидов.
- Химические свойства растворимых и нерастворимых оснований (реакции с кислотными оксидами и кислотами, амфотерными гидроксидами, солями средними и кислыми).
- Химические свойства кислот (взаимодействие с оксидами, основаниями и амфотерными гидроксидами, металлами, солями средними и кислыми).
- Химические свойства амфотерных оксидов и гидроксидов (взаимодействие со щелочами и кислотами, растворами некоторых солей и оксидами). Образование комплексных солей. Номенклатура и химические свойства комплексных солей (реакции с некоторыми кислотами и солями, разложение при нагревании).
- Химические свойства солей (взаимодействие со щелочами и раствором аммиака, с кислотами, друг с другом, с некоторыми оксидами и металлами).
- Соединения металлов IА-группы. Тривиальные названия (глауберова соль, едкий натр, поташ, селитра чилийская, кальцинированная сода, питьевая сода).
- Соединения металлов IА-группы. Образование оксидов и пероксидов, нитридов, гидридов, сульфидов, фосфидов, галогенидов, карбидов. Гидролиз нитридов, фосфидов, гидридов, карбидов.
- Соединения металлов IА-группы. Взаимодействие со сложными веществами: водой, аммиаком, спиртами и некоторыми алкинами.
- Окрашивание пламени солями щелочных металлов.
- Соединения металлов IIА-группы. Тривиальные названия (доломит, известняк, мрамор, мел, негашеная известь, гашеная известь, известковое молоко).
- Соединения металлов IIА-группы. Образование галогенидов, оксидов, пероксидов, гидридов, сульфидов, карбидов, нитридов и фосфидов.
- Соединения металлов IIА-группы. Реакции с водой.
- Окраска пламени солями щелочноземельных металлов.
- Жесткость воды и методы её устранения.
- Медь: тривиальные названия (малахит, медный купорос); получение из оксидов, из солей путем замещения и электролизом; Взаимодействие с галогенами, кислородом, азотной и серной кислотой.
- Оксид меди I: цвет, восстановительные свойства, образование комплексов с раствором аммиака.
- Оксид меди II: цвет, типичные химические свойства.
- Гидроксид меди II: цвет, типичные химические свойства оснований. Комплексообразование.
- Хром: методы получения; взаимодействие с азотной и серной кислотой, с кислородом, соляной кислотой и хлороводородом на воздухе.
- Оксид хрома III: получение путём разложения дихромата аммония и дихромата калия. Характерные амфотерные свойства.
- Оксид хрома VI: образование хромовой и дихромовой кислоты, хромата и дихромата калия/натрия.
- Окислительно-восстановительные свойства оксида хрома III, оксида хрома VI, хромата и дихромата калия/натрия.
- Оксид марганца IV: цвет, ОВ-свойства.
- Окислительно-восстановительные свойства манганатов и перманганатов. Цвета растворов.
- Железо. Особенности взаимодействия железа с кислородом, галогенами и соляной кислотой, с концентрированной серной и азотной кислотой.
- Оксид железа II: получение, ОВ-свойства, свойства типичного основного оксида, цвет. Гидроксид железа II: цвет, получение.
- Оксид железа III: получение, цвет, характерные амфотерные свойства, ОВ-свойства. Гидроксид железа III: цвет, получение, характерные амфотерные свойства.
- Железная окалина: получение, ОВ-свойства.
- Соли железа II: хлористое железо, железный купорос, желтая кровяная соль. Качественные реакции на соли железа II.
- Соли железа III: хлорное железо, красная кровяная соль. Качественные реакции на соли железа III.
- Водород: взаимодействие с металлами и неметаллами. Восстановительные свойства при реакциях со сложными веществами: оксидами и галогенидами.
- Лабораторные методы получения водорода (из кислот, щелочей, воды, гидридов). Промышленные методы получения водорода (электролизом, конверсией метана, крекингом углеводородов).
- Взаимодействие воды с металлами и неметаллами, амфотерные свойства воды. Получение и ОВ-свойства пероксида водорода.
- Агрегатное состояние и цвет элементов VIIА-группы (галогенов). Изменение окислительной активности в ряду галогенов на примере взаимодействия их с серой, фосфором, железом. Замещение одного галогена другим. Взаимодействие галогенов с водой и щелочами.
- Хлорсодержащие кислоты: хлорная, хлористая, хлорноватая, хлорноватистая, соответствующие им соли, их ОВ-свойства. Бертолетова соль, белильная известь, хлорка.
- Кислород: почему не проявляет степень окисления +6? Методы получения (из хлората калия, нитратов щелочных металлов, перманганата калия, оксида ртути II, пероксидов, электролизом, фракционной возгонкой).
- Кислород: образование оксидов, пероксидов, окалины. С какими элементами не реагирует? Реакции с серой и азотом. Реакции с сульфидами, метанов, сероводородом. Взаимодействие с оксидами металлов в промежуточной степени окисления.
- Сера: цвет, формулы: свинцового блеска, цинковой обманки, железного колчедана, серного колчедана, пирита. Получение серы из пирита, диоксида серы, сероводорода. Аллотропные модификации серы.
- Химические свойства серы: с какими элементами сера ведет себя как окислитель? Восстановительные свойства серы (реакции, в которых сера принимает значение степени окисления +4 и +6). Реакция серы со щелочами.
- Сероводород и сероводородная кислота: физические свойства, восстановительные свойства сульфид-иона. Качественные реакции на сульфид-ион. Получение сульфидов и гидросульфидов.
- Сравнение оксида серы IV и оксида серы VI: взаимодействие с водой, основными оксидами, основаниями, ОВ-свойства.
- Сравнение реакционной способности концентрированной и разбавленной серной кислоты.
- Разложение сульфатов. Качественные реакции на сульфат- и сульфит-ион.
- Азот и фосфор как простые вещества: сравнение свойств: агрегатное состояние, аллотропные модификации, взаимодействие с кислородом, водородом, металлами, серой, щелочами, кислотами.
- Сравнение свойств аммиака и фосфина: цвет, запах, токсичность, наличие водородных связей, растворимость, реакции с водой, кислотами, горение, восстановительные свойства.
- Нашатырь и нашатырный спирт. Качественные реакции на соли аммония. Разложение нитрита и нитрата аммония. Реакция раствора аммиака с растворимыми солями железа, меди, магния.
- Наиболее распространенные оксиды азота: NO и NO2, методы их получения, ОВ-свойства. Взаимодействие NO2 с водой и щелочами без доступа кислорода и в его присутствии.
- Сравнение концентрированной и разбавленной азотной кислоты.
- Фосфорный ангидрид: получение, взаимодействие с избытком и недостатком воды или щелочи, водоотнимающие свойства.
- Аллотропные модификации углерода. Взаимодействие с кислородом, водородом, серой, кремнием, восстановительная активность.Сравнение угарного и углекислого газа: строение, получение, ОВ-свойства, взаимодействие со щелочами. Химические свойства угольной кислоты.
- Кремний: методы получения, взаимодействие с водородом и галогенами, ОВ-свойства, реакция с щелочами, растворение в смеси азотной и плавиковой кислоты. Оксид кремния IV. Кремниевая кислота.
Классификация и номенклатура органических соединений
- Классификация углеводородов.
- Классификация кислород- и азотсодержащих органических соединений.
- Общие формулы и функциональные группы.
- Номенклатура органических соединений
Теория строения органических соединений.
- Гибридизация атомных орбиталей углерода.
- Гомология и изомерия. Основные типы изомерии.
- Типы связей в органических веществах.
Задания 12–16, 32
Органическая химия. Строение, получение, применение, химические и физические свойства:
- Алканов
- Алкенов
- Диенов
- Алкинов
- Циклоалканов
- Аренов
- Спиртов
- Карбонильных соединений
- Карбоновых кислот
- Аминов
- Анилина
- Аминокислот
- Белков
- Жиров
- Углеводов
Классификация химических реакций
- Классификация химических реакций в неорганической химии.
- Классификация химических реакций в органической химии.
Скорость химической реакции
- Зависимость скорости химической реакции от концентрации, температуры, давления, агрегатного состояния.
Окислительно-восстановительные реакции
- Определение окислителей и восстановителей. Типичные окислители и восстановители, и продукты их окисления и восстановления.
- Молекулы и ионы как окислители и восстановители.
- Расстановка коэффициентов с помощью электронного баланса.
- Расстановка коэффициентов с помощью ионно-электронного баланса.
Электролиз
- Электролиз в расплавах.
- Электролиз в растворах. Катодные и анодные процессы.
- Получение веществ электролизом.
Гидролиз
- Классификация солей по способности гидролизоваться.
- Среда растворов, рН.
Химическое равновесие
- Смещение химического равновесия при различных воздействиях.
Решение задач по равновесным концентрациям
Качественные реакции
- Качественные реакции в неорганической химии.
- Качественные реакции в органической химии.
Химическая промышленность
- Применение органических веществ в быту.
- Применение неорганических веществ в быту.
- Полимеры и их применение. Реакции полимеризации и конденсации.
- Классификация волокон и их получение.
- Производство серной и азотной кислоты, аммиака, метанола.
- Правила работы в лаборатории.
- Лабораторные приборы и посуда.
- Методы разделения смесей. Очистка веществ.
Задачи на растворы
Расчеты по термохимическим уравнениям
Расчеты по химическим уравнениям
Реакции ионного обмена
- Электролиты и неэлектролиты, сильные и слабые электролиты. Электролитическая диссоциация. Реакции ионного обмена.
Задачи повышенного уровня сложности (общая и неорганическая химия)
Установление молекулярной и структурной формулы вещества
Читайте также:

