Рандомизированные контролируемые исследования реферат
Обновлено: 02.07.2024
Что такое РКИ? Рандомизированныеконтролируемые клинические исследования (РКИ) проводятся с серединыпрошлого века. Их гуманистическая направленность стала ответом научногосообщества на проведение экспериментов на людях во время Второй мировойвойны в фашистских концлагерях. РКИ являются фундаментом доказательноймедицины, так как на их основе происходит принятие научно-обоснованныхрешений и проводится мета-анализ. Поэтому целесообразно более подробноостановиться на особенностях их планирования и проведения. РКИпредполагают использование тонких и чувствительных операционных истатистических методов во время проспективного исследования, в которомсопоставляемые группы получают различные виды анализируемыхвмешательств, лица контрольной группы — стандартное по современнымпредставлениям лечение.
Отличительной особенностьюсовременных РКИ является неукоснительное следование этическим нормам.Перед началом любого РКИ его протокол должен быть одобрен национальнымили региональным этическим комитетом (часто и тем, и другим). Вдальнейшем этический комитет в обязательном порядке информируется осерьезных побочных эффектах, возникших в ходе РКИ и всех изменениях впротоколе. До включения в исследование его потенциальный участник долженна добровольной основе подписать информированное согласие, где вдоступной форме должна быть изложена цель исследования, возможныеосложнения или неудобства, преимущества, связанные с участием больного висследовании, и альтернативные методы лечения. Пациент должен бытьпроинформирован о том, что решение о его участии или неучастии в данномклиническом исследовании на любом этапе выполнения никак не отразится надальнейшей тактике его ведения, и он в любой момент может прекратитьсвое участие в РКИ. Только после получения информированного согласияпациент может принимать участие в исследовании. Если РКИ предполагаетпроведение суб-исследований,требующих дополнительного обследования, то на них тоже необходимополучить информированное согласие пациента. В ряде случаев, например припроведении РКИ у детей, информированное согласие подписывают родителиили опекуны.
ЦЕЛИ И ЗАДАЧИ ИССЛЕДОВАНИЯ
Дляоценки новых методов лечения и диагностики могут применяться дваосновных вида исследования — контролируемые и неконтролируемые.Неконтролируемое клиническое испытание (без сравнения с ужеприменяющимся способом терапии или плацебо) новых методов лечениядопустимо только в исключительных случаях, когда новый метод позволяетспасти жизнь или радикально улучшить прогноз у пациентов, страдающихнеизлечимым заболеванием (в настоящее время большинство такихисследований связано с ВИЧ-инфекцией). Необходимо подчеркнуть, что даже вэтом случае предполагаемая польза нового метода должна бытьубедительной и сопоставимой, например, с эффектом инсулина при сахарномдиабете I типа.
Особняком стоят неконтролируемыеклинические испытания при изучении новых лекарственных препаратов наэтапе фазы I и II их клинического исследования, когда на здоровыхдобровольцах и ограниченном числе пациентов определяютсяфармакокинетические и фармакодинамические характеристики нового методалечения.
Актуальность проведения контролируемыхклинических исследований в настоящее время существенно возросла, так какони необходимы не только для доказательной медицины, но и привыполнении рутинной научной работы, в том числе и диссертационныхисследований клинической направленности.
ПланированиеРКИ начинается с формулирования цели и задач исследования, которыеотличаются новизной и практической значимостью. Цель исследования должнаотличаться как научной новизной, так и практической значимостью.Например, именно таким исследованием было SYST-EUR, результаты которого взначительной степени реабилитировали антагонисты кальция в леченииартериальной гипертензии, когда на них обрушилась волна критики порезультатам не совсем корректного мета-анализа.
Задачи, решаемые в РКИ, не должны бытьмногочисленными, поскольку это может привести к ложноположительнымрезультатам и затруднить интерпретацию полученных данных для практики.
КОНЕЧНЫЕ ТОЧКИ
Вмногих РКИ выделяют основные конечные точки, по которым оцениваетсяэффективность вмешательства, и второстепенные конечные точки,учитывающие другие аспекты этого вмешательства (например, побочныеэффекты, качество жизни, когнитивные нарушения, лабораторные показатели ит.д.). Хотя в ряде случаев последние сами могут становиться основнойконечной точкой (например, когнитивные изменения в исследовании SCOPE,холестерин — в исследованиях по атеросклерозу, уровень креатинина — висследованиях по почечной недостаточности, артериальной гипертензии исахарному диабету).
Впоследнее время в РКИ стали широко использоваться так называемыекомбинированные конечные точки, объединяющие сразу несколькопоказателей. Например, в исследовании PREAMI конечной точкой являлсяпоказатель смерть + госпитализация с сердечной недостаточностью +сердечное ремоделирование. Как видно, здесь использованы как жесткие,так и суррогатные конечные точки.
Существеннооблегчить задачу по выбору оптимальных конечных точек при планированииисследований может использование существующих баз данных о клиническихисходах (табл. 7.1).
Таблица 7.1. Источники информации рекомендуемых для оценки клинических показателях при проведении исследований

Ещеодной особенностью современных РКИ является проведение суб-исследований(суб-протоколов) в рамках основного РКИ, которые используютдополнительные методы обследования и позволяют ответить надополнительные вопросы, остававшиеся за рамками основного РКИ.
Длительность исследования (интервал времени от момента рандомизации больного и осуществления вмешательства до момента
оценкиконечного исхода заболевания) определяется целью и задачамиисследования, зависит от характера патологии, особенностей естественноготечения заболевания, риска развития исследуемых осложнений и времени,необходимого вмешательству для оказания потенциального влияния навыбранные конечные точки.
ВЫБОР БОЛЬНЫХ
Вторымпо значимости разделом РКИ (после формулирования цели и задачисследования) является определение критериев включения и исключения изисследования. Критерии включения предопределяются целью исследования,более широкие из них облегчают набор пациентов и позволяютэкстраполировать полученные результаты на большую популяцию больных.Однако в этом случае существует опасность формирования разнородныхисследуемых групп больных как по исходным клинико-демографическимпоказателям, так и по эффективности тестируемого вмешательства. Обычно вРКИ включают пациентов со средней тяжестью заболевания, хотя упациентов с исходно более высоким риском осложнений можно в болеекороткие сроки оценить эффект вмешательства на жесткие конечные точки.Группа пациентов с низким риском и легким течением заболевания требуетдлительного наблюдения и потенциально опасна в получении статистическидостоверного эффекта вмешательства, тогда как на самом деле оно можетоказаться эффективным.
Критерииисключения должны минимизировать возможность ошибок при проведенииисследования (например, исключение из исследования больных стерминальной стадией заболевания, сниженной функцией печени и почек).Если данный контингент пациентов не является предметом РКИ, в негообычно не включают несовершеннолетних, женщин в период беременности илактации или не использующих контрацепцию, онкологических и психическихбольных. Важной задачей критериев исключения является обеспечениеодинакового лечения и ведение пациентов в исследуемой и контрольнойгруппах, а также исключение применения в них во время исследованияпрепаратов, сходных с испытуемым.
В целом чем крупнееРКИ и чем быстрее его планируют закончить, шире должны быть критериивключения и тем меньше критериев исключения.
РАЗМЕР ИССЛЕДОВАНИЯ
Никакихнормативов, кроме получения необходимой статистической достоверностипри определении числа пациентов, участвующих в исследовании, несуществует. Небольшое количество пациентов не позволяет добитьсяоднородности сравниваемых групп и статистически достоверного эффектавмешательства. Размер РКИ зависит от ожидаемого клинически значимогоэффекта вмешательства.
Типичным исходным показателем,необходимым для расчета размера РКИ, является ожидаемый исходзаболевания при стандартном общепринятом лечении на момент планированияисследования. Кроме этого, весьма полезными оказываются данныезакончившихся РКИ по аналогичной тематике.
РазмерРКИ, в котором в качестве критериев эффективности вмешательстваиспользуются дискретные показатели исхода заболевания, всегда больше,чем размер такого же РКИ, но в котором критерием эффективностивмешательства являются продолженные показатели исхода заболевания(средние величины показателя или функционального исхода).
Достаточностьгрупп наблюдения зависит от степени предполагаемых различий в эффектевмешательства в опытной и контрольной группах, видом статистическогопоказателя эффекта вмешательства (частоты, средние величины).Естественно, чем больше ожидаемое различие в эффекте между ними, темменьше окажется необходимое число наблюдений.
Приодинаковой степени точности необходимое число наблюдений будетзначительно меньше, когда для оценки эффекта вмешательства используютсясредние величины, а не частотные показатели.
Припроведении исследования очень важно получить достоверную информацию обэффективности вмешательства в возможно более сжатые сроки. Для этогоиспользуют многоцентровые РКИ. В них происходит кооперирование (частомеждународное) и стандартизация исследовательских центров по единойпрограмме и методам наблюдения, что позволяет получить сопоставимыеданные разных учреждений.
РАНДОМИЗАЦИЯ
Рандомизация является ключевым моментом при проведении РКИ. Она должна обеспечить случайное распределение больных, независящее от желания врача или каких-либо других факторов, исопоставимость сравниваемых групп по клинико-демографическимхарактеристикам пациентов, тяжести основного исследуемого заболевания,сопутствующей патологии и проводимой терапии.
Принебольшом числе пациентов в группах даже правильно проведеннаярандомизация не может обеспечить их однородность. В этом случаеиспользуется предварительная стратификация (stratum — слой,пласт), при которой распределение вариантов вмешательства происходит вболее однородных группах больных, изначально сформированных по одномуили нескольким важным признакам. Различия пациентов по этим ключевымпризнакам должны быть минимальными. Такой подход практически гарантируетполучение надежных результатов и отсутствие систематической ошибки.Отсутствие систематической ошибки в РКИ называют обоснованностью(validity).
Наиболее частой причиной несопоставимостисравниваемых групп после рандомизации может быть включение в анализ невсех участвовавших в исследовании пациентов.
Существуетбольшое количество методов рандомизации: метод непрозрачныхзапечатанных и последовательно пронумерованных конвертов, компьютерныйметод (процедура рандомизации на основе метода генерации случайных чиселпроводится специалистом, непосредственно не участвующим в лечении),метод пронумерованных идентичных контейнеров, подготовленныхфармацевтической фирмой (код и истинное содержание контейнеров неизвестны ни пациентам, ни врачам, участвующим в исследовании),централизованная рандомизация по телефону (IVRS) специалистомфармацевтической фирмы. Наиболее объективным считается последний из них,а наименее объективным — метод конвертов.
В настоящее время существует несколько причин, по которым в научных исследованиях рандомизация не используется:
• незнание врачами-исследователями основ доказательной медицины;
• слепое следование традиционной практике и боязнь получить результаты, отличные от общепринятых и мнения авторитетов;
• боязнь применить у пациента менее эффективный метод вмешательства, ноименно ради выявления его реальной эффективности проводится РКИ;
• существующее негативное общественное мнение, отождествляющее РКИ с испытаниями на людях.
ДИЗАЙН ИССЛЕДОВАНИЙ
Сегоднядля решения конкретного клинического вопроса идентифицированыоптимальные типы (табл. 7.2) и дизайны (рис. 7.1) исследований. Каждыйиз видов исследований имеет свои достоинства и недостатки (табл. 7.4).
Таблица 7.2. Клинические вопросы и оптимальные типы исследований для их решения

Важнопонять, что структура исследования, в существенной мерепредопределяемая поставленным клиническим вопросом, прямо влияет настепень доказательности полученных данных (табл. 7.3).

Рис. 7.1. Наиболее часто используемые дизайны проведения клинических исследований
Таблица 7.3. Уровень доказательности исследований в зависимости от их структуры при оценке эффективности вмешательства


Таблица 7.4. Достоинства и недостатки исследований с различной структурой

АНАЛИЗ И ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
Главной задачей статистического анализа РКИ является установление разницы и степени ее достоверности по исходам (конечным
точкам)между группой с анализируемым вмешательством и контрольной группой. Внастоящее время существует много пакетов статических программ дляанализа полученных результатов (BMDP, SOLO, Statistica и другие). Дляполучения объективной информации об эффективности вмешательства в анализнеобходимо включать всех первоначально рандомизированных больных(intention-to-treat analysis), а не только тех, которым лечениепроведено в строгом соответствии с протоколом исследования (on protocolanalysis). Это один из основных способов минимизировать возможныеошибки, когда при intention-to-treat analysis исходят из допущения, чтовсе пациенты получили лечение, предписанное при рандомизации.
Выбываниепациентов из исследования по разным причинам (отказ от дальнейшегоучастия, побочные эффекты и плохая переносимость лечения, нарушенияпротокола пациентами или исследователями) не должно превышать 15% отисходного числа рандомизированных больных. Если процент выше, результатыисследования некорректны. Такой подход существенно снижает вероятностьполучения ложноположительного результата, когда на самом деле онотсутствует. Считается: если более 80% из включенных больных наблюдалисьдо конца исследования, его результаты могут быть достаточно надежными.
Длястатистического анализа большого массива дискретных конечных точеквычисляют c-квадрат. При малой выборке (число пациентов менее 30 вкаждой из групп вмешательства) используют методы непараметрическойстатистики (тесты Фишера или Йетса).
Результатыисследования представляются с использованием следующих показателей:число больных, которых необходимо пролечить для того, чтобыпредотвратить один нежелательный исход заболевания,абсолютного/относительного риска нежелательного исхода и их снижения суказанием статистической достоверности.
ПУБЛИКАЦИЯ РЕЗУЛЬТАТОВ
Частостатью с итогами РКИ предваряет опубликование его наиболее значимыхрезультатов и выводов в материалах крупных международных конференций исъездов. Структура статьи имеет обычный характер. Обязательнымтребованием является максимально широкое представление дизайна истатистических аспектов РКИ. Особый интерес может представлятьобсуждение результатов, так как они
могут дать дополнительную информацию о спорных моментах при его проведении.
Внастоящее время для проведения РКИ разработаны этические иметодологические стандарты. Необходимо помнить о том, чтоплацебо-контролируемые исследования оправданы, когда не существуетальтернативного способа лечения, эффективность которого не вызываетсомнений.
Сегодня врачам, исследователям иорганизаторам исследований необходимо непрерывно повышать не толькопрофессионализм, но и уровень знаний в области доказательной медицины,правоведения и GCP. При этом само проведение РКИ — не только наука, но иособый (и достаточно прибыльный) медицинский бизнес, что предъявляетеще более высокие этические требования ко всем его участникам.
1. Pocock S.J. Clinical trials. A practical approach. — John Wiley & Sons
3. Guyatt G.H. etal. Users’ guides to the medical literature. II. How to use an articleabout therapy or prevention. B. What were the results and will they helpme in caring for my patients // JAMA. — 1994. — Vol. 271. — P. 59-63.
4. Begg C. et al. Improving the quality of reporting of randomized controlled trials. The CONSORT statement // JAMA. — 1996. — Vol. 276 —
Рандомизированные контролируемые исследования являются золотым стандартом получения научных данных о новых медицинских вмешательствах.

Введение в доказательную медицину
Читая статьи, и получая консультации на нашем сайте, вы част.
Это означает, что выпуская новый лекарственный препарат, новый метод диагностики или лечения, компания-производитель должна проверить как эффективность, так и безопасность своего метода исследования или лечения, проведя рандомизированное контролируемое исследование (РКИ).
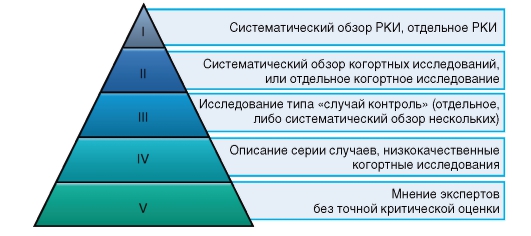
На схеме показана т.н. пирамида доказательности. Как видите РКИ занимает первое место в этой иерархической системе.
Что же означают эти три слова в данном методе клинического анализа: рандомизированное контролируемое исследование?
Контролируемое – означает, что в исследовании обязательно будет осуществляться контроль, путем сравнения с традиционным методом лечения, или с группой плацебо.
Исследование – напоминает, что препарат проходит испытание, в ходе которого он обязан показать как свою эффективность в лечении этой патологии, так и свою безопасность, в противном случае ему никогда не попасть в аптеки.
Почему в клинических исследованиях требуется рандомизация?
Случайный отбор кандидатов крайне важен, поскольку в противном случае, если мы предоставим пациенту или врачу выбирать, в какую группу поместить участника исследования, это может сильно исказить полученные результаты.
Благодаря рандомизации мы избавляемся от всякой предвзятости и делаем группы максимально однородными: по полу, возрасту, анамнезу, длительности заболевания, осложнениям, сопутствующим заболеваниям и т.д., чтобы сократить количество искажений результатов исследования от посторонних факторов до минимума.
Скажем, если врач очень хочет получить положительные результаты от изобретенного им препарата, он может сознательно или неосознанно помещать более тяжелых пациентов в группу плацебо (т.е. в группу контроля), а менее тяжелых пациентов – в группу, получающую экспериментальный препарат. Тогда он гарантированно получит в экспериментальной группе лучшие показатели лечения, но таким показателям совсем нельзя будет доверять.
А теперь представьте себе, что врач не просто хотел бы получить хорошие результаты, но и подкуплен фармацевтической компанией, напрямую заинтересованной в самых положительных результатах исследования их нового препарата. В таком случае ставки очень высоки, и финансовые потоки – тоже. Именно поэтому, проводя тщательную рандомизацию пациентов, мы исключаем не только любую предвзятость, но и любое случайное искажение.
К СВЕДЕНИЮ: Еще одним методом объективизации данных, полученных в РКИ является ослепление. Слепой метод, или ослепление - это метод проведения исследования, заключающийся в сокрытии информации от того или иного участника исследования, призванный исключить субъективное воздействие участников исследования на результат. Если РКИ сопровождалось ослеплением, то в таком случае говорят о [двойном] слепом рандомизированном клиническом исследовании. Подробнее об ослеплении (слепом методе исследования): СЛЕПОЕ ИССЛЕДОВАНИЕ
Это важно для того, чтобы четко понимать, какие преимущества (или риски) напрямую связаны с действием препарата, а какие являются следствием болезни, других препаратов, применяемых одновременно с исследуемым, или посторонних факторов.
Исследование случай-контроль
Исследование типа "случай-контроль" является одной.
Еще одним обязательным свойством исследования, увеличивающим степень контроля, является наличие достаточно большого количества участников исследования. Это необходимо, чтобы случайные различия и необычные случаи не оказывали большого влияния на полученные результаты.
Контрольная группа обычно получает плацебо: это препарат-пустышка, который выглядит, пахнет, имеет вкус идентичный настоящему препарату, однако не содержит действующего вещества.
ЭФФЕКТ ПЛАЦЕБО (PLACEBO EFFECT) — как правило (но не обязательно или не всегда), благоприятный эффект, приписываемый пациентами лекарственному средству или лечению, назначенному лечащим врачом. Ощущаемое благоприятное действие плацебо связано с ожиданием эффекта от лечения, например, из-за внушения. Подробнее об эффекте плацебо.
Сравнение со стандартным лечением
Помимо группы плацебо, сравнение нередко происходит с группой, получавшей стандартное и общепринятое при изучаемой патологии, лечение. Целью такого сравнения является определить, каковы преимущества и каковы риски экспериментальной терапии по сравнению со стандартной.
Тот факт, что новый препарат оказывает терапевтический эффект при данном заболевании – недостаточен для его одобрения и широкого использования. Он должен быть более эффективен и/или более безопасен, нежели стандартная общепринятая терапия, хотя бы в некоторых случаях, при определенных известных условиях.
Кроме всего этого, немаловажным является стоимость новой терапии, в сравнении со стоимостью стандартного лечения. Если препарат менее эффективен, но значительно более дешев – это может стать аргументом в его пользу.
Непрактичность и неэтичность плацебо в некоторых РКИ
Строгий научный дизайн исследования - не всегда является практичным. Бывает весьма сложно имитировать лечение в группе плацебо, чтобы пациент не мог определить, в какой он группе. Кроме того, существуют ситуации, когда терапия плацебо является неэтичной. Поэтому проведение РКИ может стать невозможным в следующих случаях:
Оценка качества медицинской информации
Не все медицинские исследования предоставляют одинаково наде.
- Многие агрессивные или инвазивные процедуры (с применением специального медицинского аппарата, или с применением хирургической операции) невозможно, или неэтично имитировать. Нельзя разрезать человеку ткани, только чтобы он не догадался, где находится, в лечебной, или в контрольной группах.
- Заболевание может быть слишком редким, и у ученых нет возможности набрать такое количество пациентов, которое обеспечит достоверность полученных научных данных.
- Подбор пациентов к конкретному исследованию может быть слишком трудным.
Если подобные препятствия не позволяют провести РКИ, то для такого исследования выбирается иной, более подходящий дизайн. Решение о допустимости проведения РКИ принимается специальным этическим комитетом. Клиническое испытание не может быть начато без одобрения этого комитета

Рандомизация – это процесс случайного распределения испытуемых в группу вмешательства и группу контроля. Именно она является основным моментом в проведении РКИ. Однако обратите внимание, что это не первый этап исследования. Первым этапом происходит формирование выборки пациентов: определяется круг лиц, максимально похожих друг на друга (насколько это возможно), и происходит это на основании критериев включения и исключения, описанных в протоколе исследования.
Это основной документ, в котором подробнейшим образом описываются обоснование исследования, его цели, задачи, дизайн, критерии включения и исключения, все процедуры исследования. Четко описываются все манипуляции с пациентом: когда, на какие сутки/или минуты, будет забираться кровь, выполняться электрокардиография (ЭКГ), биопсия или какие-либо иные действия. Протокол пишется разработчиками – экспертами, одобряется регуляторными органами, и именно по данному документу в дальнейшем работают все врачи-исследователи, принимающие участие в эксперименте. Благодаря этому врачи разных исследовательских центров выполняют одинаковые действия, строго следуя протоколу исследования. Отклонения от протокола исследования не допустимы, но если они случаются, то это документируется и сообщается и организаторам, и регуляторным органам. Если по ходу исследования было допущено множество отклонений от протокола, то его результаты могут быть поставлены под сомнение, и разработчикам может быть отказано в регистрации препарата.
Критерии включения и исключения
Это подробное описание тех симптомов, признаков, показателей, которые обязательно должны быть у пациента (критерии включения), и которых не должно быть ни в коем случае (критерии исключения). Например, в исследование включаются пациенты старше 40 лет, но не старше 71 года, поступившие не позднее 2 часов от появления клинических симптомов острого коронарного синдрома (ОКС), обязательно имеющие элевацию сегмента ST не менее 1 мм в не менее чем 2 смежных стандартных отведениях и/или не менее 2 мм в 2 смежных грудных отведениях. При этом у них не должно быть острой сердечной недостаточности Killip 3-4, не должно быть онкологических заболеваний, почечной, печеночной недостаточности. Это делается для того, чтобы группа пациентов, которые могут участвовать в исследовании была максимально однородной. Если пациент соответствует основным критериям включения и не имеет критериев исключения, то ему предлагают участвовать в данном клиническом исследовании. Врач-исследователь проводит с пациентом беседу, в ходе которой он объясняет суть исследования, риски и пользу от участия в исследовании, и предлагает для ознакомления документ, под названием ИС.
Информированное согласие (ИС)
Пациенты могут включаться в научное исследование только после того, как они получили полную информацию о нём и дали осознанное и добровольное согласие на участие.
Получение ИС – важнейший элемент надлежащего проведения любого исследования на человеке. Этот процесс строго регламентирован. Письменную форму ИС (сейчас в России Информационный листок пациента и Форма ИС) для КИ составляет фирма-спонсор или сам врач-исследователь (если он проводит свое, менее масштабное, например диссертационное исследование).
ИС обязательно должно содержать следующую информацию:
1. Кто проводит данное исследование?
2. Какова его цель?
3. Какой препарат (метод) исследуется, что он из себя представляет. Используется ли плацебо или какая-либо контрольная терапия?
4. Подробнейшее описание всех процедур исследования (сколько раз пациент посещает исследовательский центр, какие исследования выполняются и когда (максимально детально, вплоть до количества миллилитров крови, которое будет забрано).
5. Что потребуется от пациента (например, регулярное посещение центра)?
6. Каковы возможные риски и неудобства от участия в программе?
7. Какую пользу может получить пациент от своего участия в эксперименте?
8. Какая компенсация предусмотрена в случае нанесения вреда здоровью?
9. Предусмотрена ли оплата за участие в эксперименте (характерно для 1 фазы КИ)?
10. В обязательном порядке подчеркивается добровольность участия в исследовании (указывается, что в случае отказа – никакого влияния на стандартную помощь и терапию это не окажет) и возможность отказа от участия в нем в любой момент (и даже без объяснения причин).
11. Гарантируется конфиденциальность всей информации о пациенте (никто, кроме самого врача-исследователя не будет знать, что вся информация о данном участнике исследования – это данные, в том числе и персональные, принадлежащие именно данному человеку, все остальные участники процесса будут получать данные пациента только в обезличенном виде).
12. Оговаривается возможность проведения проверок (при соблюдении конфиденциальности) представителями официальных инстанций.
13. Указываются имена и телефоны контактных лиц (врача-исследователя, этического комитета).
14. Обязательно вносится предупреждение о том, что одномоментно пациент может участвовать только в одном клиническом исследовании.
ИС обязательно предоставляется на родном языке пациента (если необходим перевод, то он осуществляется сертифицировано) Форма согласия должна быть удобна для чтения (не мелкий шрифт, четкость и последовательность изложения информации). Документ утверждается официальными инстанциями страны, где проходит КИ и Комитетом по Этике.
Важно помнить, что ИС получается ДО выполнения любых действий с пациентом в рамках исследования, а не только до непосредственного назначения исследуемого препарата. Что это означает? Ни одно обследование, измерение, назначение в рамках протокола (а не стандартной практики) не может происходить без подписанного ИС, даже если это безболезненная и безопасная процедура, например обычный осмотр пациента или ультразвуковое исследование почек. Если данные процедуры выполняются только по причине участия в протоколе, то это уже эксперимент, и требуется согласие пациента. С другой стороны, если, например проводится исследование среди стационарных пациентов с пневмонией, то выполнение рентгенологического исследования легких является процедурой, обязательной для всех, не зависимо от участия в исследовании. В этом случае, подписывать дополнительное согласие на рентген нет необходимости, оно включено в стандартное согласие пациента на предложенный план лечения в стационаре. Если в протокол исследования вносятся какие-либо изменения, так или иначе связанные с пациентом (появляется новая информация о лекарственном средстве, изменяются процедуры исследования), то должна быть подготовлена, затем одобрена соответствующими инстанциями, а затем и подписана пациентом новая версия ИС, содержащая все внесенные изменения.
При получении ИС пациент не может быть как-либо ограничен во времени. Он может забирать форму для ознакомления домой. Может показывать форму согласия любому другом врачу, родственнику, адвокату, т. е. любому лицу, с которым захочет посоветоваться.
Форма ИС собственноручно подписывается и датируется пациентом в двух оригинальных экземплярах. Затем форму подписывает и датирует врач-исследователь, проводивший разъяснительные беседы с пациентом. Один оригинал согласия остается в исследовательском центре, а второй оригинал – забирает пациент. В истории болезни пациента обо всем этом делается соответствующая запись.
Если пациент не может сам подписать ИС (это несовершеннолетний ребенок, лицо, признанное в законном порядке недееспособным), то согласие за него может подписать его законный представитель или официально назначенный опекун.
Если пациент не может сам прочесть форму ИС (например, вследствие проблем со зрением), то в процессе чтения, и обсуждения принимает участие Свидетель (независимое лицо, не связанное с персоналом клиники). Он помогает пациенту, и в этом случае также подписывается в специальных строках формы согласия (после подписания формы пациентом).
В редких случаях возможно включение пациента в исследование без подписания ИС. Это относится к исследованиям, в реанимационной практике, когда велика вероятность поступления пациента без сознания, и без сопровождающих официальных лиц. Это подробно описывается в протоколе исследования. Такие испытания нуждаются в очень весомых обоснованиях и также проходят одобрение официальных инстанций и Этического комитета. После того, как пациент пришел в себя, с ним проводится беседа, описывается суть произошедшего, и пациент знакомится с информационным листком пациента и формой ИС. Если пациент их подписывает, то он продолжает участие в эксперименте, если пациент отказывается (а он имеет на это полное право), то его участие в научном исследовании завершено, он продолжает только стандартное лечение.
Рандомизация – наиболее оптимальный способ распределения испытуемых в группы, так как именно он позволяет минимизировать возможность систематической ошибки.
Почему так важен отбор пациентов? Достаточно очевидно, что при сравнении двух групп, существенно отличающихся друг от друга (например, по возрасту или тяжести заболевания), невозможно сравнивать их исходы (как при наличии медицинского вмешательства, так и нет). То есть, у кого тяжесть заболевания выше, всегда будут иметь больше негативных исходов, чем пациенты с более легкой формой болезни. Отбор пациентов по строгим критериям включения и исключения с последующим случайным распределением в основную группу и группу контроля и направлен на предотвращение данной ошибки.
Ошибка, обусловленная измерением, связана с различными способами оценки каких-либо параметров в двух исследуемых группах. Это могут быть погрешности измерения в различных лабораториях (и поэтому очень часто в КИ используют единую центральную лабораторию), различия в измерениях какого-либо интервала на ЭКГ, различия в опросе пациента, и акцентирование или нет при разговоре с ним на какие-либо факторы. Для нивелирования этих факторов в КИ и используют унифицированные процедуры работы с пациентами, строго прописанные в протоколе, очень часто – в различные центры для измерений поставляются одинаковые измерительные приборы, как уже отмечалось выше, используется центральная лаборатория.
Ошибка, связанная с действием вмешивающихся факторов. Очень часто два каких-либо фактора сильно взаимосвязаны между собой, и возможна ситуация, когда из-за этого неверно оценивается эффект каждого из факторов.
Если рассматривать КИ эффективности вмешательств, то условно все факторы, так или иначе влияющие на эту самую эффективность (т. е. на исходы) можно представить рис. 9.

Рис. 9. Факторы, определяющие эффективность вмешательства
Факторов, связанных с пациентом и с его врачом также немало. К сожалению, все люди имеют особенности, которые могут влиять не только на течение заболевания, на оказание помощи пациенту, но и на восприятие каждого фактора, в том числе и тех, оценка которых является целью исследования.
Эффект плацебо также существует, также, как и эффект самого вмешательства, т. е. так называемый эффект Хортона. Эффект Хортона в данном случае проявляется тем, что повышенное внимание к испытуемому, дополнительные обследования и вмешательства повышают положительное восприятие пациентом своего участия в эксперименте и того лечения, которое он получает, и тем самым искажает результаты исследования. Все это в итоге крайне затрудняет оценку эффективности именно изучаемого вмешательства. Только правильно организованные КИ с отбором схожих пациентов и случайным делением на группы, в каждой из которых и будут действовать все описанные факторы, позволяют делать вывод об эффекте изучаемого препарата/прибора/процедуры: если все другие факторы одинаково действовали в двух группах, то разница в исходах как раз и связана с проводимым лечением.
Типы рандомизации представлены на рис. 10.

Рис. 10. Типы рандомизации (Р. Флетчер Клиническая эпидемиология)
Фиксированная рандомизация – пациент попадает в группу вмешательства или контроля строго на основании заранее сгенерированных/запрограмированных таблиц, последовательностей чисел и т. п. Изменений в данных последовательностях по ходу исследования не происходит.
Простая рандомизация – для каждого участника пациента вероятность попадания в группу вмешательства или контроля 50/50 %. Типичный пример – подбрасывание монетки: орел или решка. При таком подходе группы могут различаться, а иногда и существенно и по числу испытуемых в группе, и по некоторым характеристикам (пол, возраст и т. п.)
Блоковая рандомизация – для достижения большей сбалансированности между группами, все участники делятся на блоки, в каждом из которых всегда равное число участников группы контроля или вмешательства, однако последовательность участников в каждом блоке случайна и неизвестна (рис. 11). Пациент рандомизируется в определенный блок, и занимает в нем порядковое место. При таком подходе группы получаются более сбалансированными, но если исследователю будет известен размер блока, то он может повлиять на распределение пациентов в группы.

Рис. 11. Метод блоковой рандомизации
Стратифицированная (послойная) рандомизация – при распределении в группы учитывается ряд факторов (например пол, возраст, ключевые особенности заболевания). Таким образом опять же достигается большая сбалансированность исследуемых групп.
При адаптивной рандомизации – распределение участников в группы динамически меняется так, чтобы к концу исследования наибольшее число испытуемых получило более эффективный способ терапии (это определяется после промежуточных анализов же, собранных по ходу данного исследования баз данных). Минусом такой рандомизации является необходимость частичного раскрытия данных для определенной группы аналитиков, и сложность контроля за этим.
Как на практике выглядит рандомизация? В многоцентровых клинических исследованиях она может быть локальной (на территории самой клинической базы), либо централизованной. В первом случае это как правило метод конвертов: исследователь центра получает ряд запечатанных, пронумерованных конвертов, в каждом из которых указан вид лечения/препарата. Согласно определенным процедурам протокола пациенту назначается один из конвертов, и препарат с номером, указанным внутри.
В настоящее время наиболее часто используется централизованная рандомизация. Врач-исследователь вводит определенные обезличенные данные пациента (пол, возраст, тяжесть заболевания и др.) через специальную телефонную линию или интернет в специальную единую компьютерную систему, в которой и происходит рандомизация, т. е. распределение пациента в одну из двух групп, и в ответ врач получает номер упаковки с ИП. Все упаковки имеют одинаковый внешний вид, а препарат в них в идеале должен иметь не только одинаковый внешний вид, но и одинаковый запах, вес, вкус, и для исследователя и пациента отличаются только номером. Упаковка с указанным номером выдается пациенту.
Рандомизированные исследования – это точный метод, позволяющий выявить причинно-следственную связь между терапией и исходом болезни, а кроме того, и эффективность лечения.
Общая информация
В современном мире существует множество лекарственных средств, применяемых для лечения различных болезней. Согласно рекламе производителей препаратов, они все эффективны и практически не имеют противопоказаний и побочных реакций. Однако уровни доказанной эффективности у них различны. Новые лекарства проходят многочисленные испытания, прежде чем появиться в аптечной сети. Следует отметить, что около 90% из них выбраковываются на стадиях клинических исследований.
Доказательная медицина
С давних времен для лечения недугов использовали различные лекарства. И только начиная с девятнадцатого века стали задумываться об эффективности лекарственной терапии и возможности использования в оценке качества лечения научно-обоснованных математических подходов. Доказательная медицина – такое понятие впервые было озвучено эпидемиологами канадского университета при разработке программы обучения практической медицине. Врач Д.Л. Сэкетт дал официальное определение этому термину.

Доказательная медицина – это точное, сознательное, основанное на здравом смысле использование результатов клинических исследований, подтверждающих безопасность и эффективность каких-либо методов лечения, лучших на конкретный момент. Клинические исследования могут опровергнуть терапевтические способы лечения, которые в прошлом успешно использовались и давали неплохие результаты. А также они формируют иные подходы к лечению пациентов.
Вот один из примеров. В ходе проведения тестирования лекарств противовирусного действия было обнаружено, что они снижают риск развития пневмонии как осложнения после перенесенного гриппа. Поэтому ВОЗ (Всемирная Организация Здравоохранения) подготовила рекомендации, в которые для лечения этого заболевания были включены и противовирусные лекарственные препараты. В современном мире медицинские работники при выборе терапии для лечения больных опираются на доказательную медицину и стараются применять новые лекарства. Медицина, основанная на доказательствах, предоставляет возможность составить прогноз течения болезни у конкретного индивида на основании аналогичных случаев, которые были изучены ранее.
Плацебо - что это такое?
Это такое вещество, которое по внешнему виду сходно с испытуемым препаратом, но не обладающее его свойствами и не приносящее при его приеме вред человеку. Эффективным принято считать то лекарственное средство, польза которого, по данным статистики, отличается от препарата-плацебо.

В этом случае также должно выполняться одно важное условие, а именно, доктор и пациент не имеют права знать, что конкретно принимает больной. Такая методика называется двойной слепой метод. В этом случае исключается субъективное мнение медицинских работников о проводимой терапии и косвенное влияние на индивида. Существует и тройной слепой метод. В этом случае человек, который отслеживает итоги исследования, не владеет информацией о том, как подобраны группы пациентов, в том числе и группы плацебо.
Научное исследование
Испытания проводятся с участием индивидов, для того чтобы оценить эффективность и безопасность нового препарата либо с целью расширения показаний уже имеющегося на рынке лекарства. Клинические исследования – это неотъемлемый этап при разработке новых препаратов, именно он предшествует его регистрации. В ходе экспериментального исследования изучается препарат с целью получения информации о его безопасности и эффективности. И уже на основании полученных данных уполномоченный орган системы здравоохранения принимает решение о регистрации лекарственного средства или отказе.
Лекарства, которые не прошли эти испытания, не могут получить регистрацию и выйти на фармацевтический рынок. Согласно информации ассоциации разработчиков Америки, а также производителей лекарственных препаратов для медицинского применения, примерно из десяти тысяч лекарств, которые разрабатывались, только 250 вышли на этап доклинических проверок. В следующую стадию, т. е. в клинические испытания, попадает только пять, из которых всего один в дальнейшем применяется практикующими докторами. Клинические исследования дают знания как медицинским работникам в части более точных назначений, так и пациентам в части информирования о возможных побочных реакциях и противопоказаниях.
Этапы клинических исследований
Существует несколько фаз экспериментальных исследований.
Первая по времени занимает около года. В этот период исследуются показатели: распределения, метаболизма, абсорбции, вывода, уровень дозирования, а также выбирается наиболее удобная лекарственная форма. Помощь в этом испытании оказывают здоровые добровольцы.

В случае проведения исследований лекарств, обладающих высокой токсичностью, привлекают людей, имеющих соответствующую патологию. Испытания в таких ситуациях проводят в специализированных учреждениях здравоохранения, в которых имеется необходимое оборудование и обученный медицинский персонал. Участие добровольцев, а их обычно требуется от 20 до 30 человек, в исследованиях материально поощряется.
Вторая – в этот период определяется схема приема и дозировка препарата для последующей фазы. Набирают группу добровольцев от 100 до 500 человек.
Третья – это рандомизированное исследование, в котором принимает участие большое количество людей (три и более тысяч). В этой фазе подтверждают или опровергают полученные на втором этапе данные по эффективности и безопасности препарата в определенной группе. Кроме того, изучается и сравнивается зависимость действия лекарственного средства от принятой дозы, а также прием лекарства при разных стадиях болезни или одновременное употребление с другими средствами.
Четвертая – на этом этапе проводятся клинические испытания, необходимые для получения дополнительной информации об эффекте действия лекарства, в том числе и с целью обнаружения редких, но весьма опасных побочных действий в течение длительного приема у большой группы добровольцев.
Необходимые требования
Для достоверности научных исследований при испытании препаратов требуется соблюдение некоторых правил, благодаря исполнению которых ложные результаты минимальны.
- Крупная выборка. Чем больше исследуемых больных, тем ниже погрешность.
- Статистическая обработка полученных данных. Ее проводят с учетом тех параметров, которые изучают и размера выборки. В этом случае погрешность не должна превышать семи процентов.
- Контрольные или группы плацебо. Это пациенты, получающие препарат-плацебо вместо исследуемого препарата или лечение по стандарту.
Виды клинических исследований
Известно несколько типов, каждый из которых обладает и преимуществами, и недостатками.
- Одномоментное, или поперечное. Группа пациентов обследуется однократно. Стоимость этого вида исследования небольшая. Используя его, можно оценить статистику заболеваемости и течение болезни в определенный момент в исследуемой группе. Динамику заболевания не выявить.
- Продольное, или когортное. Этот вид исследований считается самым доказательным и проводится часто. В течение длительного времени осуществляется наблюдение за группой добровольцев. Стоимость его проведения высокая, выполняется одновременно в нескольких странах.
- Ретроспективное. Дешевый вид испытаний, доказательная база низкая, поэтому ненадежный вид. Используется для выяснения факторов риска. Изучаются данные проведенных ранее исследований.
Рандомизация или случайное распределение
Это еще одно правило, которое требуется выполнять. Пациенты, принимающие участие в исследовании, объединяются в стихийные группы независимо от возраста и пола, т. е. происходит случайный отбор кандидатов, что позволяет исключить влияние этих факторов на итоги исследования.

Трудности
Сложность отбора добровольцев считается одной из серьезных и трудных проблем, с которыми сталкиваются специалисты-исследователи. В основном в группу с одним заболеванием можно включить около шести процентов пациентов.

Таким образом, полученные результаты распространяются только на пациентов, которые по характеристикам идентичны исследуемым в группах. Поэтому не представляется возможным рекомендовать их для применения в других условиях без получения нового итога испытания. Кроме того, следует учесть, что рандомизированные исследования – это вовсе не исключение ошибочных итогов при анализе.
Виды контролируемых испытаний
- Одноцентровыми, когда исследования осуществляются в одном учреждении здравоохранения. Трудности – сложно сделать выборку по всем исследуемым признакам за короткое время.
- Многоцентровыми. В процесс вовлекаются несколько медицинских организаций, и все работают по одному протоколу.
- Открытыми. Доброволец и доктор после рандомизации владеют информацией о виде лечения.
- Слепыми. Врач узнает о терапии после рандомизации, а испытуемый не будет об этом знать (этот вопрос оговаривается предварительно и получается добровольное согласие гражданина на его участие в процессе исследования).
- Двойными слепыми. В этом случае ни доброволец, ни доктор не знают, какой вид вмешательства будет у конкретного индивида.
- Тройными слепыми. Этот вид испытаний подразумевает, что врач, испытуемый и непосредственно сам исследователь, который обрабатывает полученные результаты, не владеют информацией о типе вмешательства.
Недостатки рандомизированных контролируемых испытаний
Ввиду больших материальных затрат и длительного периода:
- испытания проводятся в течение малого промежутка времени на небольшой группе добровольцев или большая часть исследований не проводится совсем;
- в связи с оплатой испытаний фармацевтическими компаниями, НИИ, университетами, указывается и их направление;
- используются критерии оценки косвенные вместо клинических.
Систематические ошибки возникают по следующим причинам:
- включение в группу только тех добровольцев, которые выдадут предсказуемый результат при приеме препарата;
- несовершенная рандомизация;
- осведомление исследователей о нахождении пациентов в конкретных группах, т. е. слепой метод не соблюдается.
Преимущества рандомизированных контролируемых исследований
- Оценивается эффективность лекарственного средства по сравнению с препаратом-плацебо в определенных группах, например, у мужчин в возрасте от 40 до 50 лет.
- Накопление информации после проведенного исследования.
- Целью может являться не возможность подтвердить собственную гипотезу, а попытка провести фальсификацию.
- Исключение ошибки, так как идет сравнение в других идентичных группах.
- Возможность комбинировать полученные результаты из нескольких исследований (мета-анализ).
Рандомизированные исследования – это контролируемые испытания с двойным или тройным методом слепого контроля, относящиеся к первому классу. Материалы и информация, полученная по их итогу, а также проведенный мета-анализ используется в практике медицинских работников как самый достоверный источник информации.
Заключение
Для внедрения в медицинскую практику доказательных исследований необходимо описывать четко группы добровольцев, на которых изучалось действие препарата для лечения конкретной патологии. Четко прописывать критерии отбора и причины исключения из испытания пациентов, а также проводить оценку результатов средствами, доступными в практической медицине.
Читайте также:

