Рак молочной железы комбинированное и комплексное лечение реферат
Обновлено: 04.07.2024
О том, что такое рак груди, происхождении и симптомах заболевания написано немало: и в глянцевых журналах, и в серьезных медицинских изданиях. И лечение рака груди освещено неплохо. Вот только любая информация имеет свойство устаревать по мере прогресса. Тем более по такой важной в мировом масштабе теме, как рак груди. Необходимо восполнить этот “пробел”.
О том, какие возможности имеет современная медицина, чтобы сделать лечение рака груди более эффективным и менее травмирующим (как с физиологической, так и с психологической точки зрения), и том, какие из описанных возможностей уже сегодня предлагает Онкологическая клиника МИБС для жителей России и других стран, - наш материал.
Возможно ли лечение рака груди без операции?
Судя по вопросам пациентов, обращающихся с запросами о возможности лечения рака молочной железы в Онкологической клинике МИБС, многих из них пугает необходимость проведения хирургического удаления опухоли. Вынуждены сообщить - несмотря на развитие лучевых методов лечения рака без операции (большинство из которых доступны в России в нашей онкологической клинике) ни протонная терапия, ни радиохирургия на КиберНоже, ни высокоточная лучевая терапия не способны полностью заменить хирургическое лечение.
Но есть прогресс и в данном направлении.
Во-первых, хирургическое лечение рака груди сегодня является лишь частью комбинированного подхода. Отвечая на потребности сообщества пациентов, мировая онкология определила наиболее эффективную форму онкологической помощи. Она включает междисциплинарный подход к лечению, при котором междисциплинарный консилиум (tumor board), состоящий из врачей различных специальностей (клинический онколог, хирург, химиотерапевт. лучевой терапевт и др.), совместно определяет тактику лечения, что исключает несовместимость назначений, а также позволяет не только эффективно бороться с опухолью и ее метастазами, но и обеспечить максимальное качество жизни пациента как во время лечения, так и после его завершения.

Ни протонная терапия, ни радиохирургия на КиберНоже, ни высокоточная лучевая терапия не способны полностью заменить хирургическое лечение рака груди
Во-вторых, благодаря собственной морфологической лаборатории МИБС, пациентам предлагается иммуногистохимия, исследование образца опухоли с целью поиска возможных уязвимостей перед действием таргетных препаратов, влияющих на эти специфические мутации клеток опухоли, или выявления отсутствия “защитного механизма” конкретного типа рака молочной железы перед специфическим иммунитетом, который может “включить” иммунотерапия.
Собственная морфологическая лаборатория (Центр морфологической диагностики МИБС) - это возможность не только пройти иммуногистохимическое исследование образцов опухоли, но и:
- получить точный ответ о злокачественности / доброкачественности опухоли молочной железы (и, таким образом, получить шанс избежать лечения при ошибке в первичной диагностике, проведенной в другом мед.учреждении);
- провести верификацию опухоли, точно определив ее тип, что позволит оптимизировать тактику лечения.
Хирургическое лечение рака груди - что нового?
Увы, но пока иммунотерапия и таргетное лечение подходят единицам из тысяч пациенток с диагнозом “рак груди”. Поэтому современные мировые протоколы оказания онкологической помощи (лечение рака груди по которым ведется и в Онкологической клинике МИБС) предусматривают проведение хирургического вмешательства с целью удаления первичной опухоли и части лимфоузлов, в которые, вероятно, распространились злокачественные клетки.
Однако хирургическое лечение рака груди в МИБС далеко от тех ассоциаций, которые всплывают в подсознании, когда мы слышим термин “хирургия”. Если рак груди выявлен на ранней стадии, современные методики органосохраняющей хирургии не только позволяют обойтись без полного удаления молочной железы (тотальная мастэктомия), но и дают возможность удалять небольшие опухоли без последующих косметических дефектов и без необходимости пластической реконструкции.
И даже при более крупных опухолях выполняемая операция будет направлена не только на удаление опухоли, но и на сохранение внешнего вида, как за счет одномоментной пластической коррекции, выполняемой во время операции, так и за счет последующей пластической реконструкции, основа которой закладывается во время основного вмешательства.
Комбинированное лечение рака груди: этап химиотерапии и “облучения” (лучевого лечения)
После проведения хирургического удаления рака молочной железы наступают не менее ответственные этапы. О высокоточной лучевой терапии, в которой специалисты и оборудование Онкологической клиники МИБС являются одними из лучших в России, Вы, наверняка слышали. И с годами наши позиции только усиливаются благодаря повышению квалификации лучевых терапевтов и медицинских физиков, а также за счет модернизации технического и программного обеспечения.
А вот обязательная в большинстве случаев химиотерапия - лечение рака груди путем системного воздействия на весь организм с целью разрушения циркулирующих в организме микрочастиц первичной опухоли (метастазы рака груди, либо метастатический рак молочной железы), - проводимая в Онкологической клинике МИБС, требует особого внимания.
Наше отделение химиотерапии делает все как для достижения максимального эффекта в борьбе с раком молочной железы (остановка роста либо деградация опухоли), так и для минимизации побочных эффектов химиотерапии.
Пациенты МИБС получают лечение рака груди, соответствующее современным стандартам:
- безопасное и точное приготовление (разведение) химиопрепаратов проводится согласно протоколу безопасности, что исключает ошибки в дозировке и назначениях;
- точная дозировка введения - каждому пациенту предоставляется инфузомат, специальное электронное устройство, через которое приготовленный химиопрепарат вводится с оптимальной скоростью;
- комфортность введения - через специальный “порт”, устанавливаемый во время несложного хирургического вмешательства в отделении хирургии Онкологической клиники МИБС, вводимый препарат химиотерапии попадает непосредственно в магистральные кровеносные сосуды, что защищает периферические вены от постоянного травмирования при длительных курсах лечения.
Лечение метастатического рака груди
К сожалению, сосредоточившись на лечении первичного рака молочной железы, пациентки и даже их лечащие врачи не уделяют должного внимания возможному началу распространения метастазов из молочной железы в другие органы. Метастатический рак груди будет требовать коррекции избранной тактики лечения или полной ее смены. Лечение одиночных метастазов в Онкологической клинике МИБС может быть проведено, как хирургически, так и радиохирургически (КиберНож, Гамма-нож, высокоточный линейный ускоритель TrueBeam STx); множественные метастазы рака груди потребуют модификации схемы химиотерапии и т.д. Но первым шагом к лечению метастазов является их раннее обнаружение - в случае позднего выявления именно метастазы рака груди часто становятся причиной летального исхода.
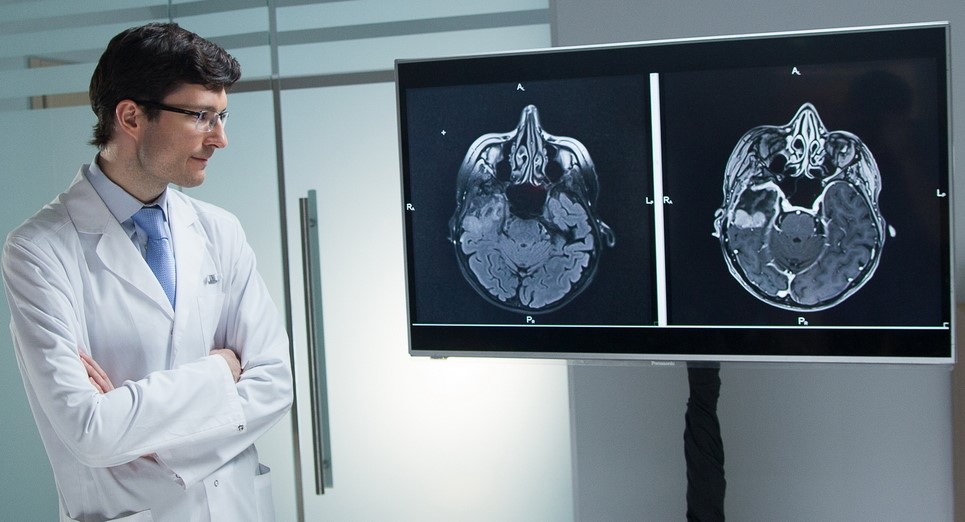
Метастазы рака груди в головной мозг – серьезное испытание как для пациентки, так и непростая задача для врача
Основные “мишени”, в которых регистрируются метастазы рака груди, - это кости, легкие, головной мозг, печень. Каждую из этих локализаций лечащий врач может просто, безопасно и, что немаловажно, относительно недорого контролировать с целью раннего выявления метастазов.
Метастазы в кости
- один из самых сложных в лечении и диагностике видов метастатического рака груди. Однако, учитывая частоту распространения злокачественных опухолей молочной железы в кости, буквально первые симптомы метастатических поражений скелета (в первую очередь, неприятные ощущения, “ломота”, в костях и неспровоцированные переломы) должны послужить сигналом к проведению доскональной диагностики.
В зависимости от клинического случая, для выявления метастазов рака груди в кости проводится МРТ всего тела, остеосцинтиграфия, КТ (зонально).
Метастазы рака груди в легкие
С поиском возможного распространения злокачественной опухоли молочной железы также отлично справляется позитронно-эмиссионная томография, что позволяет провести одновременное обследование костей и легкого. Отличную информативность предоставляет и компьютерная томография (КТ), но в таком случае, если планируется курс лучевой терапии первичной опухоли, врачу следует учитывать дополнительную лучевую нагрузку на организм - при КТ применяется иной вид ионизирующего излучения - рентгеновское.
Метастазы в печень
Несмотря на то, что метастазы рака груди в печень также отлично диагностируются на ПЭТ, проведение этого вида диагностики чаще всего оправдано при наличии симптомов. Однако и при их отсутствии у пациентки есть возможность контролировать вероятное метастазирование в печень - с помощью УЗИ. Ультразвуковое исследование на современных аппаратах экспертного класса поможет увидеть новообразования в печени, при этом стоимость такого “контроля” - невысока, а аппарат УЗИ есть едва ли не в любом из лечебных учреждений России.
Метастазы рака груди в головной мозг
Любые новообразования, в том числе, метастазы в головном мозге, выявляет МРТ с контрастом. При выполнении магнитно-резонансной томографии головного мозга с контрастом на современном томографе с напряженностью магнитного поля 1,5 Тесла и выше снимки достоверно покажут наличие и активность новообразований, что позволит не только определить опухоль, но и отличить вновь образовавшийся метастаз от того, что уже был пролечен с помощью радиохирургии и не проявляет биологической активности.
Метастазы рака груди и иммуногистохимия
Одной из особенностей метастатического рака является вероятность мутаций отдаленных метастазов относительно первичной опухоли. С точки зрения терапии — это свойство может привести к утрате метастазами специфических уязвимостей перед лечением таргетными препаратами и иммунотерапией. Поэтому пациентам, получающим таргетную терапию или иммунотерапию (если есть возможность выполнить биопсию метастаза) рекомендуем проведение иммуногистохимии для вероятной коррекции программы комплексной онкологической помощи.
Рак груди у мужчин
Современная статистика, все еще не демонстрирует положительной динамики в повышении выживаемости при раке груди у мужчин. Да, рак молочной железы угрожает и мужчинам, удивлены? Именно по причине недостаточной информированности общества мужчины, у которых проявляются даже явные симптомы рака молочной железы, не обращаются к профильному специалисту, а наблюдающие такого пациента врачи (обычно, терапевт или хирург по месту жительства) сами упускают возможность своевременной постановки диагноза “рак груди” ввиду крайней редкости данного вида рака у мужчин.
Лучшее лечение - раннее выявление
Лучший способ борьбы с раком любой локализации - это профилактика и раннее выявление. Несмотря на кажущуюся простоту подобного подхода, профилактические (скрининговые) обследования на предмет выявления опухолевых заболеваний у тех, кто не имеет никаких симптомов опухоли, по-прежнему демонстрируют высокие результаты.
Рак груди в данном аспекте - один из наиболее доступных для ранней диагностики. В составе современных “скрининговых” протоколов обязательно включена маммография - рентгенографическое исследование молочных желез. Недостатком такого метода является лучевая нагрузка на организм, из-за чего ежегодная маммография применяется в качестве базовой процедуры скрининга (в зависимости от страны) начиная с возраста 35-40 лет.
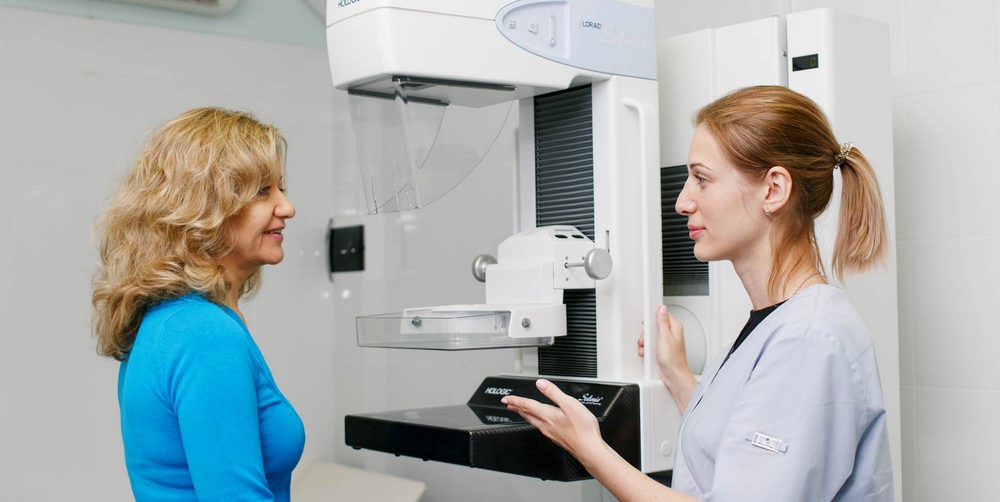
Маммография - традиционно эффективный метод скрининга рака груди
Тем, у кого повышенная вероятность встретится с таким диагнозом (например, при наличии в семейной истории рака), скрининг рака груди, до достижения “возраста маммографии”, может включать УЗИ молочных желез и МРТ молочных желез. Первый метод - прост и дешев, и его целесообразно применять чаще, однако МРТ молочных желез обладает более высокой информативностью. По этой причине МРТ молочных желез - востребованная услуга во всех Диагностических центрах МИБС в России и за ее пределами.
Психолог и лечение рака груди
Не обязательный с точки зрения протоколов, но важный с точки зрения настроя пациентки и готовности пройти все испытания, компонент онкологической помощи, получающий все большее распространение в практике мировой онкологии. Учитывая насколько психологически тяжело пациентки воспринимают саму возможность хирургического лечения, психологическая служба Онкологической клиники МИБС ведет работу в соответствии с передовыми методиками и собственными наработками для того, чтобы мобилизовать все силы пациентки на борьбу с болезнью.
Реабилитация
Современная онкологическая помощь направлена не только на борьбу с раком, но и на сохранение качества жизни после завершения. Поэтому обязательным в современном процессе оказания онкологической помощи является создание базы для облегчения процесса реабилитации еще на этапе разработки тактики лечения конкретного пациента. Поэтому в Онкологической клинике МИБС на повестке заседания междисциплинарного консилиума в обязательном порядке рассматриваются вопросы реабилитации (исходя из состава запланированного лечения), а также обсуждаются меры по максимальному облегчению состояния пациента, исходя из индивидуальных особенностей клинического случая, а пациентам, заканчивающим лечение, выдаются персональные рекомендации.
Регулярный контроль
Наиболее желаемый эффект лечения достигнут - рак молочной железы побежден. Но на этом лечение не заканчивает. Задача врачей и психолога - обосновать и организовать прохождения

Панов Николай Сергеевич
Заведующий онкологическим отделением с хирургическими койками, врач-онколог, уролог
Проведена экспериментальная работа, позволившая авторам (Бектурсынов С.М. – доктор медицинских наук, главный онколог Алматинской области и Байдувалиев А.М. – кандидат медицинских наук, начальник управления здравоохранением Алматинской области) разработать метод лечения рака молочной железы на основе абластичной лимфодисекции при органосохраняющем лечении РМЖ и получить положительные результаты. На стадии эксперимента было пролечено 77 больных, разделенных на две группы с локализованными формами рака молочной железы I, II A стадии, получивших комбинированное лечение. В первой группе осуществлялась широкая секторальная резекция молочной железы с лимфодессекцией аксилярной зоны. Во второй группе проводилась операция – радикально-секторальная резекция молочной железы со ступенчатым рассечением большой грудной мышцы и удалением малой грудной мышцы единым блоком с фасцией и лимфодессекция. Все пациенты получили послеоперационную лучевую терапию. Общая и без рецидивная пятилетняя выживаемость для первой группы составила 88,7 %, для второй группы 95,6 %.

1. Бектурсынов С.М., Садыков С.С. Результаты лечения рака молочной железы при применении нового хирургического метода с предоперационной лучевой терапией.// CONSILIUM, 2-3, 2007.
2. Бектурсынов С.М. Совершенствование абластичной лимфодисекции при органосохраняющем лечении РМЖ.// Вестник хирургии Казахстана, 2008.
3. Бектурсынов С.М. Сохранение молочной железы при комбинированном и комплексном лечении РМЖ с помощью модификации лимфодисекции.// Наука и мир, № 1. 2014.
5. Есенкулов А.Е., Есенкулова С.А., Кайбулаев Б.А. Новые подходы к терапии ранних локализованных, местно-распространенных и диссеминированных форм рака молочной железы. – Алматы, 2001.
6. Семиглазов В.Ф. Хирургическое лечение рака молочной железы (история и современность) // Практическая онкология. – 2002. – т. 3. – № 1.
Рак молочной железы занимает первое место в структуре заболеваемости женщин, а частота его неуклонно растет особенно в пожилом возрасте. Статистические данные последних лет свидетельствуют о неуклонном, интенсивном росте заболеваемости и смертности от рака молочной железы в различных странах.
Усилия онкологов, направленные на борьбу с раком молочной железы, еще не дают ожидаемого эффекта. В связи с тем, что более 50 % больных злокачественными новообразованиями обращаются в медицинские учреждения при распространенном процессе, а общепринятые методы лечения недостаточно эффективны, в структуре смертности населения Казахстана, как впрочем, и в других странах мира, онкологические заболевания продолжают занимать второе место после сердечно-сосудистых заболеваний. Это обусловливает актуальность разработки новых и совершенствование существующих методов диагностики и лечения рака молочной железы.
Чрезвычайная сложность канцерогенеза и трудности ранней диагностики рака молочной железы ставят задачу первостепенной важности – выбор оптимального варианта лечения рака молочной железы у каждой больной. Это трудная задача, так как при лечении рака молочной железы применяются все современные методы онкологии: хирургический, лучевой, цитостатический, гормональный, иммунологический и различные способы коррекции функции отдельных органов и систем.
При раке молочной существуют различные варианты хирургического, комбинированного и комплексного лечения. Однако результаты современных методов лечения остаются неудовлетворительными. Пятилетняя относительная выживаемость колеблется в пределах 55–61 % (Березкин Д.П., Литягин В.П., Есенкулов А.Е.). Больные наиболее часто погибают в первые два года от генерализации процесса. Большие перспективы возлагаются на проведение послеоперационной химиотерапии (Павлов А.С., Доценко В.С., Давыдов М.И. и др.). При применении комплексной терапии, операция остается важнейшим звеном при лечении РМЖ.
Поиски путей улучшения выживаемости больных при РМЖ с учетом вышеизложенного приобретают научную значимость в области онкологии и являются актуальными на современном этапе. В программе лечения злокачественных новообразований (в частности молочной железы), в последние 10–15 лет наметились новые подходы. Связаны они в основном с пересмотром хирургических принципов в сторону уменьшения объема оперативного вмешательства без нарушения принципов радикализма.
Целью проведенной работы является улучшение ближайших и отдаленных результатов лечения больных РМЖ путем ступенчатого рассечения грудной мышцы и удаления малой грудной мышцы с фасцией, единым блоком, лимфодессекция подключичных, подлопаточных, подмышечных, сторожевых и не сторожевых лимфоузлов при экономном хирургическом вмешательстве, и в процессе комбинированного лечения. Лимфодессекция проводились на основании данных анализа наиболее распространенных путей лимфагенного метастазирования рака молочной железы после хирургического лечения различными методами и проведение химиолучевой терапии. После хирургического лечения различными методами и проведения химиолучевой терапии осуществлен анализ пятилетней выживаемости больных РМЖ.
На протяжении пяти лет мы наблюдали и анализировали результаты комбинированного лечения больных с локализованными формами РМЖ II А стадии, лечившихся в Талдыкорганском Областном онкологическом диспансере. Больные в количестве 77 человек были распределены на 2 группы:
1 группа (27 человек) – получившие широкую секторальную резекцию с лимфодисекцией аксилярной зоны.
При широкой секторальной резекции удаляются только лимфатические узлы аксилярной зоны. Однако некоторые авторы говорят о необходимости удаления не только лимфатических узлов, но и клетчатки подключичной зоны. Мы нисколько не умоляем достоинства данной методики, но считаем, что удаление клетчатки подключичной зоны представляется не выполнимым при сохранении малой грудной мышцы, так как лимфатические узлы настолько малы, что через мышцу их определить не удается.
Преимущество нашей методики заключается в свободном доступе к подключичной вене, и абластичной лимфодессекции с медиальных концов ключицы не разрывая лимфатический аппарат, тем самым не открывая путь к выходу опухолевых клеток в операционном поле, и не нарушая принцип абластичности.
2 группа (50 человек). Эти больные получили радикально -секторальную резекцию РМЖ со ступенчатым рассечением большой грудной мышцы, удалением единым блоком с фасцией и лимфодисекцией подключичных, подлопаточных, подмышечных зон.
Послеоперационное облучение было проведено всем больным 1 и 2 группы. В зону лучевого воздействия включалась молочная железа с подлежащей грудной стенкой и 2–3 см легочной ткани, СОД 20 гр.
Пациенты были распределены не только по стадиям заболевания, но и по видам рака молочной железы. Процентное соотношение видов РМЖ отражено в рис. 1.
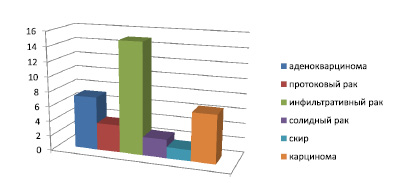
Рис. 1. Процентное соотношение видов РМЖ у экспериментальных больных
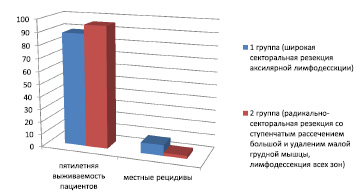
Рис. 2. Пятилетняя выживаемость больных после хирургического лечения рака молочной железы – I–II стадии
Из рис. 1 один видно, что у 7,2 % пациентов был поставлен диагноз аденокварцинома; у 3,7 % – протоковый рак; инфильтративный рак у 15 % пациентов; солидный рак – у 2,5 % пациентов; скир – у 1,5 % и кварцинома – у 6,5 % пациентов с раком молочной железы.
К первой группе, были отнесены больные, к которым был применен вид хирургического лечения под названием широкая секторальная резекция аксилярной лимфодессекции. Таких больных было 27 человек (1стадия РМЖ – 12 человек; 2 стадия РМЖ – 15 человек). Пятилетняя выживаемость у 24 женщин из 27.
Ко второй группе был применен метод под названием радикально-секторальная резекция со ступенчатым рассечением и удалением малой грудной мышцы, лимфодессекцией всех зон. Таких больных было 50 человек (1 стадия РМЖ – 20 человек; 2 стадия РМЖ – 30 человек). Пятилетняя выживаемость у 48 женщин.
Местные рецидивы у данной категории пациентов незначительные.
Результаты лечения РМЖ отражены в рис. 2.
Как видно из рис. 2 пятилетняя выживаемость в 1 группе I–II А стадии составляет 88,7 %. Местные рецидивы в послеоперационный период проявились у 8,4 % пациентов с РМЖ.
Во второй группе I-II А стадии пятилетняя выживаемость составляет 95,6 %. Местные рецидивы в послеоперационный период проявились у 2,4 % пациентов с РМЖ.
Общая пятилетняя выживаемость составила 90,2 %.
Таким образом, мы видим преимущество ступенчатого рассечения большой грудной мышцы, в стадии выживаемости пациентов и проявлении местных рецидивов в послеоперационный период.
Втрое преимущество заключается в том, что в данном виде хирургического лечения осуществляется свободный доступ к подключичной вене и абластичной лимфодессекции всех зон.
Мы считаем, что именно этот технический прием и обусловил улучшение результатов лечения у наших пациентов с различными стадиями рака молочной железы.
Апробация изложенных в статье положений проводилась на научно-практических и научно-методических республиканских и международных конференциях, посвященных вопросам онкологии. Статья является логическим продолжением опубликованных статей в международных научных журналах [3] и сборниках международных и республиканских научных конференций [1; 2].
Для цитирования: Загрекова Е.И., Мещеряков А.А. Лекарственное лечение рака молочной железы. РМЖ. 2002;14:605.
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Х имиотерапия и гормонотерапия играют существенную роль в комплексном лечении рака молочной железы практически при всех стадиях заболевания. Это объясняется особенностями данной опухоли – даже на ранних стадиях заболевания велик риск существования отдаленных микрометастазов, особенно при наличии факторов риска (поражении подмышечных лимфоузлов, отрицательных рецепторах эстрадиола и прогестерона, гиперэкспрессии Неr–2/neu и т.д.). Применение адъювантной химио– и гормонотерапии значительно улучшило результаты лечения операбельного рака молочной железы. При запущенном раке молочной железы химиотерапия и гормонотерапия являются основными методами лечения, позволяющими значительно продлить жизнь больного и улучшить ее качество. У 10–25% женщин с диссеминированным раком молочной железы возможно достижение полной регрессии опухоли с длительным безрецидивным периодом.
Адъювантная терапия
Адъювантная терапия рака молочной железы сегодня представляет собой систему стандартов, эффективность которых доказана в большом числе клинических исследований [1].
До настоящего времени остается четыре независимых прогностических фактора при резектабельном раке молочной железы: поражение регионарных лимфатических узлов, размер первичной опухоли, степень дифференцировки и содержание рецепторов к стероидным гормонам (к эстрогенам – РЭ и к прогестерону – РП).
Стандартами химиотерапии и эндокринной терапии являются: 4 цикла химиотерапии в режиме АЦ (адриамицин + циклофосфан) или АЦФ (адриамицин + циклофосфан + фторурацил) или 6 циклов химиотерапии по схеме ЦМФ (циклофосфан + метотрексат + фторурацил), а также тамоксифен 20 мг в день в течение 5 лет.
Первый фактор, положенный в основу назначения адъювантной терапии – поражение регионарных лимфатических узлов, разделяет всех больных на две группы.
Рак молочной железы без метастазов в регионарные лимфоузлы
Для назначения адъювантной терапии в этой группе необходимо определение групп повышенного риска. Граница для назначения адъювантной лекарственной терапии, что означает группу повышенного риска – снижение пятилетней выживаемости до 95% и менее (табл. 1).
Только в группе низкого риска пятилетняя выживаемость больных составляет более 95%. Во всех остальных группах проведение адъювантной лекарственной терапии улучшает результаты хирургического лечения.
Больным в пременопаузе с умеренным или высоким риском и положительным уровнем эстрогенных рецепторов показана химиотерапия с последующим назначением тамоксифена. При гормононезависимых опухолях показано назначение только химиотерапии.
Больным в постменопаузе с умеренным или высоким риском и положительным уровнем эстрогеновых рецепторов показан прием тамоксифена, а в группе высокого риска – комбинация химиотерапии с тамоксифеном. При отрицательном уровне рецепторов к эстрогенам показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена, а в группе высокого риска возможно дополнительное назначение химиотерапии. С уче– том возраста больных дополнительное назначение химиотерапии должно быть индивидуально обоснованным.
Рак молочной железы с метастазами в регионарные лимфоузлы
У всех больных раком молочной железы с метастазами в регионарные лимфатические узлы применение адъювантной лекарственной терапии улучшает результаты лечения.
При положительном уровне рецепторов к эстрогенам вне зависимости от менструальной функции показана комбинированная адъювантная терапия – химиотерапия и эндокринная терапия тамоксифеном.
При гормононезависимых опухолях показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена вне зависимости от уровня эстрогеновых рецепторов. Если уровень рецепторов к эстрогенам отрицательный, возможно дополнительное назначение химиотерапии. С учетом возраста больных дополнительное назначение химиотерапии должно быть индивидуальным.
При всей внешней простоте и схематичности назначения адъювантного лечения лишь методы, доказавшие свою эффективность в результате длительных клинических исследований, применяются для лечения больных. Оптимальная тактика адъювантной терапии постоянно совершенствуется. Совсем недавно химиотерапия рекомендовалась только больным в пременопаузе с метастазами в регионарные лимфатические узлы. В настоящее время только больным с низким риском и пожилым больным с положительными эстрогеновыми рецепторами не показано проведение химиотерапии.
При проведении адъювантной химиотерапии необходимо строго придерживаться оптимального режима (стандартных доз и интервалов между циклами). Неоправданные модификации режимов химиотерапии, несомненно, ухудшают результаты лечения.
Сегодня продолжаются исследования роли выключения функции яичников и рутинное применение данного метода адъювантного лечения нецелесообразно.
Появились данные об эффективности таксанов, как дополнительной химиотерапии к антрациклин–содержащим комбинациям у больных с неблагоприятным про– гнозом.
В связи с широкими исследованиями роли гиперэкспрессии рецептора Her2/neu наметились новые тенденции в оценке прогноза и лечения больных. Однако пока необходимо дополнительное число исследований для изменения практических рекомендаций.
Исследования по адъювантной терапии рака молочной железы интенсивно продолжаются, и можно надеяться, что в ближайшее время все больше и больше женщин будут излечиваться от рака молочной железы.
Неоадъювантная терапия
Неоадъювантная терапия – системное лечение, которое проводится до начала локального лечения (хирургического вмешательства или лучевой терапии).
Задачи неоадъювантной терапии:
- уменьшение размеров первичной опухоли и регионарных метастазов
- уменьшение объема оперативного вмешательства (радикальная резекция вместо радикальной мастэктомии)
- определение чувствительности опухоли к цитостатикам, выявление резистентных случаев с целью использования альтернативных режимов для адъювант– ной химиотерапии
- увеличение общей и безрецидивной выживаемости
- оценка новых режимов лечения по частоте полной клинической и морфологической ремиссии.
Стандартом неоадъювантной химиотерапии по результатам многоцентрового исследования NSABP B–18 признана схема АЦ, при применении которой объективный эффект составил 80%, полная морфологическая ремиссия отмечена у 15% больных.
Предполагалось, что раннее воздействие противоопухолевых лекарств на микрометастазы приведет к увеличению общей и безрецидивной выживаемости. Однако анализ 7 крупных рандомизированных исследований, в том числе NSABP B–18, включившего 1500 женщин с операбельным раком молочной железы, проведенный Wolff [2], не подтвердил эту гипотезу. Продолжительность жизни может быть увеличена только за счет рационального подхода к лечению – использования альтернативных режимов для адъювантной химиотерапии в случае низкой эффективности неоадъювантного лечения.
Продолжается поиск наиболее эффективного режима неоадъювантной химиотерапии. Особенно важным показателем является достижение полной морфологической регрессии опухоли, так как именно этот показатель статистически достоверно коррелирует с ростом общей выживаемости. С этой целью исследуются комбинации, включающие наиболее эффективные препараты, входящие в режимы неоадъювантной химиотерапии в последние годы – цисплатин, навельбин, таксаны. Некоторые авторы показали преимущество комбинаций антрациклинов и таксанов по сравнению со стандартным режимом АС. Разрабатываются новые режимы, включающие препараты, недавно вошедшие в практику химиотерапии, например, кселода и герцептин. Исследуются интенсивные режимы химиотерапии, однако пока не получено достоверных доказательств влияния интенсификации неоадъювантной химиотерапии на отдаленные результаты лечения.
Обсуждается количество курсов неоадъювантной химиотерапии. Признано, что эффект химиотерапии и частота полных регрессий опухоли зависят от количест– ва курсов лечения. Поэтому целесообразно проводить не менее 4 курсов, что безопасно для больных при условии регулярного контроля за динамикой заболевания.
У больных в менопаузе с положительными РЭ и/или РП применяется неоадъювантная гормонотерапия. Объективный эффект гормонотерапии достигает 50–70%. Для неоадъювантной гормонотерапии могут быть рекомендованы тамоксифен, анастразол, летрозол, экземестан.
Диссеминированный рак молочной железы
Для выбора метода лечения перед началом терапии необходимо оценить ряд прогностических факторов, определяющих возможный ответ заболевания на проводимое лечение. Длительный период, прошедший после лечения первичной опухоли до появления отдаленных метастазов, поражение только мягких тканей и костной системы или единичные отграниченные очаги в легких, медленный рост опухоли, удовлетворительное общее состояние больной, пожилой возраст и постменопауза, положительный уровень рецептов эстрадиола и/или прогестерона свидетельствуют о вероятно высокой чувствительности опухоли к гормонотерапии. В случае раннего появления отдаленных метастазов после лечения первичной опухоли, быстрого прогрессирования заболевания, молодого возраста больной, при множественных висцеральных метастазах, наличии лимфангоита кожи или легких лечение необходимо начинать с химиотерапии.
Эффективность гормонотерапии при положительном уровне РЭ и РП достигает 50–70%, снижается при положительных рецепторах одного вида (33%). При отрицательных РЭ и РП существует небольшой процент больных (5–10%), отвечающих на гормонотерапию. Традиционными препаратами, рекомендованными для первой линии гормонотерапии у больных в менопаузе, являются антиэстрогены – тамоксифен и торемифен. В настоящее время в I линии эндокринотерапии альтернативой тамоксифену являются антиароматазные препараты – анастрозол и летрозол. Во II линии эндокринотерапии больных раком молочной железы в менопаузе (при использовании тамоксифена в I линии) в настоящее время вместо прогестинов используются антиароматазные препараты (анастрозол, летрозол, экземестан). Применять прогестины во II линии гормонотерапии считается неэтичным.
У больных в пременопаузе гормонотерапию можно начинать с выключения функции яичников с помощью агониста гонадотропин–рилизинг гормона гипофиза – гозерелина (золадекса), а также хирургическим или лучевым методами.
Эффект гормонотерапии оценивается через 6–8 нед после начала лечения. Положительным ответом считается не только полная или частичная регрессия опухоли, но и длительная стабилизация заболевания (>=6 месяцев). Лечение продолжается до прогрессирования болезни. В случае быстрого прогрессирования болезни после гормонотерапии первой линии следует начать химиотерапию. При прогрессировании после длительного положительного эффекта на фоне первой линии гормонотерапии, а также кратковременной полной или частичной регрессии опухоли начинают гормонотерапию второй линии – ингибиторы (инактиваторы) ароматазы.
Третья линия гормонотерапии – прогестины – медроксипрогестерона ацетат (фарлутал, провера) и мегестрола ацетат (мегейс). Достаточно редко в наше время в III линии гормонотерапии используются андрогены и у женщин в постменопаузе – эстрогены.
Химиотерапия
Стандартами I линии химиотерапии рака молочной железы являются схемы: ЦМФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, метотрексат 40 мг/м 2 в/в дни 1,8, фторурацил 600 мг/м 2 в/в дни 1,8, интервал 4 нед), ЦАФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, доксорубицин 30 мг/м 2 в/в дни 1,8, фторурацил 500 мг/м 2 в/в дни 1, 8, интервал 4 недели), АЦФ (фторура– цил 500 мг/м 2 , доксорубицин 50 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), ЕЦФ (фторурацил 500 мг/м 2 , эпирубицин 100 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), АЦ (доксорубицин 60 мг/м 2 , циклофосфан 600 мг/м 2 каждые 3 нед).
Большинство исследователей отдают предпочтение антрациклиновым комбинациям, учитывая более высокий противоопухолевый эффект этих комбинаций по сравнению с ЦMФ. Комбинация ЦМФ чаще используется у пожилых больных, при противопоказаниях к применению антрациклинов.
Высокую эффективность показали комбинации антрациклинов и таксанов – АТ (доксорубицин 50–60 мг/м 2 , паклитаксел 175 мг/м 2 , интервал 3 нед), ЕД (эпирубицин 100 мг/м 2 , доцетаксел 75 мг/м 2 , интервал 3 нед).
Длительность химиотерапии обычно определяется ответом опухоли: после достижения максимального эффекта проводится дополнительно 2 курса ПХТ. Затем предпочтение может быть отдано наблюдению за больным до прогрессирования. При продолжении лечения до прогрессирования увеличивается время до прогресси– рования, однако общая выживаемость не меняется, при этом снижается качество жизни больных.
Ведется поиск эффективных комбинаций для первой линии лечения диссеминированного рака молочной железы, включающих новые препараты, в частности, капецитабин (кселода). Показано, что капецитабин имеет лечебную активность, сходную с ЦМФ.
У больных, имевших прогрессирование после химиотерапии антрациклинсодержащими комбинациями, стандартом дальнейшего лечения являются таксаны (паклитаксел 175 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед, доцетаксел 100 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед). В монотерапии у резистентных к антрациклинам больных объективный эффект составляет 41%. В последнее время все более популярным становится еженедельное введение таксанов, при этом увеличивается интенсивность лечения без увеличения токсичности. Эффективны комбинации таксанов с другими препаратами: навельбин 20 мг/м 2 в/в дни 1, 5-й + доцетаксел 75 мг/м 2 в/в со стандартной премедикацией день 1-й, интервал 3 нед; паклитаксел 175 мг/м 2 в/в со стандартной премедикацией день 1-й + фторурацил 1 г/м 2 /день в/в кап. 72–часовая инфузия дни 1, 2, 3-й, интервал 3 нед; кселода 1650 мг/м 2 дни 1–14 + паклитаксел 175 мг/м 2 (или доцетаксел 75 мг/м 2 )1 раз в 3 нед; гемцитабин 1 г/м 2 дни 1, 15-й + паклитаксел 135 мг/м 2 дни 1, 15-й, интервал 4 нед.
Для третьей и последующих линий лечения четких стандартов не разработано. Применяются комбинации препаратов, включающие навельбин, препараты платины (цисплатин, оксалиплатин), антиметаболиты (длительные инфузии фторурацила, гемцитабин, томудекс, кселода). Следует отметить высокую эффективность кселоды у больных во II (объективный ответ у 36% больных) и III (20%) линиях химиотерапии. Препарат может быть рекомендован, как альтернатива таксанам во II линии химиотерапии.
Некоторые режимы, эффективные во II–III линии лечения диссеминированного рака молочной железы: МММ – митомицин 8 мг/м 2 в/в день 1 + митоксантрон 8 мг/м 2 в/в день 1 + метотрексат 30 мг/м 2 в/в день 1; МЕП – митомицин 10 мг/м 2 в/в день 1 + цисплатин 40 мг/м 2 в/в дни 2, 7 + вепезид 100 мг/м 2 в/в дни 3 ,4, 5, интервал 4 нед; цисплатин 80 мг/м 2 в/в день 1 + кселода 2000 мг/м 2 внутрь ежедневно дни 1–14; навельбин 25 мг/м 2 в/в дни 1, 8 + митомицин 7 мг/м 2 в/в день 1, интервал 4 недели; навельбин 20 мг/м 2 в/в дни 1, 15 + цисплатин 80 мг/м 2 в/в день 1, интервал 4 нед; циклофосфан 600 мг/м 2 в/в день 1 + лейковорин 500 мг/м 2 в/в кап. в течение 2 часов + фторурацил 1,5 г/м 2 в/в постоянная 24–часовая инфузия, дни 1, 15, интервал 4 нед; навельбин 25 мг/м 2 в/в дни 1, 8 + томудекс 1 мг/м 2 в/в дни 1, 8, интервал 3 нед.
В 25–30% случаев в опухоли молочной железы отмечается гиперэкспрессия Неr–2/neu, коррелирующая с плохим прогнозом заболевания. У таких больных эф– фективен Герцептин – препарат принципиально нового механизма действия – рекомбинантные гуманизированные моноклональные антитела, связывающиеся с рецептором Неr–2/neu. Герцептин применяется еженедельно, первое введение – 4 мг/кг в/в, последующие – 2 мг/кг. Лечение продолжается до прогрессирования заболевания. Герцептин рекомендуется к применению у больных с гиперэкспрессией Неr–2/neu в комбинации с гормонотерапией и химиотерапией. Добавление герцептина к комбинации АС повысило частоту объективных эффектов с 42 до 60%. При резистентности к антрациклинам комбинация герцептина с таксолом была эффективна у 49% больных (при монотерапии таксолом эффект составил 17%). Изучаются комбинации герцептина с другими цитостатиками, например, с кселодой, навельбином [5].
1. Материалы шестой конференции по адъювантной терапии рака молочной железы, Сан–Галлен Швейцария, 1998 год.
2. A.C.Wolff, N.E. Davidson: Primary systemic therapy in operable breast cancer. J Clin Oncol 18:1558–1569, 2000.
3. C.А. Тюляндин: Химиотерапия диссеминированного рака молочной железы. Практическая онкология, 2, 2000.
4. G.N.Hortobagyi: Options for treatment of metastatic breast cancer. ASCO 35–th Annual Meeting, May 1999.
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
Хирургическая реабилитация больных раком молочной железы на различных этапах комбинированного и комплексного лечения
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России





ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
Злокачественные новообразования являются одной из основных причин смерти и инвалидизации населения не только развитых, но в последние годы и развивающихся стран. В структуре заболеваемости злокачественными новообразованиями женского населения России в 2016 г. рак молочной железы (РМЖ) составлял 21%. Абсолютное число впервые в жизни установленного диагноза РМЖ в 2016 г. составило 68 547, в то время как в 2006 г. – 50 292 [1]. Успехи клинической онкологии привели к излечению многих тысяч онкологических больных, однако при этом возникла сложная проблема адаптации и реабилитации пациенток, перенесших противоопухолевое лечение. Инвалидизация онкологических больных является следствием функциональных, анатомических, эстетических и психологических нарушений. Именно устранение или уменьшение последствий противоопухолевого лечения может радикально улучшить показатели реабилитации таких больных [2].
Реабилитация онкологических больных — целая система государственных, социально-экономических, медицинских, профессиональных, педагогических, психологических мероприятий, направленных на адаптацию к новым условиям функционирования и жизнедеятельности организма, возникших в результате заболевания и лечения злокачественной опухоли. В настоящее время существует возможность выполнения органосохраняющих оперативных вмешательств как на начальных стадиях РМЖ, так и после неоадъювантного лечения благодаря совершенствованию методов лекарственной и лучевой терапии [3—7], контролю краев резекции молочной железы [8, 9].
При наличии противопоказаний к радикальной резекции выполняют радикальную мастэктомию, приводящую к физическим и эмоциональным последствиям: утрате органа, потере женственности, сексуальности, привлекательности, что в свою очередь ведет к необратимым изменениям в социальной жизни [10—12].
Особенно актуален данный вопрос у пациенток молодого возраста, для которых психологическая травма после подобного вида операций становится непреодолимым барьером. К больным молодого возраста рекомендовано относиться особенно бережно, а при настоятельной просьбе пациентки даже в случае плохого прогноза ей нельзя отказывать в проведении реконструкции железы [13].
В связи с этим наряду с решением онкологических задач на первый план встают вопросы хирургической реабилитации, главная составляющая часть которой — реконструкция молочной железы [11, 12, 14—17].
Часто для улучшения внешнего вида молочных желез необходимы операции с противоположной стороны [18]. Вопрос об одномоментности коррекционных вмешательств с противоположной стороны необходимо решать в зависимости от вида онкологической операции и необходимости адъювантного лечения [19], однако эта проблема недостаточно освещена в отечественной литературе и требует решения.
На выбор метода реконструкции влияют различные параметры. Следует тщательно выбирать методику в зависимости от гистологического, иммуногистохимического статуса опухоли, соматического состояния и возраста пациенток.
Поэтому актуальным является разработка четких показаний к тому или иному виду реконструктивных операций после органосохраняющих и функционально-щадящих оперативных вмешательств по поводу РМЖ, этапности действий для различных стадий заболевания.
Цель исследования — разработка системного подхода к одномоментной и отсроченной хирургической реабилитации больных первично-операбельным РМЖ за счет расширения спектра возможных реконструктивно-пластических операций (РПО) и методик, способствующих достижению стойких эстетических результатов.
Материал и методы
С 2013 г. проанализирована медицинская документация 1250 больных РМЖ, госпитализированных для хирургического лечения в отделение онкологии и реконструктивно-пластической хирургии молочной железы и кожи Московского научно-исследовательского онкологического института им. П.А. Герцена — филиал НМИЦ радиологии Минздрава России.
Средний возраст больных составил 49,2±0,3 года (медиана (Ме)=48 лет, стандартное отклонение (σ) — 10,7 года).
Рак правой молочной железы был диагностирован в 613 (49,04%) случаях, рак левой молочной железы — в 637 (50,96%). Активный менструальный статус присутствовал у 595 (47,6%) больных, в состоянии менопаузы находились 655 (52,4%) пациенток.
Распределение по стадиям РМЖ было следующим: 0 — 64, I T1N0M0 — 512, IIA T0N1M0 — 1, T1N1M0 — 144, T2N0M0 — 207, IIB T2N1M0 — 115, T3N0M0 — 19, IIIA T0N2M0 — 1, T1N2M0 — 39, T2N2M0 — 52, T3N1M0 — 23, T3N2M0 — 4, IIIC T0N3M0 — 1, T1N3M0 — 10, T2N3M0 — 30, T3N3M0 — 6, T4N3M0 — 2, IIIB T4N0M0 — 5, T4N1M0 — 8, T4N2M0 — 6, IV T2N2M1 — 1. Наибольшее число составили пациентки с I и II стадией РМЖ — 40,96 и 38,88% соответственно, с 0 стадией — 5,12%, с III стадией — 14,96%, с IV стадией — 0,08%.
Наиболее часто, в 960 (76,8%) случаях, была диагностирована инвазивная карцинома неспецифического типа (WHO — Classification of tumors of the breast, 2012).
Распределение пациенток в зависимости от иммуногистохимического типа опухоли представлено в табл. 1.

Таблица 1. Распределение пациенток в зависимости от иммуногистохимического типа опухоли
В зависимости от варианта хирургического лечения пациентки были распределены на группы:
1-я группа — первичные одноэтапные и двухэтапные реконструкции молочной железы (первичные РПО) по поводу рака (п=510);
2-я группа — пациентки, которые обратились в МНИОИ им. П.А. Герцена для II этапа одномоментной реконструкции молочной железы из другого лечебного учреждения (п=9);
3-я группа — пациентки, которым выполнена отсроченная реконструкция молочной железы (п=78);
4-я группа — пациентки, которым произведены корригирующие операции на молочной железе в связи с неудовлетворительными косметическими результатами после первичных операций (п=33);
5-я группа — пациентки, которым осуществлено органосохраняющее лечение по поводу РМЖ (п=620).
Общее число проанализированных пациенток, которым были выполнены РПО, направленные на воссоздание или коррекцию формы молочной железы как органа, составило 630 (50,4%), органосохраняющие операции (ОСО) произведены 620 (49,6%).
Средний возраст в группе РПО составил 44,13±0,33 года (Ме=44, σ=8,48), в группе ОСО — 54,3±0,41 года (Ме=55, σ=10,2).
В группе первичных РПО (п=510) радикальные кожесохранные мастэктомии выполнены у 284 (55,68%) пациенток, радикальные подкожные мастэктомии — у 226 (44,3%). Сосково-ареолярный комплекс был удален у 261 (51,17%) пациентки данной группы.
Двухэтапные реконструкции молочной железы с использованием тканевых экспандеров выполнены у 236 пациенток. Силиконовые эндопротезы использованы при первичных РПО в 212 случаях, из которых в 88 применены эндопротезы с полиуретановым покрытием. Средний объем используемых экспандеров/эндопротезов составил 389,47±4,47 мл (Ме=360, σ=94,2).
Распределение пациенток в зависимости от вида операции в 1-й группе представлено в табл. 2.

Таблица 2. Распределение пациенток в зависимости от используемых материалов для первичной реконструкции молочной железы при радикальных подкожных/кожесохранных мастэктомиях (1-я группа)
С целью достижения лучших эстетических результатов контралатеральная аугментационная маммопластика в 1-й группе на I этапе первичной реконструкции была применена у 44 больных. Средний объем эндопротеза составил 236,8±15,1 мл (Ме=227,5, σ=100,7). Редукционная маммопластика и контралатеральная мастопексия выполнены у 12 и 10 пациенток соответственно.
II этап одномоментной реконструкции молочной железы в 1-й группе проанализирован у 159 больных. В 1 случае осуществлена замена тканевого экспандера на TRAM-лоскут, в 158 — на силиконовый эндопротез, из которых в 2 случаях с целью укрепления нижнего склона дополнительно применен торакодорсальный лоскут, 3 — сетчатый имплантат, в 68 случаях использованы силиконовые имплантаты с полиуретановым покрытием. Средний объем эндопротеза на II этапе 397,1±8 мл (Ме=390, σ=99,7), что также коррелирует с размерами экспандеров/эндопротезов, использованных на I этапе. С целью полноценной хирургической реабилитации контралатеральная аугментационная маммопластика на II этапе была применена у 13 больных, имплантаты с полиуретановым покрытием использованы у 3, контралатеральная редукционная маммопластика — у 15, периареолярная мастопексия — у 10. С целью коррекции операционных дефектов, улучшения полученных эстетических результатов у 33 больных данной группы был применен липофилинг. Аутожировой трансплантат получен путем водоструйной липосакции у 19 больных, обычным шприцевым методом — у 14. Всего выполнена 41 процедура липофилинга. Средний объем аутожирового трансплантата, вводимого первично, составил 118,3±12 мл (Ме=100, σ=71,5), вводимого повторно — 166,7±81 мл (Ме=180, σ=140).
Во 2-й группе (п=9) замена тканевого экспандера на эндопротез была осуществлена в 8 случаях, в 1 случае замена на расщепленный TRAM-лоскут проведена с целью реконструкции обеих молочных желез. Средний объем ранее установленного тканевого экспандера составил 362,2±12,5 мл (Ме=350, σ=37,7), замена осуществлена на средний объем силиконовых эндопротезов 377,8±27,2 мл (Ме=375, σ=81,5).
В 3-й группе (п=78) двухэтапная реконструкция с использованием тканевого экспандера была применена у 59 больных, из которых у 2 с укрытием торакодорсальным лоскутом. Последний с применением силиконового эндопротеза был применен в 4 случаях одноэтапной отсроченной реконструкции. Отсроченная реконструкция TRAM-лоскутом выполнена 11 больным, DIEAP-лоскутом — 4. Средний объем экспандера/эндопротеза составил 470±14,7 мл (Ме=450, σ=116,9).
Распределение больных 3-й группы в зависимости от вида операции представлено в табл. 3.

Таблица 3. Распределение пациенток в зависимости от варианта операции (3-я группа)
При отсроченной реконструкции редукционная маммопластика с контралатеральной стороны была выполнена 4 больным, периареолярная мастопексия — 1.
Распределение пациенток в зависимости от варианта II этапа отсроченной реконструкции (п=59) представлено в табл. 4.

Таблица 4. Распределение пациенток в зависимости от варианта операции на II этапе отсроченной реконструкции
Средний объем эндопротеза на II этапе отсроченной реконструкции составил 454,5±16,6 мл (Ме=440, σ=95,6). На II этапе аугментационная маммопластика контралатеральной стороны выполнена в 8 случаях, при этом средний объем эндопротеза составил 210±12,3 мл (Ме=210, σ=34,9). У 11 больных выполнена контралатеральная редукционная маммопластика, у 1 — периареолярная мастопексия.
В связи с недостаточной толщиной кожно-подкожного слоя в зоне планируемой реконструкции липофилинг был необходим 13 больным при отсроченной реконструкции, выполнено 15 процедур, из которых забор аутологичного жирового трансплантата был осуществлен методом водоструйной липосакции у 11 больных, обычным шприцевым методом у 2. Средний объем аутожирового трансплантата составил 220±16,6 мл (Ме=150, σ=144,3).
В 4-й группе (п=33) причиной обращения больных для корригирующей операции были в 13 случаях капсулярная контрактура, в 14 асимметрия в связи с несоответствием необходимого объема молочной железы ранее созданному при первичной реконструкции, в 4 угроза развития хирургических осложнений, у 2 ротация силиконового имплантата. Все пациентки были не удовлетворены ранее полученным косметическим результатом. В данной группе замена имеющегося силиконового эндопротеза на тканевый экспандер была осуществлена в 10 случаях, на силиконовый эндопротез другого объема и формы — в 21 случае (из которых в 1 случае дополнительными материалами для укрытия нижнего склона явились нижний деэпидермизированный фасциально-подкожный лоскут и сетчатый имплантат), TRAM-лоскут — в 2 случаях. Липофилинг потребовался 2 пациенткам. Контралатеральная аугментационная маммопластика в данной группе выполнена у 7 больных.
В 5-й группе (п=620) органосохраняющие операции в классическом варианте (радикальные резекции двумя радиальными разрезами в верхненаружном квадранте или на границе наружных квадрантов и резекции молочной железы аналогичным разрезом с определением сторожевого лимфатического узла) выполнены у 310 больных, онкопластические резекции — у 310.
Распределение больных в зависимости от вида ОПР представлено в табл. 5.

Таблица 5. Виды онкопластических резекций (5-я группа)
Для получения лучших эстетических результатов контралатеральная редукционная маммопластика при ОПР была выполнена в 98 случаях.
Результаты
В группе реконструктивно-пластических операций хирургические осложнения выявлены у 98 (19,2%) больных. Структура послеоперационных ранних и поздних осложнений представлена в табл. 6.

Таблица 6. Структура хирургических осложнений в группе реконструктивно-пластических операций
У некоторых пациенток имели место несколько видов осложнений, обусловленное ими повторное хирургическое лечение потребовалось 48 больным: вторичные швы — 7 (1,4%), замена силиконового имплантата — 14 (2,7%), удаление экспандера/имплантата — 33 (6,5%), липофилинг — 6 (1,2%), жировой некроз — 1 (0,2%).
В группе органосохраняющих операций лимфорея как основное раннее осложнение после операций на молочной железе и зонах регионарного лимфоттока присутствовала у 100% больных. Расхождение швов было отмечено у 8 (2,6%) больных преимущественно в зоне T-образного шва после онкопластических резекций. Некроз кожного лоскута имел место в 2 (0,6%) случаях при применении кожно-гландулярного ротационного лоскута.
С 2013 по 2018 г. за 5-летний период наблюдения в группе РПО (п=510) локорегионарные рецидивы выявлены у 10 (1,96%) больных (у 8 местный, у 2 регионарный). Прогрессирование основного заболевания диагностировано в 21 (4,1%) случае (метастатическое поражение костей — 6, легких — 6, мозга — 4, яичников — 1, лимфатических узлов — 4, летальный исход — 11 (2,1%).
В группе органосохраняющих операций (п=620) за 5-летний период наблюдения локорегионарные рецидивы выявлены у 7 (1,13%) больных (у 6 местные, у 1 регионарный). Прогрессирование основного заболевания диагностировано у 9 (1,45%) пациенток (метастатическое поражение костей — у 4, печени — у 2, легких — у 2, мозга — у 1, летальный исход — у 2).
Согласно опроснику МНИОИ им. П.А. Герцена, результат считали отличным при получении среднего балла от 5 до 4, хорошим — от 4 до 3, удовлетворительным — от 3 до 2, неудовлетворительным — от 2 до 0.
Косметические хирургические результаты представлены в табл. 7.

Таблица 7. Эстетические результаты реконструктивно-пластических операций у больных раком молочной железы
Оценка психологических критериев представлена в табл. 8.

Таблица 8. Анализ психологических критериев после реконструктивно-пластических операций у больных раком молочной железы
В группе органосохраняющих операций отмечены лучшие эстетические и психологические результаты, согласно опроснику МНИОИ им. П.А. Герцена (табл. 9, 10).
Таблица 9. Эстетические результаты реконструктивно-пластических операций у больных раком молочной железы Таблица 10. Анализ психологических критериев после реконструктивно-пластических операций у больных раком молочной железы
Заключение
Реконструктивно-пластические операции играют важную роль в хирургической реабилитации больных раком молочной железы, позволяют получить хорошие эстетические и психологические результаты. Органосохраняющие операции и их составляющая часть онкопластические резекции способствуют получению отличных эстетических и психологических результатов. Первичные реконструктивно-пластические и органосохраняющие операции, сопровождающиеся воссозданием естественной формы молочной железы, способствуют улучшению и ускорению реабилитации больных раком молочной железы за счет своевременного возвращения к активной социальной деятельности, предупреждения психологических стрессов, снижения частоты инвалидизации.
Участие авторов:
Концепция и дизайн исследования — М.В.Е., А.Д.З.
Сбор и обработка материала — А.Д.З., М.В.Е., И.М.Ш., А.Ю.Т., А.А.М., Г. М.З.
Читайте также:

