Пульпарные стволовые клетки реферат
Обновлено: 02.07.2024
В последние годы получено достаточное количество данных о возможности выделения стволовых клеток из пульпы зубов как детей (молочные зубы), так и взрослых. Основная популяция клеток, которые могут быть получены из пульпы зуба, - мезенхимальные стволовые клетки (МСК). В статье с учетом современных данных представлена разработка протокола выделения МСК из пульпы удаленных по ортодонтическим показаниям третьих моляров, сравнение дифференцировочного потенциала и фенотипа поверхностных антигенов с характеристиками МСК, полученных из других источников и охарактеризованных согласно существующим паспортам клеточных линий (данные Российской коллекции клеточных культур). Представленная методика выделения стволовых клеток из пульпы третьих моляров взрослых пациентов позволяет получить пул стволовых клеток, отвечающий основным характеристикам пула мезенхимальных стволовых клеток, выделенных из иных источников. Проанализирован ряд базовых характеристик, включающих морфологию клеток, их способность к мультилинейной дифференцировке и имеющая существенный интерес способность дифференцироваться в клетки-предшественники дентина – одонтобласты, а также экспрессия целого ряда типичных для МСК поверхностно-клеточных маркеров.

1. Cooper L.F. The current and future treatment of edentulism. Journal of Prosthodontics. 2009; 18 (2):116-22. DOI: 10.1111/j.1532-849X.2009.00441.x.
2. Monteiro N., Smith E.E., Angstadt S. et al. Dental Cell Sheet Biomimetic Tooth Bud Model, Biomaterials. 2016. DOI: 10.1016/j.biomaterials.2016.08.024.
3. Young C.S., Terada S., Vacanti J.P. et al. Tissue engineering of complex tooth structures on biodegradable polymer scaffolds. Journal of Dental Research. 2002; 81 (10):695-700. DOI: 10.1177/154405910208101008.
4. Ravindran S., George A. Biomimetic extracellular matrix mediated somatic stem cell differentiation: applications in dental pulp tissue regeneration. Front Physiol. 2015; 6:118. DOI: 10.3389/fphys.2015.00118.
5. Monteiro N., Yelick P. Alveolar complex regeneration. In: Tolstunov L., editor. Horizontal Alveolar Ridge Augmentation in Implant Dentistry: A Surgical Manual: Wiley-Blackwell; 2015. p. 360.
6. Yen A.H., Yelick P.C. Dental tissue regeneration - a mini-review. Gerontology. 2011; 57 (1):85-94. DOI: 10.1159/000314530.
7. Monteiro N., Yelick P. Advances and Perspectives in Tooth Tissue Engineering. Journal of Tissue Engineering and Regenerative Medicine. 2016: Ahead of print. DOI: 10.1002/term.2134.
9. Hirayama M., Oshima M., Tsuji T. Development and Prospects of Organ Replacement Regenerative Therapy. Cornea. 2013; 32:S13-S21. DOI: 10.1097/ICO.0b013e3182a18e6c.
10. Iglesias-Linares A., Yanez-Vico R.M., Sanchez-Borrego E. et al. Stem cells in current paediatric dentistry practice. Arch Oral Biol. 2013; 58: 227–238.
11. Huang G.T., Gronthos S., Shi S. Mesenchymal stem cells derived from dental tissues vs. those from other sources: their biology and role in regenerative medicine. J Dent Res. 2009; 88: 792-806.
12. Arakaki M., Ishikawa M., Nakamura T. et al. Role of Epithelial-Stem Cell Interactions during Dental Cell Differentiation. J Biol Chem. 2012; 287: 10590-10601.
13. Saito M.T., Silvério K.G., Casati M.Z. et al. Tooth-derived stem cells: update and perspectives. World J Stem Cells. 2015; 7: 399–407.
14. Yang M.B., Zhang H.M., Gangolli R. Advances of mesenchymal stem cells derived from bone marrow and dental tissue in craniofacial tissue engineering. Curr Stem Cell Res Ther. 2014; 9: 150–161.
18. Пинаев Г.П. и соавт. Клеточная биотехнология: учебное пособие. - СПб.: Изд-во Политехн. ун-та, 2011. - 225 с.
20. Alleman M., Low E., Truong K. et al. Dental pulp-derived stem cells (DPSC) differentiation in vitrо into odontoblast and neuronal progenitors during cell passaging is associated with alterations in cell survival and viability. Int J Med Biomed Res. 2013; 2 (2):133-141.
22. Gronthos S., Mankani M., Brahim J. et al. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci USA. 2000; 97:13625–1363.
24. Chai Y., Slavkin H.C. Prospects for tooth regeneration in the 21st century: a perspective. Microsc Res Tech. 2003; 60: 469–47.
25. Eap S., Bécavin T., Keller L. et al. Nanofibers implant functionalized by neural growth factor as a strategy to innervate a bioengineered tooth. Adv Healthcare Mater. 2014; 3: 386–391.
26. Otsu K., Kumakami-Sakano M., Fujiwara N. et al. Stem cell sources for tooth regeneration: current status and future prospects. Front Physiol. 2014; 5: 36–36.
27. Клеточные культуры. Информационный бюллетень. Вып. 30 / отв. ред. М.С. Богданова. - СПб.: Изд-во Политехн. ун-та, 2014. - 99 с.
Несомненно, подходы тканевой инженерии и клеточных методов лечения способствуют регенерации более предсказуемым образом и позволяют расширить терапевтические границы регенеративной терапии. В последние годы получено достаточное количество данных о возможности выделения стволовых клеток из пульпы зубов как детей (молочные зубы), так и взрослых 12. Эти данные имеют существенное значение, поскольку возможность получения стволовых клеток из зубов не несет никаких этических противоречий в отличие от эмбриональных стволовых клеток, является неинвазивной и гораздо более экономически выгодной процедурой, возможной к выполнению в течение всей жизни человека [13; 14]. Также, по данным последних проведенных исследований, выживать и сохранять свой регенеративный потенциал могут даже стволовые клетки, выделенные из зубов с пульпитом [15]. Основная популяция клеток, которые могут быть получены из пульпы зуба, - мезенхимальные стволовые клетки (МСК). В качестве возможных источников взрослых МСК для регенерации зубов сегодня рассматриваются несколько типов клеток - это МСК зуба [10], а также МСК из незубных интраоральных источников, прежде всего – слизистой оболочки щеки, десны, надкостницы, и МСК из других источников: костного мозга, жировой ткани, пупочного канатика [11; 12]. Эти клетки способны к самообновлению и мультилинейной дифференцировке, характеризуются высокой способностью к пролиферации и сегодня рассматриваются как перспективные возможные источники для применения в регенеративной стоматологии.
Цель исследования: разработка протокола выделения МСК из пульпы удаленных по ортодонтическим показаниям третьих моляров, сравнение дифференцировочного потенциала и фенотипа поверхностных антигенов с характеристиками МСК, полученных из других источников и охарактеризованных согласно существующим паспортам клеточных линий (данные Российской коллекции клеточных культур (РККК)).
Материалы и методы
В исследовании были использованы удаленные по ортодонтическим показаниям третьи моляры (n=20) пациентов обоего пола в возрасте 16-35 лет, без видимых кариозных поражений и признаков воспаления. Получено информированное согласие пациентов в письменной форме на удаление зубов и последующее выделение из них МСК для исследовательских целей.
Удаленный хирургическим путем зуб помещался в стерильный пластиковый контейнер, содержащий 5 мл стерильного физиологического раствора с 0,02% антибиотика (пенициллин-стрептомицин). Контейнер осторожно запечатывался и помещался в транспортный сосуд с заданной температурой +2+4 °С. Время от забора до поступления образца в лабораторию не превышало 2 часов.
В лаборатории поверхность зуба трижды очищалась и промывалась стерильным физиологическим раствором комнатной температуры. Выделение клеток из пульпы зуба проводилось ферментативным способом. Для этого зуб помещался в чашку Петри диаметром 60 мм, где проводилось предварительное промывание пульпарной камеры зуба 2 мл 0,5%-ного раствора коллагеназы II типа, после чего зуб находился в 2 мл 0,5%-ного раствора коллагеназы II типа в течение 1 часа при 37 °C. Затем выделенные клетки в 2 мл раствора коллагеназы II типа были собраны в пробирку объемом 15 мл, куда для остановки процесса ферментации было добавлено 3 мл рабочей питательной среды - DMEM/F12 в соотношении 1:1 (ПанЭко). Полученная клеточная суспензия центрифугировалась в течение 5 мин на 1000 об/мин при комнатной температуре. Супернатант тщательно отбирался, после чего клеточный осадок был ресуспендирован в 1 мл полной питательной среды, содержащей DMEM/F12 в соотношении 1:1, 10% FBS, 100 мкМ L-аскорбиновой кислоты,2 mM L-глутамина, 100 U/мл пенициллина, 100 мг/мл стрептомицина и 0,25 мг/мл амфотерицина B 16. Полученная суспензия клеток пульпы зуба помещалась на культуральные планшеты 25 см 2 , содержащие полную питательную среду, и в дальнейшем инкубировалась при 37 °C и 5% CO2.
Замена культуральной среды проводилась 1 раз в 2-3 дня до достижения конфлюентности 80%. Пересев культур проводился согласно стандартному протоколу пересева монослойных культур в соотношении 1:3 1 раз в 7-8 дней. Для дальнейшего анализа использованы клетки на 2-3 пассажах.
Анализ характеристик клеточной популяции
Непрерывные переменные представлены в виде средних значений стандартного отклонения для числа наблюдений (среднее ± стандартное отклонение). Все данные проверены на нормальность распределения и равенства стандартного отклонения перед анализом. Сравнение непрерывных переменных выполнялось с использованием теста Стьюдента. Критерием достоверности является 95%-ный доверительный интервал (ДИ). Статистический анализ проводился с использованием программы Statistica, ver 11.0.
Результаты
Протокол выделения клеток составлен на основе собственного опыта работы с культурой МСК и разработан для источника – зуб человека с учетом современных данных [16-19; 21; 22]. Все процедуры выделения (n=20) клеток из удаленных зубов выполнены успешно. При динамическом наблюдении за культурами клеток к концу 1-х суток культивирования отмечено формирование колоний клеток. Большая часть клеток приобретала характерную для МСК [18; 22] фибробластоподобную форму (рис. 1А). При последующих заменах питательной среды все клетки имели характерную фибробластоподобную форму (рис. 1Б).
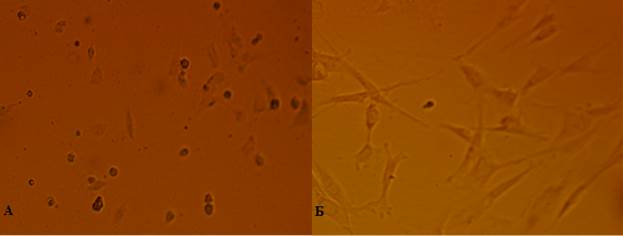
Рис. 1. А – клетки, выделенные из пульпы зуба через 24 часа культивирования. Б - клетки, выделенные из пульпы зуба, 10-е сутки культивирования
Анализ характеристик клеточной популяции
При определении принадлежности выделенных клеток к МСК проанализирована экспрессия характерных для МСК маркеров методом проточной цитофлуориметрии. Установлено, что выделенные из пульпы удаленных зубов культуры характеризуются высоким уровнем экспрессии характерных для МСК маркеров – CD90 и CD105, что составило 98,5 ± 3,8% и 96,8 ± 2,9% соответственно, и отсутствием экспрессии маркеров CD14, CD20, CD34 и CD45. Полученные результаты в сравнении с имеющимися паспортами клеток МСК из различных незубных источников (данные РККК, Российская коллекция клеточных культур позвоночных, Санкт-Петербург, ИНЦ РАН, 2016, составители Полянская Г.Г., Сакута Г.А., Еропкин М.Ю., Смирнова Т.Д., Подчерняева Р.Я., Михайлова Г.Р., Дьяконов Л.П., Гальнбек Т.В., Глинских Н.П., Бахарев А.А.) – костный мозг эмбриона, эмбриональные стволовые клетки, мышца конечности эмбриона, кожа век взрослого донора, позволяют достоверно отнести выделенные из пульпы зуба клетки к пулу МСК (таблица, рис. 2).

Рис. 2. Экспрессия маркеров CD90, CD105 МСК, выделенными из пульпы удаленных третьих моляров
Сравнительные характеристики МСК из различных источников (на основании данных паспортов клеточных линий РККК)
Стволовые клетки пульпы зуба - новое направление в клеточной заместительной терапии.
Ключевые слова
Статья
Медицина XXI века характеризуется созданием новой парадигмы в терапевтических подходах: на смену традиционным методам лечения приходит более эффективное использование внутренних возможностей самого организма. Появилось новое направление в медицине – клеточная заместительная терапия, основанная на способности стволовых клеток к восстановлению поврежденных в результате болезни или травмы тканей и органов человека. Клеточную терапию изучают сегодня по всему миру по различным направлениям, в том числе и лечения наследственных и приобретенных заболеваний, до последнего времени считавшихся неизлечимыми с помощью традиционных подходов. Стволовые клетки успешно применяют в лечении более 100 видов тяжелых болезней, среди которых инфаркт миокарда, хроническая сердечная недостаточность, инсульт, нейродегенеративные заболевания, ювенильный диабет, травмы головного и спинного мозга, а также в ряде онкологических и наследственных заболеваний.
Стволовые клетки – это недифференцированные (незрелые) клетки, имеющиеся во всех многоклеточных организмах, они способны самообновляться, образуя новые стволовые клетки, делиться посредством митоза и дифференцироваться в специализированные клетки, то есть превращаться в клетки различных органов и тканей. Развитие многоклеточных организмов начинается с одной стволовой клетки - зиготы. В результате многочисленных циклов деления и процесса дифференцировки образуются все виды клеток, характерные для данного биологического вида. В человеческом организме таких видов клеток более 220. Стволовые клетки сохраняются и функционируют и во взрослом организме, благодаря им может осуществляться обновление и восстановление тканей и органов. Тем не менее, в процессе старения организма их количество уменьшается [1].
Все стволовые клетки обладают двумя свойствами: самообновлением, то есть способностью сохранять неизменный фенотип после деления (без дифференцировки) и потентностью (дифференцирующим потенциалом), или способностью давать потомство в виде специализированных типов клеток.
Существуют два механизма, поддерживающих популяцию стволовых клеток в организме: асимметричное деление, при котором продуцируется одна и та же пара клеток (одна стволовая клетка и одна дифференцированная клетка) и стохастическое деление: одна стволовая клетка делится на две более специализированных.
Выделяют четыре основных типа стволовых клеток: эмбриональные, фетальные, соматические и мезенхимальные.
Эмбриональные стволовые клетки обнаруживаются на самой ранней стадии развития зародыша. Оплодотворенная яйцеклетка (зигота) начинает делиться через 30 часов с момента оплодотворения, и к третьему-четвертому дню эмбрион представляет собой компактный шар, состоящий из 12 или более клеток. Еще через пять-шесть дней эмбриональные клетки формируют полую клеточную сферу диаметром 150 микрон - бластоцисту. Клетки внутренней клеточной массы - бластоцисты (около 30 клеток) и есть эмбриональные стволовые клетки. Их отличительная особенность - способность к образованию из одной первоначальной клетки целой линии генетически идентичных клеток.
Фетальные стволовые клетки, в конце концов, развиваются в различные органы. Пока хорошо изучены три разновидности фетальных клеток: нейральные стволовые клетки (включая клетки нервного гребня), гематопоэтические стволовые клетки и клетки - предшественники b-клеток поджелудочной железы, вырабатывающих инсулин.
Нейральные стволовые клетки способны трансформироваться в клетки головного мозга. Клетки нервного гребня дифференцируются в клетки, иннервирующие сердце и стенку кишечника, пигментные клетки кожи (меланоциты), хрящ и кости лица, соединительную ткань и другие. Гематопоэтические стволовые клетки превращаются в разнообразные элементы крови. Большое число таких клеток содержат пуповина и плацента.
Соматические стволовые клетки способны превращаться не во все, а только в клетки определенных типов, образующие ткани взрослого организма. Возможность их использования для регенерации тканей была открыта несколько десятилетий тому назад. Источниками соматических стволовых клеток в организме взрослого человека являются костный мозг, периферическая кровь, жировая ткань, головной мозг, скелетная мускулатура, пульпа зуба, печень, кожа, слизистые оболочки желудочно-кишечного тракта, поджелудочная железа. Клетки данного вида поддерживают обновление тканей на протяжении всей жизни человека.
Соматические стволовые клетки, выделенные из костного мозга, могут превращаться в клетки головного мозга. А аналогичные клетки, полученные из ткани головного мозга, способны трансформироваться в клетки крови и мышечной ткани. В некоторых органах соматические стволовые клетки генерируют клетки нескольких типов. К примеру, стволовая клетка нервной ткани может дифференцироваться в нейроны головного мозга, глиальные клетки и астроциты. Подобная способность клеток к трансформации называется пластичностью.
Особый интерес представляют собой стволовые клетки взрослого организма, получение которых не связано с разрушением эмбриона человека, как в случае с эмбриональными стволовыми клетками. Наиболее распространенный тип мультипотентных стволовых клеток, способных к дифференцировке в остеогенном, хондрогенном и адипогенном направлении и который в настоящее время широко используется для разработки новых клеточных биомедицинских технологий, это мезенхимные стволовые клетки. Их возможно выделять из костного мозга, из жировой ткани, хрящей, пуповины и пуповинной крови, плаценты, пульпы зубов и других тканей человека [1,4,6,9].
Одним из перспективных источников стволовых клеток являются зачатки и пульпа третьих моляров человека. Главным преимуществом этого источника является доступность биологического материала. По своим морфологическим и фенотипическим свойствам эти клеточные популяции аналогичны мезенхимным стволовым клеткам человека, поскольку они обладают свойством клоногенности, способны пролиферировать как в условиях in vitro, так и in vivo, характеризуются мультипотентностью направлений дифференцировки. По результатам исследований по выделению, фенотипическому и генетическому анализу стволовых клеток, полученных из зачатков третьих моляров человека, показано, что полученные клетки обладают фенотипом, аналогичным мезенхимных стволовым клеткам, экспрессируют высокий уровень мРНК генов факторов транскрипции, характерных для плюрипотентных стволовых клеток, и способны к дифференцировке в адипогенном, хондрогенном, остеогенном и нейрональном направлении. Что немало важно, эксперименты по криоконсервации стволовых клеток из зачатков третьих моляров человека показали, что заморозка и хранение клеток не оказали существенного влияния на способность к пролиферации, дифференцировке и нейропротекции на модели in vitro [4].
Стволовые клетки возможно также получать из пульпы молочных зубов.
Изучением стволовых клеток пульпы молочных зубов впервые занялся детский стоматолог сотрудник Национального института стоматологических и черепно-лицевых исследований США доктор С. Ши (Songao Shi) в 2002 году. Пульпа зуба содержит 4 типа стволовых клеток – хондроциты, остеобласты, адипоциты и мезенхимальные стволовые клетки, которые можно успешно и быстро вырастить, значительно увеличив их количество и сохранив потенциал к преобразованию в другие типы клеток.
Адипоциты восстанавливают поврежденную сердечную мышцу, преобразуясь (дифференцируясь) в кардиомиоциты и миобласты, которые сегодня используются в кардиомиопластике при лечении заболеваний сердца и сердечно-сосудистой системы. Мезенхимальные стволовые клетки способны дифференцироваться в широкий спектр клеточных типов организма и давно используются в терапии.
Дальнейшие эксперименты с выпавшими у детей молочными зубами, показали, что стволовые клетки из пульпы, растут гораздо быстрее и они намного пластичнее в своем преобразовании в другие типы клеток, формирующие ткани и органы, при сравнении с таковыми, выделенными из периферической крови или костного мозга взрослого человека[3,4].
В 2012 году ученые из университета стоматологии Японии (Nippon Dental University) под руководством профессора Кена Яэгаки (Ken Yaegaki) в Journal of Breath Research опубликовали данные своего исследования, посвященного дифференцировке стволовых клеток пульпы зуба в клетки печени [12]. В качестве индуктора был изпользован сероводород. Выделенные из удаленных зубов стволовые клетки культивировали в специальной среде с добавлением индуктора и без него. В результате, через несколько дней, обработанные клетки дифференцировались в клетки печени и обладали способностью накапливать гликоген, проведенные тесты доказали, что полученные клетки действительно обладают всеми свойствами гепатоцитов. С помощью нового метода образовалось большое число клеток печени, с высокой степенью чистоты популяции. Это значит, что после нескольких дней культивирования, все обработанные клетки дифференцировались в гепатоциты, что является важным условием для пересадки.
В настоящее время в России услуги по организации выделения, размножения и персонального долгосрочного хранения стволовых клеток, полученных из молочных и постоянных зубов, предоставляют Банки стволовых клеток.
Из пульпы здорового зуба можно выделить всего несколько клеток, их количество от 12 до 20 клеток. Для того чтобы клетки можно было использовать в будущем, в Банке их культивируют и доводят количество до терапевтической дозы, которая составляет более 1 миллиона клеток. При этом клетки обязательно проходят контроль на бактериальную стерильность и жизнеспособность. Длительное хранение проводится в парах жидкого азота в сосудах Дьюара. Температура в них составляет ниже -150 С о . Перед замораживанием клетки обрабатываются криопротектором. Он делает мембраны клеток эластичнее и не позволяет образовываться остроконечным кристаллам, которые могут повредить при замерзании целостность клетки. В таких условиях клетки, выделенные из зубов, могут храниться очень долго. Первые исследования по криохранению были начаты более 20 лет назад. Регулярно ученые проверяют состояние клеток, замороженных в те времена, в течение всего это срока, клетки не меняют свои свойства к делению, преобразованию (дифференцировке), способности приживления и замещения поврежденных при травме или болезни участков организма, которые так помогают в регенерации, восстановлении и выздоровлении[7].
Сегодня стволовые клетки пульпы зубов можно применять в реконструкции тканей и органов (восстановлении костной и хрящевой тканей, формировании зачатка зуба и восстановлении его тканей, реконструкции печении и почек, мочевого пузыря, реконструкции роговицы, маммопластике). Стволовые клетки активно используются в черепно-лицевой хирургии при врожденных патологиях - расщелинах губы и неба, при восстановлении нарушений формирования и деформации костей челюстно-лицевой области, вызванных опухолью, инфекционными заболеваниями или травмой. В кардиопластике при лечении заболеваний сердечно-сосудистой системы: ишемии, инфаркте миокарда; при системных прогрессирующих заболеваниях: коллагенозах, артрозах, артритах; гломерулонефрите; при неврологических заболеваниях (боковом амиотрофическом склерозе, рассеянном склерозе), в ожоговой терапии. При некоторых видах онкологических заболеваний, вызывающих поражение соединительной, костной и хрящевой тканей,при диабете 1-го типа, при омоложении кожи8.
Таким образом, список заболеваний, которые лечат стволовыми клетками, увеличивается с каждым днем. Разрабатываются новые протоколы терапевтического применения стволовых клеток в лечении патологий и травм. Необходима планомерная научно-исследовательская работа по основным направлениям современных биомедицинских технологий с целью решения актуальных проблем клинической медицины, а также разработка адекватной правовой базы для повышения доступности применения стволовых клеток, источником, которых могут быть дентальные ткани в практическом здравоохранении, в частности в стоматологии.
Новосибирский государственный медицинский университет Минздравсоцразвития РФ
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии, Москва, Россия
Регенерация пульпы зуба с использованием аутологичных мезенхимальных стволовых клеток пульпы и обогащенной тромбоцитами плазмы
Журнал: Стоматология. 2017;96(6): 12-16
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздравсоцразвития, Москва





Регенерация пульпы и дентина может иметь важное значение в терапевтической стоматологии в качестве метода, направленного на сохранение зубов. В настоящее время выделены и охарактеризованы клеточные популяции, содержащиеся в пульпе молочных и взрослых зубов человека и лабораторных животных. В настоящей работе показано, что трансплантация аутологичных мультипотентных стромальных клеток пульпы зуба миниатюрных свиней в сочетании с аутологичной обогащенной тромбоцитами плазмой приводит к восстановлению пульпы зуба, репаративному дентиногенезу с образованием дентиновых мостиков уже к 30-м суткам наблюдения. Однако завершение регенерации приводит не только к восстановлению основных структур, но и к уменьшению объема пульпарной камеры вследствие напластования неодентина. Восстановление тканей пульпы зуба при нарушении целостности пульпарной камеры в отсутствие воспалительных процессов является перспективным направлением использования клеточных технологий.
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздравсоцразвития, Москва
Новосибирский государственный медицинский университет Минздравсоцразвития РФ
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии, Москва, Россия
Введение
Традиционно в качестве лечения пульпита у взрослых пациентов применяется экстирпация — полное удаление пульпы с последующей обработкой и пломбировкой пульпарной камеры и корневых каналов. Подобным образом поступают и при случайном вскрытии пульпы или сколе зуба, нарушающем целостность пульпарной камеры. При пульпотомии происходит удаление всех клеток пульпы, включая одонтобласты, участвующие в формировании дентина, что приводит к повышению хрупкости зуба, нарушению его интеграции с окружающими тканями и в результате — к его полной утрате [14]. Восстановление жизнеспособной ткани пульпы зуба при нарушении целостности пульпарной камеры в отсутствие воспалительных процессов является важной клинической задачей, позволяющей сохранить зуб и избежать затратной и не всегда эффективной установки имплантатов. Для регенерации соединительной ткани пульпы могут быть использованы стволовые клетки, извлеченные из пульпы выпавших или удаленных зубов самого пациента или доноров (аллогенные).
В настоящее время выделены и подробно охарактеризованы культуры стромальных мезенхимальных клеток (МСК) из пульпы молочных и коренных зубов — описан их иммунофенотип, исследованы пролиферативная активность и дифференцировочный потенциал [6, 13]. Показано, что, как и МСК из других источников, клетки пульпы способны к дифференцировкам в остеогенном, хондрогенном и адипогенном направлении. Но помимо этих потенций, МСК пульпы способны также к нейрональной дифференцировке, что определяется происхождением данных клеток из эктомезенхимы — производной нейрального гребня [6, 8]. Трансплантация данных клеток позволит обеспечить надлежащую иннервацию и создаст условия для формирования жизнеспособной рыхлой волокнистой соединительной ткани пульпы.
Показано, что клеточные культуры МСК, полученные из пульпы, могут быть криоконсервированы и храниться в течение длительного периода без снижения пролиферативного и дифференцировочного потенциала с целью отдаленного применения для регенерации [1, 4, 10]. Подход, основанный на использовании заранее банкированных клеток самого пациента или донорского материала, позволяет в кратчайшие сроки произвести трансплантацию, что существенно повышает эффективность лечения.
В ряде работ было показано, что подкожная трансплантация клеток пульпы, иммобилизованных на скаффолдах и помещенных во фрагмент депульпированного зуба, приводит к формированию внутри такой конструкции ткани, схожей по строению с соединительной тканью пульпы [3, 5, 12]. Кроме того, участие стволовых клеток в регенерации пульпы было показано непосредственно на модели пульпоэктомии у лабораторных животных [16, 17].
В настоящей работе проведено исследование регенерации ткани пульпы при трансплантации аутологичных мезенхимальных стромальных клеток пульпы коренных зубов в составе фибринового сгустка в пульпарную камеру после пульпоэктомии у миниатюрных домашних свиней. Восстановление тканей пульпы зуба при нарушении целостности пульпарной камеры в отсутствие воспалительных процессов является перспективным направлением использования клеточных технологий.
Материал и методы
Получение культуры клеток пульпы зуба миниатюрных свиней

Рис. 2. Культура МСК пульпы зуба миниатюрной свиньи, 3 пассаж, ув. 200. Фазовый контраст.

Рис. 3. Моляры и премоляры миниатюрной свиньи после трансплантации.

Рис. 4. а — шлиф резца миниатюрной свиньи через 14 сут после резекции пульпы. Коронка содержит пломбированный канал до пульпарной камеры. Пульпа отсутствует; б — шлиф резца миниатюрной свиньи через 30 дней после резекции пульпы. Коронка содержит пломбированный канал до пульпарной камеры. Пульпа отсутствует. Окраска толуидиновым синим и кислым фуксином. Микроскопия в отраженном свете. Ув. 5.

Рис. 5. а — шлиф моляра миниатюрной свиньи через 14 дней после трансплантации. В пульпарной камере обнаруживается клеточный трансплантат. В области устьев канала грануляционная ткань. Окраска толуидиновым синим и кислым фуксином. Ув. 5; б — шлиф премоляра миниатюрной свиньи через 30 дней после трансплантации. В пульпарной камере признаки регенерации пульпы с начальными признаками образования дентиновых мостиков. Окраска толуидиновым синим и кислым фуксином. Ув. 5; в — шлиф резца миниатюрной свиньи через 60 дней после трансплантации. В пульпарной камере признаки регенерации пульпы в области дна пульпарной камеры и со сформированным дентиновым мостиком. Окраска небесный трихром. Микроскопия в отраженном свете. Ув. 5; г — шлиф резца мини-атюрной свиньи через 60 дней после трансплантации. Отложение массива дентина в области дна пульпарной камеры. Окраска небесный трихром. Микроскопия в отраженном свете. Ув. 50.
Клетки имели характерный для мультипотентных стромальных клеток фенотип — вытянутую или полигональную форму, ядро с 2—3 ядрышками, небольшой размер (5—10 мкм) (см. рис. 1).
Получение обогащенной тромбоцитами плазмы
Для получения плазмы, обогащенной тромбоцитами (platelet-rich plasma, PRP), кровь миниатюрных свиней собирали в пробирки с ЭДТА, центрифугировали при 1100 об/мин в течение 10 мин. Тромбоциты, содержащиеся в супернатанте, осаждали центрифугированием при 3600 об/мин в течение 15 мин и ресуспензировали в половине объема супернатанта.
Получение тканеинженерной конструкции
Экспериментальная модель частичной резекции пульпы премоляров и моляров у миниатюрных свиней
Гистологическая проводка недекальцинированных шлифов
Образцы фиксировали в 70% этаноле в течение 15 дней. Затем обезвоживали и заливали в метилметакрилат (Osteo-Bead, Sigma-Oldrich) по стандартной методике, рекомендованной производителем с последующей полимеризацией. Из полученных блоков изготавливались первичные срезы 100 мкм (Isomet 100), из которых готовились шлифы толщиной 40—50 мкм, которые окрашивали кислым фуксином и толуидиновым синим, а также небесным трихромом.
Микроскопическое исследование и документирование
Результаты
Экспериментальная модель частичной резекции пульпы (группа сравнения)
Через 14 сут после частичной резекции пульпы выявлено, что коронковая часть зуба имеет дефект, заполненный пломбировочным материалом, который также наблюдался на всех последующих сроках. Стенки дефекта ровные, ход канала с жевательной или передней поверхности коронки перпендикулярно к пульпарной камере. Пульпарная камера содержит обрывки волокнистых структур. Волокнистые структуры не содержали клеточных элементов уже на 14-е сутки и в последующем на 30-е и 60-е сутки клеточная популяция не восстанавливалась. Коронка зуба сохраняет целостность своей структуры в течение 30 сут, в последующем к 60-м суткам после повреждения наблюдались трещины и сколы. Пародонтальная щель несколько расширена уже к 14-м суткам и имеет тенденцию к неуклонному расширению в последующие сроки. Собственно, пародонт с повышенной клеточностью: соединительная ткань с большим количеством фибробластоподобных клеток среди волокнистого матрикса. Корни зуба и шейка зуба с очаговыми признаками остеокластической резорбции, чаще в области межкорневой щели. В некоторых случаях было выявлено разобщение прикрепления слизистой оболочки к шейке зуба с формированием узкой, едва заметной щели.
Экспериментальное исследование трансплантации клеточной культуры пульпы зуба миниатюрных свиней (группа наблюдения)
Через 14 сут после частичной резекции пульпы и трансплантации тканеинженерной конструкции, содержащей аутологичные клетки пульпы зуба, выявлено, что коронковая часть зуба имеет дефект, заполненный аморфным белесоватым веществом (пломбировочный материал). Стенки дефекта ровные, ход канала с жевательной или передней поверхности коронки перпендикулярно к пульпарной камере. Пульпарная камера содержит базофильную клеточную структуру — клеточный трансплантат. Устья каналов корней со стороны пульпарной камеры по внутренней поверхности содержат участки с ячеистой структурой, часто богатой сосудами и высокой клеточностью. Указанные структуры напоминают по своему виду грануляционную ткань. Между сосудами нежный рыхлый волокнистый матрикс, который достигал 2/3 объема к 60-м суткам наблюдения. К этому времени на стенках пульпарной камеры заметны отложения дентина в области дна и боковых стенок. А также на поверхности под трансплантатом в виде дентинового мостика. Коронка зуба сохраняет целостность своей структуры на протяжении всех сроков наблюдения. Пародонтальная щель несколько расширена уже к 14-м суткам, однако без значимой прогрессии в течение остального времени наблюдения. Собственно, пародонт с повышенной клеточностью: соединительная ткань с большим количеством фибробластоподобных клеток среди волокнистого матрикса.
В настоящем исследовании было показано, что при трансплантации МСК пульпы в составе фибринового геля в область дефекта пульпы у миниатюрных домашних свиней уже через 14 сут наблюдается формирование рыхлой волокнистой соединительной ткани, в которой формируются дентиновые мостики, что свидетельствует о созревании функционально активных одонтобластов в области регенерации. Эффективность регенерации пульпы при использовании клеточных технологий зависит от возможности скорейшей трансплантации клеток в область дефекта после нарушения целостности пульпарной камеры. Для обеспечения немедленного введения клетки должны быть заранее получены у пациента или донора и криоконсервированы. В целом ряде исследований было показано, что хранение в жидком азоте не влияет на иммунофенотип, пролиферативную активность и дифференцировочный потенциал клеточных культур из пульпы [1, 4, 10]. При этом могут быть заморожены не только культуры стволовых клеток, а также фрагменты интактной пульпы и целые зубы [7, 9, 10]. В настоящее время уже создано несколько банков для хранения биоматериала из пульпы и периодонтальных тканей. Перед трансплантацией клетки иммобилизовали в фибриновом геле, полученном из плазмы крови, обогащенной тромбоцитами (PRP, platelet-rich plasma). Действие факторов роста, высвобождающихся при активации тромбоцитов, таких как PDGF, TGF-β, IGF-I, EGF, VEGF и др. направлено на стимуляцию ан-гиогенеза, хемотаксиса, митотической и метаболической активности клеток, участвующих в регенерации [2, 15].
Регенерация дентина при трансплантации стволовых клеток из выпавших молочных зубов была ранее уже показана в работе на миниатюрных свиньях [16]. Но в данном исследовании наряду с клеточной культурой использовали дополнительные индукторы — щелочную фосфатазу и бета-трикальцийфосфат, которые, несомненно, внесли свой вклад в регенеративный процесс, тогда как в настоящем исследовании регенерация наблюдалась и без дополнительных стимулирующих агентов.
Эффективность применения дентальных клеток пульпы в сочетании с PRP для регенерации ткани пульпы была исследована также на модели дефектов незрелых зубов у собак [17]. В данной группе было показано формирование дентиновых мостиков, что не наблюдалось при трансплантации кровяного сгустка, клеточной культуры или PRP. Однако, по заявлению авторов, образованная ткань имела остеоподобную структуру и располагалась непосредственно в верхушке каналов, а не в пульпарной камере, как в настоящем исследовании, и восстановления именно тканей пульпы показано не было.
Таким образом, трансплантация аутологичных клеток пульпы в сочетании с обогащенной тромбоцитами плазмой может стать перспективным направлением в изучении регенерации ткани пульпы при ее частичной резекции, как модели случайного вскрытия пульпарной камеры в клинической практике.

В статье рассматриваются возможности использования стволовых клеток, как в стоматологии, так и челюстно-лицевой хирургии. Выделены существующие методики по выращиванию и пересадки зубов.
Ключевые слова: стволовые клетки, стоматология, челюстно-лицевая хирургия.
Одной из перспективной отраслью современной медицины являются клеточные технологии, основой развития которых являются стволовые клетки. Эти незрелые (недифференцированные) клетки имеются во всех многоклеточных организмах и обладают способностью к самообновлению и дифференцировке в специализированные ткани.
Стволовые клетки способны трансформироваться почти в любой вид клеток, имеющийся в организме. Это дает возможность медицине возлагать большие надежды на их применение. Так, американский профессор Гронтос [3] и его коллеги в 2000 году обнаружили стволовые клетки в постоянных зубах. А в 2003 году детский стоматолог из США Сонгтао Ши обнаружил стволовые клетки в выпавшем молочном зубе своей дочери.
После проведения ряда лабораторных анализов, Сонгтао Ши обнаружил содержание в мягких тканях любого выпавшего молочного зуба около двух десятков стволовых клеток. Более того, оказалось, что стволовые клетки растут и развиваются в лабораторных условиях быстрее по сравнению с обнаруженными в пульпе постоянных зубов взрослого человека.
Пульпа зуба содержит четыре типа стволовых клеток — остеобласты, хондроциты, адипоциты и мезенхимальные стволовые клетки. Данные типы стволовых клеток возможно не только быстро вырастить, но и сохранить потенциал к преобразованию их в другие типы клеток [1]. Идеей по выращиванию зубов на месте утраченных уже на протяжении многих лет занимаются ведущие ученые, поскольку она затрагивает интересы преобладающего числа взрослого населения Земли. Использование стволовых клеток также возможно для запуска процесса самореставрации и самовосстановления частично разрушенного зуба, либо его элементов. Метод используется при пародонтозе и других заболеваниях десен.
На сегодняшний момент существует большое количество методик по выращиванию и пересадки зубов. Остановимся на некоторых из них, представленных в работе [5].
2) Подготовленные стволовые клетки определенным образом вводятся прямо в десну на место отсутствующего зуба, где впоследствии происходит развитие нового зуба. Благодаря технологии программирования клетки новый зуб, занимающий вакантное место, выращивается в соответствии с внешними и функциональными параметрами. Процесс выращивания нового зуба занимает около 2 месяцев.
3) Применение клеток мышиного эмбриона, из которых развиваются зубы (эпителиальные и мезенхимальные). Данные клетки выдерживают в питательной среде, стимулирующей их деление, далее вводят в коллагеновую матрицу. В течении несколько дней из клеток формируются полноценные зародыши зубов. С целью продолжения эксперимента у взрослых мышей вырывают зубы, а в оставшиеся на их месте лунки пересаживают выращенные зародыши, которые быстро развиваются в зубы с нормальной составом и структурой. Кроме того, в растущие зубы успешно прорастают капилляры и нервы, то есть, зубы получаются действительно полноценные.
В исследовании [4] представлены возможности коррекции патогенетических нарушений пародонтоза с помощью аллогенных клеток костного мозга от здоровых доноров на экспериментальной генетической модели мышей линии BRSUNT. Оказалось, что терапевтический эффект клеток костного мозга у мышей с пародонтозом более выражен при применении культивированных клеток, а также в зависимости от кратности введения клеток костного мозга гемопоэтических и стромальных фракций.
Таким образом, благодаря высокой регенерационной активности стволовых клеток, их использование в современной медицине, позволяет решать различные сложные клинические задачи не только в стоматологии, но и в челюстно-лицевой хирургии [2].
Основные термины (генерируются автоматически): клетка, зуб, костный мозг, стволовой, тип стволовых клеток, челюстно-лицевая хирургия, BRSUNT, выпавший молочный зуб, пересадок зубов, современная медицина.
Читайте также:

