Профилактика осложнений при ортопедическом лечении реферат
Обновлено: 04.07.2024
В настоящем обзоре представлены современные взгляды на формирование хронической ортопедической инфекции, связанной с биопленкообразованием бактерий. Кратко рассмотрены этапы формирования биопленок, фенотипы бактериальных клеток, существующих в них, а также их роль в патогенезе имплантат-ассоциированной инфекции. Состояние биопленки позволяет патогенам быть устойчивыми к лечению антибиотиками и к воздействию факторов иммунной системы из-за структурной и метаболической гетерогенности, которая обусловлена одновременным сосуществованием микробных клеток в различных состояниях, сочетающимся с активным синтезом межклеточного матрикса. В настоящее время существует несколько направлений в профилактике микробной адгезии и созревания пленок на ортопедических имплантатах. В травматологии и ортопедии в профилактических и терапевтических целях помимо системных и локальных антибактериальных препаратов можно использовать материалы для создания имплантатов с определенными физическими и химическими свойствами поверхностей. Приведены основные мишени воздействия противобиопленочных агентов. Показаны результаты клинического применения серебра и йода для профилактики и лечения инфекционных осложнений при ортопедических операциях. Сделан вывод, что, несмотря на все оптимистичные результаты, большинство применяемых методик находятся на этапе изучения и их трудно масштабировать до отраслевых стандартов, что требует дальнейших исследований.
Ключевые слова: биопленки, биопленкообразование, перипротезная инфекция, имплантат-ассоциированная инфекция, имплантаты.
Для цитирования: Гордина Е.М., Божкова С.А. Бактериальные биопленки в ортопедии: проблема и возможные перспективы профилактики. РМЖ. 2021;8:29-32.
Bacterial biofilms in orthopedics: the problem and possible prospects for prevention
E.M. Gordina, S.A. Bozhkova
Vreden National Medical Research Center of Traumatology and Orthopedics, St. Petersburg
This review presents modern views on the formation of a chronic orthopedic infection associated with the biofilm formation of bacteria. The stages of biofilm formation, the phenotypes of bacterial cells existing in them, as well as their role in the pathogenesis of implant-associated infection are briefly considered. The biofilm state allows pathogens to be resistant to antibiotic treatment and to the effects of immune system factors due to structural and metabolic heterogeneity because of simultaneous coexistence of microbial cells in various states, combined with active synthesis of the intercellular matrix. Currently, there are several directions in the prevention of microbial adhesion and maturation of films on orthopedic implants. For preventive and therapeutic purposes in traumatology and orthopedics, in addition to systemic and local antibacterial drugs, materials can be used to create implants with certain physical and chemical properties of surfaces. The main action targets of anti-biofilm agents are given This review shows the results of the clinical use of silver and iodine for the prevention and treatment of infectious complications during orthopedic operations. It is concluded that, despite all the optimistic results, most of the applied methods are still to be studied and difficult to scale up to industry standards, which requires further research.
Keywords: biofilms, biofilm formation, periprosthetic joint infection, implant-associated infection, implants.
For citation: Gordina E.M., Bozhkova S.A. Bacterial biofilms in orthopedics: the problem and possible prospects for prevention.
RMJ. 2021;8:29–32.
Введение
В настоящее время потребность в костных и суставных протезах растет из-за старения населения и, вероятно, будет продолжать расти в будущем [1, 2]. Даже с учетом современных широко используемых методов профилактики и асептической хирургической техники частота перипротезной инфекции (ППИ) после вмешательства не снижается ниже 1–2% [3, 4].
Особенностями развития инфекционных осложнений ортопедических вмешательств являются слабовыраженная воспалительная реакция организма пациента, а также способность патогенов к адгезии и биопленкообразованию на поверхности костей и имплантатов, что обусловливает низкую эффективность лечения ввиду устойчивости возбудителей к антибиотикам и факторам иммунной защиты организма [5]. Длительно текущая хроническая инфекция костей может приводить к таким осложнениям, как амилоидоз почек, дистрофические изменения паренхиматозных органов и формирование септикопиемических очагов [6], при этом основной причиной формирования инфекционного очага и развития рецидивов заболевания считают биопленкообразование патогенов [7, 8].
Биопленки: особенности строения и функционирования
Биопленки образованы микробными сообществами, которые встроены в самостоятельно продуцируемую матрицу внеклеточных полимерных веществ (extracellular polymeric substances) [9]. Матрикс, в свою очередь, объединяет бактериальные клетки в единую систему и выполняет структурно-образующую функцию. Например, полимерный матрикс Staphylococcus aureus может быть образован полисахаридами на основе β-1,6-N-ацетилглюкозамина (PNAG), белками (семейства Bap, Rbf), внеклеточной ДНК, а у Pseudomonas aeruginosa — полисахаридами (альгинат, Psl, Pel), протеинами (CdrA) и внеклеточной ДНК [10]. Толщина и структура пленок могут варьировать от монослоя до многослойного плотного сообщества клеток и зависят от таксономической принадлежности микроорганизма, длительности контакта микробов с поверхностью, свойств субстрата, на который происходит адгезия, а также ряда других факторов [11].
Закрепленные в матриксе бактерии претерпевают ряд метаболических изменений, приобретая отличия друг от друга. Даже в моновидовых биопленках сосуществуют бактерии в различных состояниях [12]. В настоящее время выделяют четыре основных метаболических состояния внутри биопленки: аэробное, ферментативное, спящее, мертвое [13].
Различия формируют несколько бактериальных фенотипов: клетки-персистеры, малые колонии (SCV — small colony variants) и жизнеспособные, но некультивируемые (VBNC — viable but non-culturable) бактерии [14, 15].
Клетки-персистеры — это бактерии, которые уже присутствуют в планктонной популяции. Они могут выдерживать высокие концентрации противомикробных препаратов и чаще обнаруживаются в биопленках [16].
Формирование SCV-фенотипа происходит в результате замедления метаболизма, роста и секреции цитотоксического фактора. Такие бактерии характеризуются меньшим размером колоний, формируемых на питательных средах [17, 18]. Перестройка на SCV-фенотип и бактериальная интернализация увеличивают выживаемость и время существования инфекта в организме хозяина [17].
Состояние VBNC соответствует метаболически наименее активным бактериям, не способным расти на питательных средах. Именно это состояние микробов в биопленках может возникать под воздействием антибиотиков [19]. Поскольку значительная часть антибиотиков нацелена на активные бактериальные клетки, эти метаболические адаптации являются ключевым фактором биопленочной устойчивости бактерий [5].
Рассеивание кластеров микроорганизмов позволяет персистировать источнику резистентной бактериальной популяции, а также обеспечивать непрерывную микробную диссеминацию в различные локусы организма, приводя к хронизации инфекционного процесса.
S. aureus, включая метициллинчувствительные (MSSA) и метициллинрезистентные (MRSA) штаммы, является наиболее распространенным видом, вызывающим ортопедическую инфекцию [6]. Streptococcus spp., Enterococcus spp., Cutibacterium acnes — это прочие виды, часто выступающие этиологическими факторами ППИ, но только S. aureus ответственен за около 50% всех ППИ [5]. Причем если ранее рассматривали только S. aureus как наиболее актуальный этиопатоген в случаях инфекционных осложнений эндопротезирования крупных суставов, то в настоящее время повсеместно растет частота ППИ, обусловленных коагулазонегативными представителями рода, преимущественно S. epidermidis [20, 21].
Существование в биопленке обеспечивает долгосрочное выживание патогенов в макроорганизме, а также наносит значительный ущерб окружающей ткани. В инфицированных тканях патоген-ассоциированные молекулярные паттерны взаимодействуют с врожденными Toll-подобными рецепторами, экспрессируемыми на различных типах клеток, а также стимулируют высвобождение воспалительных цитокинов, включая ИЛ-1 и ИЛ-6. Это приводит к активации и дифференцировке остеокластов и повышенной продукции остеобластами рецептора-активатора ядерного транскрипционного фактора каппа-В лиганд (RANKL — Receptor activator of nuclear factor kappa-B ligand). RANKL является ключевым звеном гомеостаза костной ткани, непосредственно регулирующим дифференцировку и активацию остеокластов и остеолиз. Активация Т-лимфоцитов приводит к индукции экспрессии цитокинов, повышению остеокластогенеза, потере костной ткани и, как следствие, к нестабильности компонентов эндопротеза [22].
Подходы к профилактике пленкообразования
Логичным представляется вопрос о возможности модификации поверхности имплантата с целью придания ей антиадгезивных и противомикробных свойств для предотвращения формирования микробных биопленок. В 1987 г. A. Gristina [23] впервые предложил концепцию конкуренции за поверхность, в которой судьба имплантата из биоматериала зависит от баланса между тканевой интеграцией и микробной адгезией с образованием биопленки. В рамках этой концепции была выдвинута гипотеза о том, что модификации материалов, которые усиливают остеоинтеграцию при одновременном подавлении бактериальной адгезии, могут обеспечить теоретическое преимущество и устранить риск образования биопленок и развития инфекции [24], что послужило толчком для дальнейших исследований.
C.L. Romanò et al. [25] классифицировали методики получения антибактериальных покрытий имплантатов на три основные группы:
Пассивная обработка поверхности с антиадгезивными свойствами без высвобождения антибактериальных компонентов. Данная методика не обеспечивает достаточный бактерицидный эффект, необходимый для устранения инфекционного агента, поскольку их действие ограничено периимплантационной областью.
Активная обработка поверхности с последующей элюцией антибактериальных средств.
Периоперационные антибактериальные носители или покрытия, наносимые во время операции (в том числе биоразлагаемые).
Вторая и третья группы обеспечивают только временное решение проблемы, так как их бактерицидный эффект нивелируется со временем.
Существует мнение, что оптимальная поверхность имплантата должна обладать сильным антиинфекционным потенциалом, продолжительным действием, стабильностью, не быть токсичной и вызывать минимальную реакцию со стороны макроорганизма [26].
Для достижения пролонгированного выраженного антимикробного и антибиопленочного действия поверхности могут быть физически и механически обработаны, а также покрыты или химически модифицированы. Ряд антиадгезивных покрытий на титан созданы путем изменения поверхности полимерами, сополимерами или белками. Так, D. Curto et al. [27] показали, что кристаллическая фаза оксида титана на поверхности биоматериалов снижает адгезию бактерий, не влияя на биосовместимость. S. Ferraris et al. [28] продемонстрировали, что механически получаемые нанобороздки (0,1–0,2 мкм) и кератиновые нановолокна могут увеличивать биосовместимость без увеличения степени микробной адгезии. M. Lorenzetti et al. [29] применили гидротермические методы лечения для достижения аналогичного снижения бактериальной адгезии. Полученные результаты указывают на существование возможности модификации поверхности биоматериала с целью предотвращения адгезии патогенов и формирования на его поверхности микробных биопленок.
Существуют данные о возможности физической модификации поверхности для адсорбции антибиотиков или просто применения простого погружения имплантата в антибактериальные препараты для создания временного покрытия с антимикробными и противобиопленочными свойствами [32]. Известно, что антибиотики, ковалентно связанные с металлическими поверхностями, ингибируют бактериальную колонизацию как in vitro, так и in vivo [24]. Однако антибактериальные препараты, дополнительно вносимые в костный цемент, должны соответствовать определенным требованиям — отличаться безопасностью, термостабильностью, гипоаллергенностью, водорастворимостью, иметь адекватный спектр бактерицидной активности; должна быть возможность получения препарата в форме стерильного порошка или лиофилизата [33].
По точкам приложения механизма действия Brackman и Coynye [34] разделили противобиопленочные агенты на группы, воздействующие на:
системы межбактериальной коммуникации, в частности на аутоиндуктор AI-2 (грамотрицательных бактерий), диффузный фактор сигнала (diffusible signal factor);
транскрипционную активность грамнегативных бактерий (деценовая кислота и др.);
механизмы обеспечения железом (лактоферрин, препараты галлия, пиовердин и др.);
молекулы стенки бактерии (например, D-аминокислоты препятствуют закреплению белковых амилоидных волокон; сарагозиновая кислота (zaragozic acid) нарушает архитектуру микродоменов в клеточных мембранах);
межбактериальные взаимодействия (антиматриксные молекулы, например норспермидин (norspermidine), AA-861, партенолид (parthenolide), рамнолипид (rhamnolipid) и другие бактериальные поверхностно-активные вещества);
молекулы, способствующие гибели клеток (индукторы синтеза оксида азота, вызывающего гибель бактерий).
Одним из перспективных направлений борьбы с биопленкообразованием на поверхностях ортопедических имплантатов является применение химических агентов, в том числе металлов (серебро, золото, медь, кобальт) и галогенов [35].
Антимикробное действие серебра связано с взаимодействием его ионов с тиольными группами ферментов и белков, а также с влиянием на высвобождение ионов К + из бактериальной клетки [36]. Кроме того, предполагается, что механизм действия серебра заключается в образовании активных форм кислорода и биологически активных ионов, которые повреждают клеточные стенки бактерий, связываются с нуклеиновыми кислотами, препятствуя размножению бактерий [37]. N. Harrasser et al. [38] изучали антимикробные эффекты серебра и наблюдали значительную антимикробную активность, которая положительно коррелировала с концентрациями серебра. Кроме того, V. Aurore et al. [39] определили, что наночастицы серебра усиливают бактерицидную активность в остеокластах. К числу преимуществ ионов серебра относятся антиадгезивное действие и предупреждение образования биопленок на поверхности спейсера из ПММА [40, 41].
K. Kalishwaralal et al. [42] продемонстрировали, что наночастицы серебра в концентрации 100 нМ почти полностью предотвращали биопленкообразование штаммов S. epidermidis и P. aeruginosa. В другом исследовании [43] костный цемент, импрегнированный серебром, значительно снижал биопленкообразование патогенов в сравнении со стандартным цементом. В ряде экспериментов отмечен синергичный эффект серебра в комбинации с антибиотиками [44–46]. Значимым преимуществом поверхностей, покрытых наночастицами серебра, является их способность непрерывно высвобождать действующее вещество в перипротезную область в течение значительного периода времени, таким образом, действуя как на поверхностном слое, так и непосредственно в окружающей среде [45].
Сравнительно недавно было установлено, что йод является успешным адъювантом для ирригации и санации в случаях ППИ [47]. На сегодняшний день описаны различные методики обработки поверхности имплантата растворами йода. N.M. Brown et al. [49] показали эффективность 10% повидон-йода при обработке им хирургической раны и поверхности имплантата. После имплантации протезных компонентов рану пропитывали раствором повидон-йода, а перед окончательным ее закрытием препаратом обрабатывали кожу вокруг разреза [47]. Адаптировав эту идею к поверхностям имплантатов, H. Tsuchiya et al. [48] провели клиническое исследование, в которое включили 222 пациента с послеоперационной инфекцией, в комплексном лечении которых использовали титановые имплантаты с йодной подложкой. Такие имплантаты показали свою эффективность в профилактике и лечении инфекции, связанной с ортопедическими вмешательствами. T. Shirai et al. [49] показали значимое снижение частоты инфекции, связанной с остеосинтезом, при использовании обработанных йодом внутренних и внешних фиксаторов. Толщина пленки анодного оксида составляла от 10 мкм, с более чем 50 000 пор/мм 2 и способностью удерживать 10–12 мкг/см 2 йода. T. Kabata et al. [50] также оценили клиническую эффективность и безопасность титановых имплантатов, покрытых йодом. Из 14 случаев лечения ППИ и 13 случаев первичного тотального эндопротезирования у иммуносупрессивных пациентов ни в одном случае не было диагностировано инфекционных осложнений и не получено данных о проблемах, связанных с локальной токсичностью применения препаратов йода или с нарушением остеоинтеграции покрытых йодом имплантатов. Таким образом, можно отметить, что йод, как и наночастицы серебра, обладает определенным антибиопленочным потенциалом.
Заключение
Подводя итог, можно сказать, что биопленкообразование — это естественный процесс существования микроорганизмов в окружающей среде и в организме хозяина, обеспечивающий их выживание. Состояние биопленки позволяет бактериям быть толерантными к лечению антибиотиками и к воздействию факторов иммунной системы из-за структурной и метаболической гетерогенности, которая обусловлена одновременным сосуществованием микробных клеток в различных состояниях, сочетающимся с активным синтезом межклеточного матрикса. Кроме того, близость бактерий в состоянии биопленки индуцирует возможность обмена генами устойчивости к антибактериальным препаратам.
Одним из неблагоприятных последствий биопленочных инфекций является чрезмерное потребление антибактериальных препаратов (в основном без какого-либо терапевтического эффекта) в случае сохранения инфицированного имплантата, что также способствует прогрессированию устойчивости возбудителей к антибиотикам.
Профилактика образования пленок на поверхностях имплантатов представляется одним из перспективных методов борьбы с хроническими рецидивирующими имплантат-ассоциированными инфекциями. В травматологии и ортопедии в профилактических и терапевтических целях помимо системного и локального (в составе костного цемента) применения антибиотиков возможно использование различных материалов для создания имплантатов с определенными физическими и химическими свойствами поверхностей. Однако, несмотря на все оптимистичные результаты, большинство систем находятся на этапе изучения и их трудно масштабировать до отраслевых стандартов, что требует дальнейших исследований.
По-видимому, в идеале необходима технология, которая позволяет интегрировать биологическую защиту в конструкцию имплантата, обеспечивая пролонгированную антимикробную и антибиопленочную защиту в течение срока службы заменяющего протеза и не вызывая селекцию антибиотикоустойчивых штаммов бактерий.
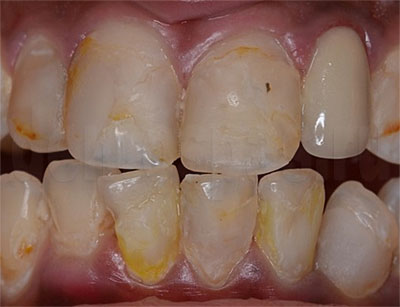
1. Неправильное препарирование опорных зубов под коронки (если условия требуют покрытия опорного зуба коронкой). Причины: недостаток опыта препарирования, торопливость. Устранение ошибки: проведение препарирования зубов согласно требованиям к той или иной конструкции.
2. Ошибки при снятии оттисков:
• Снятие оттиска только с одной челюсти;
• Снятие оттиска альгинатным материалом и передача его технику с задержкой;
• Деформация оттиска при выведении его из полости рта;
• Снятие анатомического оттиска стандартной ложкой, когда были показания для снятия функционального оттиска индивидуальной ложкой.
Причины: слабая теоретическая подготовка врача, неправильная техника снятия оттиска и использование неподходящего оттискного материала. Устранение ошибки: снятие новых оттисков.
3. Ошибки при определении центрального соотношения челюстей или пропуск этого этапа. Они приводят к неправильной постановке зубов. Причины: незнание техники определения центрального соотношения челюстей.
Устранение ошибки: повторное определение центрального соотношения челюстей или исправление ошибки на этапе проверки конструкции протеза.
4. Ошибки при проверке конструкции протеза. На этом этапе необходимо строго следовать плану — (Проверка конструкции протеза состоит из трех моментов:
1. Проверка конструкции протеза в окклюдаторе или артикуляторе.
2. Контроль рабочих моделей.
3. Проверка конструкции в полости рта.), чтобы не пропустить какую-либо ошибку, допущенную на предыдущих этапах. При проверке каркаса в случае, если он оказался эластичным, надо переснять оттиски и переделать каркас.
5. Ошибки при наложении протеза:
• Отсутствие деонтологического подхода;
• Несоблюдение принципа законченности лечения;
• Несоблюдение врачом правил асептики и антисептики. Устранение ошибок: врач должен помнить, что лечение не заканчивается наложением протеза, впереди еще период адаптации. И только после полной адаптации больного к протезу лечение считается законченным.
Врач обязан подробно проинструктировать больного о пользовании протезом, о гигиене полости рта. Перед введением в полость рта больного протезов и их полуфабрикатов врач обязательно должен проводить их дезинфекцию.
31. Осложнения ортопедического стоматологического лечения, причины возникновения, меры профилактики и лечения.
Осложнения, возникающие во время препарирования:
1). Общая реакция выражена в повышении кровяного давления, нарушения сердечного ритма, чувства страха и возбуждения.
Для предупреждения этих осложнений перед препарированием зубов с живой пульпой необходимо провести обезболивания.
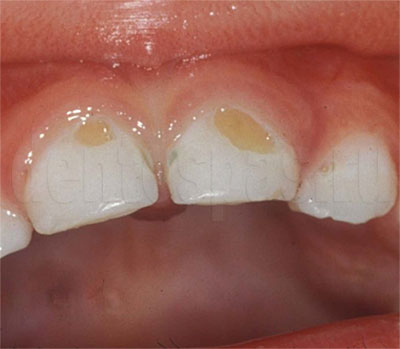
2) При недостаточном сошлифовывании твердых тканей с окклюзионной поверхности зуба искусственная коронка будет завышать прикус и вызывать перегрузку пародонта, что приводет к травматическому периодонтиту, а значит - к распиливанию и снятию коронки или мостовидного протеза.
Перегрузка зуба может проходить бессимптомно, хотя в тканях пародонта возникают тяжелые патологические изменения. Завышение прикуса искусственными коронками и мостовидными протезами приводит к нарушению кровообращения в периодонте, пульпе, резорбции костной тканей лунки, постепенном разрушении периодонта, расширению периодонтальной щели. В тяжелых случаях наблюдается кровоизлияние в периодонт, резорбция твердых тканей, деструктивные изменения в пульпе, разжижение костной ткани возле верхушки корня. На рентгенограмме это определяется в виде гранулемы. Длительная перегрузка зубов приводит к их расшатыванию.
Если недостаточно отпрепарированы твердые ткани зуба и диаметр зуба будет шире чем в области шейки зуба, то искусственная коронка будет не плотно охватывать шейку зуба. Между краем коронки и зубом цемент со временем будет рассасываться - это побуждает возникновению циркулярного кариеса, расцементировке коронки и развития воспаления десны.
3)Во время избыточного препарирования зубов под коронку возможен перегрев пульпы и травматическое раскрытие полости зуба. В результате перегрева зуба в пульпе наблюдаются гиперемия сосудов, кровоизлияние, дегенеративные изменения нервных волокон. При раскрытии полости зуба - развивается пульпит. Во избежание этих осложнений необходимо проводить прерывистое препарирования с полноценным охлаждением, центрируемым, острым абразивным инструментом, чтобы не было перегрева зуба и вибрации.
Осложнения после протезирования:
Аллергия – проводить индивидуальный подбор материалов
Гальванизм – читай 29 вопрос
Протезный стоматит – своевременная коррекция протеза
Расцементировка несъёмных протезов – устранение чрезмерной нагрузки на них

Почему могут возникать осложнения после протезирования?
Протезирование подразумевает внедрение постороннего предмета в полость рта. Организм может положительно воспринять данные элементы, а можно и отторгать конструкции. При возникновении этих нежелательных последствий важно определить основную причину, а уже затем исправлять ситуацию.
Основные виды причин осложнений при протезировании. К чему они приводят?
- Ошибки на этапе планирования установки конструкции – очень распространённая причина, в результате чего была некорректно подобрана форма и размеры протезной конструкции. Чтобы этого не произошло, на подготовительном этапе стоматолог-протезист должен выполнить снимки (если необходимо, то несколько снимков), комплексно продиагностировать состояние полости рта. Возможно, протезирование займет чуть больше, чем планировалось, но такое основательное планирование даст гарантию эффективного лечения.
- Недостаточная санация полости рта. Например, когда у пациента не был обнаружен кариес или пульпит в скрытой форме, а после процедуры лечения эти проблемы дали о себе знать. На стадии подготовки важно очистить зубы от камня и налета, пролечить все очаги воспаления, удалить разрушенные зубы, выполнить наращивание костной ткани. Во избежание осложнений, изделия по такой причине ставятся только при абсолютной санации полости рта!
- Нарушение одного из этапов процедуры протезирования. Это могут быть ошибки на стадии клинического процесса или на технической стадии. В первом случае часто недостаточно хорошо обтачиваются зубы, некорректно снимаются слепки, каркас неправильно припасовывается, была нарушена технология установки конструкции или же изначально специалист неправильно определили тип прикуса. Основные технические ошибки: некорректно подобранная форма зубов, некачественный каркас для конструкции, погрешности при отливании гипсовых моделей конструкции и др.
- Общие заболевания. Распространенные причины, которые приводят к отторжению систем, – остеопороз, сахарный диабет, скрытые или хронические воспалительные процессы в организме. Так или иначе, но протезирование – это нагрузка на организм, а при ослабленном иммунитете пациент не застрахован от возможных осложнений. Сначала необходимо пролечить заболевания или вывести их на стадию стойкой ремиссии, а уже потом переходить к установке конструкций.
- Некачественная гигиена. Несоблюдение правил гигиены приводит к скоплению патогенных микроорганизмов и необратимым осложнениям. Бактерии провоцируют кариес, воспаление десен, на фоне чего протезные конструкции могут отторгаться.
Стоматология для тех,
кто любит улыбаться
ТОП-9 осложнений после протезирования
Представляем вашему вниманию самые распространенные 9 осложнений после установки протезных конструкций:
-
Развитие воспаления десневой ткани – как следствие, приводят к гингивиту, стоматиту в острой и хронической формах. Как правило, такое осложнение в ротовой полости возникает по причине некачественного прилегания замещающей зубы конструкции. Процесс имеет такое течение: конструкция давит на ткани, кровеносные сосуды погибают, отсутствует кровоснабжение тканей, развивается воспаление.
Как решить проблему?
Стоматолог рекомендует процедуру обработки ротовой полости антисептическими растворами, а также специальными гелями для активирования регенерационных процессов тканей. При условии регулярной обработки и уходом за полостью рта десна успокаиваются.
Как решить проблему?
Минимум два раза в год (а то и чаще) проходить полное обследование у стоматолога. Ни один, даже ювелирно выполненный протез, не будет стоять так, чтобы под ним не скапливались бактерии. За полостью с такими изделиями уход должен быть в два раза более тщательным, чем обычно!
Как решить проблему?
Во-первых, стоматолог должен препарировать зубы без формирования так называемых уступов. Во-вторых, конструкция должна быть подобрана строго, возможно, понадобится несколько примерок и подгонок изделия. В-третьих, перед установкой протезного изделия необходимо обязательно пролечить десна. Возможно, понадобится регулярная терапия для поддержания здоровья мягких тканей полости рта.
Как решить проблему?
Необходимо установить, на какой именно из компонентов протезной конструкции у пациента аллергия. Скорее всего, придется заменить протез. Именно поэтому на стадии планирования протезирования важно изучить анамнез и убедиться, что у пациента нет аллергии на металл.
Как решить проблему?
Заменить протез на изделие из керамического материала. При установке керамических конструкций гальванизм не происходит.
Как решить проблему?
Установить, почему именно протез плохо зафиксирован, и выполнить повторную фиксацию с исправлением неточностей.
Как решить проблему?
Если деформация незначительная, конструкцию можно починить непосредственно в полости рта. Иногда может понадобится снятие с повторной фиксацией. Если поломка серьезная, протез придется удалить и на его место поставить новый.
Поскольку проблема – глобальная, скорее всего, необходимо повторное планирование протезирования с тщательной диагностикой прикуса и производством новой протезной конструкции.
Как решить проблему?
Определить основную причину развития аномалии прикуса, провести повторное планирование протезирования с заменой конструкции.
Исправление прикуса — сложное лечение, при котором выполняется серьезное вмешательство в зубочелюстную систему. Если ортодонтическое лечение спланировано правильно, а пациент соблюдает рекомендации лечащего врача, то риск осложнений минимален. Тем не менее, важно знать, какими они могут быть, и что нужно делать, чтобы их не возникало.
![Осложнения после ортодонтического лечения]()
Деминерализация эмали
В норме эмаль сохраняет твердость, получая минеральные вещества при омывании слюной. При установке брекет-системы закрепленные на зубах пластинки мешают контакту эмали со слюной, и риск деминерализации повышается.
Чтобы исключить его и сохранить эмаль твердой, до установки брекетов выполняется реминерализация эмали: покрытие защитным лаком, который насыщает ее фтором. При долгом лечении возможно промежуточное проведение реминерализации при регулировке брекет-системы. Когда врач снимает ее, он шлифует, полирует эмаль и покрывает ее защитным лаком еще раз.
Кариес
Риск его появления при ортодонтическом лечении повышен из-за того, что искусственная конструкция во рту мешает чистке зубов. Налет скапливается быстрее, образуется зубной камень, под которым начинает развиваться кариес.
Рецессия десны
Уменьшение объема десневой ткани рассматривается как побочный эффект коррекции прикуса. Если край десны опускается не больше, чем на 1 мм — это нормальная реакция, связанная с нагрузкой на зубочелюстную систему, временным изменением в питании тканей, изменением положения зубных корней. После завершения коррекции десневая ткань восстановится. Чтобы улучшить регенерацию, можно делать массаж при чистке зубов или использовании ирригатора.
Более выраженная рецессия (2 мм и более) считается осложнением. Может быть связана со слишком сильной нагрузкой на зубочелюстную систему, с исходным состоянием десневой ткани. Чтобы исключить такую рецессию, до начала лечения стоит пройти консультацию пародонтолога (если есть заболевания десен и предрасположенность к ним). Чтобы выравнивающая нагрузка была корректной и не провоцировала рецессию десны, важно своевременно регулировать брекет-систему у ортодонта, контролировать свое самочувствие при ее использовании (не должно быть выраженной боли, кровоточивости десен, отеков, других симптомов травмы).
Если рецессия уже происходит, нужно обратиться к пародонтологу и пройти лечение.
У вас есть вопросы?
Мы перезвоним в течение 30 секунд
Гингивит и стоматит
Гингивит — воспаление десен, которое может возникать из-за неэффективной самостоятельной гигиены. Опасно дальнейшим поражением десневой ткани. Для профилактики гингивита используют растворы для полоскания полости рта, ежедневно контролируют удаление мягкого налета с поверхности у края десны и в межзубных пространствах. Если он уже начался, обращаются к врачу, который назначит антибактериальную терапию.
Стоматит поражает слизистые ткани. При использовании брекет-систем он может быть связан с постоянным травмированием внутренней поверхности щек, губ. Нужно обратиться к ортодонту и отрегулировать систему.
Аллергия
Аллергическая реакция может возникать на сплавы и металлы, использующиеся для изготовления ортодонтических конструкций. Их ношение в этом случае будет невозможным: из-за аллергии появится постоянный зуд, повышенное слюноотделение, раздражение, которое может перейти в воспаление. При склонности к аллергическим реакциям нужно предупредить об этом врача. Желательно заранее сдать тест для оценки реакции на металлы-аллергены. По его результатам ортодонт подберет брекет-систему из таких материалов, которые точно не провоцируют аллергическую реакцию.
![Кариес, возникший после ортодонтического лечения]()
Ошибки ортодонтического лечения
Анкилоз зуба. Если при коррекции создается чрезмерная нагрузка на один из зубов, связка его корня может погибнуть. Корень в этом случае срастается с альвеолой, становится жестко закрепленным в углублении челюсти. Это не опасно потерей зуба (ткани продолжают получать питание), но его перемещение, выравнивание становится невозможным.
Апикальная резорбция корня. Возникает при сильном и постоянном давлении на зубной корень, опасна его постепенным полным разрушением. Сопровождается болевыми ощущениями, воспалением. На раннем этапе не требует лечения: если давление будет устранено вовремя, ткани регенерируют самостоятельно. На поздних этапах приводит к потере зуба. Минимальная резорбция при ортодонтическом лечении считается нормой. После коррекции прикуса при правильном распределении жевательной нагрузки нормальное состояние тканей восстанавливается без дополнительной терапии. Если резорбция выражена, протекает остро, нужно срочное обращение к ортодонту для регулировки брекет-системы. Тревожными симптомами являются постоянный дискомфорт, болезненные ощущения, отечность, покраснение десен, боль при надавливании на коронку.
Плохой результат коррекции. Зубы становятся скученными или между ними появляются большие промежутки, они отклоняются вперед или назад, ротируются, нарушается смыкание зубных рядов. Такие осложнения появляются либо из-за несвоевременной регулировки брекет-системы (пациент не соблюдает график визитов к ортодонту), либо из-за серьезных ошибок при планировании лечения. Коррекцию прикуса должны проводить только квалифицированные ортодонты, после предварительной диагностики, с постоянным отслеживанием динамики лечения.
Результат коррекции не сохраняется. Положение зубов было выровнено, но уже через несколько месяцев зубной ряд начинает искривляться, а прежние проблемы с прикусом возвращаются. Это происходит, если пациент отказывается от ретенционного периода. Это — завершающая фаза лечения, на которой фиксируется новое положение зубов. В этот период нужно носить ретейнер — незаметный аппарат, который удерживает зубы в правильном положении. Без ретенции зубы будут смещаться в исходное положение, а к существовавшим раньше проблемам могут добавиться новые.
Чтобы дети успешно развивались и росли, необходимо своевременно замечать и устранять любые отклонения. Именно поэтому каждому родителю необходимо знать, для чего предусмотрен регулярный осмотр у ортопеда и выполнять его рекомендации.

ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ

Мягко, приятно, нас не боятся дети


ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ

Мягко, приятно, нас не боятся дети


Профилактические осмотры у детских врачей нужны, чтобы выявить и вылечить патологии опорно-двигательного аппарата. В первый год жизни дети должны быть на приеме у врача пять раз. (Первый при рождении, второй после месяца, третий в три, остальные в шесть и в год). Это необходимо так часто, потому что некоторые дефекты могут быть полностью исправлены в этом возрасте.
Зачем ортопеды, и какие патологии они могут выявить?
Обычно врачи-ортопеды выявляют такие заболевания как:
- косолапость, плоскостопие, кривошея;
- дисплазия тазобедренных суставов и врожденные вывихи;
- пороки стоп и кисте;
- варусные деформации конечностей и опухоли костей; ;
- деформация грудной клетки и пороки развития ребер;
- юношеский эпифизеолиз;
- последствия остеомиелита у новорожденных.
Чтобы точно определить диагноз и степень заболевания, современные ортопеды используют методы компьютерной томографии, магнитно-резонансной томографии, рентгенографию, артроскопию, УЗИ. После этого доктор обязан назначить лечение, контролировать его, а в критических ситуациях подготовить маленького пациента к операции и реабилитации.
Причины появления ортопедических заболеваний
Самыми частыми детскими заболеваниями является укорочение конечностей, врожденные деформации, последствия других болезней. Чтобы правильно заботиться о детях с такими заболеваниями, нужно знать причины их возникновения. Основными факторами развития ортопедических болезней являются генетические отклонения и повреждения конечностей. Однако врачу и родителям нужно найти эффективную стратегию лечения. А для этого необходимо знать конкретную причину.
Поэтому можно выделить следующие факторы, которые влияют на здоровье детей:
- нарушенное нормального состояния костной системы;
- ушибы и повреждения во время родов;
- неправильная работа нервных окончаний;
- постродовые ушибы и повреждения мягких тканей;
- патологические отклонения центральной нервной системы;
- нарушенная эндокринная система;
- в раннем возрасте перенесенный рахит;
- изменения в соединительных тканях;
- неправильно подобрана одежда и обувь;
- неправильно обустроено рабочее место.
Симптомы, на которые родители должны обратить внимание
Если у ребенка есть ортопедические отклонения, то это можно понять по нескольким признакам. Во-первых, его движения скованны, отмечается ограниченное сгибание конечностей, иногда болезненное. Во-вторых, будет присутствовать быстрая утомляемость даже при небольших нагрузках. При долгой ходьбе можно заметить ненормальное стирание обуви. В-третьих, различные деформации костей и воспаление суставов, различные искривления позвоночника. Например, сколиозы, кифозы, асимметрия конечностей. В-четвертых, выраженная отечность в конце дня.
При любом из этих симптомов и жалобах ребенка, необходимо сразу же начать наблюдения за ребенком и записаться к врачу. Если лечение пройдет на первых стадиях, то можно избежать последствий. Но нужно понимать, что родители должны самостоятельно следить за ребенком. Если он не имеет каких-либо жалоб, то это не значит, что нет патологий. Некоторые болезни имеют неприятные ощущения только на последних стадиях. Сознательный отказ, пропуски осмотров доктора и невыполнение рекомендаций ортопеда может привести к ужасным последствиям. Например, различные осложнения и рецидивы, детская инвалидность, хирургическое вмешательство.
Профилактика ортопедических заболеваний
Чтобы сохранить здоровье ребенка или поддержать его после лечения, необходимо проводить специальную профилактику. Осмотры и риск основных ортопедических отклонений можно разделить по возрасту детей. Их выделяют три.
В первую группу входят дети дошкольного возраста. Перед поступлением в детский сад каждый осматривается у врача-ортопеда. Обычно они смотрят на формирование стопы, так как плоскостопие и Х-образная деформация ног встречаются в современном мире все чаще. В этом случае необходимо специальное индивидуальное лечение. Чтобы предостеречь это или облегчить лечение, нужно приобрести ортопедическую профилактическую или лечебную обувь.
Во вторую группу можно отнести детей школьного возраста с первого по четвертый классы. В этом возрасте самые популярные диагнозы – нарушение осанки и прогрессирующее плоскостопие. Для поддержания осанки можно использовать специальные корсеты и корректоры. Но это необходимо делать совместно с другими профилактическими методами, такими как специальная физкультура. Для лечения плоскостопия в этом возрасте используют чаще всего специальные стельки-супинаторы. Они смягчают удары при ходьбе.
В третью группу относят ребенка школьного возраста с пятого по девятый классы. В это время основные диагнозы, которые ставят ортопеды, это искривление позвоночника. У детей в старших классах снижается физическая активность и увеличивается время за столом, что ведет к сколиозным деформациям, головным болям и большой утомляемости. Поэтому родителю необходимо обеспечить активный образ жизни ребенка. Но при склонности к ортопедическим болезням, занятия спортом должны проходить со специальными бандажами или наколенниками с фиксацией. Также можно воспользоваться специальными матрасами и ортопедическими подушками под голову или спину.
Ортопедические заболевания являются опасными. Если вовремя не заметить их и не лечить, то у ребенка будут проблемы со здоровьем на всю жизнь. Чтобы предостеречь его от этого, необходимо посещать врача-ортопеда и выполнять предлагаемые им рекомендации.
Читайте также: