Применение кислот в промышленности реферат
Обновлено: 05.07.2024
H2SO4 ,лат. Acidum sulfuricum - сильная двухосновная кислота, молярная масса около 98 г/моль.
Чистая серная кислота - бесцветная едкая маслянистая жидкость без запаха, плотностью 1,84 г/см3, превращающаяся при 10,4°С в твёрдую кристаллическую массу. Температура кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании около 98% H2SO4.
Концентрированная серная кислота очень бурно реагирует с водой, так как при этом выделяется большое количество тепла (19 ккал на моль кислоты) вследствие образования гидратов. По этой причине следует всегда разбавлять серную кислоту, наливая её в воду, а не наоборот.
Серная кислота обладает высокой гигроскопичностью, то есть хорошо поглощает водные пары из воздуха, поэтому может применяться для осушения газов, не реагирующих с нею. Гигроскопичностью обьясняется и обугливание органических веществ, к примеру, сахара или дерева, при воздействии на них концентрированной серной кислотой. При этом образуются гидраты серной кислоты. Также из-за малой летучести её используют для вытеснения других, более летучих кислот из их солей.
Концентрированная серная кислота является сильным окислителем. Она окисляет металлы, стоящие в ряду напряжений до серебра включительно, а продукты реакции зависят от условий ее проведения и активности самого металла. Образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры.
Разбавленная серная кислота взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода (H), с выделением Н2, окислительные свойства для нее нехарактерны.
В промышленности серная кислота получают двумя методами: контактный метод с использованием твердых катализаторов (контактов), и нитрозный — с оксидами азота. Сырьём служат сера, сульфиды металлов и т.п. Выпускается кислота нескольких сортов, в зависимости от чистоты и концентрации: аккумуляторная(самая чистая), техническая,башенная, купоросное масло, олеум(раствор серного ангидрида в серной кислоте).
Применение серной кислоты:
Применение серной кислоты в промышленности
Пищевая промышленность знакома с серной кислотой в виде пищевой добавки Е513. Кислота выступает в качестве эмульгатора. Данная пищевая добавка используется для изготовления напитков. С её помощью регулируется кислотность. Помимо пищи, Е513 входит в состав минеральных удобрений. Применение серной кислоты в промышленности имеет широкое распространение. Промышленный органический синтез использует серную кислоту для проведения следующих реакций: алкилирование, дегидратация, гидратация. С помощью данной кислоты восстанавливается необходимое количество смол на фильтрах, что используются на производстве дистилированной воды.
Применение серной кислоты в быту
Серная кислота в домашних условиях пользуется спросом среди автолюбителей. Процесс приготовления раствора электролита для автомобильного аккумулятора сопровождается добавление серной кислоты. Работая с данной кислотой следует помнить о правилах безопасности. В случае попадания кислоты на одежду или открытые участки кожи, стоит немедленно промыть их проточной водой. Серная кислота, которая разлилась на металл, может нейтрализоваться с помощью извести или мела. Заправляя автомобильный аккумулятор необходимо придерживаться некой последовательности: постепенно добавлять кислоту к воде, а не наоборот. Когда вода вступает в реакцию с серной кислотой происходит сильное нагревание жидкости, что может приводить к её разбрызгиванию. Поэтому стоит быть особо внимательным, чтобы жидкость не попала на лицо, или в глаза. Кислота должна храниться в плотно закрытой емкости. Важно, чтобы химическое вещество сохранялось в недоступном для детей месте.
Применение серной кислоты в медицине
В медицине нашлось широкое применение солей серной кислоты. К примеру, магний сульфат назначается людям с целью достичь слабительного эффекта. Еще одним производным серной кислоты есть натрий тиосульфат. Лекарственное средство используется в роли противоядия в случае отправления следующими веществами: ртуть, свинец, галогены, цианид. Тиосульфат натрий вместе с соляной кислотой используется для лечения дерматологических заболеваний. Профессор Демьянович предложил союз этих двух препаратов для лечения чесотки. В виде водного раствора, натрий тиосульфат вводят людям, которые страдают аллергическими недугами.
Магния сульфат обладает широким спектром возможностей. Поэтому применяется врачами различных специальностей. В качестве спазмолитика магний сульфат вводят больным при гипертонической болезни. Если у человека присутствуют заболевания желчного пузыря, вещество вводится внутрь для улучшение желчеотделения. Применение серной кислоты в медицине в виде магния сульфата в гинекологической практике встречается часто. Гинекологи помогают роженицам посредством введения магния сульфата внутримышечно, таким способом они обезболивают роды. Помимо всех выше указанных свойств, магний сульфат обладает антисудорожным эффектом.
Применение серной кислоты в производстве
Серная кислота, области применение которой разнообразны, используется так же при производстве минеральных удобрений. Для более удобного сотрудничества, заводы,что занимаются производством серной кислоты и минеральных удобрений, в основном, расположены поблизости друг от друга. Этот момент создает непрерывное производство.
Применение серной кислоты в изготовлении красителей и синтетических волокон занимает второе место по распространенности после производства минеральных удобрений. Многие отрасли промышленности используют серную кислоту в некоторых процессах на производстве. Применение серной кислоты нашло спрос и в быту. Люди пользуются химическим веществом для обслуживания своих автомобилей. Приобрести серную кислоту возможно в магазинах, что имеют специализацию по продаже химических веществ, в том числе у нас по ссылке. Серная кислота транспортируется соответственно правилам перевозки подобного груза. Железнодорожный или автомобильный транспорт перевозит кислоту в соответствующих емкостях. В первом случае в качестве емкости выступает цистерна, во втором – бочка или контейнер.
Особенности применения и биологическая опасность
Серная кислота и близкие к ней продукты - чрезвычайно токсичные вещества, которым присвоен класс опасностиII. Их пары поражают дыхательные пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, нередко – ларингит, трахеит, бронхит. Предельно допустимая концентрация паров серной кислоты в воздухе рабочей зоны производственных помещений - 1 мг/м3 . Люди, работающие с токсичными кислотами, снабжаются спецодеждой и средствами личной защиты. Концентрированная серная кислота при неаккуратном обращении с ней может вызвать химический ожог.
При попадании серной кислоты внутрь немедленно после приема появляются резкие боли в области рта и всего пищеварительного тракта, сильная рвота с примесью сначала алой крови, а затем бурыми массами. Одновременно с рвотой начинается сильный кашель. Развивается резкий отек гортани и голосовых связок, вызывающий резкие затруднения дыхания. Зрачки расширяются, а кожа лица принимает темно-синий цвет. Отмечается падение и ослабление сердечной деятельности. Смерть наступает при дозе в 5 миллиграммов. При отравлении серной кислотой необходимо срочное промывание желудка и прием магнезии.
Кислоты взаимодействуют с металлами, стоящими в ряду активности металлов левее водорода. В результате реакции образуется соль и выделяется водород.
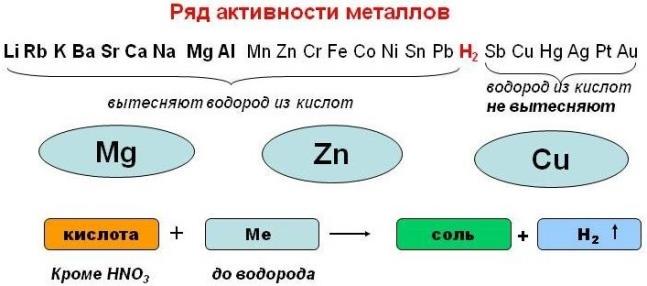
Можно сказать, что металлы, расположенные в ряду активности левее,вытесняют водород из кислот.
Например, при взаимодействии магния с соляной кислотой образуется хлорид магния и выделяется водород:
Эта реакция относится к реакциям замещения.
Необходимо отметить, что азотная кислота и концентрированная серная кислота с металлами взаимодействуют иначе (соль образуется, но водород при этом не выделяется).
2.Взаимодействие кислот с основными и амфотерными оксидами.
Кислоты реагируют с основными и амфотерными оксидами. В результате реакции обмена образуются соль и вода.
Например, при взаимодействии основного оксида калия с азотной кислотой образуется соль нитрат калия, а при взаимодействии амфотерного оксида алюминия с соляной кислотой образуется соль хлорид алюминия:
3.Взаимодействие кислот с основаниями и с амфотерными гидроксидами.
Кислоты реагируют с основаниями и с амфотерными гидроксидами, образуя соль и воду.
Так же, как в предыдущем примере, при взаимодействии гидроксида калия и гидроксида алюминия с кислотами образуются соответствующие соли:
Реакции обмена между кислотами и основаниями называют реакциями нейтрализации.
4.Взаимодействие кислот с солями.
Реакции обмена между кислотами и солями возможны, если в результате образуется практически нерастворимое в воде вещество (выпадает осадок), образуется летучее вещество (газ) или слабый электролит.
А) Кислотыреагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок.
Например, при взаимодействии раствора серной кислоты с раствором хлорида бария в осадок выпадает сульфат бария, а при взаимодействии раствора силиката натрия с раствором азотной кислоты в осадок выпадает кремниевая кислота:
Б) Продукт реакции при обычных условиях, либо при нагревании, улетучивается.
Например, при действии концентрированной серной кислоты на кристаллический хлорид натрия образуется газообразный хлороводород, а при действии соляной кислоты на сульфид железа(II) выделяется газ сероводород:
NaCl(тв.)+H2SO4(конц.)→Na2SO4+2HCl↑,
В)Если кислота, которая вступает в реакцию, является сильным электролитом, то кислота, которая образуется — слабым.
Например, соляная кислота может вытеснить угольную из её соли:
| 2HCl+CaCO3→CaCl2+H2O+CO2↑. |
4.Разложение кислородсодержащих кислот.
При разложении кислот образуются кислотный оксид и вода. Угольная кислота разлагается при обычных условиях, а сернистая и кремниевая кислота — при небольшом нагревании:
Кислоты – это химические вещества, которые вступают в реакцию с различными реагентами. Благодаря этому свойству кислоты находят широкое применение, как в быту, так и в различных видах производства. Кислоты могут отличаться по летучести, растворимости в воде и устойчивости.
Разные виды кислот находят применение в разных сферах промышленности и быта. Все зависит от индивидуальных свойств определенного вещества.

Борная кислота.
Это вещество в жидком виде можно приобрести в аптеке. Она обладает антисептическими свойствами. Часто эту кислоту используют при приготовлении смеси для борьбы с насекомыми и другими вредителями.
Раствор борной кислоты часто используют в медицине и производстве. В промышленности чаще всего встречается техническая борная кислота.
Азотная кислота.
Этот вид химической продукции используется для различных целей. В бытовых условиях этой кислотой проводят травление металлических поверхностей, таких как ножи, платы и т.д.
Азотная кислота также используется для производства азотистых удобрений. В фармакологии это вещество применяют для производства лекарственных препаратов. Ювелирная промышленность использует эту кислоту для обработки металлов и проведения определенных процессов.
Серная кислота.
Ее можно встретить в любой производственной лаборатории. Это вещество помогает синтезировать определенный элемент, который связан с другими в растворе. Серная кислота также применяется для производства взрывчатых смесей.
Моющие средства специального назначения часто содержат в своем составе серную кислоту. Перед нанесением на металл гальванического покрытия, поверхность обрабатывают серной кислотой. Это позволяет удалить все виды загрязнений, в том числе ржавчину и оксиды.

Муравьиная кислота.
Этот вид химических элементов очень распространен в сельскохозяйственном производстве. Муравьиная кислота замедляет процесс гниения и используется как консервант в кормах, которые закладываются на хранение.
Пчеловоды используют эту кислоту для обработки ульев. Это позволяет избавиться от вредителей. Также муравьиная кислота применяется в медицине и ее можно приобрести в аптеке.
Соляная кислота.

Этот вид кислот используется в медицине для лечения болезней желудка. Соляная кислота входит в состав желудочного сока. При пониженной кислотности пациенту назначают раствор соляной кислоты.
Из всех кислот наибольшее применение в различных отраслях получили серная, соляная, азотная и ортофосфорная.
Применение кислот в промышленности:
Ортофосфорная кислота широко применяется в стоматологии при пломбировании зубов. Ею протравливают зубную эмаль перед процедурой. Также в незначительных количествах ортофосфорная кислота применяется в составах отбеливателей для зубов.
Разбавленную соляную (хлороводородную) кислоту применяют для лечения некоторых заболеваний желудочно-кишечного тракта.
В полости желудка хлористоводородная кислота:
1) стимулирует секреторную активность желез желудка;
2) создает оптимальную кислотность для действия ферментов желудочного сока;
3) вызывает денатурацию и набухание белков (что способствует их расщеплению ферментами);
4) обеспечивает антибактериальный эффект секрета;
5) участвует в створаживании молока;
6) стимулирует моторную активность желудка.
Лимонная кислота используется в кулинарии, а также для выведения всевозможных пятен: от вина, различных ягод, красок, ржавчины, чернил.
Щавелевая кислота применяется для удаления пятен от чернил, ржавчины. Однако следует иметь в виду, что кристаллическая кислота может вызвать ожоги слизистых оболочек ротовой полости, пищевода, желудка и является ядовитым веществом.
Благодаря подкормке, в состав, которой входит борная кислота, растения становятся более устойчивыми не только к болезням, но и к неблагоприятным метеоусловиям. Специалисты отмечают, что благодаря борной кислоте, урожай увеличивается в среднем на 20%, а то и 25%. Особенно, такие высокие показатели у огурцов, томатов, капусты.
- Борной кислотой обрабатывают семена перед посадкой – их замачивают на 12-24 часа (в литре воды разводят 0,2 г борной кислоты).
- Борную кислоту вносят непосредственно в почву перед высадкой рассады или семян (2 г на 10 литров воды).
- Борной кислотой опрыскивают листья (5 г на 10 литров).
Уксусная кислота применяется либо в виде столового уксуса, с массовой долей кислоты до 9% или в виде 70-80%-ной эссенции. Уксус применяется в качестве консерванта, а также приправы к блюдам, удаления фруктовых пятен с тканей.
Соляная кислота п рименяется для очистки от известкового налёта раковин, ванн, умывальников, труб и радиаторов систем централизованного отопления
.
Читайте также:

