Преимущества аффинной хроматографии реферат
Обновлено: 05.07.2024
Активированные матрицы и спейсеры
Твердым основанием для аффинной матрицы чаще всего служат хорошо известные нам 4% или 6% сефароза, иногда химически скрепленная (CL-сефароза), а в некоторых специальных случаях (см. ниже) и целлюлоза.
Имеется множество способов химической активации как самих матриц, так и удаленных от матрицы концов спейсеров. Такая активация необходима для обеспечения простоты "посадки" на них лиганда (в условиях биохимической лаборатории).
Здесь нецелесообразно рассматривать все это множество способов, тем более, что большинство из них требует более серьезного знания органической химии, чем дает средняя школа. (Интересующимся и лучше подготовленным читателям я могу рекомендовать свою книгу "Хроматография белков и нуклеиновых кислот" ("Наука", 1985)).
Тем не менее, для иллюстрации подхода к проблеме опишу в общих чертах один простейший и ранее других предложенный вариант (впрочем, используемый до сих пор).
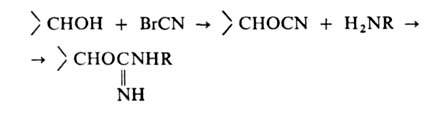
В нем активация полисахаридной матрицы, несущей на себе множество свободных ОН-групп, производится путем обработки ее бромцианом (BrCN). В результате получают (в сильно щелочной среде) прочно сидящие на нитях сефарозы химически активные группы имидокарбоната, согласно реакции. Эти электрофильные группы "охотно" образуют ковалентные связи с нуклеофильными группами лиганда.
Так например, лиганд, имеющий свободную аминогруппу, может связаться с актированной таким образом матрицей через остаток изомочевины.
Возможны еще два варианта протекания этой реакции (с выделением аммиака), но оба они приводят к тому же конечному результату: лиганд (или спейсер с аминогруппой на конце) химически прочно связывается с матрицей.
Безусловным недостатком описанного метода активации матрицы следует назвать ядовитость бромциана и токсичность некоторых побочных продуктов реакции (в том числе и НВг), содержащихся в промывных водах после активации сефарозы.
В качестве спейсеров обычно используют либо 1,6 диаминогексан,, либо 6-аминокапроновую кислоту. Таким образом на свободном конце спейсера оказывается аминогруппа или карбоксил. Присоединение к нему лиганда также требует специальной химической реакции.
Поэтому фирма "Pharmacia" выпускает готовые матрицы, в которых спейсер (6-аминокапроновая кислота) активирован этерификацией концевого карбоксила N-оксисукцинимидом.
Присоединение лиганда по аминогруппе происходит в мягких условиях, в течение одного часа, что очень важно для лабильных лигандов. N-оксисукцинимид отщепляется и на его место надежной пептидной связью присоединяется лиганд.
Лиганды
Великое множество лигандов, описанных в научной литературе, можно разбить на две главных категории. Это лиганды с индивидуальной специфичностью и лиганды с групповой специфичностью, В качестве индивидуальных лигандов могут выступать ферменты, а также субстраты или ингибиторы соответствующих ферментативных реакций (для очистки ферментов).
Использование в целях очистки аффинной пары фермент-субстрат предполагает такие условия хроматографического процесса, когда фермент не может осуществить каталитический акт преобразования субстрата, а только связывается с ним в фермент-субстратный комплекс. (Например в отсутствие необходимого второго субстрата, соответствующих ионов или при неблагоприятном значении рН).
С другой стороны, важный раздел биохимии, особенно в прикладном аспекте, составляет конструирование обменников с закрепленными ферментами, на этот раз ведущими катализ в условиях, когда его продукты легко отделяются от ферментов.
Эти продукты вытекают из колонки или остаются в супернатанте после проведения ферментативной реакции в объеме взвеси, из которой матрица с закрепленным на ней ферментом затем удаляется в осадок.
Естественно, что в этих случаях в окружении иммобилизованного фермента создаются условия не только связывания субстрата, но и катализа соответствующей реакции.
Очевидное преимущество ферментов, закрепленных на хроматографической матрице, заключается в простой возможности многократного использования этих ферментов, поскольку они автоматически освобождаются из смеси с продуктами реакции.
Так же, как ферменты, белки-рецепторы могут служить лигандами для связывания и очистки гормонов и других низкомолекулярных эффекторов. Транспортные белки плазмы крови и белки - переносчики клеточных мембран - для очистки своих низкомолекулярных партнеров.
Белки - регуляторы и участники процессов матричного синтеза, используемые в качестве лигандов, позволяют решать задачи по вычленению регуляторных и других особых участков нуклеиновых кислот. То же относится к системам выработки и транспорта энергии.
Разумеется, все участники названных здесь биоспецифических пар могут меняться ролями - те, что были иммобилизованы, могут стать объектом аффинной очистки. Весьма продуктивным оказалось и создание иммуносорбентов, обладающих сродством к определенным антигенам.
Лиганды с групповой специфичностью обладают сродством к целой группе веществ. К примеру, "кофермент А" участвует во многих ферментативных реакциях. Закрепленный на аффинной матрице, он может обеспечивать очистку любого из соответствующих ферментов. В тех случаях, когда в исходном препарате имеется только один из них, очистка будет не хуже, чем при использовании лигандов с индивидуальной специфичностью. Иногда групповая специфичность некоторых опытным путем отобранных лигандов не имеет даже четкого объяснения этой их способности.
Например, кислый аминополисахарид гепарин (М>10 000) известен в качестве антикоагулянта крови. Но кроме того он нашел применение в биохимии как конкурентный ингибитор рибонуклеаз. Это его качество, по-видимому, отражает определенное сходство полимера с РНК.
Поэтому гепарин может быть использован в качестве лиганда для ряда белков, взаимодействующих с нуклеиновыми кислотами: полимераз, растриктаз, обратной транскриптазы, факторов инициации белкового синтеза и других.
В качестве лигандов могут выступать и сами нуклеиновые кислоты. Есть способы химического закрепления их на активированных матрицах.
Но чаще ДНК и РНК, используя их нитевую структуру, закрепляют на матрицах нековалентно: либо заплавляют в 4%-ную агарозу в процессе ее затвердевания из расплавленного состояния, либо "запутывают" между нитями набухшей в воде целлюлозы - при ее высыхании.
На отобранных путем клонирования и закрепленных в аффинной матрице фрагментах ДНК, содержащих определенный ген, можно задерживать и очищать соответствующую этому гену иРНК.
Синтезированную в лабораторных условиях полиуридиловую кислоту (поли У) длиной в сотню мономеров уридина можно ковалентно фиксировать на BrCN-активированной сефарозе.
Затем, благодаря наличию у большинства иРНК высших организмов более или менее длинного полиаденилового "хвоста", выделять суммарную фракцию иРНК из смеси со всеми остальными РНК клеточного лизата. Относительно короткие цепочки (10-20 нуклеотидов) олиго-дезокситимидиловой кислоты (олиго дТ) закрепляют через концевой 5'-фосфат на матрице волокнистой целлюлозы.
На таком лиганде можно так же, как в предыдущем случае, через хвостовую поли А закрепить определенную иРНК. Затем с помощью обратной транскриптазы, для которой олиго дТ будет служить праймером, синтезировать по этой иРНК двунитевую к ДНК, которая в этом случае остается связанной с матрицей и сама может выступать в качестве лиганда.
На этом ограничим перечень возможных лигандов, далеко не исчерпав их список, и в заключение краткого очерка аффинной хроматографии рассмотрим три простых примера: два с индивидуальной специфичностью и один - с групповой.
Некоторые примеры использования аффинной хроматографии
Пример 1. Очистка фермента карбоксипептидазы А из мышцы крысы (Bodwell, Meyer, 1981).
На BrCN-активированную сефарозу 4В сажали белковый ингибитор карбоксипептидазы А, выделенный из картофеля. Фракцию гомогената мышцы, экстрагированную между 0,4М КС1 и 2М NaCI в нейтральном буфере, дополнительно очищали осаждением сульфатом аммония и сажали на аффинную колонку с ингибитором, уравновешенную тем же 2М NaCI в нейтральном буфере, затем промывали таким же раствором. Элюцию фермента вели тоже 2М NaCI, но в 0,01М Na2CO3 при рН 11,2.
Отрыв фермента от ингибитора происходил за счет сильного защелачивания элюента. Примесные белки выходили при промывке, а фермент элюировался острым пиком после смены буфера
Эффективность очистки на этом этапе можно оценить сопоставляя площади под двумя пиками, обозначенными пунктиром.
Иммунная система
Конечно же, мы не будем пытаться глубоко проникнуть в обширную область медицинской иммунологии. Коснемся только тех возможностей, которые использование иммунохимического подхода предоставляет для исследования биополимеров.
Однако для того, чтобы представить себе с чем мы будем иметь дело, необходимо, хотя бы поверхностно, познакомиться с механизмом выработки иммунитета, а также со специфическими клетками крови и молекулами его реализующими.
Широко распространенное понятие иммунитета до недавнего времени ограничивалось представлением о том, что речь идет о системе, обеспечивающей длительную неуязвимость человека для возбудителей болезней, которыми он однажды переболел хотя бы в самой легкой форме (прививка). Это тоже верно.
Но не будь у нас иммунной системы, то смертность от самых "пустяковых" на сегодняшний взгляд болезней была бы чудовищной. Человечество это по-настоящему поняло, когда столкнулось с вирусом СПИД, который атакует именно иммунную систему.
В наш организм из воздуха и пищи ежедневно проникают миллионы болезнетворных микробов и вирусов. Их всех встречает не знающее ни сна, ни отдыха "войско" иммунной защиты. Так что это за войско?
Люди, чуть знакомые с вопросом, говорят, что иммунная система вырабатывает некие "антитела", которые то ли убивают вторгшиеся микроорганизмы, то ли облепляют их, обезвреживают и вместе с собой выводят из организма.
Все это не совсем так. "Непрошенных пришельцев" уничтожают специальные крупные клетки - фагоциты. "Узнав" чужеродную клетку или вирус, они буквально "заглатывают" их. Наружная мембрана фагоцита образует углубление, наподобие мешочка, которое обволакивает "чужеземца". Потом горловина мешочка смыкается, оболочка фагоцита восстанавливается и "враг" оказывается в его цитоплазме. Здесь он подвергается атаке разнообразных литических ферментов, разрушающих сначала оболочку, а потом и сердцевину злокозненной жертвы.
В крови фагоциты называют гранулоцитами. Они входят в состав белых кровяных клеток - лейкоцитов" Фагоциты, оседающие в тканях тела, именуются макрофагами, В обоих случаях фагоцит должен в первую очередь "узнать" чужака. Вот здесь-то роль разведчиков и "наводчиков" выполняют особого рода белковые молекулы, именуемые антителами" Откуда они берутся и как узнают "противника"?
Вообще-то говоря, его в первую очередь "узнают" (с помощью антител) другие белые кровяные клетки - лимфоциты. Это - довольно мелкие клетки. До момента своей встречи с инфекцией лимфоциты не делятся и могут циркулировать в крови месяцы и годы. Большие скопления лимфоцитов находятся в лимфатических узлах и особенно в селезенке, через которую проходит вся кровь.
Встретившись с инфицирующим или просто посторонним агентом, оказавшимся в крови (их объединяют общим термином антигены) и "узнав" его, лимфоциты преображаются. Ускоряются процессы метаболизма, увеличиваются размеры, возобновляется синтез ДНК. Затем следует деление. В условиях острых инфекций один лимфоцит дает сотни тысяч клеток-потомков и все они сохраняют способность "узнавать" тот же самый антиген. Часть этих потомков так и останутся в крови, формируя иммунитет ("иммунологическую память").
Число "разведчиков", получивших приметы этого антигена, таким образом резко возрастает. В следующий раз, когда он попадет в кровь, то не успеет размножиться, как будет опознан. Но что же дальше? Как лимфоциты сообщают об опасности фагоцитам? И как, все-таки, они сами "узнают" антигены?
Только часть активированных первичной встречей с антигеном лимфоцитов размножается для создания иммунитета. Другая их часть претерпевает иную метаморфозу. Увеличивается объем цитоплазмы, ядро оттесняется в сторону, разрастается ретикулярная система. В рибосомах начинается интенсивный синтез особых белков - тех самых "наводчиков", которых мы выше назвали антителами.
Через аппарат Гольджи они выбрасываются наружу. Прошедшее эту метаморфозу лимфоциты, которых теперь именуют плазмацитами секретируют до двух тысяч антител в секунду. Часть их поступает прямо в кровь, а часть остается в лимфатических узлах, где оседают плазмациты. Все антитела, синтезируемые в потомках первого дозорного лимфоцита сохраняют способность узнавания того антигена, встреча с которым стимулировала всю цепь трансформаций.
Ну а первый лимфоцит, как он "узнал" антиген? Да при помощи тех же антител, которые в количестве примерно ста тысяч покрывали его поверхность. Получается замкнутый круг. Выходит дело, что узнающие данный антиген антитела существовали еще до его появления. Его ждали! Для того, чтобы "узнать" именно его и его потомков (если он способен размножаться), прилепиться к их поверхностям и тем самым пометить как цели для атаки фагоцитов.
Но откуда взялась первоначальная информация о структуре еще не появившегося в организме антигена? Большинство ученых считает, что все огромное множество вариантов такой информации, - заложены исходно, наследственным путем в таком же множестве изначальных лимфоцитов, быть может, как результат соответствующих "знакомств" в предыдущих поколениях животного или человека. (Некоторые ученые, напротив, полагают, что все иммунные ответы формируются в течение жизни человека под влиянием вторгающихся антигенов.
Они подчеркивают, что в первые месяцы жизни новорожденного, у него иммунная система еще не работает)
Попробуем оценить первую версию, оперируя некоторыми цифрами. Зададимся сперва вопросом: что же "узнают" антитела на поверхности антигена.
Ввиду возможного разнообразия природы и происхождения антигенов, скорее всего какую-то пространственную конфигурацию, которая может строиться из любого материала: из нескольких молекул аминокислот, липидов, Сахаров, нуклеотидов и даже из органических молекул не животного происхождения. Но эта конфигурация, ввиду избирательности связывания антитела с антигеном, должна быть непростой.
Вместе с тем, число заметно различающихся пространственных комбинаций органических молекул не безгранично, так как природа химических связей между молекулами накладывает свои ограничения. Предположим, что это число для всех возможных естественных (бактерии, вирусы, белки, нуклеиновые кислоты и др.) и искусственных антигенов имеет величину порядка десятка миллионов (~10 7 ). Известно, что число лимфоцитов, содержащихся в организме человека ~10 12 .
Это означает, что число "разведчиков", изначально располагающих "приметами" каждого возможного антигена ~10 5 . Это не так уж много по сравнению с общим числом лимфоцитов. Если "интервент" остается одиночкой, то вероятность встречи со "своим разведчиком" у него ничтожно мала. Но тогда от него и никакого ощутимого вреда быть не может.
Однако, как это всегда бывает, если в организм проникают одновременно многие тысячи одинаковых антигенов, то вероятность встречи соответственно возрастает. Особенно, если эти антигены суть болезнетворные микроорганизмы, которые начинают в нем быстро размножаться.
Тут уже ситуация меняется радикально, и вскоре "роковая встреча" становится неизбежной. Немедленно начинается массовая наработка антител нужной специфичности. Их размножение вступает в конкурентную борьбу с размножением "пришельцев".
Если антитела быстро выиграют эту гонку, то сумеют пометить собою всю "армию вторжения" и все ее солдаты будут уничтожены фагоцитами обоих типов прежде, чем появятся явные признаки заболевания. Такие явления происходят в нашем организме повседневно. Очевидно, что для фагоцитов безразлична природа антигена.
Они "узнают" только факт наличия на его поверхности антител любой специфичности. (Попутно заметим, что в случае вторжения более крупных антигенов, чем фагоциты, для уничтожения "врага" мобилизуются совсем другие средства - серия белков, так называемого комплемента, впрочем, направляемая тем же антителом. Мы эти средства рассматривать не будем - в биохимических методах исследования они применения не нашли)
Если же размножение бактерий или вирусов опережает наработку специфических антител, то болезнь развивается. В борьбу вступают другие средства защиты, например, повышение температуры тела, тормозящее это размножение. Наконец, на помощь организму привлекаются лекарства или лекарственные травы, которые животные умеют находить.
В случае повторного вторжения патогенных микроорганизмов, их уже ожидает многомиллионная армия специфических антител и лимфоцитов, созданная иммунитетом. Начальные условия для описанной выше "гонки размножений" оказываются явно в пользу защитников организма.
Подсчитано, что в крови человека свободно циркулируют и постоянно обновляются около 10 19 антител.10 12 лимфоцитов несут на себе 10 17 антител. Значит в 100 раз большее их количество находится "в свободном поиске" противника. Значительная их часть - носители иммунитета.
В ответ на введение в кровь подопытного животного (обычно кролика) некоего антигена, например, чужеродного белка (это действие именуется иммунизацией кролика), в его организме, в течение определенного времени будут вырабатываться в большом количестве специфические антитела, способные "узнавать" только этот белок.
И мы теперь знаем, что "узнавание" означает прочную связь этих антител с молекулами соответствующего антигена и только с ними одними. Все остальные антитела разнообразной специфичности, содержащиеся в так называемой иммунной антисыворотке животного, наш белок не смогут "заметить". Точно так же, как антитела, выработанные в ответ на иммунизацию кролика определенным белком-антигеном, ни с какими другими белками связаться не могут.
Литература
1. Довгяло О.П., Федоренко Н.М. Ишемическая болезнь сердца. - М.: Медицина, - 1986.
2. Долгов В.В. Морфо-функциональная характеристика эндотелия сосудистой стенки в норме и при атеросклерозе. Автореф. Док. дис. - М. - 1985.
3. Долгушин И.И., Зурочка А.В., Чукичев А.В., Колесников А.Л. Роль нейтрофилов в регуляции иммунной реактивности и репаративных реакций повреждения ткани. // Вестник Росс. Акад. мед. наук. - 2000. N 2. - C. - 14-19.
Вы можете изучить и скачать доклад-презентацию на тему Аффинная хроматография. Презентация на заданную тему содержит 21 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!





















Аффинная хроматография (от латинского affinis - родственный) (биоспецифическая хроматография, хроматография по сродству) - это метод очистки и разделения белков, основанный на их избирательном взаимодействии с лигандом, ковалентно связанным с инертным нерастворимым носителем (матрицей аффинного сорбента)
ЛИГАНДЫ - соединения, ковалентно связанные с матрицей, биоспецифически (комплементарно) взаимодействующие с выделяемыми соединениями. Биоспецифическое взаимодействие основано на стерическом соотвествии взаимодействующих веществ и связано с выполнением биологической функции лиганда и выделяемого соединения.
Примеры биоспецифического взаимодействия 1. фермент – ингибитор 2. фермент – субстрат 3. фермент – активатор 4. антиген – антитело 5. комплементарные нуклеиновые кислоты
Элюирующие растворы 1. Буферные растворы со значением рН 2,4-2,8 2. Буферные растворы со значением рН > 10 3. Буферные растворы с высокой ионной силой; 4. Буферные растворы с повышенной температурой (
6. Буферные растворы с добавлением детергентов; 7. Буферные растворы с добавлением хаотропных соединений (роданид калия или натрия); 8. Буферные растворы с добавлением денатурирующих агентов ( мочевина разрушает водородные связи);
Виды аффинной хроматографии 1. Аффинная хроматография с использованием лиганда индивидуальной специфичности. 2. Аффинная хроматография с использованием лиганда групповой специфичности
Лиганды с индивидуальной специфичностью 1. моноклональные и поликлональные антитела к данному антигену; 2. гаптены; 3. субстрат фермента 4. специфический ингибитор фермента 5. специфический активатор фермента 6. комплементарная ДНК или РНК
Лиганды с групповой специфичностью 1. лектины (конканавалин А, специфически связывающий молекулы, содержащие -D-маннопиранозил, -D-глюкопиранозил; лектин из зародышей пшеницы, специфически связывающий N-ацетилглюкозамин); 2. сахара; 3. коферменты (НАД+, НАДФ+, коферментом-А); 4. иммобилизованные нуклеозидфосфаты;
5. триазиновые красители; 6. гепарин; 7. ингибиторы протеаз; 8. консервативные области ДНК (например, промоторы); 9. желатин; 10. хелатирующие агенты
Хелатирующий агент (chelating agent) (от греческого chele — клешня) - - лиганды, обладающие способностью связывать атомы металлов. Содержат химические группы, содержащие подвижный протон (например -COOH, -ОН, -SO3H); Примером хелатирующих агентов служит этилендиаминтетрауксусная кислота (ЭДТА), которая прочно и обратимо связывает двухвалентные катионы
Одним из наиболее перспективных направлений развития аффинной хроматографии оказалось использование ее металохелатного варианта.
Фенилбороновая кислота Фенилбороновая кислота обладает способностью избирательно связывать молекулы, содержащие цис-диольную группировку, в том числе, такие как углеводы и гликопротеиды. Образующиеся ковалентные связи легко расщепляются в слабокислой среде, а также под действием конкурирующих диолов, таких как этиленгликоль, сорбитол и так далее.
Аффинная сорбция Специфическое связывание взаимодействующего с лигандом соединения. Отмыв несвязанных соединений.
Элюция – разрыв биоспецифических связей Для элюции применяется буферный раствор с крайними значениями рН, или со специфическими реагентами
Затем элюат нейтрализуется На завершающем этапе определяется специфическая активность выделенного соединения и его удельная активность в расчете на мг белка. Например:
1. Примеры биоаффинных взаимодействий 2. Виды аффинной хроматографии; 3. Металлоаффинная хроматография; 4. Свойства идеального носителя (матрицы) для аффинной хроматографии;
5. Матрицы углеводной природы. Структура. Достоинства и недостатки. 6. Полимерные синтетические носители для аффинной хроматографии. Структура. Достоинства и недостатки. 7. Применение макропористых стекол и силикагеля для синтеза аффинных сорбентов. Структура частиц, методы получения. 8. Этапы аффинной хроматографии (сорбция, промывка, элюция, нейтрализация, определение удельной активности)

Хроматография – это один из методов разделения веществ. Она используется для последующего качественного и количественного анализа физических и химических свойств микрочастиц. Разновидностью данной технологии является аффинная хроматография. Идея дифференциации белковых соединений с использованием свойства сродства молекул известна в науке уже несколько десятилетий. Однако свое развитие она получила только в последние годы, после того, как были внедрены высокопористые гидрофильные материалы, использующиеся в качестве матрицы. Данный метод позволяет решать как аналитические задачи (разделение веществ и их идентификация), так и препаративные (очистка, концентрирование).
Сущность
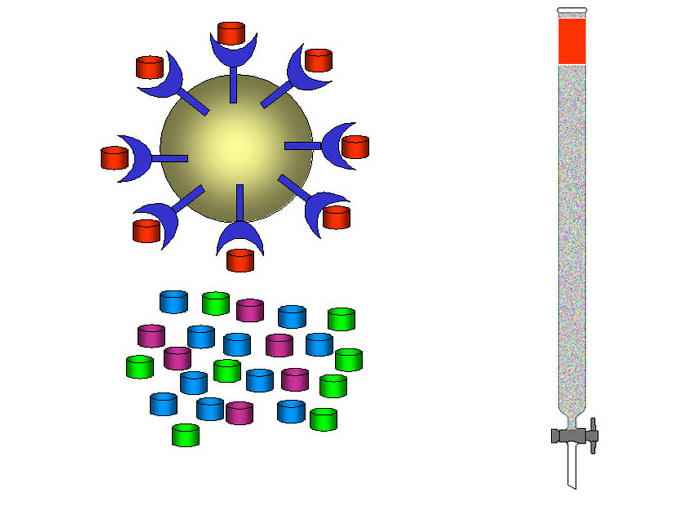
Разделение компонентов происходит следующим образом:
- рабочий раствор, содержащий вещество, которое необходимо выделить, пропускают через сорбент;
- лиганд, нанесенный на матрицу-сорбент, удерживает это вещество;
- происходит его концентрирование (накопление);
- извлечение выделенного вещества с сорбента при помощи вымывания растворителем.
Данный способ позволяет выделить целые клетки. Отличием от традиционной сорбционной хроматографии является то, что существует прочное биоспецифическое связывание выделяемого компонента с сорбентом, характеризующееся высокой избирательностью.
Адсорбенты
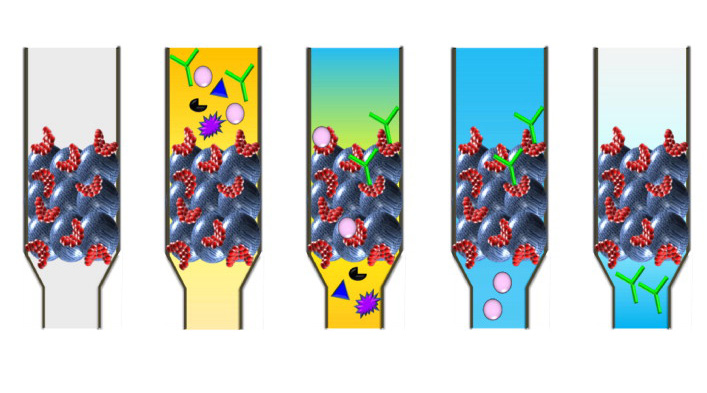
В качестве адсорбентов применяют следующие вещества:
- Гелеобразные составы на основе агарозы – полисахарида, получаемого из агара. Наиболее часто используют 3 разновидности: сефарозу 4 В, CL (сшитая агароза) и аффи-гель. Последний состав представляет собой модифицированный гель из агарозы и полиакриламида. Он обладает большей биологической инертностью, высокой химической и термической стойкостью.
- Кремнезем (силикагель).
- Стекло.
- Органические полимеры.
Для устранения механических препятствий при контакте лиганда применяют дополнительные вещества, отделяющие его от носителя (пептиды, диамины, полиамины, олигосахариды).
Аппаратура
Оборудование для аффинной хроматографии включает в свой состав следующие основные узлы:
- емкости-накопители для подвижной фазы (элюента);
- насосы высокого давления для подачи среды (чаще всего поршневые);
- фильтр для очистки элюентов от пыли;
- дозирующее устройство;
- хроматографическая колонна для разделения смеси;
- детектор для определения разделенных компонентов, выходящих из колонны;
- регистраторы хроматограмм и микропроцессорный блок (ЭВМ).
С целью уменьшения количества растворенного воздуха через подвижную фазу предварительно пропускают гелий. Для изменения концентрации элюента устанавливают несколько насосов, управляемых программатором. Хроматографические колонны изготавливаются из нержавеющей стали (при повышенных требованиях к коррозионной устойчивости), из стекла (универсальный вариант) или из акрила. Для препаративных целей их диаметр может колебаться от 2 до 70 см. В аналитической хроматографии применяют микроколонки Ø10-150 мкм.
Для повышения чувствительности детекторов в смесь вводятся реагенты, которые способствуют образованию веществ, которые больше поглощают лучи в ультрафиолетовой или видимой области спектра.
Методика проведения
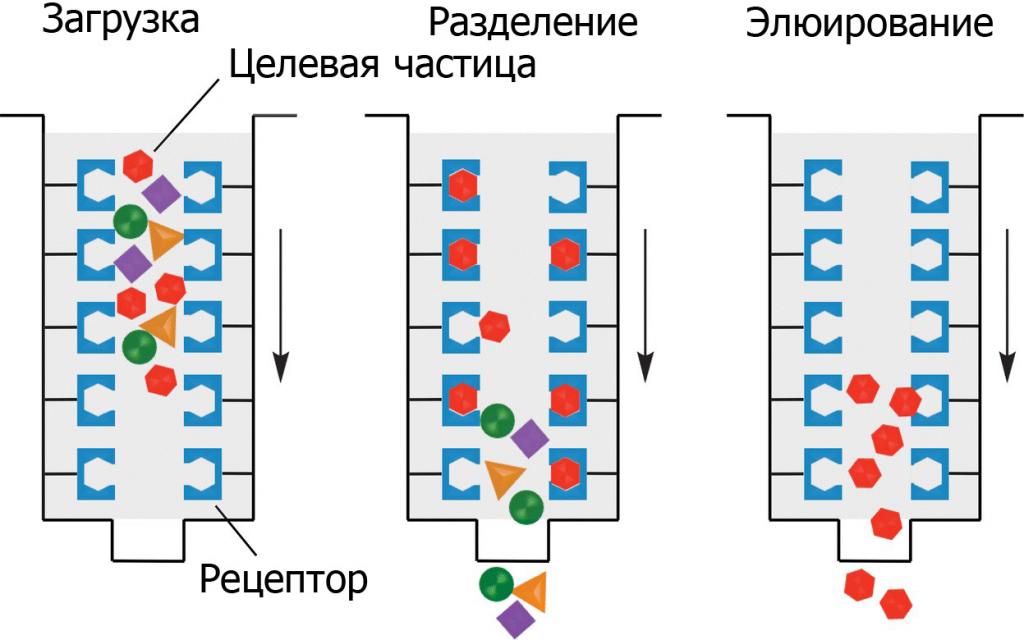
Различают 2 основных вида жидкостной аффинной хроматографии:
- Колоночная, при которой колонну заполняют неподвижной фазой и через нее пропускают смесь с потоком элюента. Разделение может происходить под давлением или под в результате действия силы тяжести.
- Тонкослойная. Элюент движется по плоскому слою адсорбента под воздействием капиллярных сил. Адсорбент наносят на пластину из стекла, керамическую или кварцевую палочку, металлическую фольгу.
Основные этапы работ включают в себя:
- подготовка адсорбента, фиксация лиганда на носителе;
- подача смеси для разделения в хроматографическую колонну;
- загрузка подвижной фазы, связывание компонента лигандом;
- замена фазы для выделения связанного вещества.
Назначение

Аффинная хроматография используется для выделения следующих видов веществ (в скобках указан вид применяемого при этом лиганда):
- аналоги ферментативных ингибиторов, субстратов и кофакторов (ферменты);
- биоорганические вещества, обладающие признаками генетической чужеродности, вирусы и клетки (антитела);
- высокомолекулярные углеводы, полимеры моносахаридов, гликопротеины (лектины);
- ядерные белки, нуклеотидилтрансферазы (нуклеиновые кислоты);
- рецепторы, транспортные белки (витамины, гормоны);
- белки, взаимодействующие с клеточными мембранами (клетки).
Эта технология также используется для получения иммобилизованных ферментов, а привязка их к целлюлозе позволяет изготовить иммуносорбенты.
Хроматография ДНК-связывающих белков
Выделение ДНК-связывающих белков производится с помощью гепарина. Этот гликозаминогликан способен связывать большой диапазон молекул. Аффинная хроматография белков данной группы используется для выделения таких веществ, как:
- факторы инициации и элонгации трансляции (синтез молекул нуклеиновых кислот и белков);
- рестриктазы (ферменты, узнающие определенные последовательности в двухцепочечной ДНК);
- ДНК-лигазы и полимеразы (ферменты, катализирующие соединение двух молекул с образованием новой химической связи и участвующие в репликации ДНК);
- ингибиторы сериновых протеаз, которые играют важную роль в иммунных и воспалительных процессах;
- факторы роста: фибробластов, Шванна, эндотелиальный;
- белки межклеточного матрикса;
- рецепторы гормонов;
- липопротеиды.
Достоинства

Данный метод является одним из самых специфических для выделения реакционноспособных соединений (ферментов и более крупных агрегатов – вирусов). Однако он используется не только для выделения биологически активных веществ.
Выявление антител в малых количествах, количественная оценка полиадениловой кислоты, экспресс-определение молекулярных масс дегидрогеназ, удаление определенных загрязнителей, изучение кинетики активации неактивной формы трипсина, молекулярного строения интерферонов человека – вот далеко не весь перечень исследований, при которых применяется аффинная хроматография. Применение в клинике обусловлено такими ее преимуществами, как:
- Возможность эффективной очистки белков, полисахаридов, нуклеиновых кислот. Они незначительно отличаются по своим физико-химическим свойствам и теряют активность при гидролизе, денатурации и прочих видах воздействия, используемых в других методах.
- Быстрота разделения веществ, динамический характер процесса.
- Отсутствие необходимости в специальной очистке ферментов и гомогенизации изоферментов для определения констант диссоциации.
- Возможность разделения широкого круга веществ.
- Небольшой расход лигандов.
- Возможность разделения веществ в больших объемах.
- Обратимый процесс связывания биологических макромолекул.
Данную методику можно совмещать с другими, накладывать дополнительное поле (гравитационное, электромагнитное). Это позволяет расширить технические возможности хроматографии.
Ферментная инженерия
Благодаря этому методу началось активное развитие новой отрасли биотехнологий – ферментной инженерии.
Аффинная хроматография применительно к выделению ферментов обладает следующими преимуществами:
АФФИННАЯ ХРОМАТОГРАФИЯ
АФФИННАЯ ХРОМАТОГРАФИЯ (от лат. affinis - родственный) (биоспецифич. хроматография, хроматография по сродству), метод очистки и разделения белков, основанный на их избират. взаимод. с лигандом, ковалентно связанным с инертным носителем. В кач-ве лигандов используют соед., взаимод. к-рых с разделяемыми в-вами основано на биол. ф-ции последних. Так, при разделении ферментов (для чего преим. и применяется аффинная хроматография) лигандами служат их субстраты, ингибиторы или коферменты. Главная особенность, к-рая обусловливает высокую эффективность аффинной хроматографии, состоит в том, что разделение основано на различии не физ.-хим. признаков молекулы (заряда, формы и размера), а специфич. функциональных св-в, отличающих данный фермент от множества др. биополимеров.
Неподвижная фаза в аффинной хроматографии представляет собой специально получаемый сорбент, построенный обычно по схеме: носитель - соединяющее звено ("ножка") - специфич. лиганд. Носителем служит чаще всего сефарозапроизводное агарозы, имеющее поперечные сшивки. Присоединение к ней лиганда или "ножки", содержащих, как правило, аминогруппу, осуществляется после активации сефарозы бромцианом:
Содержание лиганда колеблется от 0,1 до 10 мкмоль на 1 г влажного сорбента. Сефароза, однако, малоустойчива к действию ряда хим. в-в и микроорганизмов.
Более стабильны макропористые неорг. носители (кремнезем, стекло) и орг. полимеры. Если лиганд присоединяется непосредственно к носителю, эффективность специфич. взаимод. с ферментом заметно снижается вследствие пространств. затруднений. "Ножка", как правило, устраняет стерич. препятствия, отдаляя лиганд от носителя. Как и носитель, она должна быть инертной и не влиять на процессы в ходе аффинной хроматографии, чего, однако, не всегда удается достигнуть. Напр., присоединение "ножки" по приведенной выше р-ции приводит к образованию катионной группировки изомочевины, и сорбент приобретает св-ва анионита. В кач-ве "ножки" используют обычно ди- и полиамины,аминокислоты, пептиды, олигосахариды.
Лигандами могут служить субстраты (напр., крахмал или гликоген при разделении амилаз), однако их превращ. в ходе аффинной хроматографии, катализируемое разделяемым ферментом, постоянно изменяет св-ва сорбента. Поэтому, как правило, применяют аналоги субстратов, устойчивые к дальнейшему превращ., т.е. ингибиторы ферментов. Так, для выделения протеиназ используют не расщепляемые ими пептиды D-аминокислот. Эффективны прир. ингибиторы ферментов, напр. пепстатин - ингибитор аспартильных протеиназ. Иногда применяют лиганды, связывающие большие группы родственных ферментов (в частности, киназы и дегидрогеназы). Примеры таких "группоспецифич." лигандов-антрахиноновые красители, аналоги никотинамидадениндину-клеотида.
Известны лиганды (напр., производные фенилборной к-ты), имитирующие при взаимод. с ферментом структуру переходного комплекса с субстратом. Такие лиганды эффективны при выделении сериновых гидролаз.
Разделение в аффинной хроматографии обычно проводят на хроматографич. колонках; иногда разделяемую смесь помещают в сосуд с сорбентом и выдерживают до полного связывания исследуемого компонента. Затем сорбент (в колонке или сосуде) промывают буферным р-ром для удаления несвязавшихся в-в, после чего десорбируют исследуемый компонент. Десорбция (элюция) последнего обычно достигается повышением ионной силы, изменением рН буферного р-ра или добавлением в него орг. р-рителя, что ослабляет взаимод. лиганд - фермент. Более избирательна десорбция р-ром лиганда.
Помимо ферментов, методом аффинной хроматографии можно выделять также токсины, рецепторы, ингибиторы, транспортные белки и др. биологически активные в-ва. Высокой избирательностью отличается т. наз. иммуносорбция, при к-рой в кач-ве лиганда используют антитела, обладающие специфичностью к выделяемым белкам; особенно эффективны моноклональные антитела.
Для разделения белков применяется также ряд др. аналогичных методов. Т. наз. ковалентная хроматография основана на избират. образовании и последующем расщеплении ковалентных связей между выделяемым в-вом и носителем, напр. между белком с SH-группами и ртуть-орг. производными агарозы. Применяется также лигандообменная хроматография, при к-рой ферменты связываются через функциональный ион металла с комплексоном, иммобилизованным на носителе. Получила распространение гидрофобная хроматография, при к-рой сорбент (напр., фенилсефароза), содержащий гидрофобные группировки, вкрапленные в гидрофильную матрицу, взаимодействует с гидрофобными участками, содержащимися на пов-сти белков. Нередко при этом наблюдаются также ионообменные взаимод., как, напр., при использовании в качестве сорбента алкиламиносефароз.
Избират. выделение гликопротеинов обеспечивают иммобилизованные на носителях лектины - белки, специфически взаимодействующие с концевыми моносахаридными звеньями углеводных цепей. Иммобилизованные субъединицы ряда белков с четвертичной структурой м. б. использованы для извлечения этих белков из сложных смесей вследствие специфич. межсубъединичных контактов. Аффинная хроматография сформировалась как метод в кон. 60-х гг. 20 в.
Читайте также:

