Преимплантационная генетическая диагностика реферат
Обновлено: 08.07.2024
Предимплантационная диагностика - это специальный метод исследования, предшествующий этапу переноса эмбриона в полость матки, позволяющий выявить имеющиеся генетические нарушения (хромосомные аномалии), что позволяет исключить наличие у будущего ребенка каких-то генетических отклонений. Необходимо специальное оборудование, которое позволяет выявить конкретную генетическую аномалию или провести комплексное обследование для обнаружения хромосомных отклонений (анеуплодидия - трисомия 13, синдром Тернера, синдром Клайнфельтера).
Впервые эта методика была использована в 1990 году и к настоящему времени в современной науке достигнуты весьма существенные результаты.
Например, если ранее британским клиникам, занимающимся ЭКО, разрешалось проводить PGD для скрининга только трех тяжелых наследственных заболеваний, проявляющихся в детском или юношеском возрасте: муковисцидоза, рака сетчатки и семейного аденоматозного полипоза (предракового заболевания кишечника). По решению HFEA, в дополнение к этим тестам будет проводиться скрининг для выявления генов, значительно увеличивающих риск развития трех видов злокачественных опухолей – рака груди, яичников и кишечника - во взрослом возрасте.

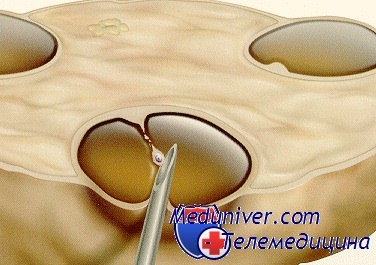
Рисунок 1.
Предимлантационная диагностика.
Кому показано проведение генетической диагностики?
Пациентам с наследственными заболеваниями;
Эти ситуации встречаются достаточно редко, поскольку больные достаточно часто знают о том, что они являются носителями какого-то гена, который может вызывать у их детей какие-то серьезные заболевания.
Пациентам с хромосомными нарушениями, которые страдают привычным невынашиванием беременности;
Эти ситуации также является достаточно редкой. В этом случае паре хорошо известно, что у них есть какая-то хромосомная аномалия, так называемая сбалансированная транслокация. В этом случае, мужчина или женщина являются внешне совершенно нормальными и практически здоровыми, но только до того момента, когда пытаются родить ребенка.
В том случае, когда их хромосомы соединяются при оплодотворении, возникает очень высокий риск развития каких-то отклонений у плода. Это сопровождается либо привычным невынашиванием, либо рождением детей с генетическими дефектами. Применение PGD позволяет использовать для переноса только здоровые эмбрионы хорошего качества, что значительно повышает процент вынашивания, а также способствует рождению здоровых детей.
Пациентам, включенным в программу, в возрасте 38 лет и более;
Пациентам в любом возрасте при неудачных попытках ЭКО (3 и более)
Дело в том, что достаточно часто клетки человека имеют какие-то хромосомные отклонения, при этом, чем больше возраст, тем больше частота встречаемости какой-то патологии. В среднем около 25-40% эмбрионов имеют какие-то хромосомные отклонения, при этом цифры повышаются до 50% у женщин в возрасте около 40 лет. При неудачных попытках ЭКО сразу необходимо думать о наличии каких-то генетический дефектов у плода, которые также могут являться причиной невынашивания.
В настоящее время данных масштабных исследований свидетельствуют о том, что:
- Частота навынашивания беременности при проведении преимплантационной диагностики ниже, чем без нее (не во всех исследованиях);
- Доказательств тому, что при применении PGD повышается процент наступления беременности, так же, как и процент живорождения, пока нет (в некоторых случаях он даже ниже, что связано с повреждением эмбриона при проведении его биопсии для взятия клеток);
В некоторых случаях PGD имеет ложные результаты:
- а) эмбрион может иметь какие-то отклонения, а по результатам исследования он совершенно нормальный;
- б) эмбрион здоров, однако по результатам PGD он имеет хромосомные нарушения;
- в) Ложные результаты по данным литературы встречаются в 5-15% случаев.
В целом, на настоящий момент можно говорить о том, что методика PGD имеет свое право на существование, значительно помогает в диагностике и профилактике наследственных заболеваний, однако, требуются дальнейшие исследования для ее усовершенствования и улучшения качества полученных результатов.
Для пар, у которых уже были дети, погибшие от врожденной генетической аномалии, или которые были вынуждены прервать патологически протекающую беременность, возможность пренатальной диагностики и прерывания беременности не бывает столь уж привлекательной. Эти пары, безусловно, предпочли бы альтернативные методы. Преимплантационная генетическая диагностика (ПГД) - разновидность пренатальной диагностики, осуществляемой еще до наступления беременности как таковой, совмещающая искусственное оплодотворение с биопсией эмбриона, которая позволяет диагностировать нарушения еще до подсадки эмбриона. ПГД применяют в специализированных клиниках уже более 15 лет. Сегодня эту технологию используют для профилактики и лечения трех групп генетических аномалий.
Во-первых, ее используют для профилактики моногенных аутосомно-рецессивных синдромов, когда родители бывают носителями, а риск рецидива составляет 25%. Кистозный фиброз был первым патологическим состоянием, диагностированным с помощью ПГД. Для лиц, пораженных аутосомно-доминантными заболеваниями, риск рецидива составляет 50%. Примерами аутосомно-доминантных синдромов, диагностируемых с помощью ПГД, служат синдром Марфана и болезнь Хантингтона. Для проведения ПГД необходим анализ ДНК отдельных клеток, поэтому основным применяемым методом стал метод полимеразной цепной реакции (ПЦР). В большинстве случаев используют методики гнездной мультиплексной и флюоресцентной мультиплексной ПЦР.
Преимплантационная генетическая диагностика (ПГД) также используют для профилактики привычного невынашивания беременности при наличии у одного из партнеров реципрокной транслокации или робертсоновской транслокации. Для лечения пар, в которых есть носитель таких транслокаций, используют две технологии. У женщин - носительниц транслокации производят биопсию первого полярного тельца вскоре после получения яйцеклетки, еще до оплодотворения, с последующим полным хромосомным анализом методом FISH. Из-за того, что описанную методику можно применить лишь к женщинам — носительницам транслокаций, чаще используют метод биопсии эмбриона.
Для диагностики робертсоновских транслокаций необходимо два FISH-зонда, расположенных на теломерных концах заинтересованных хромосом. Для диагностики реципрокных транслокаций необходимо три зонда, меченных разными информационными флюорохромами: два из них должны находиться в центромерных регионах каждой хромосомы, а оставшийся — на теломерном конце хромосомы. При этом можно различить эмбрионы с несбалансированным хромосомным набором и эмбрионы со сбалансированным набором, как нормальные, так и являющиеся сбалансированными носителями. К сожалению, как показали исследования, эмбрионы от носителей транслокаций характеризуются высокой частотой хромосомных аномалий, а беременность у таких пар возникает редко.
Уже давно известна связь возраста матери с частотой хромосомных аномалий. Также установлено, что в 60% случаев спорадических выкидышей причиной бывают хромосомные аномалии плода. В свете этого неудивительно, что ПГД используют в сочетании с искусственным оплодотворением для пар с повышенным риском анеуплоидии из-за возраста матери. Частота успешных исходов искусственного оплодотворения повышается при использовании ПГД и скрининга на анеуплоидию у женщин в возрасте от 35 до 40 лет. Скрининг на анеуплоидию в настоящее время бывает самым частым показанием к ПГД.
• Импринтинг, однородительская дисомия, митохон-дриальное наследование и аномалии тринуклеотид-ных повторов считают нетрадиционными формами наследования, способными передавать наследственные заболевания человека.
• Гены SRY, SOX9, SF1, WT1 и DAX - важнейшие гены, необходимые для дифференцировки половых желез.
• Важнейшими генами для реализации нормального фертильного мужского фенотипа служат ген АР, локализованный на длинном плече Х-хромосомы, ген SRY, локализованный на коротком плече Y-хромосомы (он определяет развитие яичек), и гены AZF (отвечающие за сперматогенез).
• Синдром Клайнфелтера (XXY) — наиболее частая генетическая причина необструктивной азооспермии.
• Микроделеции регионов AZF становятся причиной 10-20% всех случаев азооспермии и 3-10% случаев выраженной олигоспермии. Эти микроделеции передаются по всем представителям мужской линии в семье.
• Преимплантационная генетическая диагностика (ПГД) используют для диагностики моногенных и хромосомных болезней еще до наступления беременности, однако существуют опасения, что с ПГД связано повышение частоты врожденных заболеваний, ассоциированных с импринтингом.

Для родителей зачатие и рождение ребенка – всегда большое чудо и самая большая радость в жизни. Тем более, если это далось им с большим трудом, путем преодоления своих природных ограничений с помощью дорогого экстракорпорального оплодотворения. Однако, всегда есть риск того, что беременность пройдет неудачно и закончится либо ее потерей, либо рождением ребенка с врожденными аномалиями развития. Существенно уменьшить вероятность таких последствий позволяет предимплантационная генетическая диагностика (ПГД). Хотя эта медицинская услуга делает и без того недешевое ЭКО еще дороже, она позволяет оценить риск врожденных аномалий у конкретного эмбриона и принять объективное решение о дальнейшем проведении процедуры по его пересадке.
Почему важна ранняя диагностика генетических патологий человека?
ПГД – молекулярно-биологическое исследование хромосомного набора клеток эмбриона, направленное на выявление в нем генетических аномалий перед имплантацией в матку. Важность этой процедуры заключается именно в том, что возможные осложнения будущей беременности определяются еще до того, как она началась. Благодаря этому снижаются риски не только для будущего ребенка, но и его матери.
Предимплантационная генетическая диагностика эмбриона является комплексной и проводится параллельно процедуре ЭКО. Она позволяет:
- выявить до 150 хромосомных заболеваний плода, тем самым снизив вероятность рождения ребенка с аномалиями развития;
- сократить риск невынашивания беременности и повысить эффективность экстракорпорального оплодотворения.
В стандартный протокол ЭКО диагностика генетических болезней не входит – оцениваются только темп развития эмбрионов, процесс их деления и жизнеспособность. Отобранные таким образом зародыши затем переносятся в полость матки. При этом сохраняется высокая вероятность отторжения эмбрионов или рождения ребенка с врожденными нарушениями. В среднем, эффективность ЭКО без предимплантационного скрининга составляет около 35-40%.

ПГД, в свою очередь, проводится на глубоком генетическом уровне. У каждого искусственно зачатого эмбриона проводится анализ хромосомного набора. Это позволяет исключить имплантацию зародышей, у которых имеются нарушения, которые на этой стадии развития не проявляются внешними признаками. Эффективность ЭКО при использовании предимплантационной генетической диагностики достигает уже 45%.
Предимплантационный скрининг эмбрионов также позволяет определить предрасположенность к проявлению патологий уже во взрослом состоянии – например, опухолей в кишечнике, яичниках, груди. Также генетический анализ используется для раннего определения пола будущего ребенка и связанных с его половой принадлежностью аномалий.
Показания к проведению генетической диагностики эмбриона
Процедура ПГД рекомендована семейным парам и одиноким женщинам, проходящим процедуру ЭКО, в следующих случаях:
- При наличии у одного или обоих родителей серьезных наследственных заболеваний и высоком риске их передачи будущему ребенку. При этом у самих пациентов эти патологии могут никак не проявляться, если они являются лишь носителями дефективных генов.
- Если возраст матери превышает 35 лет, а отца – 39-40 лет. После этого возрастного порога в половых клетках родителей резко возрастает количество генетических ошибок. При зачатии их комбинации могут спровоцировать у будущего ребенка собственные врожденные нарушения, не связанные с наследуемыми от папы или мамы мутациями.
- При риске возникновения резус-конфликта – иммунного отторжения резус-отрицательной матери плода с положительным резус-фактором. В этом случае женская генетика несовместима с геномом ребенка. Ее организм вырабатывает антитела, которые при попадании в кровь эмбриона вызывают разрушение его красных кровяных телец. Обычно такой иммунный ответ формируется у матери в момент первых родов, когда ее кровь смешивается с кровью плода. При последующих беременностях уже выработанный иммунитет приводит к тяжелым поражениям и гибели эмбрионов.
- При наличии в яйцеклетках или сперматозоидах родителей хромосомных и генетических аномалий, обусловленных возрастом, воздействием внешних факторов (излучения, токсичных веществ и т. д.).
- При 2-х и более безуспешных предшествующих попыток ЭКО неясной этиологии, а также свыше 2 спонтанных абортов в анамнезе женщины, произошедших на ранних стадиях беременности.
- При выявлении серьезных аномалий спермы отца на спермограмме – отсутствия или малого количества сперматозоидов, их малоподвижности, большого числа клеток с нарушенной морфологией и т. д.
- При наличии у родителей ребенка с тяжелым заболеванием, требующим лечения стволовыми клетками. В этом случае рождение генетически совместимого с ним малыша (по системе HLA) может решить проблему донорства.
Генетическая диагностика болезней, проведенная перед экстракорпоральным оплодотворением, позволяет отказаться от пренатального исследования, которое несет больший риск здоровью матери и ее малыша.
Молекулярно-генетические методы диагностики
В рамках проведения генетической диагностики плода используются следующие методы исследований:
- FISH (флуоресцентная гибридизация). Стандартный и сравнительно недорогой метод генетической диагностики, отличающийся малым сроком проведения (несколько часов). Широко применяется в клиниках репруктологии России и стран постсоветского пространства. В медицинской практике развитых стран сейчас используется редко из-за относительно невысокой точности исследования из-за того, что анализу подвергаются не все хромосомы.
- CGH (сравнительная геномная гибридизация). Этот метод отличается большой стоимостью и продолжительностью исследования. Среди преимуществ – широкий перечень выявляемых аномалий и высокая точность результатов. Также с помощью этой технологии врач может определить шанс успешной имплантации конкретного эмбриона.
- ПЦР (полимеразно-цепная реакция). С его помощью определяют резус-фактор и группу крови эмбриона, а также некоторые генетические аномалии. Особенность данной технологии в том, что она требует предварительного обследования обоих биологических родителей на хромосомные нарушения. Из-за этого он не применим в том случае, если ЭКО проводится с использованием донорских ооцитов или эмбрионов.
- NGS (секвенирование нового поколения). Собирательное название нескольких методик определения нуклеотидной последовательности ДНК эмбриональных клеток, позволяющих составить ее полное формальное описание. Достаточно дорогая технология, которая, тем не менее, сегодня считается одной из наиболее эффективных, поэтому широко используется в диагностической практике.
Выбор конкретной методики предимплантационной генетической диагностики эмбрионов осуществляется врачом на основании других обследований родителей, индивидуальных показателей их организма.
Этапы молекулярно-генетической диагностики
Процедура ПГД довольно сложная и продолжительная, поэтому может проводиться только в специально оборудованном центре генетической диагностики квалифицированным врачом-генетиком. Она включает в себя несколько этапов – рассмотрим каждый из них подробнее.
Диагностика генетических нарушений. После получения яйцеклеток в отделении клинической генетики проводится их исследование следующими способами:
- Забор полярных телец. Осуществляется из еще неоплодотворенной яйцеклетки или зиготы. В этом случае исследуется лишь хромосомный набор матери, поэтому данный метод обычно используется в том случае, если наследование генетических заболеваний предполагается только по материнской линии. Если яйцеклетка здорова, ее оплодотворяют и через 5-6 дней культивации пересаживают пациентке.
- Биопсия бластомеров. Проводится на 3 день развития эмбриона, когда он состоит из 6-10 клеток. Эмбриолог извлекает исследует 1-2 бластомера, сам зародыш продолжает развиваться. Этот метод позволяет исследовать уже полный геном эмбриона и, следовательно, выявить патологии, передающиеся и по материнской, и по отцовской линии. Пересадка зародыша выполняется на 5 день его развития.
- Биопсия бластоцисты. Проводится на более позднем сроке развития эмбриона, когда число его клеток достигает 200. Из них извлекается и исследуется 5-7 бластомеров – это снижает риск повреждения самого зародыша. Биопсию бластоцисты проводят обычно как повторное исследование, если результаты исследования на начальной стадии дробления неоднозначны.
Часто для повышения точности предимплантационной диагностики указанные методы комбинируют друг с другом. В нашей клинике репродукции и генетики специалист назначает конкретную стратегию исследований индивидуально для каждой пациентки.
Пересадка эмбрионов. После анализа зародышей и отбора из них наиболее жизнеспособных осуществляется их пересадка будущей матери. Без ПГД имплантация эмбрионов выполняется на 3-5 день их развития. Применение предимплантационной диагностики, как правило, увеличивает продолжительность ЭКО. Скорость проведения всей процедуры экстракорпорального оплодотворения зависит от того, сколько эмбрионов исследуется, и какие при этом применяются методы молекулярно-генетического анализа.
Этические проблемы генетической диагностики
Диагностика генетических нарушений на ранних стадиях развития эмбриона сегодня является общепринятой медицинской практикой. Вместе с тем имеется и определенная критика в ее адрес, связанная с этикой применения. Как правило, она сводится к следующему:
- Евгенический характер анализа. Предимплантационное обследование позволяет выявить и отсеять эмбрионов с нарушениями. С одной точки зрения, это лишает права будущего ребенка на жизнь и нарушает принципы ненанесения вреда и справедливости. С другой стороны, на ранней стадии развития эмбрион представляет собой просто совокупность клеток, он не имеет развитой нервной системы, позволяющей утверждать существование у него личности.
- Использование диагностики для создания ребенка-донора. Одним из самых спорных моментов является установление генетической совместимости эмбриона с уже имеющимся у семейной пары ребенком для последующего использования родившегося малыша в качестве донора органов (например, костного мозга). Хотя само предимплантационное исследование в данном случае не наносит вреда ребенку, оно может использоваться для причинения ущерба его здоровью в будущем.
Тем не менее, имеются и явно положительные в этическом плане аспекты применения ПГД. В частности, она позволяет оградить будущих родителей от морального выбора между родительским долгом по отношению к родившемуся с нарушениями ребенку и собственным счастьем, на которое тоже имеют право. Кроме того, малыш с тяжелыми врожденными отклонениями, если и сможет выжить, столкнется в будущем с большими медицинскими и социальными проблемами. Генетическая диагностика эмбрионов позволяет отсеять из них те, что имеют нарушения, еще на той стадии, когда они точно не являются сформированной личностью. В этом случае она является морально обоснованным шагом.
Эффективность и безопасность предимплантационной диагностики
Необходимо понимать, что ПГД не дает 100-процентной гарантии, что ребенок родится без серьезных нарушений. Это исследование, хоть и в редких случая, но дает ошибочный результат. Тем не менее, эффективность предимплантационной диагностики достигает 95-97%. Однако, даже если эмбрион здоров, всегда есть вероятность, что его имплантация и дальнейшее развитие в организме матери пройдет успешно.
Другим аспектом, связанным с безопасностью генетической диагностики эмбриона, является сама процедура ее проведения. Биопсия клеток может нанести вред зародышу, нарушив естественный ход его развития и таким образом вызвав врожденные нарушения у плода. Однако, такая вероятность сегодня оценивается всего в 1%.
Эффективность и безопасность ПГД напрямую зависит от профессионализма врачей, качества оборудования и инструментов, на которых она проводится. Поэтому необходимо осуществлять предимплантационную диагностику в клинике, имеющей соответствующую лицензию. Перед выбором лечебного учреждения изучите квалификацию и опыт соответствующего врачебного персонала, ознакомьтесь с отзывами клиентов, подробно расспросите самих врачей на первичной консультации.

Статья посвящена изучению вопроса методов преимплантационной генетической диагностики в программах ВРТ
Ключевые слова: преимплантационная генетическая диагностика (ПГД), вспомогательные репродуктивные технологии (ВРТ), генетические нарушения, эмбрион.
Актуальность. Преимплантационная генетическая диагностика (ПГД) — современная методика, использующаяся в программах вспомогательных репродуктивных технологий, позволяет выявить наличие генетических нарушений у эмбрионов до переноса в полость матки.
Значительная часть визуально (внешне) нормальных эмбрионов в программах ВРТ могут быть генетически аномальными. Перенос таких эмбрионов в полость матки может повлечь за собой отсутствие имплантации (беременности), неразвивающуюся беременность либо тяжелые нарушения у будущего ребенка. [2]
Цель исследования: рассмотреть различные методы преимплантационной генетической диагностики в программах ВРТ, их возможности и ограничения.
Кому рекомендована ПГД? В последнее время рекомендуется проведение ПГД эмбриона во всех случаях использования вспомогательных репродуктивных технологий. [1] Выбор метода ПГД супружеская пара осуществляет совместно с лечащим врачом на основании тщательно собранного анамнеза.
В настоящее время актуальными методами ПГД являются:
- FISH — метод флуоресцентной гибридизации in situ (от англ. fluorescent in situ hybridization);
- aCGH (от англ. comparative genomic hybridization);
- NGS — секвенирование нового поколения (от англ. next generation sequencing);
- realTime PCR — ПЦР (Полимеразная цепная реакция) в реальном времени.
FISH (fluorescence in situ hybridization). Метод основан на связывании ДНК-зонда, меченного флюоресцентным красителем, с ДНК хромосомы исследуемого образца.
— проведение скрининга преимплантационных эмбрионов по наиболее частым анеуплоидиям хромосом 8,9, 13, 14, 15, 16, 17, 18, 21, 22, X, Y;
— определение генетического пола эмбрионов;
— проведение ПГД эмбрионов у носителей хромосомных перестроек.
— метод не включает в себя определение 24 типов хромосом;
— колоссальная зависимость от качества фиксации;
— не позволяет исключить мозаицизм;
— диагностика проводится на конкретную патологию, и не позволяет исключить аномалию в не исследуемых участках;
— нельзя выявить однородительскую дисомию;
— невозможно совмещать с другими видами ПГД (на моногенные заболевания, HLA).
aCGH (comparative genomic hybridization). Конкурентная гибридизация in situ двух геномных ДНК библиотек, одной — полученной из анализируемой ткани/единичных клеток, второй — контрольной (из лимфоцитов периферической крови здорового индивида), взятых в равном соотношении и меченых разными флуорохромами на мембрану/микрочип, на котором расположены тысячи локус-специфических ДНК-фрагментов здорового человека.
— выявление численных аномалий хромосом (анеуплоидии), включая мозаичные варианты;
— детекция структурных аберраций хромосом;
— несбалансированные субтеломерные перестройки;
— возможность определения дисомий.
— результаты исследования не исключают наличия сбалансированных перестроек: реципрокных транслокаций, инверсий, робертсоновских транслокаций;
— несбалансированных перестроек за границей разрешения: делеций и дупликаций ниже границы чувствительности, точечных мутаций;
— ограниченная возможность детекции полиплоидии и мозаицизма (от 30 %);
— результативность метода зависит от качества исходного материала.
NGS (Nеxt Generation Sequensing). Секвенирование нового поколения — техника определения нуклеотидной последовательности ДНК и РНК для получения формального описания ее структуры. Метод предоставляет исчерпывающую информацию о ДНК эмбриона в отношении заболеваний или генетических дефектов.
— возможность тестирования всех 24 хромосом одновременно с беспрецедентной точностью;
— увеличение точности для диагностики мозаичных анеуплоидий;
— можно выявить однородительскую дисомию (при анализе образцов родителей);
— можно определить гаплоидов и триплоидов;
— возможность выявления микро- и макроперестроек (от 10 п.н.);
— возможность одновременной диагностики моногенных заболеваний;
— в ПГД NGS для каждого образца назначен дополнительный молекулярный код, исключая возможность ошибки;
— низкая себестоимость расходных материалов.
— нельзя определить тетраплоидов;
— высокая стоимость оборудования.
Re alTime PCR. В данном методе используются общие принципы ПЦР, которые заключаются в удвоении участка ДНК, ограниченного праймерами, при помощи фермента ДНК- полимеразы. В итоге число фрагментов растет в геометрической прогрессии. Примерно 30–40 циклов и их число превышает несколько миллиардов, что позволяет обнаружить их различными методами.
Данная техника позволяет с высокой точностью выявить точечные мутации, количественное содержание ДНК в пробе, а также для определения уровня экспрессии генов. ПГД на определенные моногенные заболевания проводится в том случае, если в семье встречались случаи данного заболевания.
— возможность выполнения всех видов ПГД;
— позволяет детектировать уровень мозаицизма порядка 20–30 %;
— относительная дешевизна и возможность одновременного анализа гораздо большего количества образцов;
— скорость выполнения исследований;
— экономия затрат времени и труда.
— способен лишь обнаруживать специфические хромосомные изменения, не позволяя проводить детекцию нарушений, лежащих вне пределов, ограниченных праймерами;
— большая трудоемкость подготовительного этапа;
— отсутствие коммерческих наборов.
Выводы : ПГД развивается уже более 20 лет, за это время произошел значительный прогресс техник экстракорпорального оплодотворения, появились новые методы и оборудование, позволяющие расширить диапазон возможностей ВРТ. Благодаря этому ПГД превратилась из экспериментальной процедуры в действенную и самую раннюю форму преимплантационной диагностики. [2]
- Преимплантационная генетическая диагностика эмбрионов в программе экстракорпорального оплодотворения как способ профилактики наследственной патологии / И. Н. Фетисова, А. И. Малышкина, С. С. Семененко [и др.]. — Текст: непосредственный // Вестник ИвГМА. — 2018. — № 3. — С. 10–13.
- Логинова Ю. А. Современные возможности преимплантационной генетической диагностики / Ю. А. Логинова, О. Г. Чиряева. — Текст: непосредственный // журнал акушерства и женских болезней. — 2012. — № 3. — С. 75.
Основные термины (генерируются автоматически): NGS, FISH, PCR, генетическая диагностика, возможность, эмбрион, HLA, ограничение, полость матки.
Ключевые слова
эмбрион, преимплантационная генетическая диагностика (ПГД), вспомогательные репродуктивные технологии (ВРТ), генетические нарушения
преимплантационная генетическая диагностика (ПГД), вспомогательные репродуктивные технологии (ВРТ), генетические нарушения, эмбрион

Исследование проводится в рамках применения программы вспомогательной репродукции у пар, которые имеют высокий риск передачи генетических патологий или появления хромосомных нарушений у потомства. В результате в полость матки переносятся только эмбрионы, не имеющие аномалий в генетическом статусе.
ПГД – это реально работающий метод , позволяющий снизить риски спонтанных абортов и способствующий уменьшению неудачных попыток ЭКО.
История преимплантационной генетической диагностики (ПГД)
В норме генетический материал человека закодирован в 44 аутосомных хромосомах. Полный хромосомный набор представлен 22 соматическими парами и одной половой парой (у мальчиков ХУ, а у девочек ХХ). Однако нередки ситуации, когда количество хромосом может уменьшиться или, наоборот, увеличиться в результате сбоя в процессе деления клеток. Это приводит либо к рождению детей с хромосомными синдромами и множественными пороками развития, либо к подсадке нежизнеспособного эмбриона (такая беременность прерывается в первом триместре), либо к отсутствию имплантации. Чтобы снизить подобные неудачи ЭКО до этапа переноса эмбриона в маточную полость, было предложено проводить преимплантационную генетическую диагностику. Чуть позже выяснилось, что с помощью такой технологии можно также избежать передачи моногенного заболевания, носителем которого может оказаться один из родителей. Подсаживаться будут только те эмбрионы, в структуре которых нет этого аллеля.
Интересно отметить, что идея проведения подобного исследования зародилась еще до эры вспомогательных репродуктивных технологий у человека. Произошло это в 1967 году, когда ученые провели забор материала кроличьих эмбрионов, чтобы определить пол еще до подсадки. В репродуктивной медицине человека проведение генетического тестирования стало возможно с 90-х годов XX столетия, и связано с более широким распространением ЭКО и изобретением метода полимеразной цепной реакции.
Сначала в 1989 году перед имплантацией определили пол будущего ребенка. Для родителей это было важно, т.к. Х-хромосома одного из супругов содержала дефектный ген, и риск рождения больного ребенка был высок. В 1990 году уже удалось идентифицировать эмбрионы с моногенными нарушениями, в частности это касалось муковисцидоза. Позже ПГД шагнула еще дальше, предоставив возможность лечить больного брата или сестру с помощью пересадки костного мозга, свободного от мутации и полностью совместимого по системе HLA.
Как передаются по наследству генетические заболевания
Генетические заболевания, в отличие от хромосомных, связаны с изменением структуры генетического кода, когда один или несколько его участков являются патологическими. Подобные нарушения могут затрагивать как соматические хромосомы, так и половые. Стоит отметить, что мутантный аллель может быть доминирующим, то есть его влияние в паре всегда превалирует, или рецессивным, то есть патологический признак не проявится, если будет здоровый доминант. Этим определяются типы наследования генетических заболеваний. Хромосомный набор в норме всегда парный. Поэтому возможны следующие варианты:
- пара определенного генетического не имеет никаких мутаций – ребенок здоров;
- пара содержит один мутантный аллель, но он рецессивный, а доминантный аллель здоровый – заболевания нет, но ребенок является носителем патологии (может передавать ее потомству);
- пара содержит 2 мутантных аллеля и оба рецессивные – заболевание проявится;
- пара содержит 1 мутантный аллель доминантного типа – заболевание проявится, даже если рецессивный аллель здоровый;
- пара содержит 2 мутантных аллеля доминантного типа – генетическая патология проявится.
Типы наследования могут быть следующими:
- аутосомно-доминантные;
- аутосомно-рецессивные;
- Х-сцепленные доминантные;
- Х-сцепленные рецессивные;
- У-сцепленные (голандрические) – на У-хромосоме в целом мало генов, поэтому такие заболевания редкие и практически не передаются потомству, т.к. в большинстве случаев такие мужчины стерильны (гены У-хромосомы отвечают за сперматогенез и развитие яичек);
- митохондриальные – наследуются только по материнской линии (если мать больна, то будут больны все дети). Для выявления митохондриальных болезней обследование должна пройти женщина до зачатия с помощью секвенирования митохондриальной ДНК. Это выходит за рамки ПГД.
Отнесение болезни к той или иной группе позволяет генетику предположить, с какой вероятностью она проявится у потомства и составить оптимальный репродуктивный план для пары.
Доминантные заболевания
В случае доминантного наследования патологический признак превалирует над здоровым. Поэтому при его наличии (хоть в одной, хоть в 2 хромосомах) ребенок всегда болен. Здоровые дети не являются носителями мутантного аллеля.
По аутосомно-доминантному типу наследуются болезнь Марфана (поражение соединительной ткани), боковой амиотрофический склероз (поражение структур спинного мозга), нейрофиброматоз (из нервной ткани образуются опухоли), семейная гиперхолестеринемия и др.
Рецессивные заболевания
При рецессивном типе наследования заболевание проявляется только в том случае, если патологический участок присутствует одновременно в 2 хромосомах из пары. Здоровые дети от больных родителей могут быть как носителями патологического гена (одна из хромосом имеет повреждение), так и не иметь его в своем наборе (2 хромосомы в паре абсолютно нормальны).
Рецессивный тип передачи наследственного заболевания часто встречается при близкородственных браках. Основными представителями этой группы являются анемия Фанкони, лизосомные болезни накопления, фенилкетонурия, синдром Жильбера, наследственная тугоухость и другие.
Для генетики справедливо правило – если у двух здоровых родителей ребенок болен, то такой тип наследования считается рецессивным.
Х-сцепленные заболевания
Чаще всего в популяции встречаются Х-сцепленные заболевания, намного реже – У-сцепленные. В последнем случае патологический признак выявляется только у мужчин и передается по мужской линии всем сыновьям.
Х-сцепленное наследование может быть доминантным и рецессивным.
- В случае доминантного Х-сцепленного наследования от матери пораженная Х-хромосома передается как сыновьям, так и дочерям. Отцы с мутантной Х-хромосомой передают ее только дочерям (сыновья здоровы, т.к. нормальную Х-хромосому наследуют от матери). По таком механизму передается пигментный дерматоз, гипоплазия зубной эмали, устойчивый к витамину Д рахит.
- Х-сцепленное рецессивное наследование приводит к тому, что у сына проявляется заболевание. Если же передается дочери больная Х-хромосома, то ребенок, как правило, здоров (болезнь развивается только, если и вторая хромосома от отца тоже повреждена). По такому типу передаются гемофилия, глазной альбинизм, куриная слепота, дальтонизм, миодистрофия Дюшена.
Возможные преимущества генетического анализа
Что значит ПГД эмбриона? Это высокотехнологичное исследование помогает решать сразу несколько важных задач, связанных с улучшением репродуктивных и медико-генетических исходов беременности. Благодаря генетическому анализу, удается достигать следующих целей:
- уменьшать число неэффективных переносов;
- уменьшать вероятность спонтанного прерывания беременности;
- повышать шансы успешной беременности у женщин из групп повышенного генетического риска;
- предотвращать передачу по наследству генетически обусловленных заболеваний;
- уменьшить риск хромосомной патологии у новорожденных;
- снизить риск резус-конфликта.
В результате проведения ПГД снижается риск рождения больного ребенка, риск невынашивания и многоплодия, увеличиваются шансы на успешную имплантацию (в среднем на 10%) и на благополучное рождение ребенка (примерно на 15-20%).
Что дает ПГД эмбриона еще? Если брат или сестра от одних родителей имеют заболевание, связанное с мутацией, требующее пересадки костного мозга, и в базе данных подобрать совместимого донора не удается, то на помощь приходит ЭКО с преимплантационным скринингом. Что показывает ПГД в этом случае? Благодаря этому исследованию удается подобрать эмбрион, который не только не содержит мутации, но и полностью совместим по тканевым антигенам. Такое направление в терапии применяется в США и Европе уже более 15 лет, а в России с 2016 года, когда девочке с синдромом Шахванда-Даймонда пересадили здоровые стволовые клетки от ее родного брата, зачатого путем ЭКО.
Показания к преимплантационной генетической диагностике
Метод ПГД в первую очередь предназначен для выявления количественных нарушений в хромосомном наборе эмбриона, которые не являются летальными, но могут приводить к рождению ребенка с пороками развития. Это касается 13,18, 21-й пары аутосом и половых хромосом – Х- и У.
Стоит отметить, что риск генетических нарушений у плода возрастает с увеличением возраста матери. Так, Всемирная организация здравоохранения приводит такие данные статистики. Вероятность рождения ребенка с трисомией (состояние, когда вместо 2 одинаковых хромосом, имеется 3) у женщины в возрасте до 30 лет составляет 1 случай на 385 беременностей, в возрасте 40 лет – 1 случай на 63 беременности и возрасте 45+ - 1 случай на 19 беременностей. А женщины, которые вступают в программу ЭКО, зачастую перешагнули рубеж в 35-40 лет.
К тому же, некоторые хромосомные аномалии являются летальными, то есть несовместимыми с жизнью. Клинически это проявляется самопроизвольными выкидышами на ранних сроках беременности. Частота их по причине хромосомных аномалий в первом триместре доходит до 60%. Поэтому чтобы вам подсадили наиболее качественный эмбрион (без генетических поломок), и проводится ПГД.
Что показывает ПГД эмбриона еще? Это исследование позволяет также идентифицировать носительство конкретных мутантных аллелей и выбрать для подсадки здоровые эмбрионы, которые лишены патологического гена.
Таким образом, ПГД работает и в отношении выявления хромосомных синдромов, и в отношении генетических заболеваний.
Кому показано ПГД
Европейское общество репродуктологов и эмбриологов рекомендует проводить преимплантационный тест при наличии следующих показаний:
- у пары в анамнезе 1 или несколько беременностей, которые самостоятельно прервались;
- 2 и более попытки искусственного оплодотворения, которые закончились неудачей;
- возрастная категория женщины 35+;
- наличие подтвержденного мужского фактора бесплодия;
- наличие беременностей с объективно подтвержденной хромосомной патологией плода;
- мужчина и/или женщина из пары – носители структурных хромосомных перестроек (выявлено с помощью соответствующего генетического анализа).
Помимо этого ПГД эмбриона при ЭКО рекомендуется женщинам со сниженным овариальным резервом. Уменьшение численности фолликулов в яичниках практически всегда ассоциировано с плохим качеством яйцеклеток, в которых увеличивается риск спонтанных мутаций. Поэтому чтобы подсадить в полость матки здоровый эмбрион, проводится преимплантационный скрининг. Это же исследование показано также парам, у которых в анамнезе были случаи пузырного заноса, неразвивающейся и биохимической (уровень ХГЧ был повышен, но дальше гестационный процесс прервался на очень раннем сроке) беременности.
Состояния, диагностируемые с помощью ПГД
Анализ ПГД эмбриона – что это? Данное исследование позволяет провести генетическое изучение эмбрионов на нулевые сутки, 3-и или 5-ые. С помощью этого теста выявляют различные хромосомные аномалии еще до подсадки эмбриона в полость матки для того, чтобы предотвратить рождение ребенка с генетическими отклонениями и наследственными заболеваниями.
ПГД эмбриона позволяет объективно диагностировать носительство конкретных генетических патологий. В свою очередь преимплантационный генетический скрининг в медицине репродукции направлен на выявление общих изменений количества хромосом (увеличение или уменьшение).
Условно все нарушения в строении генетического аппарата будущего ребенка можно разделить на 3 категории:
- хромосомные изменения;
- генетические мутации, которые затрагивают один или несколько генов;
- спонтанное возникновение мутаций в половых клетках (родители здоровы, а проблема появляется впервые у ребенка).
Заболевания, сцепленные с полом
Практически все заболевания, которые сцеплены с полом, наследуются через патологически измененную Х-хромосому. Поэтому женщины могут быть как больными, так и здоровыми носителями. Мужчины всегда проявляют заболевание. Патологии, сцепленные с полом, возникают при наличии мутаций в половых хромосомах родительских организмов и связаны с нарушением генетических процессов.
Наиболее распространенными патологиями этой группы являются:
- гемофилия;
- дальтонизм;
- фосфат-диабет;
- мышечная дистрофия Дюшена, Леша-Найхана и другие.
Одиночные дефекты гена
Одиночные дефекты гена могут приводить к развитию моногенных заболеваний у потомства. Благодаря ПГД удается подсадить эмбрион, который не имеет соответствующей мутации. Так наследуются:
- муковисцидоз – заболевание, при котором образуется густой секрет, приводящий к закупорке выводных протоков желез (чаще поражаются легкие, бронхи, поджелудочная железа);
- несиндромальная нейросенсорная тугоухость – снижение слуха вследствие повреждения нервных рецепторов внутреннего уха;
- наследственные миопатии – слабость мышц, связанная с нарушением их развития или нарушением иннервации, приводящая к обездвиженности.
Хромосомные расстройства
Хромосомные заболевания не зависят от генетического аппарата родителей, а возникают при нарушениях расхождения хромосом в процессе мейотического деления.
Наиболее частые хромосомные заболевания, связанные с изменением численности хромосом, это:
Кандидаты для биопсии эмбриона и ПГД
Биопсия эмбриона и преимплантационное генетическое тестирование проводится в тех ситуациях, когда риск хромосомных и генных нарушений достаточно высок. В первую очередь это определяется возрастом родителей. Задуматься о возможных генетических поломках стоит женщинам старше 35 лет и мужчинам старше 40 лет. Помимо этого есть определенные клинические ситуации, когда повышена вероятность генетических нарушений. Последние могут быть причиной привычного невынашивания беременности, многократных неудачных попыток ЭКО. ПГД рекомендуется и в тех случаях, когда имеется мужское бесплодие, связанное с хромосомными аномалиями, или же кто-то из потенциальных родителей имеет доказанное носительство хромосомных перестроек, транслокаций, инверсий и других хромосомных патологий.
Пары с повторными неудачами ЭКО
Повторные неудачи ЭКО нередко связаны с наличием генетических аномалий у эмбриона/плода. Преимплантационная диагностика позволяет отбирать только здоровые эмбрионы. Это в разы повышает результативность цикла ЭКО, снижает вероятность рождения ребенка с хромосомными аномалиями, а также риск спонтанных прерываний беременности.
Используемые методы
Как делают ПГД эмбриона? Состояние будущего плода изучают в самые ранние сроки его развития. Материалом для исследования могут служить полярные тельца, бластомеры и клетки трофэктодермы. Оптимальным вариантом является исследование трофэктодермы, т.к. это самый малотравматичный вариант биопсии, а биопсийный материал, который получают на 5-е сутки, наиболее информативен. Генетику удается получить большее количество эмбриональных клеток, а значит, и большее количество копий ДНК. В рамках тестах изучается последовательность нуклеиновых кислот.
Раньше изучались единичные хромосомы. Как правило, те, в которых чаще всего встречаются проблемы. На сегодня микроматричная сравнительная геномная гибридизация позволяет исследовать все пары хромосом (как соматические, так и половые).
Читайте также:

