Полиморфизм белков биохимия реферат
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Министерство образования и науки Российской Федерации
федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Институт Естествознания и Экономики
ПО ДИСЦИПЛИНЕ
БИОЛОГИЧЕСКАЯ ХИМИЯ
Коллаген – главный белок соединительной ткани
Направление подготовки: 050100 Педагогическое образование
Профиль подготовки: Биология
Форма обучения: очная
Доцент кафедры химия
Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Коллаген - основной компонент соединительной ткани и самый распространённый белок у млекопитающих, составляющий от 25 % до 35 % белков во всём теле, т.е. 6% массы тела. Название "коллаген" объединяет семейство близкородственных фибриллярных белков, которые являются основным белковым элементом кожи, костей, сухожилий, хряща, кровеносных сосудов, зубов. В разных тканях преобладают разные типы коллагена, а это, в свою очередь, определяется той ролью, которую коллаген играет в конкретном органе или ткани.
Молекула коллагена (тропоколлагена) построена из трех пептидных цепей, каждая из которых содержит около 1000 аминокислотных остатков. Необычен аминокислотный состав коллагена: каждая третья аминокислота – это глицин, 20 % составляют остатки пролина и гидроксипролина, 10 % - аланина, остальные 40 % представлены всеми другими аминокислотами. Коллаген – единственный белок, в котором содержится гидроксипролин. Эта аминокислота получается путем гидроксилирования части остатков пролина уже после образования пептидных цепей.
Коллаген – сложный белок, гликопротеин: содержит моносахаридные (галактозильные) и дисахаридные (галактозилглюкозильные) остатки, соединенные с гидроксильными группами некоторых остатков оксилизина.
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянную структуру на молекулярном уровне, было представлено в середине 30-х годов прошлого века. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран работали над строением мономера коллагена.
Коллаген синтезируют и поставляют в межклеточный матрикс почти все клетки (фибробласты, хондробласты, остеобласты, одонтобласты, цементобласты, кератобласты и др.). Синтез и созревание коллагена является сложным многоэтапным процессом, который начинается в клетке и заканчивается в межклеточном матриксе. Нарушения синтеза коллагена, обусловленные мутацией в генах, а также в процессе трансляции и пост- трансляционной модификации сопровождаются появлением дефектных коллагенов. Поскольку около 50% всех коллагеновых белков содержатся в тканях скелета, а остальные 40% в дерме и 10% в строме внутренних органов, то нарушения синтеза коллагена сопровождаются патологией как костно-суставной системы, так и внутренних органов.
Синтез коллагена включает два этапа. На внутриклеточном этапе происходит трансляция и посттрансляционная модификация полипептидных цепей, и на внеклеточном - модификации белка, завершающаяся образованием коллагеновых волокон (рис.1).
Внутриклеточный этап синтеза коллагена. Пептидные α-цепи коллагена синтезируются на полирибосомах, связанных с мембранами эндоплазматической сети. Её синтезированные пептидные цепи в цистернах подвергаются посттрансляционной модификации, которая включает:
• удаление сигнального пептида проколлагеновой цепи при участии специфической протеиназы;
• гидроксилирование остатков пролина и лизина, которое начинается в период трансляции полипептидной цепи вплоть до её отделения от рибосом.
Реакции гидроксилирования катализируют оксигеназы. В реакции гидроксилирования используются О2 и 2-оксоглутарат, а в качестве кофактора участвует аскорбиновая кислота. Гидроксилазы пролина и лизина в активном центре содержат Fе2+, а аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту, необходима для сохранения атома железа в ферроформе (рис.2). В реакциях гидроксилирования один атом кислорода присоединяется к четвёртому атому углерода в остатке пролина, а второй атом кислорода включается в янтарную кислоту, которая образуется при декарбоксилировании 2-оксоглутарата (рис.3).
Наряду с гидроксилированием пролина происходит гидроксилирование остатков лизина с образованием 5-гидроксилизина. В дальнейшем гидроксилированные остатки лизина подвергаются гликозилированию(рис.4).
При участии гликозилтрансфераз образуются ковалентные О-гликозидные связи между 5-ОН группой гидроксилизина и остатком галактозы или дисахаридом галактозилглюкозой. К амидной группе аспарагина присоединяются молекулы N-ацетилглюкозамина или маннозы. Одновременно с гидроксилированием пролина формируется стабильная трёхспиральная структура коллагена. Из эндоплазматической сети молекулы проколлагена перемещаются в аппарат Гольджи, где они включаются в секреторные пузырьки и в их составе секретируются во внеклеточное пространство (рис.5).
Внеклеточный этап - модификация молекул проколлагена. В межклеточном пространстве при участии протеолитических ферментов от молекулы проколлагена отщепляются N- и С-концевые пептиды и освобождается тройная спираль коллагена (тропоколлагена). Далее происходит процесс самосборки коллагеновых фибрилл, фиксированных межмолекулярными ковалентными связями (сшивками). В формировании этих связей участвуют остатки лизина и 5-гидроксилизина и их альдегидные производные, которые образуются вследствие окислительного дезаминирования. Окислительное дезаминирование лизина и 5-гидроксилизина происходит с участием лизилоксидазы. Особенностью этого фермента является присутствие Cu2+ в активном центре. Молекулы лизилоксидазы синтезируются в клетке в виде проферментов и после связывания с ионами Cu2+ упаковываются в везикулы, которые покидают клетку. На клеточной поверхности молекула пролизилоксидазы подвергается ограниченному протеолизу и в сфор- мировавшемся активном центре при участии ионов Cu2+ происходит окисление остатка тирозина до тирозинхинона. Образовавшаяся в активном центре хиноидная структура связывает остатки лизина в молекуле проколлагена с образованием фермент-субстратного комплекса (рис.6).
На следующем этапе аллизин и 5-гидроксиаллизин конденсируются вместе с лизиловыми и гидроксилизиловыми остатками; формируются внутри- и межмолекулярные поперечные связи. В реакции конденсации аллизина с остатком лизина другой цепи образуется основание Шиффа. В случае альдольной конденсации двух остатков аллизина образуются альдольные межмолекулярные связи (лизиннорлейцин) (рис.7).
Альдольная конденсация характерна для коллагена костной ткани и дентина, а основания Шиффа наиболее часто встречаются в коллагенах сухожилий.
Около 25% молекул тропоколлагена распадается, не образуя фибрилл. Получившиеся фрагменты выполняют сигнальные функции и стимулируют коллагеногенез. Пространственная организация фибрилл завершается при участии фибронектина, протеогликанов и коллагенов, ассоциированных с фибриллами.
Коллаген - ярко выраженный полиморфный белок. В настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. Вариантов α-цепей, образующих тройную спираль, гораздо больше 19 (около 30). Для обозначения каждого вида коллагена пользуются определённой формулой, в которой тип коллагена записывается римской цифрой в скобках, а для обозначения α-цепей используют арабские цифры: например коллагены II и III типа образованы идентичными α-цепями, их формулы, соответственно [α1(II)]3 и [α1(III)]3; коллагены I и IV типов являются гетеротримерами и образуются обычно двумя разными типами α-цепей, их формулы, соответственно [α1(I)]2α2(I) и [α1(IV)]2α2(IV). Индекс за скобкой обозначает количество идентичных α-цепей (табл. 1).
Гены коллагена называются соответственно типам коллагена и записываются арабскими цифрами, например COL1 - ген коллагена I типа, COL2 - ген коллагена II типа, COL7 - ген коллагена VII типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид a-цепи). Например, COL1A1 и COL1A2 кодируют, соответственно, α1 и α2-цепи коллагена I типа.
Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных.
Выделяют 19 типов коллагена, которые подразделяют на несколько классов в зависимости от того, какие структуры они могут образовывать.
95% всего коллагена в организме человека составляют коллагены I, II и III типов, которые образуют очень прочные фибриллы. Значительное содержание именно этих типов коллагена объясняется тем, что они являются основными структурными компонентами органов и тканей, которые испытывают постоянную или периодическую механическую нагрузку (кости, сухожилия, хрящи, межпозвоночные диски, кровеносные сосуды), а также участвуют в образовании стромы паренхиматозных органов. Поэтому коллагены I, II и III типов часто называют интерстициальными. К классу фибриллообразующих относят также минорные коллагены V и XI типов (рис.8).
Этот класс объединяет коллагены, которые выполняют очень важную функцию: они ограничивают размер фибрилл, образуемых интерстициальными коллагенами (прежде всего, I и II типов), и участвуют в организации межклеточного матрикса в костях, коже, хрящах, сухожилиях. К этим коллагенам относят коллагены IX, XII, XIV и XVI типов. Коллагены этого класса сами фибрилл не формируют, но непосредственно связаны с фибриллами, которые образуют интерстициальные коллагены.
К этому классу относят коллагены IV, VIII, X типов. Особенности строения и функционирования таких белков можно рассмотреть на примере наиболее изученных к настоящему времени коллагенов IV и VIII типов.
Коллаген IV типа является ключевым структурным компонентом базальных мембран, которые представляют собой особую форму межклеточного матрикса. Его секретируют различные типы клеток: эпителиальные, эндотелиальные, мышечные, нервные, жировые. Особенностью коллагена IV типа является то, что повторяющиеся спирализованные участки с последовательностью (Гли-х-у)nчасто прерываются короткими неспиральными сегментами. Это, вероятно, увеличивает гибкость коллагена IV типа и способствует образованию на его основе сетчатых структур (рис.9).
К этому классу относят коллаген VI типа, который является короткоцепочечным белком. Он образует микрофибриллы, которые располагаются между крупными фибриллами интерстициальных коллагенов. Этот коллаген широко представлен в хрящевом матриксе, но больше всего его содержится в межпозвоночных дисках: в nucleus pulposus он составляет -20% общего коллагена. Две молекулы этого коллагена соединяются антипараллельно с образованием димера. Из димеров образуются тетрамеры, которые секретируются из клетки, и вне клетки связываются "конец в конец" с образованием микрофибрилл.
Функции коллагена VI типа пока полностью не ясны, хотя известно, что его микрофибриллы могут связываться со многими компонентами межклеточного матрикса: фибриллами интерстициальных коллагенов, гиалуроновой кислотой, протеогликанами. Молекула этого коллагена содержит многочисленные последовательности Арг-Гли-Асп (RGD), поэтому возможно его участие в клеточной адгезии через присоединение к мембранным адгезивным молекулам, например интегринам α1β1 и α2β1 (рис.10).
К этому классу относят коллагены VII и XVII типов, которые называют также коллагенами, связанными с эпителием, так как они обычно находятся в местах соединения эпителия с субэпителиальными слоями.
Коллаген VII типа - основной структурный компонент "заякоренных" фибрилл. Каждая молекула этого белка содержит два неколлагеновых домена (НК1 - у С-конца, НК2 - у N-конца) и один коллагеновый домен между ними. Из мономеров образуются димеры, при этом молекулы соединяются в области НК2-доменов антипараллельно по отношению друг к другу. Затем НК2домены отщепляются, и димеры соединяются между собой "бок о бок" с образованием фибрилл (рис.11).
Эти фибриллы играют важную роль в присоединении эпидермиса к дерме, так как одним концом они могут присоединяться к lamina densa, на которой лежит кожный эпителий, а другой их конец проникает в более глубокие субэпидермальные слои кожи и связывается там со структурами, называемыми "якорные диски".
Коллаген XVII типа представляет собой трансмембранный белок и обычно находится в гемидесмосомах эпидермиса. Предполагают, что этот коллаген взаимодействует с другими молекулами гемидесмосом и таким образом участвует в процессе присоединения эпидермиса к дерме.
Как и любой белок, коллаген функционирует в организме определённое время. Его относят к медленно обменивающимся белкам; Т1/2 составляет недели или месяцы. Разрушение коллагеновых волокон осуществляется активными формами кислорода и/или ферментативно (гидролитически).
Нативный коллаген не гидролизуется обычными пептидгидролазами. Основной фермент его катаболизма - коллагеназа, которая расщепляет пептидные связи в определённых участках спирализованных областей коллагена. Известны 2 типа коллагеназ:
1.Тканевая коллагеназа присутствует у человека в различных органах и тканях. В норме она синтезируется клетками соединительной ткани, прежде всего, фибробластами и макрофагами. Тканевая коллагеназа - металлозависимый фермент, который содержит Zn2+ в активном центре. В настоящее время известно 4 изоформы этого фермента. Активность коллагеназы зависит от соотношения в межклеточном матриксе её активаторов и ингибиторов. Среди активаторов особую роль играют плазмин, калликреин и катепсин В. Тканевая коллагеназа обладает высокой специфичностью, она перерезает тройную спираль коллагена в определённом месте, примерно на 1/4 расстояния от С-конца, между остатками глицина и лейцина (или изолейцина) (рис.12).
Образующиеся фрагменты коллагена растворимы в воде, при температуре тела они спонтанно денатурируются и становятся доступными для действия других протеолитических ферментов. Нарушение катаболизма коллагена ведёт к фиброзу органов и тканей (в основном печени и лёгких). А усиление распада коллагена происходит при аутоиммунных заболеваниях (ревматоидном артрите и системной красной волчанке) в результате избыточного синтеза коллагеназы при иммунном ответе.
2.Бактериальная коллагеназа синтезируется некоторыми микроорганизмами. Например,Clostridium histolyticum (возбудитель газовой гангрены) выделяет коллагеназу, расщепляющую пептидную цепь коллагена более чем в 200 местах. Этот фермент гидролизует следующую связь -X-Гли-Про-У- между звеньями X и Гли.
Таким образом разрушаются соединительнотканные барьеры в организме человека, что обеспечивает проникновение (или инвазию) этого микроорганизма и способствует возникновению и развитию газовой гангрены. Сам возбудитель не содержит коллагена и поэтому не подвержен действию коллагеназы.
У молодых людей обмен коллагена протекает интенсивно, с возрастом (и особенно в старости) заметно снижается, так как у пожилых и старых людей увеличивается количество поперечных сшивок, что затрудняет доступность коллагена для действия коллагеназы. Поэтому, если у молодых людей в возрасте 10-20 лет содержание гидроксипролина в моче может достигать 200 мг/сут, то с возрастом экскреция гидроксипролина снижается до 15-20 мг/сут.
В некоторых ситуациях синтез коллагена заметно увеличивается. Например, фибробласты мигрируют в заживающую рану и начинают активно синтезировать в этой области основные компоненты межклеточного матрикса. Результат этих процессов - образование на месте раны соединительнотканного рубца, содержащего большое количество хаотично расположенных фибрилл коллагена. Сходным образом происходит замещение погибающих клеток соединительной тканью в печени при циррозе, в стенках артерий при атеросклерозе, в мышцах при их дистрофии.
Коллаген является основным белком соединительной ткани млекопитающих и составляет около 30% от общей массы белков организма. Существование разновидностей волокнистой соединительной ткани: рыхлой и плотной (оформленной и неоформленной) во многом объясняется наличием всевозможных комбинаций различных типов коллагена, молекулы которых кодируются почти 20 генами.
Коллаген входит в состав косметических средств, используемых для:
1)образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
2)пролонгирования действия экстрактов, масел и др. в составе косметических композиций;
3)придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
1. Бурджанадзе Т.В. Термодинамическое обоснование водно-мостиковой структуры коллагена Биофизика, 1992;37(2):231-237.
2. Вавилова Т.П. Биохимия тканей и жидкостей полостей рта: учебное пособие / - 2-е изд., испр. и доп. - 2008. - 208 с. : ил.
3. Михайлов А.Н. Коллаген кожного покрова и основы его переработки. М., 1971;527.
4.Николаев А.Я. Биологическая химия.- 3-е изд., перераб. и доп.-М.: Медицинское информационное агенство.-2004.-566 с.: ил.
5. Павлова В.Н, Копьева Т.П, Слуцкий Л.И, Павлов Г.Г. Хрящ. М., 1988:325.
6. Степанов B.M. Молекулярная биология. М., 1996; 334.
7. Церетели Г.И. Тепловая денатурация коллагена в растворе и фибриллах. Биофизика 1982;27(5):780-784.
Белки играют исключительно важную роль в живой природе. Жизнь немыслима без различных по строению и функциям белков. Белки - это биополимеры сложного строения, макромолекулы (протеины) которых, состоят из остатков аминокислот, соединенных между собой амидной (пептидной) связью. Кроме длинных полимерных цепей, построенных из остатков аминокислот (полипептидных цепей), в макромолекулу белка могут входить также остатки или молекулы других органических соединений.
Содержание работы
Введение . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
Состав и свойства белков . . . . . . . . . . . . . . . . . . . . . . . 5
Классификация белков . . . . . . . . . . . . . . . . . . . . . . . . . 6
Полиморфизм белков . . . . . . . . . . . . . . . . . . . . . . . . . . 6
Гемоглобины человека . . . . . . . . . . . . . . . . . . . . . . . . . 9
Группы крови . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9
Заключение . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .11
Список использованной литературы . . . . . . . . . . . . . . . . . 12
Файлы: 1 файл
Полиморфизм белков в норме и патологии.docx
- Состав и свойства белков . . . . . . . . . . . . . . . . . . . . . . . 5
- Классификация белков . . . . . . . . . . . . . . . . . . . . . . . . . 6
- Полиморфизм белков . . . . . . . . . . . . . . . . . . . . . . . . . . 6
- Гемоглобины человека . . . . . . . . . . . . . . . . . . . . . . . . . 9
- Группы крови . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9
Список использованной литературы . . . . . . . . . . . . . . . . . 12
Белки играют исключительно важную роль в живой природе. Жизнь немыслима без различных по строению и функциям белков. Белки - это биополимеры сложного строения, макромолекулы (протеины) которых, состоят из остатков аминокислот, соединенных между собой амидной (пептидной) связью. Кроме длинных полимерных цепей, построенных из остатков аминокислот (полипептидных цепей), в макромолекулу белка могут входить также остатки или молекулы других органических соединений. На одном кольце каждой пептидной цепи имеется свободная или ацилированная аминогруппа, на другом - свободная или амидированная карбоксильная группа.
Конец цепи с аминогруппой называется М-концом, конец цепи с карбоксильной группой — С-концом пептидной цепи. Между СО-группой одной пептидной группировки и NH-группой другой пептидной группировки могут легко образовываться водородные связи.
Группы, входящие в состав радикала R аминокислот, могут вступать во взаимодействие друг с другом, с посторонними веществами и с соседними белковыми и иными молекулами, образуя сложные и разнообразные структуры.
В макромолекулу белка входит одна или несколько пептидных цепей, связанных друг с другом поперечными химическими связями, чаще всего через серу (дисульфидные мостики, образуемые остатками цистеина). Химическую структуру пептидных цепей принято называть первичной структурой белка или секвенцией.
Для построения пространственной структуры белка пептидные цепи должны принять определенную, свойственную данному белку конфигурацию, которая закрепляется водородными связями, возникающими между пептидными группировками отдельных участков молекулярной цепи. По мере образования водородных связей пептидные цепи закручиваются в спирали, стремясь к образованию максимального числа водородных связей и соответственно к энергетически наиболее выгодной конфигурации.
В зависимости от пространственной структуры все белки делятся на два больших класса: фибриллярные (они используются природой как структурный материал) и глобулярные (ферменты, антитела, некоторые гормоны и др.).
Полипептидные цепи фибриллярных белков имеют форму спирали, которая закреплена расположенными вдоль цепи внутримолекулярными водородными связями. В волокнах фибриллярных белков закрученные пептидные цепи расположены параллельно оси волокна, они как бы ориентированы относительно друг друга, располагаются рядом, образуя нитевидные структуры, и имеют высокую степень асимметрии. Фибриллярные белки плохо растворимы или совсем нерастворимы в воде. При растворении в воде они образуют растворы высокой вязкости. К фибриллярным белкам относятся белки, входящие в состав тканей и покровных образований. Это миозин—белок мышечных тканей; коллаген, являющийся основой седиментационных тканей и кожных покровов; кератин, входящий в состав волос, роговых покровов, шерсти и перьев. К этому же классу белков относится белок натурального шелка - фиброин, вязкая сиропообразная жидкость, затвердевающая на воздухе в прочную нерастворимую нить. Этот белок имеет вытянутые полипептидные цепи, соединенные друг с другом межмолекулярными водородными связями, что и определяет, по-видимому, высокую механическую прочность натурального шелка.
Пептидные цепи глобулярных белков сильно изогнуты, свернуты и часто имеют форму жестких шариков—глобул. Молекулы глобулярных белков обладают низкой степенью асимметрии, они хорошо растворимы в воде, причем вязкость их растворов невелика. Это прежде всего белки крови—гемоглобин, альбумин, глобулин и др. Следует отметить условность деления белков на фибриллярные и глобулярные, так как существует большое число белков с промежуточной структурой.
Свойства белка могут сильно изменяться при замене одной аминокислоты другой. Это объясняется изменением конфигураций пептидных цепей и условий образования пространственной структуры белка, которая в конечном счете определяет его функции в организме.
1.Состав и свойства белков
Число аминокислотных остатков, входящих в молекулы отдельных белков, весьма различно: в инсулине 51, в миоглобине - около 140. Поэтому и относительная молекулярная масса белков колеблется в очень широких пределах - от 10 тысяч до многих миллионов. На основе определения относительной молекулярной массы и элементарного анализа установлена эмпирическая формула белковой молекулы - гемоглобина крови (C738H1166O208S2Fe)4 Меньшая молекулярная масса может быть у простейших ферментов и некоторых гормонов белковой природы. Например, молекулярная масса гормона инсулина около 6500, а белка вируса гриппа — 320 000 000.
Вещества белковой природы (состоящие из остатков аминокислот, соединенных между собой пептидной связью), имеющие относительно меньшую молекулярную массу и меньшую степень пространственной организации макромолекулы, называются полипептидами.
Провести резкую границу между белками и полипептидами трудно. В большинстве случаев белки отличаются от других природных полимеров (каучука, крахмала, целлюлозы), тем, что чистый индивидуальный белок содержит только молекулы одинакового строения и массы. Исключением является, например, желатина, в составе которой входят макромолекулы с молекулярной массой 12 000— 70000.
Строением белков объясняются их весьма разнообразные свойства. Они имеют разную растворимость: некоторые растворяются в воде, другие — в разбавленных растворах нейтральных солей, а некоторые совсем не обладают свойством растворимости (например, белки покровных тканей). При растворении белков в воде образуется своеобразная молекулярно-дисперсная система (раствор высокомолекулярного вещества). Некоторые белки могут быть выделены в виде кристаллов (белок куриного яйца, гемоглобина крови).
Белки играют важнейшую роль в жизнедеятельности всех организмов. При пищеварении белковые молекулы перевариваются до аминокислот, которые, будучи хорошо растворимы в водной среде, проникают в кровь и поступают во все ткани и клетки организма. Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть—на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал. Т.е. белки выполняют каталитические (ферменты), регуляторные (гормоны), транспортные (гемоглобин, церулоплазмин и др.), защитные (антитела, тромбин и др.) функции.
Белки — важнейшие компоненты пищи человека и корма животных. Совокупность непрерывно протекающих химических превращений белков занимает ведущее место в обмене веществ организмов. Скорость обновления белков у живых организмов зависит от содержания белков в пище, а также его биологической ценности, которая определяется наличием и соотношением незаменимых аминокислот. Белки растений беднее белков животного происхождения по содержанию незаменимых аминокислот, особенно лизина, метионина, триптофана. Белки сои и картофеля по аминокислотному составу наиболее близки белкам животных. Отсутствие в корме незаменимых аминокислот приходит к тяжёлым нарушениям азотистого обмена. Поэтому селекция зерновых культур направлена, в частности, и на повышение качества белкового состава зерна.
2 Классификация белков
Белки подразделяются на две большие группы: простые белки, или протеины, и сложные белки, или протеиды. При гидролизе протеинов в кислом водном растворе получают только а-аминокислоты. Гидролиз протеидов дает кроме аминокислот и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.); это соединения белковых веществ с небелковыми.
Протеины. Альбумины хорошо растворяются в воде. Встречаются в молоке, яичном белке и крови.
Глобулины в воде не растворяются, но растворимы в разбавленных растворах солей. К глобулинам принадлежат глобулины крови и мышечный белок миозин.
Глутелины растворяются только в разбавленных растворах щелочей. Встречаются в растениях.
Склеропротеины — нерастворимые белки. К склеропротеинам относятся кератины, белок кожи и соединительных тканей коллаген, белок натурального шелка фиброин.
Протеиды построены из протеинов, соединенных с молекулами другого типа (простетическими группами).
Фосфопротеиды содержат молекулы фосфорной кислоты, связанные в виде сложного эфира у гидроксильной группы аминокислоты серина. К ним относится вителлин—белок, содержащийся в яичном желтке, белок молока казеин.
Гликопротеиды содержат остатки углеводов. Они входят в состав хрящей, рогов, слюны.
Хромопротеиды содержат молекулу окрашенного вещества, обычно типа порфина. Самым важным хромопротеидом является гемоглобин — переносчик кислорода, окрашивающий красные кровяные тельца.
Нуклеопротеиды — протеины, связанные с нуклеиновыми кислотами. Они представляют собой очень важные с биологической точки зрения белки—составные части клеточных ядер. Нуклеопротеиды являются важнейшей составной частью вирусов — возбудителей многих болезней.
3 Полиморфизм белков
Явление полиморфизма широко распространено в природе и первоначально было открыто в отношении ряда морфологических признаков организма (пигментация глаз у дрозофилы, окраска шерстного покрова у кроликов и пушных зверей, масти у лошадей и т.д.).
В последнее время, благодаря усовершенствованию лабораторных методов, был обнаружен наследственно обусловленный полиморфизм многих биохимических систем - групп крови, типов белков и ферментов, крови, молока и других биологических жидкостей организма животных. У многих видов живых существ уровень полиморфизма по белкам чрезвычайно высок.
По определению Форда (Ford е. , 1945), полиморфизм - это одновременное существование в популяции двух или нескольких вариаций признака, причем частота самой редкой из них не может обусловливаться только интенсивностью мутационного процесса в данном локусе, а является результатом гетерозиготного состояния уже существующих аллелей.
Существующие методики электрофореза на различных гелях позволяют дифференцировать типы белков по их подвижности в электрическом поле. Различия в электрофоретической подвижности измененного белка и белка исходного типа вызваны тем, что с изменением структуры белка изменяется общий заряд его молекулы. При помощи электрофореза можно легко отличить гомозиготных особей от гетерозиготных по любому полиморфному локусу.
Мутации, в отличие от полиморфизма, как правило, не совместимы с жизнью. Их частота в популяции не превышает 1–2%. Типы полиморфизмов определяются природой структурных изменений. Например, SNP (Single Nucleotide Polimorphism) – замена одного нуклеотида на другой. Возможны также вариации последовательности нуклеотидов, их выпадения и вставки. Последствия экспрессии (работы) поморфного гена различны, например, активность фермента, кодирующегося этим геном, может повышаться, понижаться или оставаться неизменной.
Поскольку большинство нормальных клеток человека диплоидны, то они содержат две копии каждой хромосомы, одна из которых получена от отца, а вторая от матери. Эти две копии одной и той же хромосомы называют гомологичными .
В ДНК каждой хромосомы содержится более тысячи генов. Соответствующие друг другу гены в гомологичных хромосомах называют аллелями.
Аллели могут быть идентичными и содержат одинаковую последовательность нуклеотидов. В этом случае индивидуум, имеющий такие аллели, будет гомозиготен по данному признаку. Если аллели различаются по последовательности нуклеотидов в ДНК, то говорят о гетерозиготном наследовании гена. В этом случае индивидуум будет иметь 2 белковых продукта гена, различающихся по аминокислотной последовательности.
У каждого человека существует только 2 разных аллеля одного гена, тогда как в популяции людей вариантов аллелей может быть огромное множество.
Как уже говорилось ранее, изменчивость структуры ДНК, а, следовательно, разнообразие аллелей, обусловлено мутационным процессом и рекомбинациями в гомологичных хромосомах половых клеток. Если в ходе мейоза рекомбинации сопровождаются обменом участками ДНК, меньшими по размеру, чем ген, то такой процесс может приводить к появлению новых, прежде не существовавших аллелей. А поскольку рекомбинации - более частые события, чем мутации в кодирующих участках гена, то разнообразие вариантов аллелей обусловлено главным образом ими.
У разных особей возникают варианты (мутации) разных генов или варианты одного и того же гена. Варианты генов, образующиеся у отдельных особей, могут постепенно распространяться в популяции в результате наследования, если они не летальны. Так формируется генотипическая неоднородность популяции, которая ведет и к фенотипической неоднородности. На молекулярном уровне фено-типическая неоднородность проявляется как полиморфизм белков — существование разных форм белка, выполняющих одинаковые или очень сходные функции (изобелки). Чаще всего изучают полиморфизм ферментов (т. е. наличие изофер-ментов), поскольку их гораздо легче обнаружить, чем другие белки, по катализируемой ими реакции.
Как известно, место, занимаемое геном в хромосоме (или молекуле ДНК), называют генным локусом. Варианты одного гена в гомологичных хромосомах, занимающие в них гомологичные же локусы (т. е. одинаковое место в одномерном пространстве нитей ДНК), называют аллелями (рис. 5.9). В популяции может быть множество разных аллелей одного гена, в то время как у отдельного индивида — только два, поскольку клетки человека диплоидны (в гаплоидных половых клетках — только один аллель). Гомологичные хромосомы половых клеток в процессе мейоза (профаза I) могут обмениваться аллелями или их частями (рекомбинация). Если при рекомбинации обмениваются не целиком аллельные гены, а участки ДНК меньшей длины, то такой обмен может приводить к появлению новых, прежде не существовавших в популяции аллелей, а не просто новых сочетаний прежних аллелей. После слияния гамет в диплоидном наборе зиготы получаются различные сочетания аллелей, как уже существовавших в популяции, так и вновь возникших в процессе мейоза в паре гамет, образовавших данную зиготу. Рекомбинации — гораздо более частые события, чем мутации, поэтому разнообразие форм внутри вида обусловлено главным образом именно рекомбинациями.Существование в популяции двух или большего числа аллелей одного гена и соответствующих белков называют аллеломорфизмом (частный случай полиморфизма). Аллеломорфизм возникает в процессе филетической эволюции генов. Распространенность (частота) разных аллелей в популяции неодинакова. Принято считать, что аллели с частотой больше 1 % являются полиморфами; если частота меньше, то существование измененного локуса можно объяснить за счет одних только повторных мутаций.
При дихотомической эволюции происходит удвоение генов, т. е. образуются новые генные локусы: сначала копии исходного гена, но последующие независимые, неодинаковые мутации копий приводят к появлению в организме изобелков. В этом случае варианты белка являются продуктами разных генных локусов, а не аллельных генов. На практике не всегда легко доказать, являются ли варианты белка продуктами одного локуса, т. е. аллеломорфами, или разных локусов.
Таким образом, изобелки — это множественные молекулярные формы белка, обнаруживаемые в пределах организмов одного биологического вида, как результат наличия более чем одного структурного гена в генофонде вида. Множественные гены могут быть представлены как множественные аллели или как множественные генные локусы.
Основными методами изучения полиморфизма белков и ферментов являются электрофорез в крахмальном или акриламид-ном геле и иммуноэлектрофорез. Белки (в том числе ферменты) находятся в растворе в виде частиц, несущих определенный электрический заряд, которые под действием электрического тока перемещаются к катоду или аноду.
Сейчас у сельскохозяйственных животных изучено более 150 полиморфных локусов белков (в том числе ферментов) крови, молока, тканей (табл. 34), расположенных в аутосомах. Установлено сцепление трех локусов казеина молока ocSi-Cn, J3-Cn и к-Cn (каппа-казеин).
34. Некоторые биохимические полиморфные системы
| Система | Символ локуса | Число аллелей | |||
| Крупный рогатый скот | Свиньи | Овцы | Лошади | Куры | |
| Гемоглобин Альбумин Трансферрин | нь Alb Tf | 10 9 12 | - 5 3 7 ' 5 13 | 2 3 10 | 2 3 4 |
| Система | Символ локуса | Число аллелей | ||
| Крупный рогатый скот | Свиньи | Овцы | Лошади | Куры |
| Церулоплазмин | Ср | 2 __ _ | ||
| Эстераза | Es | 2 3 6 3 | ||
| р-Лактоглобулин | P-U | _ _ _ _ | ||
| ctsi-Казеин | asj-Cn | |||
| р-Казеин | P-Cn | |||
| к-Казеин | к-Cn | |||
| у-Казеин | T-Cn |
Аллели гемоглобинового локуса обозначаются так: Hb A , Hb B и т. д., а генотип — НЬ А НЬ А , НЬ В НЬ В и т. д. В связи с кододоми-нантным наследованием большинства биохимических систем фенотип животного соответствует его генотипу, поэтому фенотип можно записать НЬАА или НЬА, НЬВВ или НЬВ.
Замещение аминокислот в белке может вызвать функциональные различия полиморфных форм. Например, у человека кроме нормального гемоглобина НЬ* известно более 50 патологических вариантов S, С, G и т. д., которые вызывают различные гемоглобинопатии (серповидно-клеточная анемия S, талассемия С). Одним из первых был открыт гемоглобин серповидных эритроцитов, который от нормального отличается заменой в шестом положении глутаминовой аминокислоты на валин. В районах распространения тропической малярии лица, гомозиготные по Hb s Hb s , погибают в раннем возрасте от серповидно-клеточной анемии. Гетерозиготы Hl^Hb 8 устойчивы к малярии, а люди с нормальным генотипом Hty^HtA предрасположены к заболеванию.
Это неоспоримый пример сбалансированного полиморфизма, когда приспособленность гетерозигот выше, чем гомозигот, а оба аллеля сохраняются в популяции с промежуточной частотой. Это доказывает существование однолокусного гетерозиса по устойчивости к болезни. В. П. Эфроимсон (1968) выдвинул гипотезу о том, что иммунитет к малярии имеет адаптивное значение и обусловлен изменением молекулы гемоглобина НЬ, что препятствует его использованию малярийным плазмодием.
Гемоглобин выполняет важную для организма функцию переноса кислорода из органов дыхания к тканям и переноса углекислого газа от тканей в органы дыхания. У крупного рогатого скота открыто 10 типов гемоглобина, но у скота швицкой, костромской, джерсейской и других пород в основном встречаются аллели НЬ^ и НЬ В . У животных черно-пестрой, айрширской, герефордской и других пород имеется только один тип А.
Хорошо изучен полиморфизм трансферрина (Tf), который переводит железо плазмы в диионизированную форму и переносит его в костный мозг, где оно используется вновь для кроветворения. Трансферрин также подавляет размножение вирусов в организме. У человека недостаточность трансферрина может быть следствием некоторых перенесенных заболеваний, в частности наследственного гемохроматоза. Количество Tf снижается при циррозе печени, инфекционных болезнях. На рисунке 47 представлена схема расшифровки электрофореграммы типов трансферрина. Известно 12 аллелей Tf, но среди европейских пород наиболее часто встречаются аллели A, Di, D2 и Е.
Белок церулоплазмин (Ср) играет центральную роль в обмене меди в организме, являясь основным переносчиком ее в ткани. Нарушение функции церулоплазмина или снижение его содержания в плазме крови ведет, например у человека, к возникновению генетического заболевания нервной системы с некротическими изменениями в печени.
Все больше появляется работ по иммуногенетическому анализу белковых систем. Генетически детерминируемые анти-генные^арианты сывороточных белков, по которым различают особей одного вида, называют аллотипами. О. К. Баранов (1981) у американской норки выявил 8 аллотипов липопротеина (Lpm), обозначенных цифрами от 1 до 8. Липопротеины транспортируют липиды. Предполагают, что аллотипы Lpm-системы кодируются комплексом тесно сцепленных гомологичных генов. Аллотипы в основном наследуются аллогруппами,
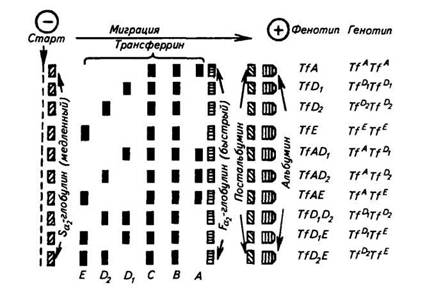
Рис. 47. Расшифровка электрофореграммы различных типов сывороточных трансферринов крупного рогатого скота
например Lpm 6 > 8 , Lpm 4 ' 6 > 8 , Lpm 3 ' 4 > 6 > 8 и т. д. Аллогруппа — совокупность аллотипов, наследуемых как одна группа. Совокупность сцепленных генов одной хромосомы, контролирующих аллогруппу, называют гаплотипом.
У свиней идентифицированные аллотипы липопротеина детерминируются генами пяти локусов, временно обозначенных р, г, s, t, u. Закрытая система Lpb включает 8 аллелей, Lpr и Lpu — по два аллеля, а открытые системы Lps и Lpt — один аллель. Все аллотипы определяются аутосомными кодоминантными генами. Локусы и, р, t тесно сцеплены, а г и s локализованы в разных хромосомах. Имеются данные о связи некоторых типов Lpb с артериосклерозом у свиней.
ЗНАЧЕНИЕ БИОХИМИЧЕСКОГО ПОЛИМОРФИЗМА
Биохимические полиморфные системы белков используются для следующих целей:
1) изучения причин и динамики генотипической изменчивос
ти, составляющей основу эволюционной генетики;
2) уточнения происхождения отдельных животных;
3) описания межпородной и внутрипородной дифференциа
ции, изучения филогенеза и аллелофонда пород, линий и се
мейств, а также генетических процессов, происходящих в попу
ляциях животных, и изменения их генетической структуры в
процессе селекции;
4) определения моно- и дизиготных двоен;
5) построения генетических карт хромосом;
6) подбора гетерозисной сочетаемости;
7) выявления связи с резистентностью к заболеваниям, про
дуктивностью;
8) использования биохимических систем в качестве генетичес
ких маркеров в селекции животных.
Изучение 9 полиморфных систем белков у 10 главных групп скота позволило подтвердить вывод о том, что зебувидный скот Индии значительно отличается от европейских пород и принадлежит к другому виду (Bos indicus). Санга (тип африканского горбатого скота) занимает промежуточное положение между индийским зебу и европейскими породами, но в то же время имеет свои уникальные признаки. Часть из них — следствие обмена генов в результате миграции зебувидного скота Индии в Африку. Использование генных частот позволяет вычислить генетические дистанции между породами и определить их эволюционную взаимосвязь. На рисунке 48 в качестве примера показаны эволюционные взаимосвязи между 14 породами скота.
По данным С. А. Петрушки (1970), частота аллеля p-Lg A была в 2 раза выше у животных голландской и симментальской пород (0,514 и 0,436) в сравнении с бурой латвийской (0,210). Многие
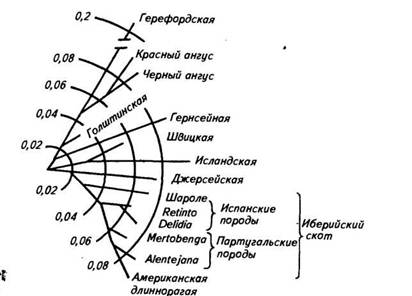
Рис. 48. Эволюционные взаимосвязи между 14 городами скота, вычисленные на основании генетического расстояния но 14 локусам. Филогенетическое древо изображено в полярных координатах; расстояние оценивалось способом наименьших квадратов радиальной длины каждого сегмента (по Kidd п др., 1980)
европейские породы имеют очень низкую частоту типов транс-феррина ТР и TF.
Использование полиморфных систем белков вместе с группами крови повышает точность определения происхождения животных. Так, по группам крови отцовство можно установить в 81 % случаев, а дополнительные анализы только типов транс-феррина повышают точность до 90 %.
По данным В. В. Пилько, Ю. О. Шапиро и А. С. Гурьяновой (1970), в четырех хозяйствах Белоруссии у коров бурой латвийской и костромской пород с TfDD удой был выше на 256— 270 кг, чем у животных с другими генотипами. Л. С. Жеброский и др. (1979) на большом материале показали, что ген к-Сп А во всех стадах связан с повышенной молочностью. Таким же эффектом обладает аллель p-Lg A , но в то же время он снижал содержание жира в молоке коров черно-пестрой породы.
Данные по красной датской породе свидетельствуют о том, что только 3 % генетической изменчивости в содержании жира и 5 % в молочности обусловлены различиями по группам крови. Видимо, есть большая вероятность установления более тесной корреляции генетических полиморфных систем с резистентное -тью к некоторым заболеваниям вследствие менее сложной их генетической детерминации, чем признаков продуктивности.
Анализ полиморфизма яичного белка овоглобулинового локу-са G3 показал, что куры с типом АВ более устойчивы к пуллоро-зу—тифу. Восприимчивость к этому заболеванию кур породы леггорн была связана с аллелем G^S, а породы корниш — с алле-лем G B 3.
В Австралии, а потом в Кении у породы овец ромни-марш с типом гемоглобина НЬА найдена более высокая резистентность к гемонхозу (заболевание, вызываемое нематодами, паразитирующими в сычуге), чем у животных с гемоглобином типов НЬВ и НЬАВ. Однако имеются сведения и об отсутствии связи типов гемоглобина у местных флоридских овец с невосприимчивостью к гемонхозу.
Устойчивость овец к лептоспирозу связана с гетерозиготнос-тью по гемоглобиновому локусу (НЬАВ), тогда как особи с типом А или В более восприимчивы. Эта инфекционная болезнь проявляется у животных кратковременной лихорадкой, желтухой, гемоглобинурией, абортами и другими признаками. У свиней найдена ассоциация лептоспироза с аллелем амилазы Ат А . Уровень антител к лептоспирозу увеличивался у животных с этим аллелем, а с аллелем Am" — уменьшался.
У свиней установлена связь типов фермента фосфогексоизо-мераза (PHI) с синдромом злокачественной гипертермии (MHS). Коэффициент корреляции между чувствительностью к MHS и генотипом РН1 В /РН1 В равен 0,19, а относительный риск возникновения MHS у особей этого генотипа по отношению к имеющим его животным был 18,8.
Изучение новых биохимических полиморфных систем позволит глубже понять динамику генотипической изменчивости в популяциях и механизмы поддержания этой изменчивости, изменение генетической структуры популяций при селекции, планирование и контроль с их помощью селекционного процесса. Можно рассчитывать на выявление более однозначных связей отдельных аллелей или их совокупности с резистентностью к болезням, признакам продуктивности и использовать полиморфные системы как генетические маркеры в селекции.
Контрольные вопросы. 1. Что такое генетическая система групп крови, тип крови, феногруппа? 2. В чем заключаются особенности наследования групп Крови? 3. Как определяются группы крови у животных? 4. Какие теоретические предпосылки лежат в основе связи групп крови с продуктивностью и устойчивостью к болезням? 5. Какое значение группы крови имеют для практики? 6. Почему возникает гемолитическая болезнь новорожденных? Какие методы профилактики этой болезни вы знаете? 7. Что лежит в основе генетического полиморфизма? 8. Какое значение для практики имеет биохимический полиморфизм?
Читайте также:

