Отравление оксидом азота реферат
Обновлено: 02.07.2024
Введение. Оксид азота (II) – молекула года, а также вещество, за исследование физиологических и биохимических свойств которого была присуждена Нобелевская премия на исходе прошедшего тысячелетия
Цель работы – расширить базовые представления об оксиде азота, при этом объясняя возросший интерес к данной молекуле в лице мирового научного сообщества.
История изучения биологических свойств окиси азота отсчитывается с середины 20 века и продолжается по сей день. В этот продолжительный период было сделано много важных открытий в изучении механизмов различных жизненно важных процессов человеческого организма, которые протекают с непосредственным участием NO:
• 1955 г. – Роберт Форчготт обнаружил расслабляющее действие света на аорту кролика;
• 1970-е гг. – Ферид Мьюрэд экспериментально подтвердил влияние NO на активацию гуанилатциклазы;
• 1980 – 1991 гг. – Р. Форшготт и параллельно с ним Луис Игнарро публикуют серию статей про EDRF (Endothelium-Derived Relaxing Factor);
• 1998 г. – Р. Форчготт, Ф. Мьюрэд и Л. Игнарро стали лауреатами Нобелевской премии по физиологии или медицине за открытие роли оксида азота как сигнальной молекулы в сердечно-сосудистой системе.
Оксид азота (NO) – в нормальных условиях бесцветный газ, плохо растворимый в воде, однако хорошо растворимый в органических средах. Вследствие наличия в его электронной структуре неспаренного электрона относится к разряду радикалов (нитроксил-анион). Данный факт объясняет крайне непродолжительный срок существования молекулы в соответствующем состоянии.
Учитывая крайне высокую реакционную способность окиси азота, организму необходимо ее синтезировать и впоследствии хранить в нужных количествах на определенных этапах метаболизма.
Для синтеза эндогенного оксида азота в каждой клетке нашего организма предусмотрен ген, в результате активации которого происходит выработка фермента NO–синтазы. Данный фермент катализирует реакцию превращения аминокислоты L–аргинин в цитруллин с выделением молекулы NO.
Выделившись в результате описанной реакции, окись азота либо сразу же направляется на нужды организма, либо хранится до востребования последним в форме динитрозильного комплекса с железом (Fe+2). Подобные комплексы (сокращенно ДНКЖ) имеют важное биологическое значение: они не только стабилизируют никтроксил-анион, но и способствуют его транспорту от места образования до места действия.
Оксид азота – нейромедиатор.
Физико-химические свойства оксида азота (II) детерминируют его участие в механизме передачи импульсов по нервным волокнам. Нитроксил-анион – это универсальный трансмиттер химических синапсов.
Для большинства нейромедиаторов существует ряд ограничений: они передают импульс только в одном направлении (от пре- к постсинаптическому нейрону) посредством трансмембранных клеточных рецепторов соответственно всего двух нейроцитов, формирующих синапс. В то же время NO способен передавать сигнал не только в пределах лишь одного синапса, но и между целой группой близко расположенных нервных клеток, при этом осуществляя обмен информацией в обе стороны без участия рецепторов.
Такой вариант передачи возбуждения между клетками имеет определенный ряд преимуществ. Исключается необходимость существования в клетках механизмов специфического энзиматического расщепления (например нейромедиатор ацетилхолин расщепляется холинэстаразой), а также механизмов специфического обратного захвата для прекращения потерявшего актуальность сигнала (прошедшего синаптическую щель химического трансмиттера). Будучи высокореакционной частицей, молекула NO вступает в реакции с другими радикалами организменной среды, что в итоге приводит к неспецифическому прекращению его действия как медиатора.
Вазодилататорный эффект NO.
Endothelium-Derived Relaxing Factor (EDRF) – на русский язык дословно переводится как эндотелий-производный расслабляющий фактор, являющийся очередным эквивалентным названием оксида азота (II). Данная аббревиатура довольно четко и понятно описывает функциональное назначение NO в процессе вазодилатации (расширения) кровеносных сосудов нашего организма.
Ацетилхолин (АЦХ) – основной нейромедиатор парасимпатической нервной системы. При воздейтсвии АЦХ на сосуды из эндотелия последних высвобождается NO, который впоследствии стимулирует расслабление гладкомышечного слоя тех же сосудов.
Стоит отметить, что впервые данное явление было описано Робертом Форчготом в процессе его работы с аортой кролика. В том эксперименте при воздействии светового излучения на раскрытый кровеносный сосуд происходило расширение последнего. Одно из возможных объяснений данного явления - высвобождение NO из состава ДНКЖ под влиянием видимого спектра излучения, что в дальнейшем приводит к описанному ранее эффекту.
Оксид азота очень важен для нормального функционирования человеческого организма. Многие его условно патологические состояния невозможно разрешить без участия NO. При физической нагрузке организму требуется большее количество кислорода, что в случае недостаточного усвоения может привести к гипоксии. Чтобы избежать длительного кислородного голодания активируется процесс бронходилатации (увеличение просвета воздухоносных путей в легких), вследствие чего усиливается газообмен между окружающей средой и организмом человека.
Естественное состояние при активном потреблении пищи и жидкости – увеличение объема желудка вследствие расслабления мышц его фундального отдела. Данный эффект также достигается при непосредственном участии NO.
Нитроглицерин – широко известный своим лекарственным действием нитроэфир. Стенокардия (возникает из-за недостаточного кислородного снабжения сердечной мышцы), кишечная колика (спазм гладкой мускулатуры кишечника), повышенный тонус матки и прочие патологические состояния нашего организма могут быть устранены применением данного вещества. Дело все в том, что при разрушении данной молекулы возможно образование окиси азота хорошо известной своим вазодилататорный эффектом и, как следствие, спазмолитическим действием на ткани организма. Поэтому при острых состояниях, сопровождающих многие заболевания внутренних органов человека, вполне может быть применен препарат, содержащий нитроглицерин, для устранения подобной болезненной симптоматики.
Участие в иммунном ответе.
Оксид азота (II) является условным цитотоксическим фактором, который вырабатывается макрофагами и некоторыми другими клетками иммунной системы с целью оказания повреждающего эффекта на клетки бактерий, грибов, простейших, а также на различные злокачественные образования макроорганизма хозяина. В основе данного процесса лежит реакция взаимодействия NO с супероксидом (O2−). В результате образуется высокотоксичный окислитель пероксинитрит (ONOO−), который уже непосредственно взаимодействует со структурными (белки) и генетическими (ДНК) компонентами инфекционных агентов, тем самым нейтрализуя их патогенный потенциал.
Самыми известными для широкой общественности антимикробными препаратами (АМП) являются препараты из группы нитроимидазолов (метронидазол и другие). Принцип действия препарата метронидазола следующий: в процессе метаболизма соответствующего соединения в клетке анаэробных микробов образуется нитроксил-анион (NO), оказывающий описанный ранее повреждающий эффект. В случае же более поздних эволюционных представителей (аэробов) подобной картины при приеме нитроимидазолов не наблюдается, поскольку образующийся в них NO сразу же окисляется с образованием относительно безвредных нитратов.
Стоит так же отметить, что при резком увеличении концентрации оксида азота (II) в результате различных иммунных реакций или при активно развивающихся инфекционных болезнях (сепсис, пневмония и др.) возможна следующая клиническая картина: в результате чрезмерной вазодилатации наблюдается резкое падение АД, что чревато коллапсом и гипоксией жизненно важных органов – печени, мозга, сердца и т.д. Таким образом излишняя продукция NO может оказывать отрицательное воздействие как на региональный воспалительный процесс (наблюдается чрезмерная интенсивность воспаления), так и на весь организм в целом.
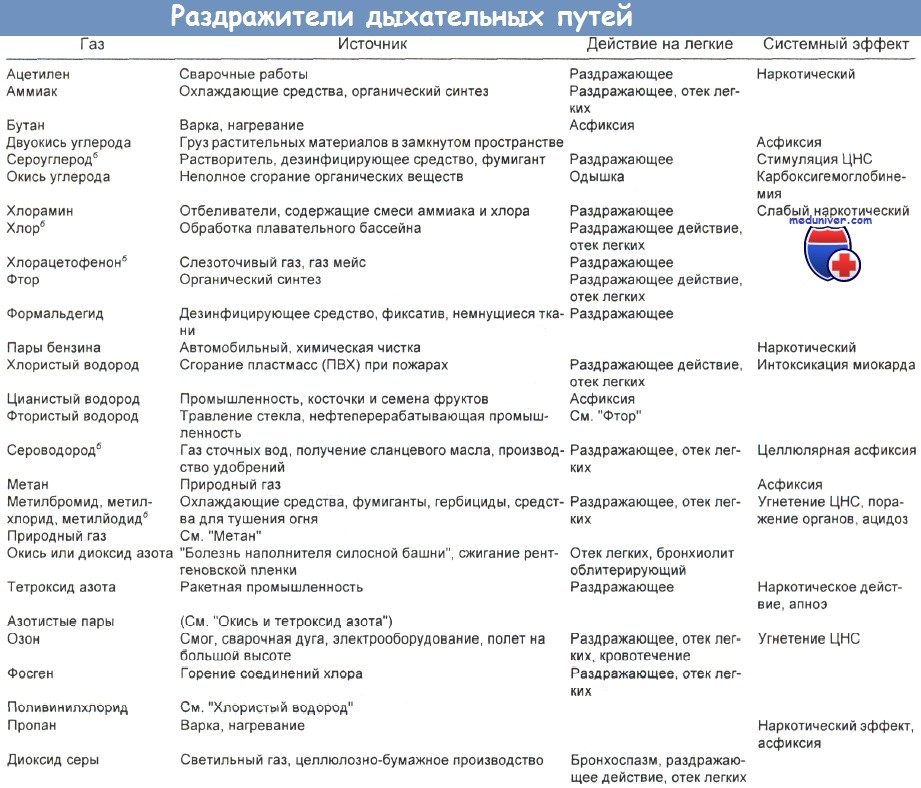
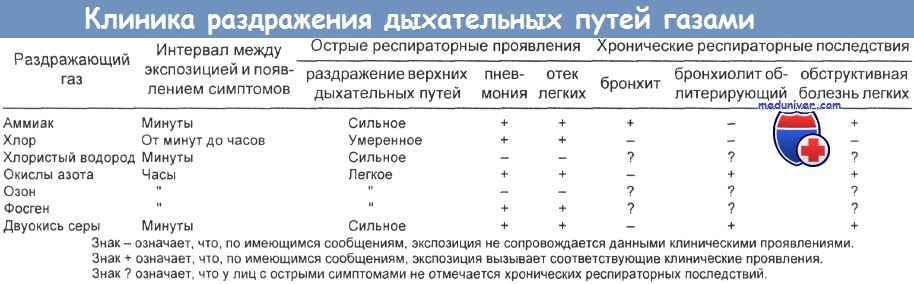
При сжигании газа во время приготовления пищи и при зажигании сигнальных ламп выделяются окись азота (NO), диоксид азота, окись углерода, диоксид углерода и вода. При нормальном использовании невентили-руемой кухонной газовой плиты к фоновой концентрации диоксида азота в доме может добавиться еще 25 частей на 1 млрд (ppb). Эти уровни могут достигать 200-400 ppm.
Диоксид азота, продукт сгорания в неправильно функционирующих машинах для обработки поверхности льда, может скапливаться в закрытых катках, которые плохо вентилируются. В состав токсичных газов, вдыхаемых на ледовых аренах, входит и окись углерода, которая индуцирует ранние симптомы, сравнимые с симптомами латентного периода после экспозиции к диоксиду азота.
а) Повреждение легких. Вдыхание диоксида азота приводит к поражению легких, зависимому от величины дозы. Поражение легких морфологически характеризуется утратой реснитчатых клеток в дыхательных путях и дегенерацией альвеолярных эпителиальных клеток типа I; базальная мембрана при этом остается оголенной.
Исчезновение клеток типа I, которые в норме покрывают 97 % поверхности альвеол, приводит к гипертрофии эпителиальных клеток типа II — в возмещение поврежденных клеток типа I. В течение 72 ч оголенные базальные мембраны снова приобретут покров, но это уже будут быстро размножающиеся клетки типа II.
б) Утечки азотной кислоты. При утечках азотной кислоты образуются окислы азота, в том числе диоксид азота. У пациентов, подвергшихся воздействию паров, в течение нескольких часов отмечается период относительно хорошего самочувствия, вслед за чем развивается быстро прогрессирующий и часто летальный некардиогенный отек легких. Структурно поражение легких проявляется главным образом в дистальных бронхиолах и примыкающих альвеолах.
в) Легкие хоккеиста. Установлено, что выхлопные газы, высвобождающиеся в ограниченном пространстве, являются причиной отравлений окисью углерода. Хуже известен факт, что диоксид азота тоже может выделяться из плохо работающей машины для восстановления ледового покрытия во время хоккейных матчей.
г) Легочно-альвеолярный протеиноз. Легочно-альвеолярный протеиноз — необычная болезнь, для которой характерно накопление в альвеолах зернистого эозинофильного белково-липидного вещества, дающего положительную Шифф-реакцию. Она поражает преимущественно мужчин в возрасте 20—40 лет.
В патогенезе этой болезни нет ни специфического инфекционного агента, ни процесса образования опухолей. Эта болезнь вызывается кремнеземом и диоксидом азота. Возможен дефект клеток типа II и/или легочного сурфактанта, который ведет к чрезмерному продуцированию сурфактанта. Лечение, по-видимому, не влияет на ход болезни. Возможные терапевтические подходы включают аэрозольный ацетилцистеин и полный лаваж легких. Может произойти спонтанная ремиссия.




Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В статье представлен анализ проблемы оксида азота (NO) в биологии и медицине. Дается описание физических свойств NO, приводится классификация и характеристики NO-синтаз, освещаются вопросы открытия и синтеза оксида азота, его физиологической роли и механизмов действия, описывается воздействие высоких и низких концентраций NO. Оксид азота вырабатывается различными клетками организма и контролирует в них многие функции и биохимические процессы, выполняя роль внутриклеточного мессенджера. Оксид азота вызывает релаксацию кровеносных сосудов и гладкомышечной ткани, обладает нейромодулирующей и противоопухолевой активностью, регулирует синтез и секрецию гормонов, активность тромбоцитов, взаимодействие лейкоцитов со стенками сосудов. Разнообразие эффектов оксида азота обусловлено образованием физиологически активных метаболитов NO и его взаимодействием с различными молекулярными мишенями, а также носит дозозависимый характер.

1. Абатуров А.Е. Роль монооксида азота в неспецифической защите респираторного тракта // Здоровье ребёнка. — 2009. — № 1. — С. 16.
2. Ванин А.Ф. Оксид азота в биомедицинских исследованиях // Вестник Российской АМН. — 2000. — № 4. — С. 3-5.
3. Виничук С.М., Черенько Т.М. Ишемический инсульт: эволюция взглядов на стратегию лечения. — Киев : Комполис, 2003. — 120 с.
4. Волошин Л.В., Малахов В.А., Завгородняя А.Н. Эндотелиальная дисфункция при цереброваскулярной патологи. — Харьков: Харьковская медицинская академия последипломного образования, 2006. — 92 c.
6. Голиков П.П., Николаева Н.Ю., Гавриленко И.А. Оксид азота и перекисное окисление липидов как факторы эндогенной интоксикации при неотложных состояниях // Бюллетень экспериментальной биологии и медицины. — 2000. — № 7. — С. 6-9.
7. Гриневич В.В., Акмаев И.Г., Волкова О.В. Основы взаимодействия нервной, эндокринной и иммунной систем. — СПб. : Symposium, 2004. — 159 с.
8. Казаков В.Н., Снегирь М.А., Снегирь А.Г., Гайдарова Е.В., Ивнев Б.Б., Натрус Л.В. Пути взаимодействия нервной, эндокринной и иммунной систем в регуляции функций организма // Архив клинической и экспериментальной медицины. — 2004. — Т. 13, № 1. — С. 3-10.
9. Крыжановский Г.Н. Дизрегуляционная патология : руководство для врачей и биологов. — М. : Медицина, 2002. — 631 с.
11. Малахов В.О. Початкові стадії хронічних церебральних ішемій (патогенез, клініка, лікування, профілактика). — Харьков : Ранок, 2004. — 228 с.
12. Малахов В.А., Завгородняя А.Н., Лычко В.С., Джанелидзе Т.Т., Волох Ф.А. Проблема оксиду азоту в неврологии : монография. — Суми : Видавництво СумДПУ им. А.С. Макаренка, 2009. — 242 с.
13. Мартусевич А.К., Перетягин С.П. Молекулярная стереотипия в реализации эффекта некоторых лечебных физико-химических факторов: роль NO // Вестник Нижегородского университета им. Н.И. Лобачевского. — 2012. — № 2 (3). — С. 205-210.
15. Мацко М.А. Соотношение некоторых медиаторов стрессреализующих и стресслимитирующих систем в остром периоде ишемического инсульта // Патологическая физиология и экспериментальная терапия. — 2004. — № 4. — С. 14-16.
17. Полетаев А.Б., Морозов С.Г., Ковалев И.В. Регуляторная метасистема. Иммунонейроэндокринная регуляция гомеостаза. — М. : Медицина, 2002. — 168 с.
18. Рейхерт Л.И., Быченко С.М., Кичерова О.А., Подлузская И.Д., Тенина О.А., Соколова А.А. Роль окислительного стресса в механизмах формирования демиелинизирующего процесса при рассеянном склерозе // Неврологический вестник им. Бехтерева. — 2006. — Т. XXXVIII, № 3-4. — С. 40-45.
20. Салей А.П., Рецкий М.И. Роль оксида азота в формировании мотивационного поведения и обучения // Вестник ВГУ. Серия: химия, биология, фармация. — 2003. — № 1. — С. 75-80.
21. Сепиашвили Р.И., Шубич М.Г., Карпюк В.Б. Оксид азота при астме и различных формах иммунопатологии // Астма. — 2001. — Т. 2, № 2. — С. 5-14.
23. Сомова Л.М., Плехова Н.Г. Оксид азота как медиатор воспаления // Вестник ДВО РАН. — 2006. — № 6. — С. 7-80.
24. Сосунов А.А. Оксид азота как межклеточный посредник // Соросовский образовательный журнал. — 2000. — №. 6. — С. 27-34.
25. Ballou D.P., Zhao Y., Brandish P.E., Marietta M.A. Revisiting the kinetics of nitric oxide (NO) binding to soluble guanylate cyclase: the simple NO-binding model is incorrect // Proc. Natl. Acad. Sci. USA. — 2002. — Vol. 99, № 19. — P. 12097-12101.
26. Bredt D.S. Nitric Oxide Signaling in Brain: Potentiating the Gain with YC-1 // Molecular Pharmacology. — 2003. — № 63. — Р. 1206-1208.
27. Dawson V., Dawson T., Bartley D. Mechanisms of nitriс oxide mediated neurotoxicity in primary brain cultures // Neurosci. — 1993. — Vol. 13, № 7. — P. 2651-2661.
28. Herbert J., Goodyer I.M., Grossman A.B., Hastings M.H., de Cloet E.R., Lightman S.L., Lupien S.J., Roozendaal B., Seck J.R. Do corticosteroids damage the brain? // Neuroendocrinology. — 2006. — Vol. 18. — P. 393-411.
29. Plotnikoff N.P., Faith R.E., Murgo A.G., Good R.A. Cytokines: Stress and Immunity. — Boca Raton: CRC Press, 2006. — 405 р.
30. Tomomi G., Masataka M. Nitric oxide and endoplasmic reticulum stress // Arteriosclerosis, Thrombosis and Vascular Biology. — 2006. — № 26. — Р. 1439.
32. Zhao Y.D., Courtman D.W., Deng Y., Kugathasan L., Zhang Q., Stewart D.J. Rescue of monocrotaline-induced pulmonary arterial hypertension using bone marrow-derived endothelial-like progenitor cells: efficacy of combined cell and eNOS gene therapy in established disease // Circ. Res. — 2005. — № 96. — Р. 442-450.
В настоящее время большое внимание уделяется изучению роли оксида азота (NO), как универсального трансмиттера, в развитии различных патологических состояний. NO вызывает расслабление гладких мышц сосудов, участвует в защите от патогенов, является нейромедиатором, регулирует программируемую гибель и пролиферацию клеток, играет важную роль в секреторной и репродуктивной системе. В связи с этим целью настоящего обзора является попытка обобщить данные литературы для того, чтобы приблизиться к более глубокому пониманию возможностей использования NO в биологии и медицине.
В свободном состоянии монооксид азота (NO) – это бесцветный газ без запаха, обладающий высокой реакционной способностью. Его молекулярная масса составляет 30,01 г/моль, растворимость в воде – 74 см3/дм3, показатель преломления – 1,0002697, температура плавления – 163,6 °С, температура кипения – 151,7 °С [5].
Основным природным источником NO являются электрические разряды молний в грозу. При сгорании топлива примерно 90% оксидов азота превращается в NO, а оставшиеся 10% – в диоксид азота [20]. В ходе химических реакций значительная часть монооксида азота превращается в N2O. Это бесцветный газ со сладковатым вкусом, большие количества которого приводят к притуплению болевой чувствительности и потере сознания, благодаря чему в смеси с кислородом (80% N2О+20% О2) он иногда применяется для наркоза.
Обнаружено, что оксид азота вырабатывается различными клетками организма – эндотелиоцитами, эпителиоцитами, мезангиоцитами, миоцитами, лимфоцитами, нейтрофилами, тромбоцитами, макрофагами, моноцитами, фибробластами, нейронами, гепатоцитами, тучными клетками – и контролирует в них многие функции и биохимические процессы [21; 22]. Одно из наиболее удивительных открытий последнего десятилетия – установление роли NO как внутриклеточного мессенджера .
Профессор доктор биологических наук А.Ф. Ванин в 1965 году обнаружил в биологических объектах с помощью электронного парамагнитного резонанса радикалы неизвестной природы, показав их гипотензивное действие. В 1985 г. он получил данные, что открытые радикалы имеют отношение к окиси азота [16].
В 1980 году фармаколог из Университета штата Нью-Йорк Р. Фарчготт в эксперименте показал, что ацетилхолин расширяет кровеносные сосуды в тех случаях, когда стенка сосудов не повреждена. Р. Фарчготт пришел к выводу, что неповрежденные эндотелиальные клетки продуцируют сигнал, расслабляющий гладкую мускулатуру сосудов. Этот сигнал молекулы был назван EDRF (эндотелиум-получательно-распределяющий фактор).
Независимо от Р. Фарчготта в поисках неизвестной сигнальной молекулы принимал участие доктор Л. Игнарро из Калифорнийского университета в Лос-Анджелесе. В 1986 году Л. Игнарро заключил, что EDRF идентичен окиси азота.
В 1977 году врач-фармаколог Ф. Мюрад из Медицинской школы Техасского университета в Хьюстоне установил, что нитроглицерин и другие родственные сосудорасширяющие вещества освобождают окись азота, которая расширяет гладкую мускулатуру клеток.
В июле 1986 года Р. Фарчготт и Л. Игнарро получили аналогичные данные. Это вызвало лавину исследований в различных лабораториях во всем мире. 10 декабря 1998 г. в Стокгольме (Швеция) трем ученым из США: Р. Ферчготту, Л. Игнарро и Ф. Мюраду, была присуждена Нобелевская премия по физиологии и медицине за открытие роли оксида азота как сигнальной молекулы в сердечно-сосудистой системе [12].
Синтез монооксида азота в организме
Образование монооксида азота происходит в результате окисления атомом кислорода L-аргинина в присутствии специфического фермента NO-синтазы [1] .
2L-аргинин + 3НАДФН + 4O2 + 3H+ → 2L-цитруллин + 2NO + 3НАДФ+ + 4H2O
В зависимости от структуры и локализации различают следующие изоформы NO-синтаз (NOS): эндотелиальные (eNOS), нейрональные (nNOS) и макрофагальные (mNOS). Активность nNOS имеет максимальное значение около 300 нмоль/мг/мин, mNOS – до 1000 нмоль/мг/мин, eNOS – около 15 нмоль/мг/мин. Молекула nNOS (161 kDa) состоит из 1434 аминокислотных остатков, mNOS (131 kDa) – 1153, eNOS (133 kDa) –1203. nNOS и mNOS содержатся, главным образом, в цитоплазме клетки, eNOS связана с клеточными мембранами [9; 22; 23]. В активный центр NOS входит железопорфириновый комплекс, содержащий цистеин или метионин. В синтез монооксида азота посредством NO-синтаз включаются шесть кофакторов: никотинамидадениндинуклеотидфосфат (НАДФ-Н), флавинадениндинуклеотид (ФАД), флавинмононуклеотид (ФМН), тетрагидробиоптерин, гем и кальмодулин.
Изоформы NOS отличаются по механизму действия и биологическому значению для организма. Поэтому их подразделяют на конститутивную (cNOS) и индуцибельную (iNOS). Нейрональная NOS является только конститутивной, mNOS –индуцибельной формой, eNOS в 80% является конститутивной и в 20% – индуцибельной ферментативной формой (табл. 1).
Активность cNOS зависит от концентрации Са2+ и кальмодулина. Механизм действия eNOS и nNOS имеет сходный характер. Под влиянием вазодилятаторных агентов (ацетилхолина, аденозина, 5-оксиптриптамина, глутамата, брадикинина, гистамина и других) в цитозоле эндотелиальных клеток возрастает уровень Са2+, который соединяется с кальмодулином. Комплекс Ca-кальмодулин выступает как кофактор, активирующий NOS. Под влиянием ингредиентной NOS образуются малые количества NO, который осуществляет местную регуляцию. Он диффундирует к прилегающим гладким мышцам, вызывая последовательную активацию гуанилатциклазы, протеинкиназы G, протеинфосфатазы. В результате дефосфорилируется одна из субъединиц К+ мембранного канала, приводя к усилению калиевой проводимости через плазматическую мембрану миоцитов. Вследствие конформационных изменений, вызванных гиперполяризацией мембраны, снижается проницаемость кальциевых каналов и падает уровень свободного Са2 + в клетках. Это вызывает расслабление миофибрилл и является причиной снижения тонуса кровеносных сосудов [ 13; 22; 24; 26; 32].
Сравнительная характеристика NOS [1]
Нейроны, эпителиоциты, эндотелиоциты, миоциты скелетных мышц и сосудов, нейтрофилы, тромбоциты, f3-клетки поджелудочной железы
Макрофаги, нейтрофилы, эпителиоциты, кардиомиоциты, глиальные клетки, миоциты сосудов, эндотелиоциты, нейроны
Эндотелиоциты, кардиомиоциты, тромбоциты, нейроны
Основные регуляторные механизмы
Цитоплазма, эндоплазматический ретикулум, сарколемма
Фагосомы, пероксисомы, мембрана, ядро клетки, митохондрии
Аппарат Гольджи, мембрана клетки в области маленьких инвагинаций, которые содержат трансмембранный кавеолин, ядро клетки, митохондрии
Активация сNOS наблюдается при гипоксических состояниях организма, при вазоконстрикции сосудов, под влиянием фактора активации тромбоцитов (ФАТ) через ФАТ-рецепторы на клетках эндотелия [2; 6; 12]. Монооксид азота, продуцируемый под влиянием nNOS и eNOS, при некоторых формах патологии, наряду с регуляторным, оказывает и протективное действие [10; 11; 21].
iNOS появляется в клетках (макрофагах, нейтрофилах, кератиноцитах, фибробластах, хондроцитах, остеокластах) только после индукции их бактериальными эндотоксинами и некоторыми медиаторами воспаления (гамма-интерфероном, ИЛ-1, ИЛ-2, фактором некроза опухоли), активными формами кислорода, а также гормонами, которые воздействуют на синтез циклического аденозинмонофосфата (адреналин, глюкагон). iNOS участвует в реакциях неспецифического иммунитета [12; 15; 18; 20-23; 26].
Физиологическая роль и механизмы действия NO
Все многообразие физиологических эффектов NO можно разделить на 3 типа:
• повреждающее действие [17; 19].
Центральная и периферическая нервная система. Наиболее хорошо изучена роль NO в нервной системе, где окись азота активирует процесс выброса нейромедиаторов из нервных окончаний во время синаптической передачи. Более того, молекула NO сама может играть роль нейромедиатора [4; 12; 20; 21; 22; 26].
nNOS регулирует рост и дифференцировку клеток ЦНС и, предположительно, их восстановление после локальных ишемических повреждений головного мозга [11; 12; 17]. В ишемизированном участке мозга глутаматергические нейроны вместо физиологической порции нейротрансмиттера выделяют поток глутамата, который обрушивается на NO-синтезирующие нейроны, – происходит так называемый глутаматный каскад. В результате повышается поступление Ca2+ в клетку и, как следствие, возрастает синтез и выделение из нейрона NO [23]. Ингибиторы синтеза оксида азота (нитроаргинин, гемоглобин) защищают нейроны, снижая их гибель на 73% [4; 7; 26].
NO участвует в процессах долговременной синаптической потенциации, связанной с образованием памяти. Таким образом, в мыслительной деятельности окись азота является и непосредственным участником, и косвенным регулятором [11; 15; 23].
Сердечно-сосудистая система. NO поддерживает вазодилатацию, регулирует кровоток и контролирует базальное артериальное давление [7; 12; 16]. Окисленные липопротеины низкой плотности (ЛПНП) подавляют синтез оксида азота в тромбоцитах, стимулируют их агрегацию, образование тромбоксана А2 и серотонина, способствуя дисфункции эндотелия и нарушению структуры сосудов, ведущих к развитию атеросклероза [11; 12].
В случае инфаркта миокарда оксид азота стимулирует ангиогенез [12]. NO способствует синтезу эндотелиального фактора роста, тормозит пролиферацию и миграцию гладкомышечных клеток [11], гипертрофию сосудов [1], подавляет синтез внеклеточного матрикса, поддерживая всем этим нормальную структуру сосудистой стенки.
Пищеварительный и урогенитальный тракты, дыхательная система. Оксид азота участвует в обеспечении моторной функции желудочно-кишечного тракта, при этом некоторые заболевания ( болезнь Гиршспрунга , ахалазия кардии , хроническая псевдообструкция кишечника ) обусловлены снижением числа внутрикишечных нейронов, вырабатывающих NO [12]. NO регулирует поступление желчи в кишечник и является одним из важных факторов защиты слизистой желудка путем воздействия на её кровоснабжение.
NO, вырабатываемый в гепатоцитах, защищает эти клетки от действия ряда токсичных веществ, включая этанол и парацетамол . Эндогенный оксид азота подавляет синтез белка в печени, ингибирует ряд ферментов энергетического обмена, в том числе митохондриальную аконитазу , НАДН-дегидро-геназу и сукцинатдегидрогеназу (комплексы I и II дыхательной цепи). При поражении гепатотоксичными окислителями NO может действовать как антиоксидант , сохраняя клеточные запасы восстановленного глутатиона . Оксид азота замедляет распад глюкозы , ингибируя глицеральдегидфосфатдегидрогеназу . Таким образом, защитное действие NO может быть обусловлено замедлением обменных процессов и сохранением запасов энергии в печени.
В различных отделах почки представлены все три изоформы NOS. Оксид азота активно участвует в её физиологических процессах: регулирует почечную гемодинамику, гломерулярную фильтрацию, ингибирует транспорт Na+ и увеличивает его экскрецию.
NO играет важную роль в регуляции функций легких и в патофизиологии заболеваний системы дыхания. Активные радикалы азота увеличивают продукцию муцина и эпителиальной слизи, ускоряют движения ресничек реснитчатого эпителия, индуцируют активность апикальных анионных и базолатеральных калиевых каналов эпителиоцитов, способствуя механической элиминации инфекционных агентов.
При цилиарной дискинезии, муковисцидозе, дефиците α1-антитрипсина, легочной артериальной гипертензии наблюдается снижение содержания NO в выдыхаемом воздухе [1].
Иммунонейроэндокринная система. Установлена важная роль оксида азота в регуляции иммунонейроэндокринной системы [8; 9; 15]. Запуск стресс-реакции происходит за счет активации гипоталамо-гипофизарно-надпочечниковой и симпатоадреналовой систем [27]. Торможение активности nNOS способствует увеличению концентрации вазопрессина и окситоцина [29]. NO ингибирует активацию гипоталамо-гипофизарно-надпочечниковой системы, вызываемую вазопрессином, обладая стресслимитирующим действием [9; 13; 15; 29].
Аксоны NO-ергических нейронов надпочечников контактируют с хромаффинными клетками, продуцирующими катехоламины. Выделение оксида азота происходит одновременно с норадреналином. В небольших концентрациях NO угнетает высвобождение катехоламинов из надпочечников и симпатических нервных окончаний, приводя к ограничению стресс-реакции [28].
Оксид азота выполняет функцию медиатора воспаления. Каждая фаза асептического воспаления ассоциирована с определенными изоформами NOS. На ранней фазе воспалительной реакции под действием медиаторов (гистамина, брадикинина, простагландинов и лейкотриенов) [30] происходит стимуляция продукции оксида азота с помощью nNOS. Параллельно усиливается активность еNOS. В клетках сосудистого эндотелия NO активирует растворимую гуанилатциклазу, что приводит к усиленному образованию цГМФ, который вызывает релаксацию гладкомышечных клеток сосудов, увеличивая сосудистую проницаемость [17]. сNOS и iNOS имеют отношение к продукции оксида азота в ранней фазе воспаления.
В развитие поздней фазы воспаления вносит вклад только оксид азота, продуцируемый с помощью iNOS, локализованной в лейкоцитах. На этой стадии воспалительного процесса NO стимулирует синтез и высвобождение провоспалительных цитокинов – ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-6, лейкотриенов, хемокинов, которые, в свою очередь, стимулируют миграцию лейкоцитов в очаг воспаления. NOS контролирует биосинтез ИЛ-4, ИЛ-10, ИЛ-11 и ИЛ-13, которые относятся к противовоспалительным цитокинам [17; 30].
Действие высоких и низких концентраций оксида азота
Действие оксида азота опосредовано его концентрацией (рисунок). Малые физиологические концентрации NO (
Введение. Оксид азота (II) – молекула года, а также вещество, за исследование физиологических и биохимических свойств которого была присуждена Нобелевская премия на исходе прошедшего тысячелетия
Цель работы – расширить базовые представления об оксиде азота, при этом объясняя возросший интерес к данной молекуле в лице мирового научного сообщества.
История изучения биологических свойств окиси азота отсчитывается с середины 20 века и продолжается по сей день. В этот продолжительный период было сделано много важных открытий в изучении механизмов различных жизненно важных процессов человеческого организма, которые протекают с непосредственным участием NO:
• 1955 г. – Роберт Форчготт обнаружил расслабляющее действие света на аорту кролика;
• 1970-е гг. – Ферид Мьюрэд экспериментально подтвердил влияние NO на активацию гуанилатциклазы;
• 1980 – 1991 гг. – Р. Форшготт и параллельно с ним Луис Игнарро публикуют серию статей про EDRF (Endothelium-Derived Relaxing Factor);
• 1998 г. – Р. Форчготт, Ф. Мьюрэд и Л. Игнарро стали лауреатами Нобелевской премии по физиологии или медицине за открытие роли оксида азота как сигнальной молекулы в сердечно-сосудистой системе.
Оксид азота (NO) – в нормальных условиях бесцветный газ, плохо растворимый в воде, однако хорошо растворимый в органических средах. Вследствие наличия в его электронной структуре неспаренного электрона относится к разряду радикалов (нитроксил-анион). Данный факт объясняет крайне непродолжительный срок существования молекулы в соответствующем состоянии.
Учитывая крайне высокую реакционную способность окиси азота, организму необходимо ее синтезировать и впоследствии хранить в нужных количествах на определенных этапах метаболизма.
Для синтеза эндогенного оксида азота в каждой клетке нашего организма предусмотрен ген, в результате активации которого происходит выработка фермента NO–синтазы. Данный фермент катализирует реакцию превращения аминокислоты L–аргинин в цитруллин с выделением молекулы NO.
Выделившись в результате описанной реакции, окись азота либо сразу же направляется на нужды организма, либо хранится до востребования последним в форме динитрозильного комплекса с железом (Fe+2). Подобные комплексы (сокращенно ДНКЖ) имеют важное биологическое значение: они не только стабилизируют никтроксил-анион, но и способствуют его транспорту от места образования до места действия.
Оксид азота – нейромедиатор.
Физико-химические свойства оксида азота (II) детерминируют его участие в механизме передачи импульсов по нервным волокнам. Нитроксил-анион – это универсальный трансмиттер химических синапсов.
Для большинства нейромедиаторов существует ряд ограничений: они передают импульс только в одном направлении (от пре- к постсинаптическому нейрону) посредством трансмембранных клеточных рецепторов соответственно всего двух нейроцитов, формирующих синапс. В то же время NO способен передавать сигнал не только в пределах лишь одного синапса, но и между целой группой близко расположенных нервных клеток, при этом осуществляя обмен информацией в обе стороны без участия рецепторов.
Такой вариант передачи возбуждения между клетками имеет определенный ряд преимуществ. Исключается необходимость существования в клетках механизмов специфического энзиматического расщепления (например нейромедиатор ацетилхолин расщепляется холинэстаразой), а также механизмов специфического обратного захвата для прекращения потерявшего актуальность сигнала (прошедшего синаптическую щель химического трансмиттера). Будучи высокореакционной частицей, молекула NO вступает в реакции с другими радикалами организменной среды, что в итоге приводит к неспецифическому прекращению его действия как медиатора.
Вазодилататорный эффект NO.
Endothelium-Derived Relaxing Factor (EDRF) – на русский язык дословно переводится как эндотелий-производный расслабляющий фактор, являющийся очередным эквивалентным названием оксида азота (II). Данная аббревиатура довольно четко и понятно описывает функциональное назначение NO в процессе вазодилатации (расширения) кровеносных сосудов нашего организма.
Ацетилхолин (АЦХ) – основной нейромедиатор парасимпатической нервной системы. При воздейтсвии АЦХ на сосуды из эндотелия последних высвобождается NO, который впоследствии стимулирует расслабление гладкомышечного слоя тех же сосудов.
Стоит отметить, что впервые данное явление было описано Робертом Форчготом в процессе его работы с аортой кролика. В том эксперименте при воздействии светового излучения на раскрытый кровеносный сосуд происходило расширение последнего. Одно из возможных объяснений данного явления - высвобождение NO из состава ДНКЖ под влиянием видимого спектра излучения, что в дальнейшем приводит к описанному ранее эффекту.
Оксид азота очень важен для нормального функционирования человеческого организма. Многие его условно патологические состояния невозможно разрешить без участия NO. При физической нагрузке организму требуется большее количество кислорода, что в случае недостаточного усвоения может привести к гипоксии. Чтобы избежать длительного кислородного голодания активируется процесс бронходилатации (увеличение просвета воздухоносных путей в легких), вследствие чего усиливается газообмен между окружающей средой и организмом человека.
Естественное состояние при активном потреблении пищи и жидкости – увеличение объема желудка вследствие расслабления мышц его фундального отдела. Данный эффект также достигается при непосредственном участии NO.
Нитроглицерин – широко известный своим лекарственным действием нитроэфир. Стенокардия (возникает из-за недостаточного кислородного снабжения сердечной мышцы), кишечная колика (спазм гладкой мускулатуры кишечника), повышенный тонус матки и прочие патологические состояния нашего организма могут быть устранены применением данного вещества. Дело все в том, что при разрушении данной молекулы возможно образование окиси азота хорошо известной своим вазодилататорный эффектом и, как следствие, спазмолитическим действием на ткани организма. Поэтому при острых состояниях, сопровождающих многие заболевания внутренних органов человека, вполне может быть применен препарат, содержащий нитроглицерин, для устранения подобной болезненной симптоматики.
Участие в иммунном ответе.
Оксид азота (II) является условным цитотоксическим фактором, который вырабатывается макрофагами и некоторыми другими клетками иммунной системы с целью оказания повреждающего эффекта на клетки бактерий, грибов, простейших, а также на различные злокачественные образования макроорганизма хозяина. В основе данного процесса лежит реакция взаимодействия NO с супероксидом (O2−). В результате образуется высокотоксичный окислитель пероксинитрит (ONOO−), который уже непосредственно взаимодействует со структурными (белки) и генетическими (ДНК) компонентами инфекционных агентов, тем самым нейтрализуя их патогенный потенциал.
Самыми известными для широкой общественности антимикробными препаратами (АМП) являются препараты из группы нитроимидазолов (метронидазол и другие). Принцип действия препарата метронидазола следующий: в процессе метаболизма соответствующего соединения в клетке анаэробных микробов образуется нитроксил-анион (NO), оказывающий описанный ранее повреждающий эффект. В случае же более поздних эволюционных представителей (аэробов) подобной картины при приеме нитроимидазолов не наблюдается, поскольку образующийся в них NO сразу же окисляется с образованием относительно безвредных нитратов.
Стоит так же отметить, что при резком увеличении концентрации оксида азота (II) в результате различных иммунных реакций или при активно развивающихся инфекционных болезнях (сепсис, пневмония и др.) возможна следующая клиническая картина: в результате чрезмерной вазодилатации наблюдается резкое падение АД, что чревато коллапсом и гипоксией жизненно важных органов – печени, мозга, сердца и т.д. Таким образом излишняя продукция NO может оказывать отрицательное воздействие как на региональный воспалительный процесс (наблюдается чрезмерная интенсивность воспаления), так и на весь организм в целом.
Читайте также:

