Особенности бактериальной микрофлоры при хронических тонзиллитах реферат
Обновлено: 05.07.2024
На сегодняшний день повсеместное распространение антибактериальных препаратов и их бесконтрольный прием привели к селекции среди патогенной микрофлоры и формированию стойкой резистентности к данным методам лечения за счет изменения генома микроорганизмов. Несмотря на развитие медицинских технологий и методологий, в том числе, в оториноларингологии, остается актуальным решение вопроса лечения пациентов с хроническим тонзиллитом. Использование препаратов бактериофагов стимулирует активизацию факторов специфического и неспецифического иммунитета, поэтому фаготерапия особенно эффективна при лечении хронических воспалительных заболеваний глотки бактериальной этиологии, в том числе и в детском возрасте.
Ключевые слова: хронический тонзиллит, микрофлора, микроорганизмы, бактериофаги.
THE USE OF BACTERIOPHAGES IN CHRONIC TONSILLITIS
Gadeliya M.V.*
Kuban State Medical University; Krasnodar, Russia
Abstract
Currently, the widespread use of antibacterial drugs and their uncontrolled intake have led to selection among pathogenic microflora and the formation of persistent resistance to these methods of treatment due to changes in the genome of microorganisms. Despite the development of medical technologies and methodologies, including the field of otorhinolaryngology, the issue of treatment of patients with chronic tonsillitis remains relevant. The use of bacteriophage preparations stimulates the activation of specific and non-specific immunity factors, therefore phage therapy is especially effective in the treatment of chronic inflammatory diseases of the pharynx of bacterial etiology, including children.
Keywords: chronic tonsillitis, microflora, microorganisms, bacteriophages.
Введение
Несмотря на существование большого спектра лечебных методов хронического тонзиллита, его общая заболеваемость и частота обострений снижаются год от года незначительно [14]. По данным Департамента мониторинга, анализа и стратегического развития здравоохранения Минздрава России распространенность хронических болезней миндалин и аденоидов составляет 1 154,4 на 100 тыс. населения. По эпидемиологическим данным последнего десятилетия распространенность хронического тонзиллита составляет 5-37% среди взрослого населения и 15-63% – среди детского [20], [22], [23].
Проблема лечения хронического тонзиллита остается актуальной в связи с ростом числа ежегодных обострений и процента осложнений у трудоспособных и социально активных граждан. Все больше исследователей докладывают об увеличении количества экстренных операций в оториноларингологии, например, вскрытий тонзиллогенных флегмон пространств шеи, паратонзиллярных абсцессов, их дренирования [4], [15]. Кроме того, уже существует доказательная база связи хронического тонзиллита с возникновением и существованием других соматических патологий: болезней сердца, почек, женской половой системы, щитовидной железы, суставов, – что подтверждается и данными, которые публикует ВОЗ [9], [13], [14], [26].
Основная часть
По данным В.Т. Пальчуна (2013), хронический тонзиллит является хроническим процессом инфекционно-аллергической природы, который сопровождается наличием очага инфекции в области небных миндалин в условиях снижения иммунного ответа. В норме нарушение естественного ограничения воспаления в пределах крипт небных миндалин не происходит, а за счет продуктов данного процесса активируется механизм развития иммунитета по типу антиген-антитело. При хроническом тонзиллите воспаление распространяется за пределы тканей небных миндалин, микроорганизмы с поверхности крипт проникают глубоко в лимфоидную ткань и разносятся с током крови и лимфы в другие ткани и органы [15].
За счет нарушения местного иммунитета образуется и поддерживается стойкий очаг хронической инфекции в области небных миндалин, сопровождающейся периодическими обострениями в виде ангины с классическими признаками острого воспалительного процесса. Местный состав микроорганизмов способен меняться с течением времени, однако среди наиболее агрессивных и распространенных инфекционных агентов выделяют стрептококки, стафилококки, различные вирусы, реже — хламидии и микоплазмы. Ведущим этиологическим фактором является β-гемолитический стрептококк группы А, который обнаруживают примерно в 30—60% случаев при установленном диагнозе хронический тонзиллит. Однако, в последнее время изменилось отношение к факторам патогенности β-гемолитического стрептококка группы А, в связи с обнаружением его способности формировать биопленки, причем, в условиях in vitro была доказана их чрезвычайная антибактериальная резистентность [14], [15], [30], [37].
В лаборатории в ходе проведения исследования микробного состава оценивают частоту выделения каждого микроорганизма полуколичественным методом. Так, наибольшее значение имеют зеленящие стрептококки и клостридии (++++), St. еpidermidis (+++); S.pneumoniae, тогда как роды Neisseria и Lactobacterium представлены в небольшом количестве (++); возможно выделение отдельно встречающихся колоний пептострептококков, актиномицетов, энтерококков, спирохет и микобактерий, а также грибов рода Candida (+). Анализируя приведенные данные, можно говорить о возможном транзиторном носительстве этих микробов, в том числе – Staphylococcus aureus, и как следствие – необходимости их эрадикации только в случае выраженной клинической картины при неоднократно положительных результатах микробиологического исследования с превышением допустимых титров [7], [43].
Такая картина характерна и для развития хронического тонзиллита: при исследовании ткани небных миндалин, особенно их глубоких отделов, обнаруживали как патогенные микроорганизмы до 30% от состава ассоциации (S.aureus, St.pyogenes), так и представителей условно-патогенной микрофлоры практически в аналогичном процентном соотношении (S.viridans, S.epidermidis) [17].
Практикующим оториноларингологам необходимо помнить об микробиологических особенностях процесса при хроническом тонзиллите, что повлияет как на постановку диагноза, так и на прогноз заболевания и выбор метода лечения.
На сегодняшний день повсеместное распространение антибактериальных препаратов и их бесконтрольный прием привели к селекции среди патогенной микрофлоры и формированию у нее стойкой резистентности к данным методам борьбы за счет изменения генома микроорганизмов. По этой причине перспективным альтернативным направлением медицины считают фаготерапию при борьбе с заболеваниями, имеющими инфекционную природу. Бактериофаги представляют собой вирусы, паразитирующие на бактериях, поэтому стойкий антибактериальный эффект при их применении достигается за счет специфического лизиса патогенных микроорганизмов в очаге воспаления. Традиционно бактериофаги выпускают в жидкой форме во флаконах, однако существует таблетированная форма для кишечной группы [5], [36], [53], [59].
Бактериофаги выпускают в виде монопрепарата, содержащий один штамм вируса (лизирующие стафилококки, сальмонеллы, стрептококки, эшерихии, клебсиеллы, протеи, псевдомонады и шигеллы), а также в их комбинации, обладающих воздействием на несколько видов или родов бактерий (пиобактериофаг, интести-бактериофаг, колипротейный бактериофаг, секстафаг) [8], [48], [51], [56].
Решение вопроса о применении препаратов, содержащих фаги, для лечения различных инфекционных процессов должно приниматься лечащим врачом после анализа результатов микробиологического исследования биоматериала из очага воспаления с учетов превалирующего вида бактерий и ее чувствительности к фагу. Последний допускают к применению только при его высокой активности в отношении лизиса данного конкретного вида микроорганизма в очаге инфекции [31].
Количество вызываемых бактериями заболеваний, при которых возможно применение фагов весьма велико. Так, их можно использовать для лечения гнойно-воспалительных осложнений в послеоперационном периоде, при внутрибольничных и урогенитальных инфекциях, патологии нижних дыхательных путей, ЛОР-органов и других систем, а у новорожденных и беременных пациентов [1], [39], [53], [56].
Вследствие высокой безопасности и ареактогенности бактериофаги разрешены к применению в педиатрии без возрастных ограничений (в т. ч. и недоношенным детям) [2]. Использование препаратов бактериофагов стимулирует активизацию факторов специфического и неспецифического иммунитета, поэтому фаготерапия особенно эффективна при лечении хронических воспалительных заболеваний на фоне иммунодепрессивных состояний. Свою высокую эффективность и хороший уровень переносимости бактериофаги продемонстрировали в терапии кишечных инфекций у детей. Подтверждением стали хорошие результаты, полученные при проведении клинического исследования (корпорация Nestle Nutrition, 2009) по применению бактериофага Escherichia coli в лечении кишечной инфекции детей в возрасте от 6 мес. до 5 лет. В другом исследовании у детей с острым гнойным риносинуситом было показано положительное влияние бактериофагов на мукоцилиарный клиренс – важный универсальный механизм защиты слизистой оболочки дыхательных путей. Это позволяет отнести бактериофаги не только к этиологическим, но и к патогенетическим средствам терапии гнойно-воспалительных заболеваний лор-органов. По результатам клинических исследований также были получены данные о положительном влиянии фаготерапии на клинические проявления хронического тонзиллита и высеваемость Staphylococcus aureus с поверхности небных миндалин [19], [27].
Несмотря на практически полное отсутствие противопоказаний, все же следует применять бактериофаги строго следуя инструкции производителя. Кроме того, доза и способ введения препарата будут зависеть от характера инфекционного процесса – в частности, его локализации, поэтому бактериофаги можно использовать местно в виде аппликаций раствора, примочек, тампонов, введения в полости, в том числе- мочевого пузыря через катетер, ректально и перорально. В случае рецидивирующих инфекционных заболеваний возможно повторное использование бактериофагов после проведения микробиологического исследования [20], [40].
Следует отметить, что при местном применении количество используемого бактериофага будет зависеть от объема пораженного участка. При инфекциях ЛОР-органов бактериофаги назначают в виде полосканий, промываний полостей, совместно с каплями, пропитанной фагом турунды, которую оставляют в области очага в течение 1 часа. При абсцедирующих процессах после элиминации гноя бактериофаг вводят в полость, причем, его количество должно быть меньше объема удаленного отделяемого.
Некоторые ученые по данным исследования приводят данные об обнаружении бактериофагов после их применения в крови и моче [20]. Поэтому производители фагов рекомендуют для достижения хорошего терапевтического результата использовать их как местно, так и в пероральной форме, даже если инфекция носит локальный характер. Согласно производителям препаратов по инструкции возможно применение фагов перорально для лечения мочеполовых (цистит, пиелит, пиелонефрит, эндометрит, сальпингоофорит), кишечных и прочих инфекций. В зарубежной и отечественной научно-медицинской практике накоплен значительный опыт применения фагов для терапии заболеваний бактериальной природы [7], [10], [11]. Соблюдение необходимых рекомендаций по применению этих препаратов позволяет достичь хорошего лечебного эффекта [3].
Так, О.В. Вертакова (2017) при лечении пациентов с хронической инфекцией глотки на фоне общесоматических заболеваний проводила курсы местной аппликации фагов в сочетании с веществами, позволяющими фиксировать данные препараты в лакунах небных миндалин, тем самым пролонгирую их антибактериальный эффект. По результатам проведенного бактериологического исследования на базе городской больницы города Новосибирск, автор установила, что проводимые 2-6 раз в год курсы антибактериальной терапии у пациентов с хронической инфекции глотки, приводят к дисбактериозу слизистой с ростом условно-патогенной микрофлоры, что требует коррекции и хорошо достигается за счет включения в схему лечения активных пробиотиков в жидкой форме (в частности, Bifidum adolescentis MC-42), эффект которых особенно очевиден у лиц с сопутствующей патологией. Кроме того, ученая предложила собственную методику временной интралакунарой фиксации таких препаратов, что позволило снизить частоту субъективных жалоб пациентов практически в 2,25 раза [6].
Заключение
Список литературы / References
Список литературы на английском языке / References in English
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Микрофлора небных миндалин при хроническом тонзиллите
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии





Цель исследования - разработка стандартных подходов к фармакотерапии обострений хронического тонзиллита (ХТ) на основании данных о региональной специфике микробного пейзажа миндалин. Методы исследования: бактериологические исследования мазков со слизистой оболочки глотки у 668 пациентов с разными формами ХТ. В половине случаев ХТ определен Streptococcus pyogenes, в 24,5% - Mycoplasma pneumoniae. Наличие сопутствующей патологии респираторного и пищеварительного трактов у пациентов увеличивает вероятность идентификации энтеробактерий, энтерококков и стафилококков в ассоциации со стрептококками и микоплазмами. Для обоснованного выбора тактики антибиотикотерапии рекомендовано оценивать отягощающий анамнез и проводить бактериологическую диагностику с выделением и определением чувствительности к противомикробным средствам всех возможных патогенов.
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Кафедра оториноларингологии, кафедра клинической фармакологии, бактериологии, аллергологии и иммунологии Ставропольской государственной медицинской академии
Хронический тонзиллит (ХТ) — инфекционно-аллергическое заболевание всего организма с наибольшими проявлениями патологического процесса в лимфоидном аппарате глотки. Выраженность проявлений ХТ обусловлена множественными факторами: индивидуальной реактивностью организма, вирулентностью возбудителей, особенностями окружающей среды, длительностью заболевания и т.д.
Одним из основных факторов, определяющих характер клинических проявлений ХТ, являются микробный пейзаж небных миндалин и вирулентность инфекции. Единого мнения о составе микрофлоры в лакунах небных миндалин в настоящее время нет. Это обусловлено, по-видимому, в первую очередь региональными особенностями микрофлоры, поражающей верхние отделы респираторного тракта, способами ее забора и использованием различных методов исследования патологического содержимого небных миндалин.
Исследования, проведенные в различных регионах России [1—3], подтверждают ведущую роль β-гемолитического стрептококка группы А (БТСА) в этиологии ХТ. Вместе с тем при хронической форме патологии в качестве сопутствующей микрофлоры выявляются различные виды сапрофитных и условно-патогенных микроорганизмов.
Разнообразие микрофлоры в лакунах миндалин у больных, страдающих ХТ в различных климатогеографических регионах, затрудняет выработку стандартных подходов к лечению этого весьма распространенного заболевания.
Цель исследования — разработка стандартных подходов к фармакотерапии ХТ на основании данных о региональной специфике микробного пейзажа миндалин.
Материал и методы
Результаты и обсуждение
Бактериологический диагноз был подтвержден у 425 (63,6%) обследованных. У остальных пациентов обострение процесса, видимо, было связано с вирусной инфекцией. Стрептококковый процесс выявлен у 53% пациентов, причем в подавляющем большинстве случаев выделен ЮГСА, а на долю пневмококка пришлось лишь 7,8% случаев обострений. В 24,5% выделены Mycoplasma pneumoniae. Необходимо отметить, что у 98 (23,1%) пациентов были идентифицированы ассоциации микроорганизмов: в ассоциациях с микоплазмами и стрептококками присутствовали Staphylococcusaureus (26,8% всех случаев ХТ), Enterococcus faecalis (3,5%) и представители Enterobacteriaceae spp. (15,3%).
В зависимости от стадии и выраженности воспалительного процесса в лимфаденоидном аппарате глотки заметно менялся и состав микрофлоры в небных миндалинах. Так, в стадии ремиссии ХТ при стихании воспалительного процесса БГСА составляли 27%, а преобладали микоплазмы, энтеробактерии и стафилококки. При катаральной, фолликулярной и лакунарной ангине удельный вес БГСА заметно повышался и достигал 65% при формировании паратонзиллярного абсцесса. Необходимо отметить, что в ранее проведенном исследовании выявлена корреляция частоты персистенции в миндалинах Mycoplasma pneumoniae с частотой обострений у больных с ХТ [3]. Энтерококки и различные виды энтеробактерий выявлялись только у пациентов с сопутствующей патологией желудочно-кишечного тракта (гастроэзофагеальная рефлюксная болезнь, язвенная болезнь).
При оценке чувствительности микроорганизмов к противомикробным средствам установлено, что БГСА в 100% случаев чувствительны к β-лактамным антибиотикам (пенициллин, амоксициллин и др.), левофлоксацину. Резистентными к эритромицину оказалось 12,4%, а к левомицетину — 38% штаммов БГСА. 33% штаммов Mycoplasma pneumoniae оказались резистентными к эритромицину, по 19,4% — к азитромицину и кларитромицину, 8,3% — к тетрациклинам, 16,3% — к офлоксацину/левофлоксацину и всего 5,6% — к ципрофлоксацину. Все штаммы Staphylococcusaureus оказались β-лактамо-продуцирующими, а резистентных к оксациллину, а значит и ко всем β-лактамным антибиотикам, выделено 7,6%.
Таким образом, основными возбудителями обострений при ХТ остаются БГСА, которые выявляются у большинства пациентов, причем с увеличением тяжести процесса доля стрептококков только увеличивается. Частое выявление стафилококков, продуцирующих β-лактамазы, заставляют рассматривать в качестве стартовой терапии назначение защищенных аминопенициллинов. Заметную роль в формировании воспалительного процесса, по-видимому, играет Mycoplasma pneumoniae, а у пациентов с сопутствующей патологией желудочно-кишечного тракта — энтерококки, энтеробактерии. Различный уровень резистентности микроорганизмов позволяет рекомендовать проведение бактериологической диагностики отделяемого из лакун миндалин перед выбором рациональной тактики антибактериальной терапии.
По результатам бактериологической диагностики выбор терапии рекомендуется строить на основании выявленного характера микроорганизмов и уровня их резистентности к противомикробным препаратам. В частности, стрептококковый процесс требует 10-дневной терапии феноксиметилпеницилином или амоксициллином. В случае выявления ассоциации стрептококков со стафилококками, энтерококками или энтеробактериями стартовым следует рассматривать амоксициллин/клавуланат. При микоплазмозах рекомендуется использовать макролидные антибиотики либо фторхинолоны.
Выводы
1. В обязательный перечень диагностических процедур у больных с ХТ следует включать бактериологическое исследование с выявлением всех возможных возбудителей обострений (включая стрептококки, микоплазмы).
2. Выбор тактики антибиотикотерапии (амоксициллин либо амоксициллин/клавуланат, макролиды или фторхинолоны), рекомендованной стандартами, должен строиться с учетом индивидуального микробного пейзажа в каждом случае ХТ.
СОСТОЯНИЕ МИКРОФЛОРЫ КИШЕЧНИКА У БОЛЬНЫХ ХРОНИЧЕСКИМ ТОНЗИЛЛИТОМ ПРИ КОМПЛЕКСНОЙ ЭТИОТРОПНОЙ ТЕРАПИИ

"Любой эпизод острого заболевания и обострение хронического инфекционного процесса приводит к сдвигу в эндобиоценозе. Немаловажным фактором воздействия на микробиоценоз являются антимикробные препараты, однако, при остром и хроническом тонзиллите, острых респираторных инфекциях и других заболеваниях верхних дыхательных путей врачи не придают значения этим изменениям".
ПРОБИОТИКИ И ХРОНИЧЕСКИЙ ТОНЗИЛЛИТ
Примечание редактора

Хронический тонзиллит — длительное воспаление глоточной и нёбных миндалин (от лат. tonsollitae — миндалевидные железы). Развивается после перенесённой ангины и других инфекционных болезней, сопровождающихся воспалением слизистой оболочки зёва (скарлатина, корь, дифтерия), или без предшествующего острого заболевания.
Для простой формы хронического тонзиллита характерны только местные симптомы (боль в горле и др.), если к ним присоединяются общие явления (стойкий шейный лимфаденит, повышенная температура тела, изменения со стороны сердца и т.д.), такая форма называется токсико-аллергической.
Хронический тонзиллит может быть вызван различными инфекциями. Среди патогенов при хроническом тонзиллите наиболее часто обнаруживают стафилококки, стрептококки, пневмококки, гемофильную палочку, моракселлу, аденовирусы, вирус Эпштейна — Барр (ВЭБ), вирусы Коксаки, вирус герпеса, различные анаэробы, микоплазмы, хламидии, грибы.
ВАЖНОЕ ЗАМЕЧАНИЕ К ИССЛЕДОВАНИЮ!
Стоит отметить, что приведенное ниже исследование, в части касаемой применения пробиотиков, привязано к использованию коммерческого препарата Линекс. Проведение исследований под конкретный препарат - это общепринятая и вполне оправданная практика. Если посмотреть результаты запросов по данной теме, то можно увидеть, что не только производители Линекса заинтересованы в продвижении своей продукции микробиологического производства. Таким примером являются, например, рекомендации по использованию пробиотического препарата Бифидум БАГ при профилактике и лечении тонзиллита .
Однако с учетом того, что капсулированная форма Линекса, использованная в исследовании, состоит из таких видов пробиотических микроорганизмов, как Lactobacillus acidophilus, Bifidobacterium infantis, Enterococcus faecium, то опираясь на результаты работы можно предположить, что эффективность пробиотикотерапии можно повысить. Это следует из того, что жидкая форма пробиотиков (в отличие от капсулированной) помимо толстого кишечника активно воздействует и на тонкий кишечник, где происходят все значимые биохимические и микробные процессы (т онкий кишечник отдельно (!) упоминается в исследовании).
Кроме того, в работе особо отмечается прогрессивное снижение общего количества микроорганизмов в тонкой кишке на фоне терапии основного заболевания, преимущественно за счет уменьшения численности Lactobacillus, Bifidobacterium и Propinibacterium freudenreichii . Пробиотические культуры классических (молочных) пропионовоксилых бактерий (ПКБ) P. freudenreichii в описанном исследовании 2016 года не использовались. И здесь стоит отметить, что б иоконцентраты с ПКБ от ООО "Пропионикс", обладающие бифидогенными свойствами восполняют дефицит не только ПКБ, но и бифидобактерий . Более того, при снижении кол-ва Lactobacillus в кишечнике, их восстановление с помощью приема лактопрепаратов происходит намного быстрее в присутствии ПКБ, которые по последним данным 2018 г. входят в систему защиты благоприятной для человека микробиоты (Рыжкова Е.П. Классические пропионовокислые бактерии как пробиотики / Учебное пособие – М.: изд. Биологический факультет МГУ, 2018 – 52с.).
И последнее, что хотелось подчеркнуть, это указание на устойчивость бактериальных штаммов из Линекса к антимикробным препаратам (как на преимущество), а также на их совокупную эффективность. Однако указанная устойчивость не является исключительным свойством бренда, т.к. многие штаммы полезных микроорганизмов, используемые в современных жидких пробиотиках, помимо устойчивости к агресивной среде ЖКТ, устойчивы и к антибиотикам, что допускает их совместное использование в случае необходимости. Так, например, классические пропионовые бактерии P. freudenreichii устойчивы к пенициллину, хлортетра-циклину, хлормицетину, стрептомицину, эритромицину, грамицидину С, полимиксину и некоторым др., а потому возможно их совместное применение. Тоже относится и к синергизму (совокупной полезной активности): например, совместное использование бифидобактерий и пропионовокислых (толерантных к лактобациллам) выражается в повышении их антимутагенного, в т.ч. антибиотического (бактерицидного и бактериостатического в отношении патогенов ) эффекта, в т.ч. наблюдается усиление антиоксидантной и иммуномодулирующей активности.
ИССЛЕДОВАНИЕ

Способность организма к ответу на инфекционный агент во многом определяется состоянием эндобиоценоза, не только являющегося важным компонентом надежной внутренней системы контроля организма за инфекциями, но и обеспечивающим становление тонких механизмов гомеостаза, саморегуляции [1]. Нормальные симбиотические отношения допускают существенные колебания количественного состава того или иного эпитопа микробиоценоза, однако, всегда в рамках определенного баланса, прежде всего функционального, между различными видами [2]. Любой эпизод острого заболевания, в том числе и обострение хронического инфекционного процесса, является толчком к изменению среды организма, сдвигу в эндобиоценозе. Немаловажным фактором воздействия на микробиоценоз являются антимикробные препараты, однако, при хроническом и остром тонзиллите, острых респираторных инфекциях и других заболеваниях верхних дыхательных путей врачи не придают значения этим изменениям. Вместе с тем, сам факт обнаружения количественных и качественных изменений в биотопах без рассмотрения их в контексте клинических данных не является решающим аргументом в определении глубины нарушений и обосновании необходимости лечебного вмешательства. Необходима целостная оценка организма.
Цель исследования
Дать оценку количественного и качественного состава микрофлоры кишечника у больных хроническим тонзиллитом в стадии обострения на фоне базисной терапии и в комплексе с пробиотиком Линекс.
Материалы и методы
Обследовано 62 больных острым бактериальным тонзиллитом или хроническим в стадии обострения,в возрасте от 18 до 43 лет (в среднем 27,7 ± 1,1 года),из них: 32 (52,8%) мужчины и 30 (47,2%) женщин,находившихся на обследовании и лечении в клиникеинфекционных болезней ВМедА им. С.М. Кирова.
Критериями включения в настоящее исследованиебыли возраст от 18 до 45 лет, диагностированныйтонзиллит, пероральная моноантибиотикотерапия, атакже добровольное информированное согласие пациентов на проведение исследования.
Критериями исключения из настоящего исследования были: смена антибиотика во время лечения; сопутствующие заболевания желудочно-кишечного тракта в стадии обострения; использование других антибиотиков, про,- пре,- синбиотических препаратов на момент исследования, или в течение 2-х недель до его начала; наличие тяжелой сопутствующей патологии; неспособность самостоятельного приема лекарственных препаратов, заполнения анкет, а также письменного согласия на проведение исследования; добровольный отказ пациента от проведения исследования.
В зависимости от терапии, всех пациентов рандомизировали на две группы, сопоставимые по полу, возрасту, этиологии заболевания, тяжести и длительности течения с момента манифестации признаков тонзиллита. Результаты исследования регистрировали и оценивали до лечения и на 5-й день наблюдения.
В составе базисной терапии, включавшей режим, диетическое питание (стол №15) по М.И. Певзнеру , все пациенты получали трехдневный курс азитромицина по 500 мг в сутки.
1-ю группу составили 32 больных ХТ (группа Л), программа лечения которых, помимо базисной терапии, включала двухнедельный пероральный прием пробиотического поликомпонентного препарата Линекс (Lactobacillus acidophilus, Bifidobacterium infantis, Enterococcus faecium) по 2 капсулы 3 раза в день после еды.
2-ю группу составили 30 больных ХТ (группа АБ), программа лечения которых включала только базисную терапию.
Результаты и обсуждение
Таблица 1 Состав микрофлоры толстой кишки у больных тонзиллитом при комплексной этиотропной терапии, lg КОЕ/г
У больных как 1-ой (Л), так и 2-ой (АБ) группы, после проведенного лечения наиболее выраженным было снижение количества кишечной палочки с нормальной ферментативной активностью (7,6±0,2 lg КОЕ/г и 6,7±0,3 lg КОЕ/г в первой группе и в группе сравнения – 9,0±0,2 lg КОЕ/г и 6,2±0,3 lg КОЕ/г (p
После завершения антибактериальной терапии основного заболевания в комплексе с пробиотиком, у тех пациентов первой группы, у которых до начала терапии обнаружены грибы рода Candida, на 5-й день исследования их рост не отмечался.
В группе больных, получавших только этиотропную терапию (2-я группа, АБ), выявлено значительное снижение всех определявшихся представителей нормальной микробиоты кишечника, а также условно-патогенной флоры.
Помимо выраженного уменьшения количества Bifidobacterium spp. (9,1±0,2 lg КОЕ/г и 6,4±0,3 lg КОЕ/г; p
По данным масс-спектрометрии при обострении ХТ в тонкой кишке наблюдается снижение обще численности микроорганизмов преимущественно за счет уменьшения количества Lactobacillus, Bifidobacterium и Propinibacterium freudenreichii на фоне избыточного роста Eubacterium и Staphylococcus (табл. 2). Кроме того, возросла численность анаэробов Bacteroides fragilis, Porphyromonas и Propinobacterium acnes, при периодическом избытке Bacillus megaterium, Bacillus cereus, C. difficile, а также Streptococcus mutans, Prevotella и Bacteroides.
Уровень эндотоксинемии у больных 1-й группы снижался к 5-м суткам лечения с 1,024718 до 0,99435 (р>0,05), тогда как во 2-й группе отмечалось его увеличение с 0,299363 до 0,32557 (р>0,05).
Содержание кокков, бацилл и коринебактерий у пациентов 1-й группы на фоне терапии увеличилось, тогда, как у больных 2-й группы отмечалось снижение. Так, уровень Streptococcus spp. в 1-й группе увеличился в 9 раз по сравнению с исходным (5,675406 и 43,60326, p 0,05).
Уровень Lactococcus у больных 1-й группы превысил референсные значения (с 322,0784 до 571,4638, р 0,05).
Численность Lactobacillus к 5-м суткам терапии в обеих группах не достигало нормы, однако в 1-й группе выявлено увеличение их численности с 1309,728 до 1424,912. В то же время при монотерапии антибиотиком отмечено снижение числа лактобацилл с 886,0019 до 847,7987.
Содержание Bifidobacterium оставалось без существенных изменений как в группе получавших Линекс® (1129,789 и на 5-е сутки 1187,419), так и в группе контроля (с 544,8046 до 648,9446).
На фоне проведенной терапии у пациентов 1-й группы выявлено увеличение численности популяции микрогрибов, продуцирующих кампестерол и ситостерол, однако различия были не значимы – с 161,4923 до 168,6245 и с 257,5063 до 329,3031, соответственно (p>0,05). У больных 2-й группы отмечалось снижение этих показателей, но не достигающее уровня достоверности (p>0,05). В обеих группах наблюдался рост численности дрожжеподобных грибов рода Candida с 109,1159 до 173,3375, (р 0,05) – во 2-й.
На фоне приема пробиотического препарата выявлено незначительное снижение количества Staphylococcus, Bacillus cereus и Corineform group (p>0,05) и достоверное уменьшение популяции Bacillus megaterium – в 4,5 раза (p
Таблица 2 Состав микрофлоры толстой кишки у больных тонзиллитом при комплексной этиотропной терапии
На 5-й день терапии у больных 1-й группы име- ло место увеличение популяции большинства анаэробов. Общее количество Eubacterium, Clostridium group, Propionibacterium acnes, Prevotella и Fusobacterium выросло, однако изменения численности некоторых представителей этих групп было недостаточно значимым. Количество Eubacterium lentum и Propionibacterium jensenii выросло в 2 раза, а Bacteroides fragilis – в 3,5. У пациентов 2-й группы концентрация этих микроорганизмов снизилась, либо сохранялась на прежнем уровне, а количество представителей рода Clostridium даже несколько увеличилось. В то же время у пациентов этой группы отмечался значительный рост Bacteroides ruminicola, уровень которых вырос в 3 раза и отмечалось двукратное увеличение числа Propionibacterium acnes.
До начала терапии у всех пациентов выявлено низкое содержание основных представителей аэробных актинобактерий. Численность Actinomyces и Pseudonocardia была снижена в 3 раза, по сравнению с нормальными показателями, без статистически значимого различия в группах сравнения. Количество Rhodococcus было снижено в 4,5 раза, тогда как Actinomycetes были обнаружены только у одного пациента 2-й группы в низкой концентрации. После проведенного лечения обращает на себя существенная разница показателей в группах сравнениях. Так, у пациентов 1-й группы на 5-й день исследования отмечался рост Streptomyces (с 104,4846 до 128,1612, p 0,05), тогда как у больных 2-й группы наблюдалось снижение количества этих микроорганизмов на фоне приема антибиотика. И, наоборот, у представителей 1-й группы на фоне лечения обнаруживалось снижение количества Nocardia asteroides, тогда как в группе сравнения выявлено ее увеличение.
До начала терапии только в одном случае в 1-й группе в тонкой кишке выявлялась E.coli в количестве 3,5×107 КОЕ. Однако к 5-му дню наблюдения отмечено снижение содержания этого микроорганизма до нормальных значений.
Во всех случаях не были обнаружены представители рода Enterococcus, но были выделены грамотрицательные палочки. В 1-й группе, на фоне лечения, количество Pseudomonas aeruginosa выросло с 0,08507 до 0,140437 (p>0,05), у одного пациента 2-й группы они появились на фоне приема антибиотика. Также у больных 1-й группы отмечался рост Porphyromonas (с 0,195804 до 0,895437, p>0,05), вместе с тем количество Acinetobacter у этих пациентов на фоне терапии снижалось (с 0,621489 до 0,274079, p>0,05).
Заключение
Проведенные исследования выявили значительное снижение всех определяемых представителей нормальной микробиоты кишечника и условно-патогенной флоры у пациентов 2-й группы.
Установлено, что на фоне терапии основного заболевания отмечается прогрессивное снижение общего количества микроорганизмов в тонкой кишке ,преимущественно за счет уменьшения численности Lactobacillus, Bifidobacterium и Propinibacterium freudenreichii , в сочетании с избыточным ростом Eubacterium и Staphylococcus. Кроме того, растет численность анаэробов Bacteroides fragilis, Porphyromonas, Propinobacterium acnes, Bacillus megaterium, Bacillus cereus, C. difficile, а также Streptococcus mutans, Prevotella и Bacteroides.
После проведенного лечения у пациентов обеих групп определялись значительные изменения состава микробных маркеров в крови. Из 56 определяемых показателей в 1-й группе наблюдения либо сохранялись на высоком уровне, либо стали превышать нормальные значения по 33 параметрам, тогда как во 2-ой группе – по 24. Уровень эндотоксинемии при назначении препарата Линекс снижался, тогда как при терапии только антибиотиком, этот показатель возрастал.
Микробиологическое исследование кала является эталоном оценки качественного и количественного состава микробиоты толстой кишки. В связи с объективными трудностями получения материала для исследования из тонкой кишки, в настоящее время для оценки состава микробиоценоза этого отдела кишечника все шире используется анализ микробных метаболитов крови методом масс-спектрометрии. По данным обоих этих методов, у больных острым бактериальным тонзиллитом и при обострении хронического тонзиллита в различных отделах кишечника выявлено снижение количества представителей собственно аутохтонной микрофлоры с одновременным доминированием анаэробов, обладающих провоспалительной и протеолитической активностью.
Полученные данные позволяют рассматривать антибиотики и пробиотики не как несовместимые группы препаратов или антагонисты. Там, где начинаются проблемы применения одной из групп лекарственных средств, там могут начинаться преимущества другой. И лишь совместное их рациональное использование создает предпосылку достижения максимального результата в широком спектре клинических ситуаций [3].
Пробиотики, состоящие из нескольких штаммов, за счет особенностей природной устойчивости к ряду антимикробных препаратов получают некоторые преимущества перед индигенной микрофлорой. В такой ситуации пробиотическая поддержка микробиоценоза реализует сложный комплекс пробиотических свойств как каждого штамма, входящего в препарат, так и совокупной активности пробиотической композиции. Среди них – обеспечение стабильности индивидуального микробиологического ядра кишечного микробиоценоза, ферментативная активность, обеспечение синтеза витаминов, резистентности эпителиального барьера и другие.
Литература
1. Жданов К.В., Захаренко С.М., Гусев Д.А., Куртуков М.В., Сукачев В.С., Сигидаев А.С. Особенности микроэкологии кишечника у больных циррозом печени. Лечение и профилактика. – 2012. - 3(4). – С. 36-49.
3. Захаренко С.М., Суворов А.Н. Антибиотики, пробиотики, пребиотики: друзья или враги? // Consilium Medicum том 11/ №8 2009. - С.47-51.
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ

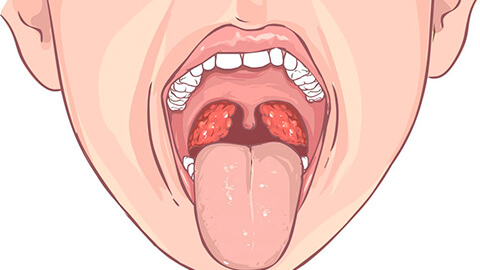
Хронический тонзиллит — это вялотекущий воспалительный процесс, который происходит в небных миндалинах. Больные хроническим тонзиллитом на протяжение долгого времени чувствуют дискомфорт и боли в горле, у них наблюдается повышение температуры, покраснение миндалин с образованием гнойных пробок в лакунах.
Что такое миндалины и как появляется хронический тонзиллит
Небные миндалины состоят из лимфоидной ткани, которая выполняет защитную функцию. Миндалин пронизывают глубокие и сложные по строению каналы — крипты, которые заканчиваются на поверхности миндалин лакунами — специальными углублениями, через которые содержимое лакун выводится наружу. В среднем, на миндалине находится от 2 до 8 лакун. Считается, что чем больше размер лакун, тем проще и быстрее выводятся выделения.
Кроме небных миндалин, в глотке есть другие образования, выполняющие защитную функцию: на корне языка расположена язычная миндалина, на задней стенке носоглотки — аденоидные вегетации (аденоиды), в глубине носоглотки вокруг слуховой трубы — трубные миндалины.
Воспаление тканей небных миндалин называют тонзиллитом, а затяжной воспалительный процесс — хроническим тонзиллитом.
Виды хронического тонзиллита
В зависимости от того, как протекает болезнь, хронический тонзиллит может быть:
- компенсированным;
- декомпенсированным;
- затяжным;
- рецидивирующим;
- токсико-аллергическим.
Компенсированный тонзиллит протекает скрытно: миндалины не беспокоят дискомфортом и воспалениями, у больного не отмечается повышения температуры, однако при внешнем осмотре видны покраснения, миндалины, как правило, увеличены.
При хроническом тонзиллите время от времени появляется дискомфорт в горле — першение, небольшие боли. Обострения заболевания — ангины — беспокоят больного при рецидивирующей форме тонзиллита.
Токсико-аллергический хронический тонзиллит делят на две формы:
- первая форма характеризуется добавлением к основным симптомам таких осложнений, как боли в суставах, повышение температуры, боли в области сердца без ухудшения показателей электрокардиограммы, повышением утомляемости;
- вторая форма превращает небные миндалины в устойчивый источник инфекции, которая разносится по всему организму и осложняет работу сердца, почек, суставов, печени. Больной чувствует себя утомленным, снижается работоспособность, нарушается ритм сердца, воспаляются суставы, обостряются болезни мочеполовой сферы.
В зависимости от места распространения воспалительного процесса хронический тонзиллит может быть:
- лакунарным, при котором воспаление затрагивает лакуны — углубления в миндалинах;
- лакунарно-паренхиматозным, когда воспаление происходит в лакунах и лимфоидной ткани миндалин;
- флегмонозным, когда воспалительный процесс сопровождается гнойным расплавлением тканей;
- гипертрофическим, сопровождающимся усиленным разрастанием тканей миндалин и окружающих поверхностей носоглотки.
Причины появления хронического тонзиллита
Хронические тонзиллиты в большинстве случаев развиваются после перенесения больным острой формы заболевания — острого тонзиллита или ангины. Недолеченная ангина может появиться вновь или обостриться из-за пробок в лакунах и криптах миндалин, которые закупориваются казеозно-некротическими массами — гнойными выделениями, отходами жизнедеятельности бактерий и вирусов.
Основными возбудителями болезни чаще всего являются:
- вирусы — аденовирусы, обычный герпес, вирус Эпштейна — Барра;
- бактерии — пневмококки, стрептококки, стафилококки, моракселла, хламидии;
- грибки.
Кроме того, повлиять на появление хронического тонзиллита могут следующие факторы:
- несоблюдение техники безопасности на производствах: большое количество пыли, наличие задымленности, загазованности, взвесей вредных веществ во вдыхаемом воздухе;
- хронические заболевания полости рта, ушей, носоглотки: хронические отиты, синуситы, кариес, пульпит, пародонтиты и пародонтоз, при которых гнойные выделения попадают на миндалины и провоцируют развитие воспалительного процесса;
- снижение иммунной функции небных миндалины: защитные вещества, выделяемые лимфоидной тканью, больше не могут справляться с большим количеством бактерий и вирусов, которые, в свою очередь, скапливаются и размножаются;
- злоупотребление средствами бытовой химии;
- употребление в пищу еды, содержащей малое количество витаминов и минералов, нерегулярное питание, некачественная еда;
- фактор наследственности: кто-либо из родителей страдал или страдает хроническим воспалением миндалин;
- вредные привычки — употребление алкоголя и курение, которые помимо негативного влияния на иммунитет, осложняют течение заболевания;
- частые стрессовые ситуации, длительное нахождение в состоянии сильного эмоционального напряжения;
- отсутствие нормального режима труда и отдыха: недосыпание, переутомление.
Симптомы хронического тонзиллита

Определить самостоятельно, есть ли у человека хронический тонзиллит, крайне сложно: этим должен заниматься опытный врач-отоларинголог. Однако, необходимо знать основные симптомы и признаки заболевания, при появлении которых нужно сразу обратиться к врачу:
- головные боли;
- неприятное ощущение инородных тел в горле: крошек с острыми краями, мелких фрагментов пищи (вызывается скоплением на лакунах и в скриптах гнилостных отложений и пробок из слизи, продуктов жизнедеятельности бактерий и вирусов);
- стойкая сыпь на коже, которая долго не проходит, при условии, что никаких высыпаний у больного раньше не было;
- повышение температуры тела;
- боль в области поясницы: хронические воспаления миндалин нередко вызывают осложнения в работе почек;
- боли в области сердца, неустойчивый сердечный ритм;
- боли в мышцах и суставах: хронические тонзиллиты часто ведут к ревматическому поражению суставов;
- быстрая утомляемость, пониженная работоспособность, плохое настроение;
- увеличение лимфоузлов за ушами и на шее;
- увеличение небных миндалин;
- появление на миндалинах рубцов, спаек, пленок;
- пробки в лакунах — образования желтого, светло-коричневого, коричневого оттенков твердой или кашицеобразной консистенции.
Большинство дополнительных признаков хронического тонзиллита появляется при сбоях в работе других органов и жизненно важных систем: сердца, почек, кровеносных сосудов, суставов и иммунной системы.
Например, в воспаленных миндалинах могут паразитировать бета-гемолитические стрептококки группы А, который по строению белка схож с соединительной тканью сердца. При тонзиллите иммунная система может ошибочно атаковать ткани сердца, пытаясь подавить микроорганизмы, вызвавшие воспаление небных миндалин, вследствие этого появляются неприятные ощущуения в области сердца, ухудшается общее состояние, появляется опасность возникновения серьезных сердечных заболеваний — миокардита и бактериального эндокардита.
Диагностика хронического тонзиллита
Правильно установить наличие, форму и тип хронического тонзиллита может только врач-отоларинголог в , поэтому своевременное обращение в поликлинику — залог быстрой постановки диагноза и назначения лечения.
Наиболее точные признаки хронического заболевания получают, изучая историю болезни и проводя наружный осмотр небных миндалин: на наибольшую вероятность тонзиллита будут указывать частые заболевания ангиной, а также гнойные отложения и пробки в лакунах и криптах.
Кроме изучения анамнеза и осмотра, применяют лабораторное исследование крови и бакпосев из зева на флору и чувствительность к антибиотикам.
Лечение хронического тонзиллита
Для лечения хронических тонзиллитов применяют консервативный и хирургический методы. Врач-отоларинголог назначает хирургическую операцию только в крайнем случае: небные миндалины играют важную роль в иммунной системе человека, защищая носоглотку от проникновения болезнетворных микроорганизмов. Удаление миндалин может проводиться только в том случае, если они в силу патологического изменения ткани больше не могут выполнять свою защитную функцию. Принимая решение о хирургическом удалении небных миндалин, нужно еще раз вспомнить, что это — важнейшая часть общего иммунной системы организма, ответственная за защиту органов носоглотки.
Лечение хронического тонзиллита проводится амбулаторно в медицинском учреждении врачом-отоларингологом. Процесс лечения можно разделить на несколько этапов, каждый из которых выполняет свою функцию.
Этап первый: промывание небных миндалин
На данном этапе больному промывают миндалины, освобождая лакуны и крипты от казеозно-некротических масс и пробок. При отсутствии современного оборудования такая работа, как правило, выполняется обычным шприцем: в него набирают дезинфицирующий раствор и поршнем выдавливают его на поверхность миндалин и в лакуны. Недостатки такого метода — слишком слабое давление струи раствора, которое не позволяет глубоко промыть и очистить крипты, а также возможное возникновение рвотного рефлекса, вызываемого прикосновением шприца к миндалинам.
Этап второй: обработка антисептиком
После очищения миндалин на них при помощи ультразвука наносят антисептик: ультразвуковые волны преобразуют антисептический раствор в пар, который под давлением наносится на поверхность миндалин.
Для закрепления антибактериального эффекта, миндалины обрабатывают раствором Люголя: в его состав входят йод и йодид калия, которые обладают мощным антибактериальным свойством.
Этап третий: физиотерапия
Одним из эффективных, безболезненных и не имеющих побочных эффектов методов физиотерапии является лазеротерапия. Ее положительные свойства:
- обезболивание;
- активизация метаболических процессов;
- улучшение обмена веществ в пораженном органе;
- регенерация пораженных тканей;
- повышение иммунитета;
- значительное улучшение свойств и функций крови и кровеносных сосудов.
Для нейтрализации вредных микроорганизмов в ротовой полости, используется ультрафиолетовое излучение.
Количество процедур для промывания, обработки антисептиками и физиотерапии назначается врачом в индивидуальном порядке. В среднем для того, чтобы полностью очистить миндалины и вернуть им способность самоочищаться, промывание нужно повторить минимум 10-15 раз. Для того, чтобы полностью исключить необходимость хирургического вмешательства, курсы консервативного лечения повторяют несколько раз в год.
В крайних случаях, когда лимфоидная ткань миндалин в результате болезни замещена соединительной тканью и миндалины перестают защищать организм от микроорганизмов, являясь постоянным источником возбудителей болезней, назначают тонзиллэктомию. Тонзиллэктомия — хирургическая операция по удалению небных миндалин. Она выполняется в условиях стационара под местным или общим обезболиванием.
Профилактика хронического тонзиллита
Предупредительные меры по избежанию рецидива воспалительного процесса в области небных миндалин включает в себя несколько комплексных мер:
Читайте также:

