Обнаружение гельминтов в биологическом материале объектах окружающей среды реферат
Обновлено: 02.07.2024
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика гельминтозов и протозоозов
Дата введения: с момента утверждения
1. Разработаны Институтом медицинской паразитологии и тропической медицины им.Е.И.Марциновского ГБОУ ВПО Первого Московского государственного медицинского университета (МГМУ) им.И.М.Сеченова (В.П.Сергиев, М.Н.Лебедева, В.Г.Супряга, Ф.П.Коваленко, Е.Н.Морозов, Е.Н.Понировский, Т.В.Продеус, Л.В.Федянина, А.А.Фролова, Е.Н.Жиренкина, К.Ю.Кузнецова, И.В.Кухалева, В.М.Ракова, Н.А.Турбабина, Е.А.Черникова, В.Д.Завойкин, О.П.Зеля, Л.Ф.Морозова, Г.Л.Плющева, Н.Р.Цаава); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Т.М.Гузеева); ФБУЗ "Федеральный центр гигиены и эпидемиологии" Роспотребнадзора (Т.Г.Сыскова); кафедрой факультетской хирургии N 1 Первого МГМУ им.И.М.Сеченова (Г.X.Мусаев); отделом хирургии печени НИЦ Первого МГМУ им.И.М.Сеченова (Г.Г.Ахаладзе); ФБУН "Ростовский НИИ микробиологии и паразитологии" Роспотребнадзора (Т.И.Твердохлебова, Ю.И.Васерин, Е.П.Хроменкова, С.А.Нагорный, Л.Л.Димидова, А.В.Упырев, Л.В.Шишканова, Е.Ю.Криворотова, А.С.Кожухина); Военно-медицинской академией им.С.М.Кирова (С.С.Козлов); НИИ эпидемиологии и микробиологии им.Н.Ф.Гамалеи (Д.Б.Гончаров); Российским научным центром хирургии им.Б.В.Петровского РАМН (Г.А.Шатверян); кафедрой молекулярной биологии МГУ им.М.В.Ломоносова (А.А.Колесников); кафедрой тропических и паразитарных болезней Российской медицинской академии последипломного образования (А.Е.Беляев); Управлением Роспотребнадзора по городу Москве (Т.Н.Иванова); ФБУЗ "Центр гигиены и эпидемиологии в городе Москве" (Н.И.Тимошенко).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 29 октября 2013 г. N 3).
3. Утверждены врио руководителя Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главного государственного санитарного врача Российской Федерации А.Ю.Поповой 26 ноября 2013 г.
4. Введены взамен МУК 4.2.735-99 "Паразитологические методы диагностики гельминтозов и протозоозов".
2-е издание, исправленное и дополненное
Область применения
1. Методические указания (далее - МУК) устанавливают порядок применения метода отбора проб и методов лабораторных исследований биологического материала от людей с целью обнаружения возбудителей гельминтозов и протозоозов, определения их видовой принадлежности.
2. Методические указания предназначены для специалистов паразитологических, микробиологических лабораторий санитарно-эпидемиологической службы, медицинских организаций независимо от их организационно-правовых форм, индивидуальных предпринимателей, а также научно-исследовательских институтов, осуществляющих лабораторную диагностику гельминтозов и протозоозов.
3. Методические указания носят рекомендательный характер.
Раздел 1. Лабораторная диагностика кишечных гельминтозов
1.1. Лабораторная диагностика кишечных гельминтов
Гельминты человека относятся преимущественно к двум типам червей: типу плоских червей Plathelminthes и типу круглых червей Nemathelminthes. Тип плоских червей, поражающих человека, включают два класса: ленточные черви - Cestoda и сосальщики - Trematoda. Тип круглых червей включает в себя один класс, имеющий медицинское значение, собственно класс Nematoda.
Большинство гельминтозов можно диагностировать прямыми методами, то есть по обнаружению в биологическом материале (кал, моча, мокрота, дуоденальное содержимое и пр.) гельминтов на разных стадиях развития (взрослых особей, яиц или личинок). Для этого используют макроскопические и микроскопические методы диагностики.
Отбор проб и условия доставки биологического материала в лабораторию для паразитологического исследования
Материалом для лабораторных паразитологических исследований на гельминтозы служит различный биологический материал: кал, кровь, моча, мокрота, лаважная жидкость, дуоденальное содержимое, содержимое кист, биопсионный или постоперационный материал, гистологические препараты внутренних органов и тканей и другой.
Отбор проб кала
Кал после дефекации отбирают из разных участков в количестве не менее 50 г.
Пробу помещают в чистую сухую, стеклянную или пластмассовую посуду с крышками.
Проба кала доставляется в лабораторию и исследуется в день дефекации.
При невозможности исследования пробы кала сразу после дефекации или в день поступления материала в лабораторию, пробу кала хранят при температуре от 0 до 4°С не более суток или собирают в консервант (прилож.8).
Отбор дуоденального содержимого (желчь )
Материал доставляется в лабораторию в чистых химических или центрифужных пробирках сразу после зондирования пациента натощак.
Доставляют все три фракции (порции "А", "В", "С") и исследуют сразу после поступления в лабораторию.
Порцию "А" доставляют для исследования на наличие возбудителей стронгилоидоза, трихостронгилоидозов, анкилостомидозов.
Порции "В" и "С" доставляют для исследования на яйца гельминтов, паразитирующих в протоках печени и желчном пузыре.
Отбор проб мокроты и лаважной жидкости
В лабораторию доставляется мокрота, выделенная при откашливании (не слюна и не слизь с носоглотки), в стерильной посуде с крышками. Проба мокроты исследуется сразу после поступления в лабораторию.
Лаважная жидкость в лабораторию доставляется в стерильной посуде и исследуется в день доставки.
Отбор проб мочи
В лабораторию доставляется моча, собранная между 10 ч утра и 14 ч дня, или все порции суточной мочи; желательно собрать мочу после физической нагрузки (например, 20-30 приседаний).
1.1.1. Методы исследования кала на яйца гельминтов
1.1.1.1. Макроскопические методы
Макроскопические методы служат для обнаружения в кале целых половозрелых гельминтов или их фрагментов невооруженным глазом или с помощью ручной лупы и/или стереомикроскопа.
На поверхности кала после дефекации можно видеть активно ползающих остриц; иногда выделяются с калом аскариды; у пациентов с дифиллоботриозом могут выделяться обрывки стробилы лентеца, а у инвазированных свиным цепнем с калом часто отходят членики гельминта. У инвазированных бычьим цепнем также происходит отхождение члеников, однако значительная доля члеников отходит активно вне дефекации. В живом состоянии такие членики пациенты часто сравнивают с лапшой. Пациент может доставить членики в лабораторию, но если они подсохли, то на лапшу они перестают быть похожи, а выглядят скорее как чешуйки размером с ноготь мизинца. Перед исследованием такой членик следует размочить в физиологическом растворе. Кроме того, за отхождением взрослых гельминтов необходимо следить при оценке результатов лечения.
Необходимые реактивы и оборудование
Предметные стекла большие (610; 812 см)
Лупа, микроскоп и бинокулярный стереоскопический микроскоп типа МБС
Подготовка к исследованию
1) Извлекать пинцетом или препаровальной иглой все подозрительные частицы и крупные образования на отдельное предметное стекло или чашку Петри.
2) Образования, подозрительные на фрагменты гельминтов, рассматривать под микроскопом МБС или под лупой между двумя предметными стеклами.
3) Мелких гельминтов рассматривать в капле глицерина или физиологического раствора под микроскопом при увеличении: окуляр 7 или 10, объектив 8 или 10.
4) Членики ленточных гельминтов поместить на предметное стекло, подсушить, закрыть другим предметным стеклом, слегка сдавить и рассмотреть строение матки.
5) Микроскопия всех визуально обнаруженных в кале паразитов или фрагментов обязательна для уточнения морфологических особенностей и идентификации паразита.
Применение. Метод применяется при идентификации зрелых паразитов или их фрагментов, например для дифференциальной диагностики члеников цестод (бычьего, свиного цепня и широкого, чаечного лентеца).
1.1.1.2. Микроскопические методы
1.1.1.2.1. Метод толстого мазка под целлофаном по Като и Миура
Толстый мазок представляет собой тонкий слой пробы кала на предметном стекле под гигроскопическим целлофаном, пропитанным смесью глицерина, фенола и малахитового зеленого.
Примечание. Гидрофильный целлофан горит в отличие от полиэтиленовой пленки, которая плавится и непригодна для исследования.
Необходимые реактивы и оборудование
Раствор фенола 6%-й (100 мл дистиллированной воды + 6 г фенола)
Раствор малахитового зеленого 3%-й (2,5 г малахитовой зелени + 75 мл дистиллированной воды)
Обезжиренные предметные стекла
Палочки стеклянные или деревянные
Валик или резиновая пробка
Подготовка к исследованию
Приготовление рабочего раствора Като: 100 мл 6%-го раствора фенола + 100 мл глицерина + 1,2 мл 3%-го раствора малахитового зеленого (раствор можно хранить длительное время в склянке из темного стекла с притертой крышкой).
При отсутствии фенола и малахитовой зелени можно использовать раствор глицерина (50 мл глицерина + 50 мл дистиллированной воды).
Подготовка целлофановых полосок. Нарезать полоски из гидрофильного целлофана, чтобы их размер соответствовал размеру предметного стекла.
1) Полоски поместить в рабочий раствор Като не менее, чем на 24 ч до проведения анализа. В 200 мл рабочего раствора можно обрабатывать до 5 тыс. новых целлофановых полосок.
2) На предметное стекло нанести пробу кала размером с горошину. Весь объем пробы кала растереть индивидуальной стеклянной палочкой по стеклу.
3) Мазок кала накрыть целлофановой полоской, обработанной в растворе.
4) Целлофан сверху притереть резиновой пробкой или специальным валиком, ширина которого соответствует или немного больше ширины предметного стекла, до получения тонкого, равномерного, прозрачного слоя.
5) Препарат просветляется при комнатной температуре в течение 20-30 мин.
6) Микроскопировать при увеличении: объектив 8 или 10, окуляр 7 или 10 (для уточнения морфологического строения яиц гельминтов - объектив 40).
1) Позволяет просмотреть в 20-30 раз больше препаратов кала, чем в нативном мазке без применения гигроскопических целлофановых полосок.
2) Выявляет яйца гельминтов желудочно-кишечного тракта при высокой и средней интенсивности инвазии.
1) Рекомендуется при массовых обследованиях населения на кишечные гельминтозы.
2) При обследованиях населения на анкилостомидозы, трихостронгилидозы и гименолепидоз необходимо учитывать, что применение данного метода имеет ограничения во времени, а именно возбудители указанных инвазий разрушаются в течение 1-2 ч.
1.1.1.2.2. Методы седиментации
Метод формалин-эфирной или уксусной седиментации
В основе методов седиментации (осаждения) лежит разность удельного веса используемых химических реактивов и яиц гельминтов: удельный вес яиц высокий, и они концентрируются в осадке.
3. Микроскопические методы Обнаружение яиц гельминтов
Метод толстого мазка (метод Като)
Метод обогащения
Применение детергентов
Обнаружение личинок гельминтов по
методу Бермана
• Обнаружение личинок гельминтов при
культивировании на фильтровальной
бумаге (метод Харада и Мори)
4. Плоские черви
5. Сосальщики
6. Характерные стадии жизненного цикла
Жизненный цикл трематод
делится на два различных
класса: конечный (при этом
паразит
обитает
в
организме
человека,
домашних
и
диких
животных)
и
промежуточный
(когда
паразиты заселяют тела
пресноводных улиток).
8. Мирацидий
9. Спороцисты
10. Редии
11. Церкарии
12. Метацеркарии
13. Мариты (половозрелые особи)
14. Сосальщики, обитающие в органах
• Печеночные сосальщики (Fasciola hepatica,
Clonorchic Sinensis, Opistorchis felineus and
O. viverrini)
• Кишечные сосальщики (Fasciolopsis buski,
Echinostoma trivolvis, Heterophyes
heterophyes, Metagonimus yokogowai)
• Легочные сосальщики (Paragonimus
westermani)
15. Life cycle
16. Печеночный сосальщик
17. Двуустка китайская (Clonorchis sinesis)
18. Двуустка китайская (Clonorchis sinesis)
19. Opisthorchis felineus и O. viverrini
20. Opisthorchis felineus
21. Кишечные сосальщики
22. Fasciolopsis buski
23. Цикл развития
24. Fasciolopsis buski
25. Легочный сосальщик Paragonimus westermani
26. Легочный сосальщик Paragonimus westermani
27. Schistosoma (жизненный цикл)
28. Schistosoma haematobium
Длина тела самца – 10-15 мм, самки до 20 мм, тело
покрыто шипами
Паразиты всегда встречаются парами
Промежуточные хозяева – пресноводные моллюски
родов Bullinus, Physopsis
Основные хозяева – человек и обезьяна
Взрослые особи живут в организме человека до 40 лет
и локализуются в мелких венах малого таза,
преимущественно мочевого пузыря и матки
Половозрелая самка откладывает до 300 яиц в сутки,
которые попадают во внешнюю среду с мочой
29. Симптоматика
Зуд и покалывание в месте внедрения церкариев в кожу,
сыпь;
В период миграции молодых шистосом появляется кашель
с мокротой и даже кровохарканьем, симптомы
бронхиальной астмы;
Головная боль;
Слабость;
Снижение аппетита;
Дизурия (нарушение мочеиспускания);
Гематурия (выделение крови в конце мочеиспускания);
Болезненное мочеиспускание
30. Осложнения
Пиелонефрит;
Гнойные воспалительные процессы почек;
Поражение предстательной железы и семенных пузырьков;
Отек мошонки;
Частичная или полная импотенция;
Нарушения менструального цикла;
Самопроизвольные аборты;
Сепсис;
Уремия;
Гидронефроз;
Полипозные разрастания на слизистой оболочке влагалища, шейки
матки;
Свищи мочеиспускательного канала и промежности;
Камни мочевого пузыря
31. Диагностика
32. Симптомы
Период тканевой пролиферации характеризуется развитием фиброза в
местах поражения слизистой оболочки кишечника. По мере развития
заболевания в кишечнике образуются полипозные разрастания, что
проявляется болями, метеоризмом, частичной или полной
непроходимостью кишечника. При обширных пораженияхтолстой кишки
часто возникает диарея, обезвоживание, снижается масса тела.
Различают лёгкую, среднетяжёлую, тяжелую и очень тяжёлую формы
течения шистосомоза. Лёгкая форма протекает с периодически
возникающими проявлениями энтероколита. При среднетяжёлой форме
течения наряду с непостоянным болям в животе отмечаются анемия и
потеря массы тела. Тяжёлая форма протекает с большой слабостью,
сильной анемией, изнурительной и очень частой диареей, с
обезвоживанием и истощением организма. При очень тяжёлой форме
имеются симптомы далеко зашедшего цирроза печени с портальной
гипертензией, асцитом, спленомегалией и выраженной кахексией
SCHISTOSOMA JAPONICUM
Возбудитель — S. japonicum (Katsurada, 1904).
Самка имеет длину 15 — 26 мм, самец — 9,5 —
13 мм. Яйца овальные с небольшим
расположенным сбоку крючковидным или
рудиментарным
шипом.
Дифинитивным
хозяином является не только человек, но и
различные млекопитающие (собаки, кошки,
свиньи,
грызуны,
обезьяны).
Взрослые
гельминты паразитируют в системе воротной и
мезентериальных вен человека. Особенностью
J. japonicum является то, что пары
гельминтов постоянно остаются в одном
месте и продуцируют до 3000 — 5000 яиц.
Географическое распространение. Японский шистосомоз регистрируется в Южном
Китае, на острове Тайвань, на Филиппинских островах, в Южной Японии, на острове
Сулавеси.
Эпидемиология. Японский шистосомоз — природно-очаговое заболевание.
Источником является не только больной, но и домашние и дикие животные.
Промежуточные хозяева — S. japonicum — моллюски рода Oncomelania. Инвазия
церкариями происходит в воде или при хождении босиком по влажной прибрежной
Патогенез и патологическая анатомия
имеют много общего с кишечным
шистосомозом Мэнсона. Однако развитие
патологических изменений как в стенке
кишечника, так и в печени происходит
раньше и интенсивнее, участки фиброза и
обызвествления имеют большие размеры.
Более
тяжелое
течение
японского
шистосомоза связано с тем, что каждая
особь S. japonicum продуцирует в 10 раз
больше яиц, чем другие виды шистосом,
при этом в тканях образуются их большие
скопления. В поздней стадии при развитии
трубчатоиндуративного фиброза печени
клеточная
инфильтрация
принимает
диффузный характер. Деструкция ветвей
воротной
вены
вызывает
тяжелую
портальную
гипертензию
со
спленомегалией
и
развитием
коллатерального
кровообращения.
Нередко поражается ЦНС в связи с заносом
яиц гельминта в головной мозг.
СИМПТОМАТИКА
Инкубационный период длится 10-12 недель. Клинические проявления шистосомоза различны.
Болезнь может протекать бессимптомно, легко, но в отдельных случаях описаны тяжелые и
молниеносные формы, связанные с тяжелой интоксикацией и аллергизацией организма
продуктами жизнедеятельности паразитов. Различают три стадии болезни - начальную, острую и
хроническую.
Острая фаза болезни сопровождается лихорадкой, сыпью, отеком, болями в кишечнике, диареей,
судорогами, гиперэозинофилией (уровень эозинофилов в крови до 60% и более). Известна
молниеносная форма с внезапным началом, выраженными аллергическими симптомами, крайне
тяжелым течением, развитием менингоэнцефалита и летальным исходом. В хронической стадии
болезни преобладают нарушения деятельности желудочно-кишечного тракта, сопровождающиеся
болями в животе, поносом со слизью и кровью, увеличением печени и селезенки.
Через 3 - 5 лет после заражения нередко развивается цирроз печени со спленомегалией, асцитом
и расширением поверхностных вен и вен пищевода. Гибель подобных больных наступает
вследствие кровотечения из варикознорасширенных вен нижнего отдела пищевода, реже - от
печеночной недостаточности. Шистосомозная инвазия оказывает угнетающее влияние на гипофиз
и функцию половых желез, в результате чего у инвазированных в очагах замедляются рост и
половое созревание.
Тяжелым осложнением хронической стадии японского шистосомоза является поражение ЦНС,
обусловленное заносом яиц в вещество мозга. В острой фазе болезни могут развиваться
диффузные поражения головного мозга аллергической природы, в хронической стадии чаще
наблюдаются очаговые поражения, симулирующие опухоль мозга. Признаками вовлечения в
процесс ЦНС являются эпилептические припадки, парезы, параличи конечностей, слепота.
Прогноз японского шистосомоза значительно тяжелее, чем при других шистосомозах, так как чаще
развиваются цирроз печени и поражения ЦНС.
37. Cestoda
38. Особенности цикла развития Отряд Pseudophyllidia
39. Характеристика жизненного цикла отряд Pseudophyllidia
42. Отряд Cyclophyllidea
• Яйцо с онкосферой (эмбрионом) внутри
• Цистецеркоид – сколекс, окруженный
несколькими рядами фиброзной ткани
• Цистецерк с инвагинированным сколексом
в заполненном жидкостью пузыре
• Половозрелая особь
43. Бычий цепень (Taeniarhynchus saginatus)
• Бычий цепень (Taeniarhynchus saginatus) – это большой ленточный
червь, который вызывает инфекцию под названием тениаринхоз. Код
болезни B68.1 (МКБ-10).
• Тениаринхоз – пероральный биогельминтоз, антропоноз.
• Постоянный хозяин бычьего цепня – человек. Крупнорогатый скот
является промежуточным хозяином цепня.
• Головка червя (сколекс) 1,5–2,0 мм в диаметре, имеет четыре
присоски. Тело (стробила) лентовидной формы состоит из большого
числа (до 2000) члеников (проглоттид). Размер зрелых члеников в
дистальной части тела (20–30) х 12 мм, длина их больше ширины. В
одном зрелом членике насчитывается до 170 тыс. яиц, внутри которых
находятся зародыши (онкосферы). Половозрелый цепень может
достигать в длину 12-15м.
• Длительность инвазии может продолжаться несколько лет. Известны
случаи паразитирования у человека нескольких особей бычьего
цепня.
44. Невооруженный цепень Taenia saginata
45. Невооруженный (бычий) цепень Taenia saginata
46. Морфологические особенности Taenia solium
• Гельминт внешне напоминает
бычьего цепня, но меньших
размеров (не более 3 м);
• головка (0,6-2 мм) помимо 4
присосок вооружена 22-32
крючьями;
• зрелые проглоттиды
содержат до 50 000 яиц и
неподвижны:
• свиной цепень имеет 3-х
дольный яичник и от 7 до 12
ответвлений матки с каждой
стороны;
• зрелые членики выделяются с
испражнениями по 5—6 штук;
47. Вооруженный (свиной) цепень Taenia solium
48. СИМПТОМЫ (КЛИНИЧЕСКАЯ КАРТИНА) ТЕНИОЗА
Взрослый свиной (вооруженный) цепень вызывает заболевание —
тениоз.
Заболевание, характеризующееся диспептическими
расстройствами и токсико-аллергическими реакциями.
У больных тениозом наблюдаются следующие симптомы:
- расстройства кишечника;
- слабость;
- головокружение;
- тошнота, рвота;
- периодические головные боли;
- нарушения сна;
- боли в животе:
- продолжительность жизни в организме человека 3-17 лет с
последующей петрификацией.
49. ДИАГНОСТИКА ТЕНИОЗА
• С целью диагностики применяют осмотр выделившихся
с фекалиями человека члеников и микроскопию кала.
• Тениоз выявляют обнаружением яиц и онкосфер в
испражнениях.
• По характеру выделения члеников и их строению
(членик сдавливают между двух предметных стекол и
подсчитывают число боковых ответвлений матки)
обычно удается дифференцировать тениаринхоз и
тениоз.
• Окончательный видовой диагноз можно также
поставить на основании изучения головок цепней,
выделившихся при дегельминтизации.
50. Вооруженный цепень Taenia solium
51. Цистицеркоз
• Цистицерки имеют вид прозрачных пузырьков
диаметром от просяного зерна до 1,5 см,
заполнены прозрачной жидкостью. Внутри
просвечивает белой точкой головка, имеющая
такое же строение, как и у взрослого цепня.
Формируются цистицерки в течение 2—4 мес.
В организме человека цистицерки выживают
несколько лет, в организме свиньи до двух лет,
после чего погибают и обызвествляются.
Echinococcus granulosus
(Эхинококк) – биогельминт,
возбудитель эхинококкоза.
Заболевание распространено повсеместно, но чаще
встречается в странах с развитым пастбищным
животноводством (Южная Америка, Австралия и
Новая Зеландия, Северная Африка, Южная Европа,
Япония, Индия; в России: Башкортостан,
Татарстан,
Ставропольский,
Краснодарский,
Алтайский, Красноярский, Хабаровский край,
Волгоградская,
Самарская,
Ростовская,
Оренбургская, Челябинская, Томская, Омская,
Камчатская, Магаданская, Амурская области и
Чукотский автономный округ).
55. Морфологические особенности
Половозрелая форма имеем тело длиной
3-5 мм, состоит из:
• головки (с присосками и 2 венчиками
крючьев) – сколекс;
• шейки;
• гермафродитных
члеников
(проглоттид);
• зрелого
членика
(проглоттида)
(составляет половину длины тела).
В матке содержится до 5000 яиц.
А – схема, Б – микрофотография
1 – хоботок с двумя венчиками крючьев;
2 – присоски; 3 – шейка; 4 – гермафродитная
проглоттида; 5 – зрелая проглоттида; 6 –
зрелые яйца в матке.
56. Жизненный цикл
Основные хозяева – плотоядные животные (собака, волк, шакал), промежуточные – человек,
травоядные и всеядные животные (КРС, МРС, свиньи и др.) Заражение окончательных хозяев
происходит при поедании ими органов пораженных животных. Из организма окончательного
хозяина с фекалиями во внешнюю среду попадают яйца эхинококка.
Зрелые
проглоттиды
способны выползать из
Человек для эхинококка является биологическим тупиком!
анального
отверстия
окончательного хозяина
и
рассеивать
яйца,
передвигаясь по шерсти
животного.
Попав на траву, яйца или
проглоттиды
заглатываются
промежуточным
хозяином. В кишечнике
из
яиц
выходят
онкосферы, попадают в
кровь и разносятся в
различные
органы
(печень, легкие, мышцы,
кости), где развивается
финна – эхинококковый
пузырь. Полость пузыря
заполнена
жидкостью,
содержащей
продукты
обмена паразита.
57. Инфицирование
1. От больных собак при несоблюдении правил личной
гигиены.
2. От овец и других животных на шерсти которых
находятся яйца, попавшие на них с травы или почвы.
Симптоматика
1.
2.
3.
4.
Крапивница
Кожный зуд
Боль и тяжесть в правом подреберье
При поражении легкого: боль в груди, кашель, одышка,
иногда кровохарканье
Осложнения: прорыв эхинококкового пузыря в бронх,
брюшную или грудную полости и обсеменение сколексами
полости тела человека; нагноение.
58. Диагностика
1.
2.
3.
4.
Эпидемиологический анамнез.
Клинико-рентгенологическое обследование (обнаружение
кистозных образований при поражении легких и костей)*.
Иммунологическое обследование (выявление специфических
антител (IgG) в сыворотке крови методом ИФА).
Проведение аллергологической пробы – реакции Кас(ц)они
(при эхинококке положительна в 89-90 % случаев): 0,2 мл
стерильной эхинококковой жидкости вводят внутрикожно, при
положительной реакции на месте введения жидкости
появляется покраснение, а далее сплошная интенсивная
краснота (кожная анафилаксия).
*дополнительно: УЗИ, компьютерная томография, сканирование с
помощью радиоактивных изотопов и др.
Медицинское значение имеют три группы гельминтов—нематоды (круглые черви), цестоды (ленточные черви) и трематоды (сосальщики).
Диагностическими стадиями обычно являются яйца и личинки паразитов. Реже можно наблюдать взрослых особей аскарид и остриц, и, кроме того, в диагностике определенных цестодозов используются морфологические особенности члеников или проглотит возбудителей. В целом, лабораторная диагностика большинства гельминтозов основывается на идентификации яиц возбудителей.
Для видовой идентификации яиц гельминтов используются следующие признаки.
1. Размеры. Измеряют длину и ширину яиц, которые обычно имеют определенную у каждого вида величину.
2. Форма. Для каждого вида характерна своя особая форма яиц.
3. Стадия развития при выделении во внешнюю среду. У одних Видов яйца состоят из одной клетки; у других в яйце может быть несколько клеток; у третьих яйца обычно эмбрионированы (т.е. они содержат личинки) при выделении с фекалиями во внешнюю среду. Иногда, если пробы фекалий исследуют через несколько часов или спустя 1—2 дня после дефекации, яйца гельминтов развиваются до более взрослых стадий. В идеале на анализ следует принимать только свежие пробы фекалий.
4. Толщина оболочки яйца. Яйца некоторых видов, например аскарид, имеют толстую оболочку; у других видов гельминтов, например у анкилостомид, оболочка яиц тонкая.
5. Цвет. Яйца некоторых видов паразитов бесцветны (например, яйца анкилостомид, остриц), у других они желтого или коричневого цвета (яйца аскарид, власоглавов).
6. Наличие морфологических особенностей, таких, как крышки, шипы, пробки, крючочки или фестончатая наружная оболочка.
При обнаружении яйца гельминта или похожего на него объекта следует тщательно оценить все перечисленные выше признаки, чтобы установить видовой диагноз.
Для того чтобы установить видовую принадлежность яиц гельминтов, необходимо определить их размер, форму, стадию развития, толщину оболочки, цвет и наличие морфологических особенностей, таких, как крышечки, шипы, пробки, крючочки и бугристая наружная оболочка.
Для установления видового диагноза используют специальные определители и схематические изображения яиц гельминтов.

Рис. 34.1. Идентификация кишечных паразитов – гельминтов.
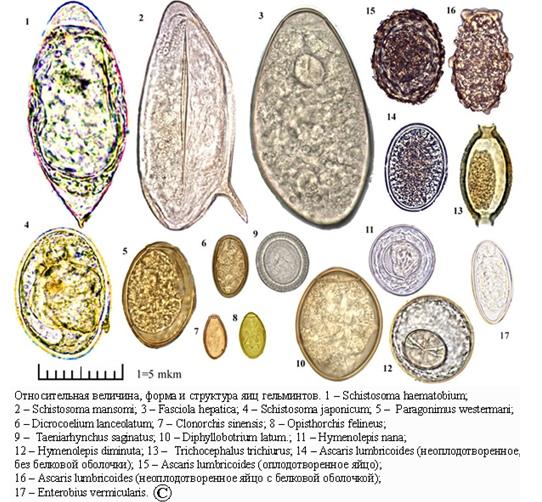
1. Schistosoma hematobium; 2. Schistosoma mansoni; 3. Fasciola hepatica; 4. Schistosoma japonicum;
5. Paragonimus westermani; 6. Dicrocoelium lanceolatum; 7. Clonorhis sinencis;
8. Opistorchis felineus; 9. Taeniarynchus saginatus; 10. Diphyllobotriun latum; 11. Hymenolepis nana;
12. Hymenolepis diminuta; 13. Trichocephalus trichiurus; 14. Ascaris lumbricoides (неоплодотворенное, без белковой оболочки); 15. Ascaris lumbricoides (оплодотворенное яйцо);
16. Ascaris lumbricoides (неоплодотворенное яйцо с белковой оболочки); 17. Enterobius vermicularis
Рис. 34.2. Относительная величина, форма и структура яиц гельминтов.
1. ИССЛЕДОВАНИЕ ИСПРАЖНЕНИЙ.
Гельминтологические исследования проводятся с целью диагностики гельминтозов путем обнаружения в патологическом материале яиц, личинок, взрослых гельминтов или их фрагментов. Поскольку большинство гельминтов в половозрелой стадии развития находится в желудочно-кишечном тракте или в сообщающихся с ним органах, чаще всего применяются макро- и микрогельминтоскопические методы исследования фекалий (не более суточной давности).
С целью повышения достоверности обследования анализы должны быть повторены несколько раз ежедневно с промежутком 1-3 дня.
1.1. МАКРОГЕЛЬМИНТОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ ИСПРАЖНЕНИЙ
Метод отстаивания. Суточную порцию фекалий тщательно промывают водой, пока вода над осадком не станет прозрачной. Слив верхний слой, переносят осадок в чашку Петри и на темном фоне просматривают его под лупой или невооруженным глазом.
Метод отсеивания. Перемешанные с водой фекалии помещают на систему сит специального прибора. После промывания водопроводной водой сита переворачивают и, смыв содержимое в чашки Петри, просматривают невооруженным глазом или под лупой.
1.2. МИКРОГЕЛЬМИНТОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ
Используют гельминтоовоскопические и гельминтоларвоскопические методы с целью обнаружения яиц гельминтов и их личинок.
1.2.1. ГЕЛЬМИНТООВОСКОПИЧЕСКИЕ МЕТОДЫ
При использовании гельминтоовоскопических методов обнаружения гельминтов вначале готовят двоякого рода мазки – нативный и толстый.
Нативный мазок. Небольшое количество фекалий растирают на предметном стекле в капле 50%-ного раствора глицерина или кипяченой воды. Крупные частицы осторожно удаляют, смесь накрывают покровным стеклом и исследуют под микроскопом (просматривают два мазка).
Делая нативный мазок, следует знать, что при слабых инвазиях в нем редко обнаруживаются яйца гельминтов.
Толстый мазок с целлофаном по Като. Метод основан на обнаружении яиц гельминтов в толстом мазке кала, просветленном глицерином и подкрашенном малахитовым зеленым. Подготовленный толстый мазок фекалий покрывают кусочком целлофана, смоченного смесью глицерин-фенол влажного целлофана. Препарат исследуют через 30–60 мин, когда он слегка подсохнет и просветлится, вследствие чего яйца гельминтов легко обнаружатся под малым увеличением микроскопа.
В большом мазке хорошо видны окрашенные крупные яйца гельминтов, несколько хуже – прозрачные яйца карликового цепня. Для обнаружения мелких яиц этот метод непригоден.
Методы обогащения
Среди методов обогащения используют методы флотации (всплывания) и седиментации (осаждения).
А). Методы флотации основаны на применении насыщенных растворов различных химических веществ, в которых яйца всплывают благодаря разнице удельного веса.
Метод всплывания по Фюллеборну основан на всплывании яиц гельминтов в насыщенном растворе хлорида натрия (удельный вес 1,18), что дает возможность выявления яиц при небольшом их количестве. Метод более эффективен, чем изучение нативного мазка. Достоинствами является доступность и дешевизна. Данный метод хорошо выявляет яйца нематод и карликового цепня.
Однако яйца трематод, тениид, неоплодотворенные яйца аскарид не всплывают в данном растворе. Поэтому требуется обязательно исследовать не только поверхностную пленку, но и осадок, что усложняет метод. К недостаткам относится и замедленное всплывание яиц: яйца карликового цепня всплывают через 15-20 мин, аскарид – через 1,5-2 часа, власоглава – через 2-3 часа.
Метод Е.В.Калантарян также метод обогащения, но более эффективен и проще. Применяется насыщенный раствор нитрата натрия с относительной плотностью 1,38. Поэтому яйца большинства гельминтов всплывают и обнаруживаются в поверхностно пленке, исследование осадка не требуются.
Недостаток метода – дефицит нитрата натрия, а также то, что яйца трематод, онкосферы тениид не всплывают и остаются в осадке.
Б). Метод осаждения (седиментации) яиц гельминтов основаны на использовании химических веществ, растворяющих жиры и белки фекалий.
Метод П.П.Горячева основан на принципе осаждения яиц. Мазок в этом случае получается светлый, что облегчает обнаружение мелких яиц трематод.
Метод Горячева был предложен для обнаружения яиц описторха и оказался эффективнее, чем исследование нативного мазка и метода Фюллеборна. В настоящее время для диагностики описторхоза (клонорхоза) рекомендуются методы Като и Калантарян, как достаточно эффективные и технически более простые.
1.2.2. ГЕЛЬМИНТОЛАРВОСКОПИЧЕСКИЕ МЕТОДЫ (выявление личинок)
В свежих пробах фекалий обычно обнаруживаются рабдитовидные личинки (т.е. личинки I стадии) кишечной угрицы (Strongyloides stercoralis). Однако при исследовании фекалий через12 ч после дефекации эти личинки могут превратиться в филяриевидные личинки (заразная стадия паразитов); эти личинки необходимо дифференцировать от личинок анкилостомид, которые могут появиться в фекалиях через 12—24 ч. Появление филяриевидных личинок кишечной угрицы может свидетельствовать о генерализованной гиперинвазии.
Метод закручивания по Е.С.Шульману. Метод предложен для обнаружения в кале личинок гельминтов, в первую очередь стронгилоидов. Исследуют только свежевыделенные фекалии, которые размешивают палочкой в 5-кратном количестве воды. Через 20-30 ск после начала размешивания палочку быстро вынимают, образовавшуюся на ее конце каплю жидкости переносят на предметное стекло и микроскопируют.
Метод Берманна основан на способности личинок гельминтов мигрировать по направлению к теплу и служит для их выявления в фекалиях, в первую очередь при подозрении на стронгилоидоз.
Метод культивирования личинок анкилостомид на фильтровальной бумаге при температуре 25°С в течение 5–7 дней. За это время развившиеся из яиц личинки спускаются по бумаге на дно пробирки. Их убивают нагреванием и осадок исследуют под микроскопом; если точного определения вида паразитов не требуется, пробирки просматривают невооруженным глазом.
2. МЕТОДЫ ИССЛЕДОВАНИЯ ДРУГИХ ЭКСКРЕТОВ И СЕКРЕТОВ
2.1. Исследование дуоденального содержимого и рвотных масс предусматривает обнаружение яиц и личинок гельминтов, паразитирующих в желчных и панкреатических протоках, желчном пузыре, в двенадцатиперстной кишке (яйца описторхисов, фасциол, клонорхисов, анкилостомид, личинки стронгилоидов).
В дуоденальном содержимом микроскопируют имеющиеся в нем хлопья и плотные включения, а затем, разлив его по пробиркам, добавляют равный объем серного эфира, центрифугируют и исследуют осадок.
В рвотных массах изредка обнаруживаются гельминты или их фрагменты (например, при прорыве нагноившейся эхинококковой кисты из легкого в бронхи с рвотой выделяется светлая водянистая или гнойная жидкость). Диагноз ставится на основании обнаружения обрывков кутикулярной оболочки, сколексов и крючьев эхинококка.
§ осуществлять профилактику распространения инфекции.
§ роль микроорганизмов в жизни человека и общества;
должен овладеть следующими компетенциями:
ОК 1, 2, 3, 4, 8, 9, 11
ПК 1.1, 1.2, 1.3, 2.1, 2.2, 2.3, 3.1.
1. Вопросы для самоподготовки:
1. Особенности морфологии и жизнедеятельности гельминтов класса Сосальщики
2. Особенности морфологии и жизнедеятельности гельминтов класса Ленточные черви
3. Особенности морфологии и жизнедеятельности гельминтов типа Круглые черви
2. В дневнике для практических работ заполните таблицу:
Гельминты – возбудители заболеваний человека
| Название паразита | Заболевание, им вызываемое | Способ заражения | Клиника | Диагностика (заполняется на занятии) | Профилактика |
| Класс Сосальщики (Trematoda) 1. Печеночный сосальщик, Fasciola hepatica. 2. Кошачий (сибирский) сосальщик, Opisthorchis felineus 3. Кровяные сосальщики или шистосомы (Schistosoma haematobium, mansoni, japonicum) | |||||
| Класс Ленточные черви (Cestoda) 1. Бычий цепень (Taeniarhynchus saginatus). 2. Свиной цепень (Taenia solium). 3. Карликовый цепень (Hymenolepis nana). 4. Широкий лентец (Diphyllobothrium latum). | |||||
| Класс Собственно круглые черви (Nematoda) 1. Аскарида (Ascaris lumbricoides) 2. Острица (Enterobius vemicularis) 3. Власоглав (Trichocephalus trichiurus). 4. Трихинелла (Trichinella spiralis) |
1. Генис Д. Е. Медицинская паразитология. – М.: Медицина, 1985.
Главы: 1, 2, 3; стр. 14.
3. Лекционный материал.
Практическое занятие № 16
Тема: Методы микробиологической диагностики вирусных инфекций
Место проведения: кабинет доклинической практики
Продолжительность: 90 мин.
Тип занятия: КУЗ
В результате освоения учебной дисциплины обучающийся
§ проводить забор, транспортировку и хранение материала для микробиологических исследований;
§ дифференцировать разные группы микроорганизмов по их основным свойствам;
§ проводить простейшие микробиологические исследования;
§ осуществлять профилактику распространения инфекции.
§ роль микроорганизмов в жизни человека и общества;
должен овладеть следующими компетенциями:
ОК 1, 2, 3, 4, 8, 9, 11
ПК 1.1, 1.2, 1.3, 2.1, 2.2, 2.3, 3.1.
1. Вопросы для самоподготовки:
1. Строение и классификация вирусов.
2. Репродукция вирусов.
3. Бактериофаги, морфология и химический состав. Взаимодействие с бактериальной клеткой. Значение бактериофагов.
2. Выпишите в дневник для практических занятий и выучите значение следующихтерминов:
вирусология, вирус, бактериофаг, капсид, суперкапсид, нуклеокапсид, капсомер, продуктивная вирусная инфекция, абортивная вирусная инфекция, латентная вирусная инфекция, вирогенная вирусная инфекция
3. В дневнике для практических работ сделайте рисунки:
- Строение сложных вирусов (рис. 2.7)
- Различные формы вирионов (рис. 2.8
3. Лекционный материал
Практическое занятие № 17
Тема: Профилактика вирусных инфекций
Место проведения: кабинет доклинической практики
Продолжительность: 90 мин.
Тип занятия: КУЗ
В результате освоения учебной дисциплины обучающийся
§ проводить забор, транспортировку и хранение материала для микробиологических исследований;
§ дифференцировать разные группы микроорганизмов по их основным свойствам;
§ проводить простейшие микробиологические исследования;
§ осуществлять профилактику распространения инфекции.
§ роль микроорганизмов в жизни человека и общества;
должен овладеть следующими компетенциями:
ОК 1, 2, 3, 4, 8, 9, 11
ПК 1.1, 1.2, 1.3, 2.1, 2.2, 2.3, 3.1.
1. Вопросы для самоподготовки:
1. Возбудители вирусных респираторных инфекций
2. Возбудители вирусных кровяных инфекций
3. Возбудители вирусных кишечных инфекций
4. Возбудители вирусных раневых инфекций
2. В дневнике для практических работ заполните таблицы:
- Возбудители вирусных респираторных инфекций
- Возбудители вирусных кровяных инфекций
- Возбудители вирусных кишечных инфекций
- Возбудители вирусных раневых инфекций
Читайте также:

